Действие антител на вирусы
Для защиты организма против внедрившихся агентов антитела действуют главным образом двумя путями: (1) прямой атаки патогенного агента; (2) активации системы комплемента, которая имеет множество своих собственных способов для разрушения внедрившегося в организм агента.
Прямое действие антител на внедрившиеся в организм агенты. На рисунке показаны антитела (обозначенные красными Y-образными полосками), реагирующие с антигенами (обозначенными затененными объектами). В связи с бивалентной природой антител и множеством антигенных участков на большинстве внедряющихся агентов антитела могут инактивировать их одним из следующих способов.
1. Агглютинация, при которой многочисленные крупные частицы с антигенами на их поверхности, например бактерии или красные клетки крови, связываются вместе, образуя комок.
2. Преципитация, при которой молекулярный комплекс растворимого антигена (например, столбнячный токсин) и антитела становится таким большим, что переходит в нерастворимое состояние и выпадает в осадок.
3. Нейтрализация, при которой антитела закрывают токсические участки антигенного агента.
4. Лизис, при котором некоторые сильнодействующие антитела способны непосредственно атаковать мембраны клеточных агентов и вызывать их разрушение.
Этих прямых действий антител, атакующих антигенные патогенные агенты, часто недостаточно, чтобы играть главную роль в защите организма против внедряющихся микроорганизмов. Более мощная защита обеспечивается путем усиливающих эффектов системы комплемента, изложенных далее.

Комплемент — собирательный термин для системы примерно из 20 белков, многие из которых являются предшественниками ферментов (проферментами). Главными действующими факторами этой системы являются 11 белков, обозначаемых С1-С9, В и D. Все они присутствуют в норме среди белков плазмы крови, как и среди белков, просочившихся из капилляров в тканевые пространства. Проферменты в норме не активны, но они могут активироваться так называемым классическим путем.
Наиболее значимыми являются следующие эффекты.
1. Опсонизация и фагоцитоз. Один из продуктов каскада комплемента — С3b — мощно активирует фагоцитарную активность и нейтрофилов, и макрофагов, заставляя эти клетки поглощать бактерии, к которым прикрепляются комплексы антиген-антитело. Этот процесс, называемый опсонизацией, увеличивает в сотни раз число бактерий, которые могут быть разрушены.
2. Лизис. Одним из наиболее важных продуктов каскада комплемента является литинеский комплексу представляющий собой комбинацию многочисленных комплементарных факторов и обозначаемый как C5b6789. Он оказывает прямое действие, разрушающее клеточные мембраны бактерий или других патогенных организмов.
3. Агглютинация. Продукты комплемента также изменяют поверхности внедряющихся организмов, способствуя их прилипанию друг к другу.
4. Нейтрализация вирусов. Ферменты и другие продукты реакции комплемента могут атаковать структуры некоторых вирусов, в результате последние теряют свою вирулентность.
5. Хемотаксис. Фрагмент С5а инициирует хемотаксис нейтрофилов и макрофагов, заставляя большое количество этих фагоцитов мигрировать в тканевые области, прилежащие к антигенному агенту.
6. Активация тучных клеток и базофилов. Фрагменты С3а, С4а и С5а активируют тучные клетки и базофилы, заставляя их выделять гистамин, гепарин и некоторые другие вещества в местные ткани. Эти вещества, в свою очередь, ведут к увеличению локального кровотока, усилению просачивания жидкости и плазменных белков в ткань и другие местные тканевые реакции, способствующие инактивации или обездвиживанию антигенного агента. Те же факторы играют большую роль в воспалении и аллергических реакциях, которые мы обсудим далее.
7. Воспалительные эффекты. Кроме воспалительных эффектов, связанных с активацией тучных клеток и базофилов, вклад в местное воспаление вносят и некоторые другие продукты комплемента. Эти продукты ведут к: (1) еще большему увеличению уже повышенного кровотока; (2) усилению утечки белков из капилляров; (3) коагуляции белков интер-стициальной жидкости в тканевых пространствах, что предотвращает движение внедрившихся организмов по тканям.
Сильный иммунитет, слабый иммунитет, риски тяжёлой формы болезни COVID-19.
Люди по всему миру болеют новой коронавирусной инфекцией. Одни переносят легко, другие тяжело, с угрозой для жизни — какие тут факторы важны и какова роль иммунитета? Есть накапливающаяся статистика: все уже запомнили, что риски тяжёлого течения COVID-19 сильно растут с возрастом пациента, значительно выше для мужчин, чем для женщин, выше для людей с астмой, заболеваниями сердца и почек, для тех, кто принимает сартаны (распространённое лекарство для лечения артериальной гипертензии) и т.д. Но эти разрозненные факты не особо помогают понять патогенез, т.е. как развивается болезнь, и выделить важные факторы выздоровления или наоборот, проявления тяжёлой формы COVID-19.
Есть основания полагать, что большинство смертей от коронавируса связаны с чрезмерной и разрушительной реакцией иммунной системы, а не с прямыми повреждениями, которые организму наносит размножающийся вирус.
Иммунная реакция на вирус отличается у разных людей уже с первых часов заражения, она зависит и от наследственных факторов, факторов среды (например, загрязнённый городской воздух) и от привычек (например, курения или занятий спортом), влияющих на состояние иммунитета слизистых оболочек дыхательных путей. У кого-то быстро вырабатываются интерфероны — первые сигналы для организма о необходимости противовирусной защиты. В идеальной ситуации сигнал интерферонов I типа приводит к тому, что эпителий сам защищается от репликации вируса, и вдобавок иммунные клетки приходят и уничтожают заражённые клетки, которых на первой стадии немного. Если выработка интерферонов происходит с задержкой, вирус успевает размножиться, и для борьбы с ним требуется больше активирующих сигналов иммунитету, воспаление развивается интенсивнее/стремительнее, что приводит к — бóльшему повреждению ткани (эпителия альвеол лёгких).
Хорошо изучено, что для разных вирусных инфекций очень важен тайминг продукции интерферонов I типа. Ранняя выработка интерферона или системное введение дополнительного экзогенного интерферона (на ранних асимптоматических стадиях болезни) в моделях на животных защищает от различных вирусов (первого SARS-коронавируса, хорошо изученной модельной инфекции LCMV , вируса иммунодефицита обезьян): ткань, подвергающаяся атаке инфекции, и врождённый иммунитет справляются с первой порцией вируса сразу после заражения. А вот если продукция интерферонов I типа начинается с задержкой, вирус успевает размножиться и распространиться по площади органа и дальше по организму. В тех же моделях на животных такая динамика ассоциирована со сниженным числом Т-киллеров субпопуляции CD8+ и патологически сильным системным воспалением — организм сильнее повреждается из-за действия врождённого иммунитета, и в таком случае становится гораздо сложнее полностью избавиться от вируса.
У вируса Эболы, например, есть белок VP35, ответственный за подавление выработки интерферона, поэтому Эбола сразу переходит на второй тип динамики вирусного иммунного ответа. Из других респираторных вирусов пандемический штамм гриппа 1918 года тоже отличался нехарактерным для большинства сезонных штаммов гриппа эффективным подавлением продукции интерферонов I типа и параллельно повышал, как считается, уровень воспалительных сигналов (цитокинов) в системном кровотоке, что приводило к тяжёлому устойчивому воспалению ткани лёгких.
- настроить иммунный ответ с общей непонятной паники на противовирусный ответ (выбрать и активировать нужные клетки Т-хелперы);
- выбрать из разнообразия Т-клеток те, которые способны убить зараженные вирусом клетки, не повредив соседние клетки лёгких (активировать Т-киллеры);
- дополнительно выработать антитела с помощью В-клеток, чтобы блокировать готовые вирусные частицы.
Реакция адаптивного иммунитета точнее и безопаснее, на этой фазе организм стремится уменьшить мощности врождённого иммунитета и быстро ответить с помощью адаптивных иммунных клеток. Если нашлись специфичные к вирусу Т-клетки и В-клетки (способные узнать белковые фрагменты вируса своими Т- и В-клеточными рецепторами), они получают лицензию на работу и размножение, это значит, что в организме формируется клон клеток — множество одинаковых специфичных к вирусу клеток. Из этого множества одинаковых потомков часть клеток скорее всего выживет и сформирует иммунную память, чтобы повторно человек не заразился.
Самая важная часть противовирусного адаптивного иммунного ответа — это специфичные Т-киллеры (CD8+ Т-клетки), которые уничтожают заражённые клетки респираторного/кишечного эпителия. При этом тоже повреждается ткань альвеол, но иначе мы не можем избавиться от вируса, уютно и спокойно размножающегося внутри наших клеток. Т-клеточный иммунный ответ на новые инфекции сильно ослабляется с возрастом, особенно после 60 лет. Специфичную Т-клетку к совершенно новой инфекции сложно подобрать, скорее всего, у пожилого пациента в организме вообще нет таких подходящих клеток: почти все Т-клетки представляют собой клоны иммунной памяти на старые прошедшие инфекции, а тимус (вилочковая железа) уже не производит новые Т-клетки [2].
Очень многие эксперты сейчас говорят и пишут, что как только ваш организм начинает вырабатывать нейтрализующие коронавирус антитела, вы точно выздоровеете, это дело времени. Это не совсем так. Кроме того, что можно не успеть обогнать вирус, сейчас всё больше данных говорит о том, что антитела усиливают повреждение лёгких и ускоряют кровоизлияние в них, от которого человек погибает. Например, здесь показано, что титр (концентрация, уровень в плазме крови) IgG-антител скоррелирован с возрастом, тяжёлыми симптомами и лимфопенией (снижением количества клеток адаптивного иммунитета). Это же показывает и модель, в которой макак заражали предыдущим вирусом SARS (высокий титр эффективных нейтрализующих антител IgG к spike-белку оболочки коронавируса коррелировал с сильным повреждением ткани лёгких). Почему так происходит, что от антител ухудшается течение COVID-19, интуитивно же должно же быть наоборот?
Дело в том, что кроме последовательности
врождённый иммунитет → доставка вируса или его обломков в лимфоузел → подбор, поиск и активация адаптивного иммунитета
есть и следующая часть: адаптивный иммунитет выбрал стратегию конкретного иммунного ответа (Т-хелперы подумали и решили) → часть оружия врождённого иммунитета выключается, нужная часть продолжает использоваться. Здесь антитела типа IgG1 направляют и активируют конкретную часть врождённого иммунитета: атаку М1-воспалительных макрофагов на клетки, на поверхности которых сидит вирус. Это не сломанная, а адекватная реакция именно на вирусную инфекцию, но чрезмерная. До этого часть макрофагов в лёгких находились в спокойном режиме, в котором они стимулируют регенерацию: размножение клеток, рост матрикса [4], на котором клетки живут; а также занимались уборкой мёртвых клеток и мусора. М1-воспалительные макрофаги уничтожают матрикс, атакуют клетки, облепленные вирусом, и очень быстро разрушают тонкие альвеолы.
Возможно, при производстве терапевтических антител подойдёт применяющийся сейчас подход с оптимизацией по максимальной прочности связывания антител с вирусом. При этом может возникнуть необходимость поменять изотип гуманизованных антител, например, с IgG1 на IgG4, т.к. IgG4 будут мешать вирусу проникать в клетку, но не будут активировать макрофаги. Возможно, подход к подбору терапевтических антител придётся поменять и это вообще будет антитело не на spike-гликопротен вируса, а на другой антиген. Относительно лечения пациентов с COVID-19 сывороткой, полученной от переболевших этим заболеванием людей, что-то определённое сказать сложно, т.к. подобный препарат будет содержать смесь антител с разными свойствами и функциями, и прогнозировать результат терапии на современном этапе весьма затруднительно. Об этом проще будет говорить по результатам, которые мы увидим в течение следующих двух-трёх месяцев.
За последние недели я видела довольно много противоречивых данных о лимфопении (снижении количества клеток адаптивного иммунитета) у пациентов COVID-19. Пока непонятно, это все клетки ушли на войну в лёгкие/кишечник и поэтому снижена численность в крови? Или иммунные клетки активно погибают? Вопрос остаётся открытым, но и не все исследования подтверждают этот факт. В некоторых когортах не было разницы по общей численности лимфоидных клеток между пациентами с лёгким и тяжёлым протеканием болезни, то есть лимфопения под вопросом.
Кажется, есть возможность для более сложной регуляции работы В-клеток и выработки антител, но это на данный момент не до конца изучено. В геноме SARS-CoV-2 (у первого SARS такого не было) есть участок, комплементарный продукту гена BLNK, который важен для развития В-лимфоцитов. Теоретически, коронавирус может с помощью этой РНК влиять на дифференцировку новых наивных В-клеток и в селекции активированных В-клеток, пока идёт отбор оптимальных антител, тем самым меняя адаптивный иммунный ответ.
08 сентября 2015
- 1694
- 1,4
- 0
- 3
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Антитела как лекарства
В фармакологии используются два основных понятия: лекарство и мишень. Мишень — это структура организма, связанная с определенной функцией, нарушение которой приводит к заболеванию. В случае болезни на мишень можно оказать определенное воздействие, которое должно привести к лечебному эффекту. Лекарством называется вещество, специфически взаимодействующее с мишенью и влияющее на состояние клетки, ткани, организма [1]. В качестве мишени может выступать рецептор на поверхности клеточной мембраны, фермент или канал, проводящий в клетку различные соединения. Однако путь к потребителю для любого лекарства долог: после подтверждения его функциональной активности следуют стадии доклинических и клинических испытаний, на которых малые молекулы подстерегает опасность так никогда и не стать лекарством. Под действием ферментных систем пациента они могут стать ядовитыми, или их изомеры окажутся токсичными. Низкомолекулярное вещество может выводиться слишком быстро или, напротив, накапливаться в организме, отравляя его. Поэтому в последние годы всё бóльшую долю на рынке лекарственных средств занимают макромолекулы, и среди них важнейшую роль играют антитела — защитные белки организма (рис. 1).
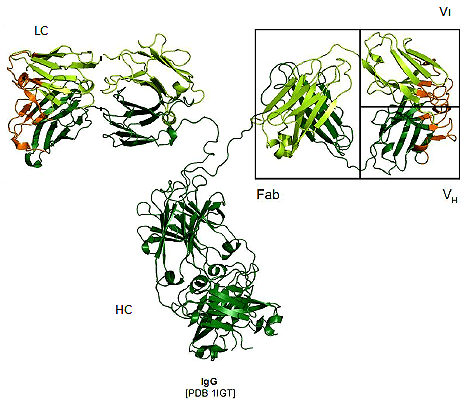
Рисунок 1. Структура антитела. Антитело состоит из двух тяжелых (HC) и двух легких (LC) аминокислотных цепей, соединенных между собой. Каждая из этих цепей имеет вариабельный домен (VH или VL), который ответственен за связывание антигена. Вариабельным он называется именно потому, что эти участки наиболее сильно отличаются у разных антител, то есть представлены множеством вариантов. Участок, который отщепляется ферментом папаином, называется Fab-фрагментом.
От структуры антитéла зависят такие важные свойства, как связывание им антигена, прочность этого связывания и стабильность молекулы. Однако природа создания антител в организме очень сложна, и никто не может гарантировать, что в ответ даже на идентичные антигены образуются одинаковые по структуре антитела. Если же для создания лекарства или диагностического набора используются антитела к одному и тому же антигену, но обладающие разной структурой, то из-за разницы в стабильности и специфичности о стандартизации и воспроизводимости результатов работы можно будет забыть. Это означает, что такие антитела никак не могут стать диагностическими или лекарственными. Отсюда вывод: нужны антитела с идентичной структурой.
Получение антител для нужд человека, как правило, начинается с иммунизации животных. Проводится несколько инъекций антигена, и в сыворотке крови накапливаются специфические антитела. Эти антитела, полученные напрямую из сыворотки иммунизированного животного, произведены разными плазматическими клетками, то есть они поликлональны. Для получения совершенно идентичных — моноклональных — антител в семидесятых годах прошлого века учеными Георгом Кёлером и Сéсаром Мильштейном был разработан метод гибридóм [3]. Он основан на слиянии плазматических лимфоцитов (продуцируют антитела, но не живут в культуре) и клеток миеломы (это опухолевые клетки, которые ничего не продуцируют, но зато замечательно культивируются), в результате чего такая гибридная клетка от В-лимфоцита наследует способность выделять нужные исследователям антитела, а от опухолевой — бессмертие (практически бесконечное деление).
Библиотека в пробирке
Метод, который был назван фаговым дисплеем, основан на способности бактериофагов (вирусов, поражающих бактерии) выставлять на своей поверхности случайные пептидные последовательности в составе поверхностных белков [5]. Бактериофаг представляет собой ДНК, окруженную белковой оболочкой — капсидом, — и способен размножаться только внутри клетки-хозяина. Проникая туда, он беззастенчиво пользуется ферментными системами несчастной бактерии, предоставляя ей свою ДНК для синтеза необходимых для его размножения белков [6]. Инфицированная фагом бактериальная клетка послушно воспроизводит всё, что закодировано в геноме вируса, чтобы его потомство собрало свою оболочку из готовых строительных блоков. Если в геном фага-прародителя исследователем внедрена нуклеотидная последовательность, кодирующая нужный пептид, у его потомства на поверхности вирусной частицы появляется несколько копий гибридного капсидного белка, состоящего из собственной полипептидной цепи и фрагмента антитела. Множество бактериофагов, на поверхности которых представлены случайные фрагменты антител, называется фаговой библиотекой (рис. 2).
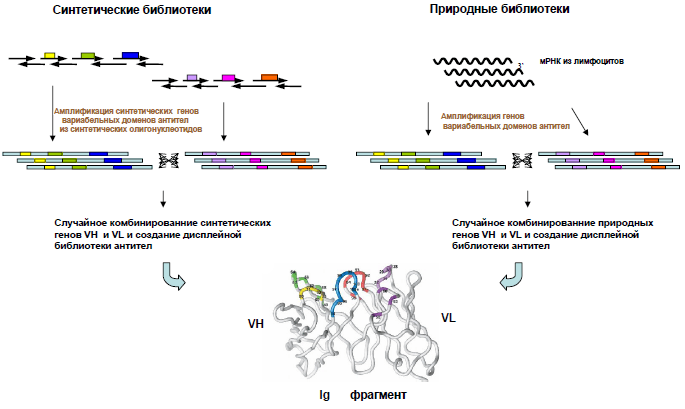
Рисунок 2. Создание синтетических и природных библиотек антител. За основу библиотеки берутся нуклеотидные последовательности вариабельных доменов антител (иммуноглобулинов, Ig), природные или синтетические. Далее их случайным образом комбинируют, и в результате образуется множество фрагментов антител, на основе которых можно создать фаговую библиотеку [8].
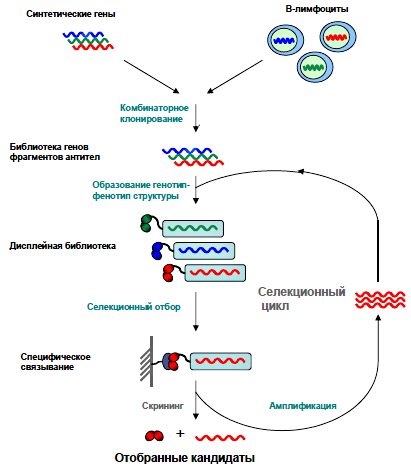
Рисунок 3. Схема селекции. Создание фаговой библиотеки из синтетического или природного источника предполагает образование структур, объединяющих в себе как нуклеотидные, так и аминокислотные последовательности фрагмента антитела (генотип-фенотип-структура). Затем обеспечивается контакт с антигеном (привязанным к пластику дисплейной библиотеки), который специфически связывается с определенными фрагментами антител, экспонированными на фаговой частице.
Обычно проводится 3–4 раунда селекции, в результате чего отбирается ДНК уже сравнительно небольшого количества фагов, и на ее основе в бактериальных клетках нарабатываются фрагменты антител для дальнейшего анализа. По источнику материала дисплейные библиотеки можно разделить на три группы.
- Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Раз люди-доноры здоровы, значит, их иммунным клеткам не доводилось сражаться с по-настоящему опасными антигенами. Как любого, кто не решал серьезных жизненных проблем, их называют наивными.
- Сфокусированные библиотеки создаются из клеток иммунизированного животного. В этом случае иммунной системе животного приходится потрудиться, ведь в течение нескольких недель ее регулярно атакуют, заставляя вырабатывать поликлональные антитела. Антиген, который вводят исследователи, оказывается в фокусе внимания иммунной системы животного, что увеличивает число вариантов антител к нужному антигену.
- Синтетические библиотеки состоят из генов, синтезированных искусственно [8].
Каждый из перечисленных видов библиотек имеет свои достоинства и недостатки. Например, синтетические библиотеки базируются на небольшом количестве структур вариабельных доменов антител, поэтому работать с ними гораздо проще, чем с природными, которые содержат разнообразные по термодинамическим и экспрессионным характеристикам последовательности. Зато при использовании вариантов из природных библиотек ниже вероятность развития иммунного ответа [9].
Полученные таким способом молекулы можно подвергнуть изменениям, совершенствуя их свойства. Кроме того, из одного и того же фрагмента антитела можно создать целый ряд терапевтических агентов. В зависимости от цели терапии его можно связать с токсином (например, для борьбы с опухолью), с цитокином (для адресной доставки к больному месту) или с другим фрагментом-помощником, даже с радионуклидом.
Успех современной фармакологии во многом зависит от развития таких областей науки, как молекулярная биология, биоинформатика и генная инженерия. Благодаря этим дисциплинам стало возможным синтезировать нужные последовательности ДНК, комбинировать и изменять их, а также получать животные белки в бактериальных системах. Несомненным достоинством современных технологий является то, что с их помощью можно не только получать аналоги уже существующих антител, но и создавать совершенно новые [7].
Рано праздновать победу!
Несмотря на все преимущества антител перед малыми молекулами, с их применением возникли проблемы. В 2004 году было обнаружено, что в нескольких случаях прием инфликсимаба (ремикейда, Remicade) — противовоспалительных моноклональных антител — сопровождался развитием у пациентов лимфом. В мае 2006 года в журнале Американской медицинской ассоциации (JAMA) опубликовали данные, что ремикейд усиливает риск развития рака в три раза [10]. В июне 2008 года FDA сообщило о возможной связи развития лимфом и других видов опухолей у детей и подростков с приемом ремикейда.
Установлено увеличение риска смертельного исхода у онкологических больных при приеме авастина (2,5%) — блокатора фактора роста эндотелия (VEGF) — по сравнению с использованием только химиотерапии (1,7%). Дело в том, что сам по себе Avastin (бевацизумаб) не взаимодействует с раковыми клетками. Он блокирует фактор роста эндотелия (клеток выстилки сосудов), который выделяет опухоль, чтобы создать вокруг себя больше кровеносных сосудов для интенсивного питания. Опухоль выделяет такой же VEGF, как и другие, здоровые части организма, поэтому блокирование роста определенной доли нужных организму сосудов (например, сосудов для питания сердца) оказывается неизбежным. Таким образом, в случае применения авастина повышение смертности пациентов связано не с основным заболеванием, а с сердечной недостаточностью [10].
Современные протоколы уже основаны на комбинированном подходе к лечению, включая вакцины, химиотерапию и моноклональные антитела. Исследователям еще предстоит разработать такие препараты и схемы терапии, которые обеспечат эффективное и безопасное лечение пациентов.








БИОЛОГИЧЕСКАЯ РОЛЬ ПРОТИВОВИРУСНЫХ АНТИТЕЛ
Уникальность антител заключается в том, что они способны специфически взаимодействовать только с тем антигеном, который вызвал их образование [4].
Иммуноглобулины (Ig) разделены в зависимости от локализации на три группы:
- сывороточные (в крови);
- секреторные ( в секретах- содержимом желудочно- кишечного тракта, слезном секрете, слюне, особенно- в грудном молоке) обеспечивают местный иммунитет(иммунитет слизистых);
- поверхностные ( на поверхности иммунокомпетентных клеток, особенно В- лимфоцитов) [8].
Легкие и тяжелые цепи состоят из отдельных блоков-доменов. В легких (L) цепях - два домена- один вариабельный (V) и один константный (C), в тяжелых (H) цепях - один V и 3 или 4 (в зависимости от класса иммуноглобулина ) C домена.
Существуют легкие цепи двух типов - каппа и лямбда, они встречаются в различных пропорциях в составе различных (всех) классов иммуноглобулинов.
Выявлено пять классов тяжелых цепей - альфа (с двумя подклассами), гамма (с четырьмя подклассами), эксилон, мю и дельта. Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов- А, G, E, M и D.
Именно константные области тяжелых цепей, различаясь по аминокислотному составу у различных классов иммуноглобулинов, в конечном результате и определяют специфические свойства иммуноглобулинов каждого класса.
Известно пять классов иммуноглобулинов, отличающихся по строению тяжелых цепей, молекулярной массе, физико-химическим и биологическим характеристикам: IgG, IgM, IgA, IgE, IgD. В составе IgG выделяют 4 подкласса ( gG1, IgG2, IgG3, IgG4), в составе IgA- два подкласса (IgA1, IgA2).
Структурной единицей антител является мономер, состоящий из двух легких и двух тяжелых цепей. Мономерами являются IgG, IgA (сывороточный), IgD и IgE. IgM-пентамер (полимерный Ig). У полимерных иммуноглобулинов имеется дополнительная j ( joint) полипептидная цепь, которая объединяет ( полимеризует) отдельные субъединицы (в составе пентамера IgM, ди- и тримера секреторного IgA) [1,10].
Основные биологические характеристики антител:
1. Специфичность - способность взаимодействия с определенным (своим) антигеном (соответствие эпитопа антигена и активного центра антител).
2. Валентность - количество способных реагировать с антигеном активных центров (это связано с молекулярной организацией - моно- или полимер). Иммуноглобулины могут быть двухвалентными (IgG) или поливалентными (пентамер IgM имеет 10 активных центров). Двух- и более валентные антитела навывают полными антителами. Неполные антитела имеют только один участвующий во взаимодействии с антигеном активный центр (блокирующий эффект на иммунологические реакции, например, на агглютинационные тесты). Их выявляют в антиглобулиновой пробе Кумбса, реакции угнетения связывания комплемента.
3. Афинность - прочность связи между эпитопом антигена и активным центром антител, зависит от их пространственного соответствия.
4. Авидность - интегральная характеристика силы связи между антигеном и антителами, с учетом взаимодействия всех активных центров антител с эпитопами. Поскольку антигены часто поливалентны, связь между отдельными молекулами антигена осуществляется с помощью нескольких антител.
5. Гетерогенность - обусловлена антигенными свойствами антител, наличием у них трех видов антигенных детерминант:
- изотипические - принадлежность антител к определенному классу иммуноглобулинов;
- аллотипические - обусловлены аллельными различиями иммуноглобулинов, кодируемых соответствующими аллелями Ig гена;
- идиотипические - отражают индивидуальные особенности иммуноглобулина, определяемые характеристиками активных центров молекул антител. Даже тогда, когда антитела к конкретному антигену относятся к одному классу, субклассу и даже аллотипу, они характеризуются специфическими отличиями друг от друга (идиотипом). Это зависит от особенностей строения V- участков H- и L- цепей, множества различных вариантов их аминокислотных последовательностей [6].
Распространение вируса в организме блокируют в основном антитела. В процессе развития специфического иммунитета синтезируются антитела к большинству антигенов вируса. Однако считается, что вирусную инфекцию сдерживают в основном антитела к поверхностным гликопротеинам. Эти антигены, часто называемые протективными, локализованы на поверхности вирионов или экспрессируются на мембране зараженной вирусом клетки. Механизмы гуморального противовирусного иммунитета могут быть различными. Способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной [5].
Антитела, адсорбируясь на поверхности вирионов, блокируют его жизненно важные функции. Прежде всего, это блокада прикрепления к клетке хозяина, проникновения в нее, раздевание вируса. Адсорбция антител на белках капсида не позволяет некоторым вирусам (вирусу чумы плотоядных, кори и др.) проникать из клетки в клетку путем их слияния [9]. Кроме того, считают, что антитела, активируя систему комплемента, вызывают повреждения оболочки некоторых вирусов и блокируют клеточные рецепторы для вирусов. Однако в настоящее время этот процесс не считают существенным в противовирусной защите [11].
Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. Второй механизм действия антител на внутриклеточный вирус - это реакция антителозависимой клеточной цитотоксичности, осуществляемая ЕК-клетками. Антитела, фиксированные на мембране пораженной вирусом клетки, контактируют с ЕК-клетками (через Fc-фрагмент IgG), которые убивают зараженные клетки с помощью перфоринов и гранзимов [7].
Библиографический список
Бессарабов, Б.Ф. - Инфекционные болезни животных./ Б.Ф.Бессарабов, Е.С.Воронин.[Текст]- М.:Колос, 2007. – 66-89.
Гендон, Ю. З. Общая и частная вирусология./ Ю.З.Гендон.[Текст] – М.:Мир, 2008. – С.158-187.
Горьский, Б. В. Основы общей ветеринарной вирусологии. 2-е изд./Б.В.Горьский.[Текст] - М.:Колос, 2007. – С.214-217.
Земсков, М. В. Основы общей микробиологии, вирусологии и иммунологии. – 2-е изд./М.В.Земсков[Текст] - М.:Колос, 2011. – С.300-312.
Киселев, О.И. - Вопросы общей вирусологии. /О.И.Киселев, И.Н.Жилиский.[Текст] - Спб.:Инферно, 2007. – С.98-109.
Рудаков, Н.В. - Краткий курс лекций по медицинской микробиологии, вирусологии и иммунологии. Часть 1. Общая микробиология, вирусология и иммунология./Н.В.Рудаков[Текст] - Омск:Красно, 2009. – С.164-177.
Сергеев, В.А. - Вирусы и вирусные вакцины. / В.А.Сергеев, Е.А.Непоклонов, Т.И.Алипер.[Текст] - М.:DRAFT, 2007. – С.144-195.
Теппер, Е.З. - Практикум по микробиологии. /Е.З.Теппер, В.К.Шильникова.[Текст] - Спб:Дрофа, 2011. – С.25-36.
Читайте также:


