Диагностика гриппа птиц методом пцр

Цель исследования. Разработка норм времени методом полимеразной цепной реакции с использованием различных его вариаций при диагностике гриппа птиц.
Обычно с птицеводческих хозяйств биологический материал поступает партиями от 10 и более проб одновременно. В качестве наиболее распространенного количества одновременно проводимых исследований мы брали 10 проб. Независимо от количества одновременно участвующих в постановке ПЦР образцов каждый раз проводили постановку положительных и отрицательных контролей (2 образца).
Биологическим материалом для исследования служили помет; мазки из клоаки или с глотки и трахеи; трахеальные смывы; внутренние органы, мясо птицы, субпродукты; яйцо больной (подозреваемой в заболевании) птицы. Мазки и смывы для постановки ПЦР использовали без предварительной обработки. Остальной биологический материал подвергался предварительной обработке.
Постановку ПЦР осуществляли два ветеринарных специалиста, первый проводил исследования в 1 и 2 зонах, с переходом с одной зоны в другую с предварительной сменой одежды. Второй специалист работал в 3 зоне, где проводил детекцию продуктов амплификации методом электрофореза в агарозном геле и осуществлял учет и интерпретацию полученных результатов.
Разработаны нормы времени на подготовку биологического материала одной пробы, при одновременной подготовке 10 и 20 проб. Затраты времени ветеринарного специалиста на подготовку 1 пробы помета к исследованию составили 4,4 мин., 10 проб – 14,6 мин., 20 проб – 26,5 мин. Ветеринарный специалист на подготовку пробы внутренних органов, мяса, субпродуктов затрачивает 4,6, 17,7 и 32,7 мин.; яйца – 4,5, 16,9, 31,1 мин. соответственно. В зависимости от количества одновременно подготавливаемых проб затраты времени на подготовку одной пробы заметно сокращаются. Стандартные отклонения нормы времени составляют во всех случаях не более 2,0 %. В качестве модели нормы времени при подготовке всех видов биологического материала при диагностике гриппа птиц методом ПЦР использовали средние затраты труда ветеринарного специалиста, что составило при исследовании 1 пробы – 4,2 мин., 10 проб – 13,3 мин., 20 проб – 24,0 мин. Наблюдается заметная экономия времени на подготовку биоматериала с увеличением количества одновременно исследуемых проб.
Диагностику гриппа птиц методом ПЦР разными способами постановки реакции всегда начинают с выявления генома вируса Influenza virus A. При обнаружении РНК вируса осуществляется дальнейшее исследование с типированием выявленного вируса. Расчеты затрат рабочего времени ветеринарных специалистов на постановку ПЦР при диагностике гриппа птиц приведены в таблице 1.
Форматы постановки ПЦР
Затраты времени на исследование, мин.
Формат EPh (выявление РНК вируса гриппа А)
в том числе на 1 исследование
Формат EPh (выявление РНК вируса гриппа А и идентификация субтипов H5 и H7)
в том числе на 1 исследование
Формат FEP (выявление РНК вируса гриппа А)
в том числе на 1 исследование
Формат FEP (выявление РНК вируса гриппа А и идентификация субтипов H5, H7 и H9)
в том числе на 1 исследование
Формат FRT (выявление РНК вируса гриппа А)
в том числе на 1 исследование
Формат FRT (выявление РНК вируса гриппа А и идентификация субтипов H5, H7 и H9)
в том числе на 1 исследование
В структуре затрат рабочего времени при исследовании на грипп птиц в формате EPh (рисунок 1) при исследовании единичной пробы (отрицательная реакция) наибольший удельный вес занимает экстракция РНК из исследуемого материала (28,5 %) и детекция продуктов амплификации в агарозном геле (26,5 %), меньше – проведение амплификации (18,4 %) и постановка реакции обратной транскрипции (16,9 %). При одновременном исследовании 10 и 20 проб наибольший удельный вес приходится на экстракцию РНК – 49,9 и 54,9 %, в то же время заметно уменьшаются затраты времени, связанные с детекцией продуктов амплификации в агарозном геле – 14,0 и 10,9 % соответственно. Наблюдается так же уменьшение затрат времени при проведении амплификации и постановка реакции обратной транскрипции. Затраты времени, связанные с учетом интерпретации полученных результатов занимают в пределах десяти процентов и возрастают прямо пропорционально объемам одновременно проводимых исследований.
Затраты рабочего времени ветеринарного врача, проводящего исследование на грипп птиц методом ПЦР с электрофоретической детекцией продуктов амплификации в агарозном геле как при отрицательной, так и при положительной реакции постановка ПЦР занимает от 32,58 % (при исследовании 1 пробы, отрицательной реакции) до 72,3 % (при исследовании 20 проб, отрицательной реакции). Соответственно подготовительно-заключительные работы составляют от 27,7 до 67,4 %. Следует отметить, что наблюдается заметное сокращение затрат времени ветеринарного специалиста, связанные с обслуживанием рабочего места при одновременном исследовании 10 и 20 проб как при получении отрицательной реакции, так и при положительной реакции (когда дальнейшая работа сопряжена с типизацией вируса гриппа А).
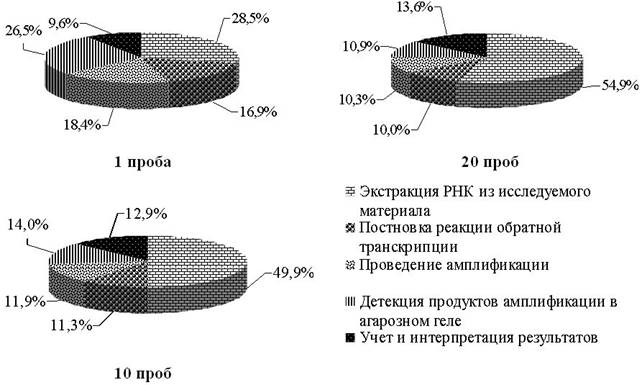
Аналогичным образом осуществлен анализ затрат рабочего времени ветеринарного врача при исследовании на грипп птиц методом ПЦР по конечной точке (формат FEP) и в режиме реального времени (формат FRT). Затраты времени ветеринарного специалиста при исследовании на грипп птиц в формате FEP при исследовании единичной пробы на выявление вируса гриппа А составляет 29,7 мин., при одновременном исследовании 10 проб – 93,1 и 20 проб – 166,7 мин., при идентификации субтипов вируса гриппа А 41,3, 121,8 и 214,6 мин. соответственно.
Выводы:
1. Метод полимеразной цепной реакции является эффективным методом диагностики болезней животных и птиц.
2. Оптимальное количество одновременно исследуемых проб методом ПЦР в условиях ветеринарных лабораторий 10 и более, это позволяет экономить время ветеринарного специалиста за счет сокращения отдельных рабочих процессов во время постановки реакции.
Рецензенты:
Поставить диагноз на грипп птиц можно путём выделения вируса и идентификации его в РСК, РН и РТГА, а также выявления специфических AT в процессе эпизоотии или по прошествии её (ретроспективная диагностика). В нашей стране биопромышленность выпускает 2 диагностических набора:
а) набор специфических АГ и сывороток к ним для диагностики гриппа птиц 13-и серотипов;
б) диагностический набор для идентификации вируса НБ и Ш (актуального эпизоотического типа).
Выделение вируса. Взятие и подготовка материала. В качестве вируссодержащего материала используют селезёнку, головной мозг, синусы, трахею, лёгкие, воздухоносные мешки, кишечник от больной птицы или свежих трупов. Материал в лабораторию доставляют в замороженном виде в термосе со льдом. Инфекционные титры вируса в назальных смывах бывают максимальными через 2-4 дня после заражения птицы и достигают 10 5 -10 7 ЭИДзо/мл смыва. Изолировать вирусы из клоачных смывов удаётся чаще всего на 5-8-й день после экспериментального заражения птицы.
Заражение куриных эмбрионов. Испытуемую суспензию инокулируют 9-10-дн КЭ (не менее 5 на одну пробу) в аллантоисную или амниотическую (лучше) полости общепринятым методом и инкубируют в течение 72 ч. Экстраэмбриональную жидкость каждого эмбриона раздельно проверяют на ГА-активность капельной РГА с 1 %-ной взвесью эритроцитов кур. При отсутствии положительной РГА проводят еще 3-5 слепых пассажей, используя для заражения КЭ эмбриональную жидкость предыдущего пассажа. Если титры ГА низкие, проводят таким же образом еще 2-3 дополнительных пассажа. Проба испытуемого материала считается отрицательной, если в 3-5 слепых пассажах не будет обнаружено ГА и патогенного действия вируса (гибели КЭ). При положительной РГА проводят идентификацию выделенного вируса.
Заражение культуры клеток. Вирус после 2-5 пассажей хорошо развивается в культуре фибробластов КЭ. ЦПД обычно проявляется через 24-48 ч (в зависимости от дозы и адаптации). Присутствие его устанавливают при помощи РГА и РГАд. Предложен ускоренный метод титрования инфекционности вируса гриппа в культуре клеток путем подсчета гемадсорбирующих клеток. Метод позволяет получить результат через 8 ч после заражения.
Биопроба на цыплятах. Испытуемую суспензию инокулируют цыплятам 2-3-месячного возраста. Летальную инфекцию у цыплят можно вызвать при любом методе заражения (подкожно, внутримышечно, в мозг, конъюнктиву) подтипами А1, А7 и А5. Заражение per os с кормом и водой удается непостоянно, лишь в случае высокой патогенности эпизоотического изолята гриппа. Зараженные цыплята, как правило, гибнут через 36-72 ч в зависимости от дозы и вирулентности возбудителя.
Индикация и идентификация вируса. Для этой цели широко используют методы ИФ, цитоскопию, биопробу (на птице и КЭ) и серологическую идентификацию. С помощью монАТ можно идентифицировать не только разные группы вирусов (ВГП и ПМВ), но и определять подтипы ВГП и серотипы ПМВ птиц, и даже штаммы внутри одного подтипа, а также локализацию компонентов вириона в зараженных клетках (МРВГП - МА клонов 1С6, 5С10, N:2 - МА клоны 303 и т.д.). На основе монАТ можно готовить диагностические препараты для выявления АГ и AT в РТГА, НИФ, РСК, ИФА и др. реакциях.
РГА. Для индикации вируса в патологическом материале можно использовать РГА. Надосадочную жидкость после центрифугирования суспензии проб из органов и тканей больной птицы, а также смывов исследуют в капельной или пробирочной РГА с 1%-ной суспензией эритроцитов кур или 0,5%-ной взвесью эритроцитов морской свинки. Реакцию учитывают через 20 мин и 1 ч. Специфичность определяют в РТГА.
Цитоскопия. Метод заключается в исследовании тканевых элементов в отпечатках, полученных со слизистой оболочки верхних дыхательных путей (лучше) и органов. Препараты высушивают и окрашивают одним из методов: по Романовскому, Пигаревскому, Быковскому и т. п. При окраске по Быковскому и Пигаревскому в цитоплазме клеток при гриппе обычно обнаруживают тельца-включения ярко-красного цвета; при окраске по Романовскому - фиолетового цвета. Внутриклеточные включения находят не только в клетках цилиндрического эпителия, но и в цитоплазме макрофагов, лейкоцитов и плоского эпителия. В настоящее время этот принцип исследования используется с применением люминесцентной микроскопии.
Метод простого флюорохромирования. На мазки-отпечатки из органов и смывов наносят 1-2 капли рабочего раствора акридина оранжевого (1:10000), покрывают покровным стеклом и свежий препарат (в течение 10 мин после приготовления) рассматривают в люминесцентном микроскопе. Ядра клеток выявляются по изумрудно-зеленому свечению, РНК плазмы клеток - в виде не резко ограниченных гранул красного или оранжевого цвета. В препарате, имеющем вирус гриппа, выявляются включения в виде четко отграниченных ярко-красных гранул в цитоплазме клеток.
Для идентификации гриппа млекопитающих и птиц наиболее простым и высоко достоверным методом является РТГА. РН - штаммоспецифическая и также высоко достоверная, но используется в диагностике значительно реже. Ее обычно применяют при некоторых неясных и спорных случаях.
Реакция связывания комплемента. Используют для определения типоспецифичности выделенного вируса, когда в РТГА не удается установить родственных связей между выделенным и эталонными штаммами вируса гриппа по антисывороткам к ним. В этом случае в РСК с эталонными иммунными сыворотками против вирусов гриппа типов А, В и С устанавливают типовую принадлежность штамма.
В последнее время для типирования нейраминидазы вируса начали применять РТНА, но в диагностической ветеринарной практике она пока еще не применяется. Ее используют, в основном, для изучения АГ связей различных штаммов вируса гриппа.
Реакция торможения гемагглютинации. Идентификацию испытуемого вируса проводят с набором эталонных штаммоспецифических гриппозных сывороток к его АГ вариантам. Для дифференциации в реакцию вводят сыворотку против вируса НБ. РТГА ставят микро- или макрометодом по общепринятой методике.
Иммуноферментный метод. Может быть использована как экспресс-метод диагностики гриппа птиц. Препараты готовят непосредственно ex tempore от убитой больной или свежепавшей птицы. Прямой метод ИФ позволяет определять АГ ВГП в мазках-отпечатках тканей птиц, идентифицировать АГ данного вируса из различных тканей организма, инкубационных яиц, печени зараженных эмбрионов и культур клеток фибробластов; выявить вирусный АГ даже в тех случаях, когда вирус из пораженных тканей выделить не удается.
В ветеринарной диагностической практике для идентификации выделенного вируса РДП не используют, так как необходимы концентрированные и очищенные АГ. В основном применяют ее для изучения АГ структуры вирусов гриппа. Разработаны наборы для ИФА с монАТ, непосредственно обнаруживающие ГА, нуклеокапсидный или матриксный белки вируса гриппа. Идентификацию вирусспецифической нуклеиновой последовательности предлагается осуществлять ПЦР с 2-мя типами праймеров (на основе генов неструктурного белка и ГА). Тест стандартизован для определения AT к ВГП в сыворотке крови у индеек.
Минимальные АГ различия между вариантами и родительским вирусом выявлялись только монАТ, продуцируемыми клетками гибридомы PEG-1 или фрагментами селезенки гипериммунных животных. МонАТ дают возможность точно проследить филогенетические взаимоотношения между вирусными штаммами в составе субтипа, а в сочетании с методами пептидного картирования и определения последовательности а.к. - выяснить молекулярную структуру АГ участка ГА.
Серодиагностика и ретроспективная диагностика. Обнаружение анти-ГА, ВНА и КСА - надежный признак протекающей или уже прошедшей инфекции ГП в стаде.
РТГА. Исследование парных сывороток проводят с диагностической целью при атипичном, часто вялом течении болезни с поражением органов дыхания. Сыворотку от диких птиц на присутствие противогриппозных AT исследуют при изучении роли перелетных птиц в распространении гриппа. Обязательным условием для ретроспективной диагностики ГП является одновременное исследование парных сывороток, так как для диагностических целей имеет значение сравнительный титр AT против вирусов различных серологических подтипов в 1-й и 2-й пробах сыворотки. Первую пробу сыворотки хранят при 4°С или в замороженном виде. Обе пробы исследуют одновременно. Перед постановкой реакций сыворотки прогревают при 60°С 30 мин, а затем освобождают от термостабильных ингибиторов, используя СО2, КО4 и др. методы. Если титр AT во 2-й пробе сыворотки (через 10-14 дн после заболевания) превышает не менее чем в 4 раза титр AT к тому же типу вируса в 1-й пробе, то РТГА считается положительной, подтверждающей диагноз гриппа птиц. При постановке РТГА с парными сыворотками больных птиц необходимо использовать не только набор эталонных штаммов (например, к вирусам A/Fowl plague, A/Chick/Scotland, A/Turkey, A/Duck), но и местные штаммы того птицехозяйства, где зарегистрирована болезнь. При анализе результатов РТГА необходимо указывать, сколько сывороток было с низким, средним и высоким титром к тому или иному штамму вируса гриппа. В ряде случаев вместо индивидуальных сывороток показатели иммунитета стада (после переболевания или прививки живой вакциной) можно изучить на сыворотках,.полученных от нескольких птиц. В этих случаях испытуемые сыворотки, взятые от отдельных птиц, нужно соединять в равных объемах. На протяжении опыта (120 дн после реконвалесценции) в сыворотках кур находили анти-ГА: до 75-го дня титры сохранялись примерно на одном уровне (5-5,8 log2), а в дальнейшем снижались (до 4,4-4,6 log2).
РСК применяют для обнаружения АГ и AT в целях ранней и ретроспективной диагностики гриппа. Ставят с аллантоисными жидкостями КЭ или с очищенными диагностикумами. РДП широкого применения не нашла, так как необходимы высокие концентрации чистых АГ. Среди исследователей нет единого мнения о чувствительности этой реакции. Некоторые авторы указывают, что чувствительность РДП сравнительно невысока, поскольку достоверные положительные результаты получали лишь при исследовании сывороток с титром AT в РТГА 1:80 и выше.
Реакция радиального гемолиза. В настоящее время используется для сероэпидемиологических исследований и при оценке эффективности противогриппозных вакцин. РРГ с ВГ А обладает выраженной штаммовой специфичностью: диаметр зон гемолиза с гомологичными АГ при исследовании сывороток хорьков, зараженных 6-ю различными вирусами, были в 1,5-3 раза больше, чем с гетерологичными. При правильном подборе штамма РРГ может быть с успехом использована для определения анти-ГА.
Показано хорошее совпадение результатов титрования AT в ELISA, РСК и ИФ. Однако в ELISA значительно выше (титр 1:481-1:1520), чем в РСК и РИФ. Сенсибилизацию лунок панелей проводят РНК-АГ вируса гриппа А. Предложен новый метод приготовления AT эритроцитарных диагностикумов к вирусам гриппа, которые с успехом могут быть изготовлены на основе любых штаммов вируса гриппа. Они позволяют определять типовую принадлежность эпизоотических и межэпизоотических штаммов ВГП, свиней и лошадей. В практической работе врачу ветеринарной лаборатории, возможно, придется встретиться не только с гриппом кур и уток, но и с гриппом индеек.
Таблица 107 - Лабораторные методы дифференциации гриппа и ньюкаслской болези птиц
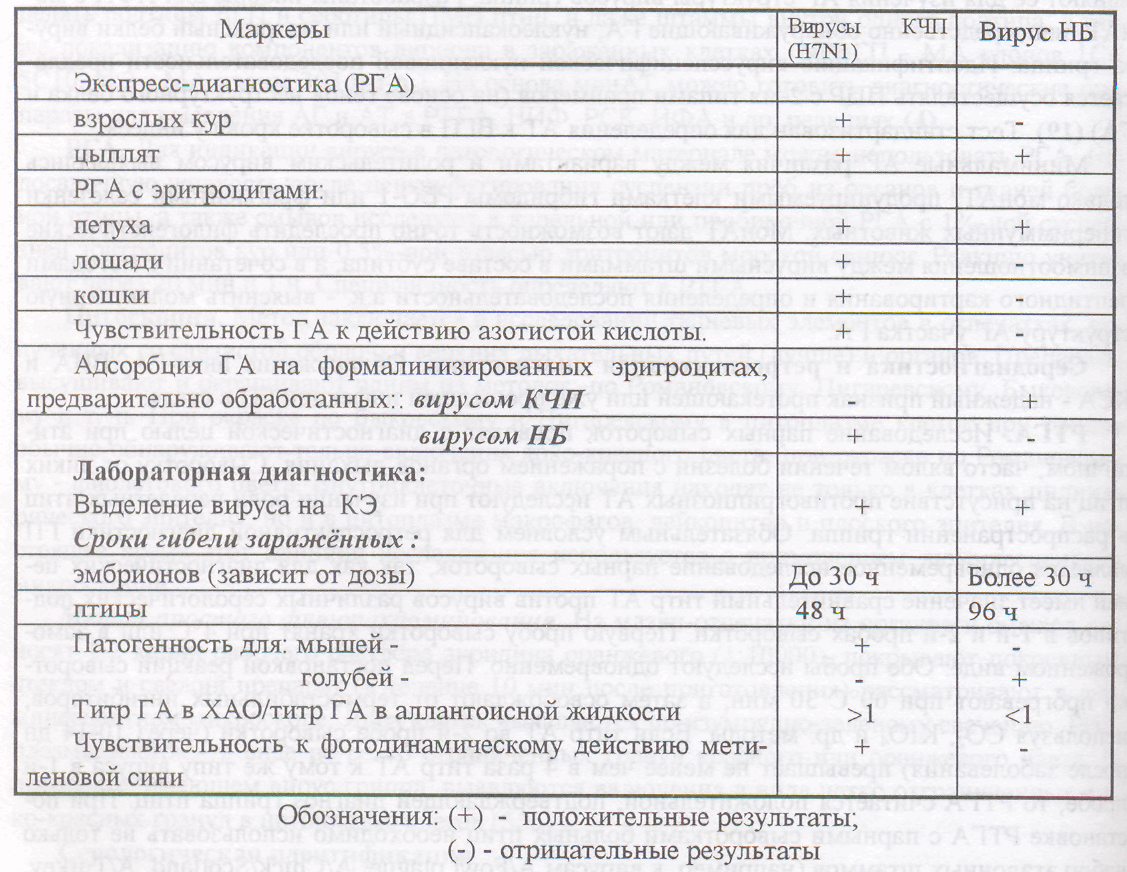
Умея диагностировать грипп кур и уток, имея набор диагностикумов, врач лаборатории при необходимости сможет поставить диагноз при гриппозной инфекции индеек.
При респираторных вирусных болезнях КРС, свиней и птиц (грипп, парагрипп, РС-инфекция) разработан направленный тест. Это новый иммуноферментный мембранный тест быстрого обнаружения вирусов гриппа в носоглоточных смывах. Чувствительность направленного метода Flu-А составляла 90%. С помощью этого теста более легко обнаруживается клеточно-ассоциированный АГ, присутствующий в клинических пробах, чем свободный вирус. С помощью Flu-А теста удалось обнаружить вирусы гриппа А птиц (субтипы ГА Н3 и Н6) и свиней (H1N1) в клоачных смывах и гомогенатах.
Дифференциальная диагностика. КЧП (H7N1) и другие формы гриппа птиц следует отличать от НБ, ИБ, ИЛТ, гемофилеза и респираторного микоплазмоза. Для идентификации вирусов НБ и КЧП используется диагностический набор.
В сомнительных случаях для дифференциального диагноза ставят РН на КЭ и заражают птиц, иммунных к вирусу НБ.
Лабораторная диагностика гриппа свиней
Грипп свиней (инфлюэнца свиней, энзоотическая бронхопневмония) - высоко контагиозная, остро протекающая болезнь, возникающая в холодное время года и характеризующаяся внезапным началом, резко выраженной лихорадкой, общей слабостью и поражением органов дыхания. Вирус гриппа свиней (ВГС) может вызвать заболевание людей и, наоборот, установлена возможность заражения свиней вирусом гриппа человека.
Болезнь впервые диагностирована в США в 1918 г. во время пандемии гриппа людей. Встречается во многих странах Европы и Америки, зарегистрирована и в бывшем СССР В отдельных хозяйствах причиняет большой экономический ущерб. Описана вспышка гриппа среди 115 свиноматок, вызванная "новым типом" вируса гриппа H3N2, который появился в Дании в 1990 г. Степень опоросов сократилась с 90 до 43% - через 14 дн после появления заболевания. Снизилось количество новорожденных поросят.
Выделение вируса. Выделение вируса на лабораторных животных. Используют хорьков, белых крыс, но чаще белых мышей. В качестве исходного материала для выделения вируса используют кусочки лёгкого, трахеи, бронхиальный экссудат, носовые смывы от больных свиней.
Мышей заражают интразально под эфирным наркозом и в течение 5- 7 дн наблюдают за ними, обращая внимание на общее состояние животных. Если животные не гибнут, их убивают. На вскрытии отмечают изменения в лёгких. Затем проводят ещё 3-4 пассажа. По мере адаптации вирулентность вируса для белых мышей значительно возрастает, они гибнут на 4-7-й, а иногда на 14-й день после заражения.
Выделение вируса на КЭ. Испытуемый материал инокулируют в аллантоисную или амниотическую полости 9-12-сут КЭ, которые после заражения инкубируют 48-72 ч, иногда до 96 ч при температуре 37°С. Для выделения вируса обычно проводят 2-3 слепых пассажа.
Выделение вируса в культуре клеток. Культура клеток почек поросёнка - универсальная биологическая система, применяя которую можно выделить вирус от больных свиней. Для быстрой индикации вируса гриппа в 1-слойных культурах почечного эпителия поросят используют РГАД с эритроцитами курицы, морской свинки или 0-группы человека. ГАд, положительная РГА, а также дегенеративные изменения клеток указывают на присутствие вируса в исследуемом материале. Вирус, вызвавший явление ГАд, должен адаптироваться к КЭ и вызывать накопление ГА.
Риноцитоскопия. Со слизистой оболочки носа делают мазки-отпечатки. Положительный диагноз ставят на основании обнаружения в отпечатке в первые 1-3 дн болезни большого количества клеток цилиндрического эпителия. Позднее содержание цилиндрических клеток в мазке уменьшается. Вопрос о диагностическом значении цитоплазматических включений при гриппе свиней неясен; в литературе нет достаточно обоснованных сообщений.
Обнаружение вируса в РГА. При постановке РГА обычно используют эритроциты кур или морской свинки. Берут 0,5 мл носового смыва, добавляют 0,5 мл 0,5%-ной взвеси эритроцитов, тщательно встряхивают и оставляют при комнатной температуре на 1-2 ч. Результаты реакции учитывают общепринятым методом. Чувствительность реакции можно повысить, увеличив объем испытуемых смывов. РГА со смывами используют только при массовом заболевании гриппом, так как процент специфических реакций не превышает 30.
(1).jpg)
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.

Программа разработана совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.
Методические указания МУК 4.2.2136-06 “Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 9 ноября 2006 г.)
В справке нет пункта 3!
Дата введения: с момента утверждения
ВГПА - вирус гриппа птиц типа А
Биобезопасность - биологическая безопасность
ЛПУ - лечебно-профилактические учреждения
МФА - метод иммунофлуоресцирующих антител
ОТ-ПЦР - метод обратной транскрипции - полимеразной цепной реакции
1.1 В настоящих методических указаниях определены порядок сбора, упаковки, хранения, транспортирования и выполнения лабораторных исследований биологического материала от больных (и умерших) пациентов при лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА).
1.2 Методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, лечебно-профилактических и других организаций, независимо от организационно-правовой формы.
3.1 При эпизоотическом неблагополучии в России и за рубежом по ВГПА и при отсутствии лабораторно подтвержденных случаев заболевания людей на данной территории:
3.1.1 Забор материала от пациентов (или умерших) с подозрением на инфекцию ВГПА проводят в лечебно-профилактических учреждениях (ЛПУ).
Применяемые на этом этапе тест-системы должны обеспечивать первичную идентификацию возбудителя как вируса гриппа типа А и дифференциацию штаммов этого вируса по типу гемагглютинина (например Н5).
3.1.4 При получении положительных результатов подтверждающего тестирования референс-лаборатория проводит изоляцию вируса, изучение его свойств и депонирование.
Максимальное внимание должно уделяться случаям ВГПА с предположительной передачей от человека человеку. Регистрация подобных случаев требует незамедлительного проведения комплекса противоэпидемических мероприятий и изучения генетических особенностей изолята ВГПА.
3.2 При наличии лабораторно подтвержденных случаев заболевания людей ВГПА на данной территории:
3.2.1 Забор материала проводят в ЛПУ при подозрении на заболевание ВГПА.
3.2.3 Обязательное подтверждающее тестирование в референс-лаборатории не проводится. Направление материала в референс-лабораторию осуществляется в случаях возникновения противоречивых результатов при первичном тестировании.
4.3 Для исследования забирают следующие виды клинического материала:
- смывы из полости носа и ротоглотки (для ОТ-ПЦР-анализа);
- мазки из полости носа (для МФА и ОТ-ПЦР-анализа) и ротоглотки (для ОТ-ПЦР-анализа);
- носоглоточное отделяемое (для выделения вируса, ОТ-ПЦР-анализа).
- фекалии (для ОТ-ПЦР-анализа).
Перечисленные выше процедуры по забору клинического материала врачи осуществляют в противочумных костюмах IV типа (или длинном хирургическом халате, с завязками на спине, шапочках), дополненных ватно-марлевыми повязками или респираторами типа ШБ-1 (или РБ) “Лепесток-200”. На руки надевают резиновые перчатки.
Целесообразно также включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж и биоптаты легких при возможности их забора. Данные процедуры осуществляет врачебный персонал, одетый в противочумный костюм I типа (или длинный хирургический халат, с завязками на спине, дополненный фартуком, бахилами, косынкой, очками, ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200” и перчатками).
Выбор времени забора клинического материала очень важен, так как наиболее высокое содержание вируса в дыхательных органах человека регистрируется в течение первых четырех дней после появления признаков заболевания. Образцы должны быть собраны в течение 3 сут. после появления клинических признаков, указанных в п. 6.1.
Для постмортальной диагностики используют аутоптаты легких, трахеи и селезенки.
От одного больного должно забираться не менее трех видов клинического материала. Обязательно следует забирать мазки из полости носа и роторлотки и носоглоточное отделяемое. Каждый образец материала помещают в отдельную транспортную емкость.
4.4 Сбор материала производят в пробирки со стабилизирующей средой, приготовленной согласно приложению 4, и/или в пробирки с транспортной средой, предоставляемой (или рекомендуемой) фирмой-производителем тест-систем.
4.5 Отправку материала в лабораторию осуществляют в транспортной таре со стабилизирующей средой (приложение 4).
1) в транспортную емкость (плотно закрывающиеся пластмассовые пробирки или флаконы с завинчивающимися крышками); плотно закрытый верхний конец транспортной емкости вместе с крышкой герметизируют различными пластификаторами (парафин, парафильм и др.); емкость маркируют;
2) в полиэтиленовый пакет подходящего размера с ватой (или другим гигроскопичным материалом) в количестве достаточном для адсорбции всего образца в случае его утечки; полиэтиленовый пакет следует герметично заклеить или запаять;
5.1.1 Образцы от одного пациента могут быть упакованы в один полиэтиленовый пакет. Не допускается упаковывать образцы материалов от разных людей в один и тот же пакет.
5.1.2 В полиэтиленовый пакет вкладывают бланк направления с указанием: наименование направляющего учреждения, ФИО больного, возраст, место жительства, предварительный диагноз, эпидемиологический анамнез, вид материала, дата и время взятия материала.
5.2 Герметично закрытые полиэтиленовые пакеты помещают в термоизолирующий плотнозакрывающийся контейнер (термос), приспособленный для транспортирования биологических материалов.
5.2.1 В термоконтейнеры и термосы помещают охлаждающие элементы или пакеты со льдом. К наружной стенке термоконтейнера или термоса прикрепляют этикетку с указанием вида материала, условий транспортирования, названия пункта назначения. Сроки и условия транспортирования упакованных проб клинического материала указаны в приложении 2.
5.3 Транспортирование проб клинического материала в референс-лабораторию, вирусологические лаборатории и лаборатории учреждений противочумной системы Роспотребнадзора осуществляется нарочным(и), информированным о правилах доставки материала в соответствии с п. 3.4. СП 1.2.036-95.
6.1 При отсутствии лабораторно подтвержденных случаев заболевания людей на данной территории лабораторные исследования с целью диагностики ВГПА следует проводить у пациентов с респираторными заболеваниями тяжелого течения и неясной этиологии при наличии как минимум двух из перечисленных (следующего комплекса - убрать) симптомов:
- фебрильная лихорадка с температурой тела выше 380C;
- затрудненное дыхание или дыхательная недостаточность;
- водянистая диарея при отсутствии слизи и крови в фекалиях;
в комбинации хотя бы с одним из следующих эпидемиологических признаков в период 1-7 дней перед появлением симптомов :
- посещение мест регистрации заболевания ВГПА у птиц или людей;
- тесный контакт (в радиусе 1 метра) с лицом, являющимся подозрительным, вероятным или подтвержденным случаем ВГПА;
- контакт с погибшими или больными птицами, уход, убой, ощипывание, разделка тушек, подготовка к употреблению домашней или дикой птицы или контакт с их останкам или объектами окружающей среды, контаминированными их фекалиями на территории, где в течение последнего месяца были заподозрены или подтверждены случаи инфекции ВГПА у животных или людей;
- манипуляции с образцами клинического материала (от животных или людей), подозрительным на зараженность ВГПА в лаборатории или в иной обстановке;
- употребление сырых или недостаточно приготовленных продуктов из домашней птицы на территории, где в течение последнего месяца были заподозрены или подтверждены случаи инфекции ВГПА у животных или людей.
- Тесный контакт с подтвержденно инфицированным ВГПА животным, но не домашними или дикими птицами (например, кошка или свинья).
Данный случай расценивается как подозрительный случай ВГПА.
Вероятный случай ВГПА - лицо, умершее от необъясненного острого респираторного заболевания, которое расценивается как эпидемиологически связанное по времени, месту и экспозиции с вероятным или подтвержденным случаем ВГПА, а также лицо, отвечающее критериям для подозрительного случая, и одному из дополнительных критериев:
a. инфильтраты или признаки острой пневмонии на рентгенограмме грудной клетки плюс признаки дыхательной недостаточности (гипоксемия, выраженное тахипноэ) или
b. положительный результат лабораторного подтверждения инфекции, вызванной вирусом гриппа А, но недостаточное лабораторное подтверждение инфекции.
6.2 При наличии лабораторно подтвержденных случаев заболевания людей ВГПА на данной территории показанием к обследованию являются клинические симптомы, приведенные в п. 6.1. Дополнительные эпидемиологические признаки являются необязательными.
6.3 Исследование секционного материала от умерших на наличие вируса ВГПА проводят при:
- сходстве клинической картины заболевания, приведшего к летальному исходу, с описанной в п. 6.1 или невозможности исключения такой клинической картины в анамнезе и при наличии в анамнезе хотя бы одного из перечисленных в п.п. 6.1 дополнительных эпидемиологических признаков.
6.4 Исследования проводят с использованием диагностических тест-систем, разрешенных к применению в установленном порядке. Для выявления ВГПА методом ОТ-ПЦР предпочтение должно отдаваться диагностическим тест-системам, которые обеспечивают максимальную контаминационную безопасность исследований.
6.5 При проведении первичного тестирования на наличие вируса ВГПА должны исследоваться не менее 2 видов клинического материала (например: мазки из полости носа и из ротоглотки) с использованием как минимум двух методов - ОТ-ПЦР и МФА.
6.6 При получении отрицательных результатов исследования всех образцов выдается окончательный отрицательный ответ.
При отсутствии регистрации заболевания людей, вызванных ВГПА, на данной территории при получении хотя бы одного положительного результата при МФА исследовании или использовании ОТ-ПЦР выдается предварительный положительный ответ и образцы направляют для подтверждающего тестирования в референс-лабораторию.
В период регистрации заболевания людей, вызванных ВГПА на данной территории, обязательное подтверждающее тестирование не проводят, и при получении хотя бы одного положительного результата при вирусологическом исследовании или использовании ОТ-ПЦР выдается окончательный положительный ответ.
6.7 При подтверждении в референс-лаборатории положительного результата первичного тестирования, при исследовании хотя бы одного вида клинического материала выдается окончательный положительный ответ.
При получении в референс-лаборатории отрицательных результатов исследования двух видов клинического материала проводится повторное тестирование. При получении аналогичного результата выдается окончательный отрицательный ответ.
7.1 Первичное исследование материала от больного, подозрительного на зараженность вирусом ВПГА, проводят в лабораториях, имеющих разрешение на работу с ПБА III-IV групп патогенности.
Подтверждающее тестирование осуществляется в референс-лаборатории.
7.2 Проведение работ, не связанных с накоплением вируса, образованием аэрозолей инфицированного материала (окраска и просмотр мазков, постановка серологических реакций с необеззараженным, диагностическим материалом, серологические исследования с необеззараженным материалом) осуществляют в противочумном костюме IV типа, дополненном ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200 и резиновыми перчатками. Работы проводят в боксе биологической безопасности II класса.
7.3 Проведение работ по заражению культур клеток или куриных эмбрионов, а также связанных с возможностью образования аэрозоля осуществляют в боксах безопасности III класса. Работы проводят в противочумном костюме IV типа, дополненном ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200 и резиновыми перчатками.
7.4 Аптечка экстренной профилактики лабораторий, проводящих диагностику заболеваний, вызванных ВГПА, должна быть укомплектована в соответствии с СП 1.3.1285-03 и дополнена двумя из следующих противовирусных препаратов: Циклоферона и Амиксина, Ремантадина, Альгирема, Арбидола и Озельтамивира (Тамифлю).
7.5 Режимы обеззараживания различных объектов при лабораторной диагностике ВГПА (в соответствии с СП 1.3.1285-03).
7.5.1 Обеззараживание поверхностей помещения (пол, стены, двери), оборудования, рабочих столов и др. - двукратным протиранием с интервалом 15 мин 6% раствором перекиси водорода или 3% раствором хлорамина (экспозиция 120 мин), либо любым дезинфицирующим средством, обладающим вирулицидной активностью, с последующей обработкой УФ в течение 60 мин.
Запрещено одновременное использование 6% раствора перекиси водорода и 3% раствора хлорамина в пределах одной лаборатории в связи с опасностью взрывоподобного характера протекания химической реакции при смешении этих растворов.
7.5.2 Обеззараживание защитной одежды осуществляют:
а) кипячением в 2% растворе соды в течение 30 мин с момента закипания;
б) замачиванием на 30 мин при 50. С в 3% растворе перекиси водорода с 0,5% моющего средства.
7.5.3 Обеззараживание перчаток - замачиванием на 60 мин в 6% растворе перекиси водорода с 0,5% моющего средства или в 3% растворе хлорамина.
7.5.4 Обеззараживание лабораторной посуды, автоклавируемых дозаторов, наконечников, вируссодержащих жидкостей, агарозного геля, инструментария из металла проводится методом автоклавирования - давление 2,0 кГс/см2 (0,2 Мпа), температура 132+-2. С, время 45 мин.
7.5.5 Обеззараживание дозаторов - двукратным протиранием поверхностей дозатора с интервалом 15 мин 6% раствором перекиси водорода, с последующей обработкой в парах формалина в течение 60 мин.
| Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации | Г.Г. Онищенко |
Рекомендуется использование следующей стабилизирующей среды для хранения и транспортировки материала от людей для дальнейших вирусологических исследований.
Среда готовится в стерильных условиях, автоклавирование не допускается, можно стерилизовать фильтрованием через нитроцеллюлозный стерильный фильтр в стерильную же посуду.
- среда для культур клеток N199, содержащая 0,5% BSA;
- пенициллин 2 х 10(6) ед./л, стрептомицин 200 мг/л, полимиксин В 2 х 10(6) ед./л, гентамицин 250 мг/л, нистатин 0,5 х 10(6) ед./л.
Методические указания МУК 4.2.2136-06 “Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 9 ноября 2006 г.)
Текст методические указания официально опубликован не был
2. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 9 ноября 2006 г.
Читайте также:


