Днк вирусы механизм действия
86. 1. Определение, химический состав вирусов, функции компонентов.
Функция нуклеиновой кислоты вируса: …
Функция белков вирусных частиц: …
Размножение вирусов, синтез их нуклеиновых кислот.
Где размножается вирус?
О видах вирусов
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
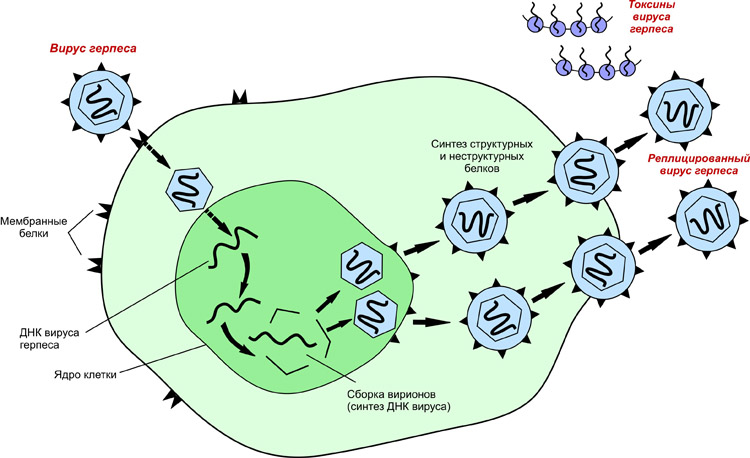
Как вирусная частица попадает в клетки.
Что происходит с вирусной частицей после её попадания в клетку.
86. 3. Онкогенные вирусы. См. п.87.
86. 4. ВИЧ. См. п.77 и 80.
86. 5. Прионы.
86. 1. Определение, химический состав вирусов, функции компонентов. –
Опеределение вируса.
Вирусами называют КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ С БЕЛКАМИ,
которые могут находиться во внешней среде вне клеток и
могут при попадании в организм проникать в клетки и размножаться внутри клеток.
Некоторые вирусы вдобавок к НК и белкам содержат липиды и углеводы.
Таким образом, вирусы не являются клетками, у вирусов нет органелл.
Отдельный комплекс нуклеиновых кислот с белками называется вирусной частицей или вирионом.
Функция нуклеиновой кислоты вируса:
нуклеиновые кислоты используются для синтеза белков вирусных частиц (кодируют первичную структуру белка).
Функция белков вирусных частиц:
1 – защищают НК от повреждений (НК сами по себе очень неустойчивы), образуя оболочку вокруг НК,
2 – участвуют в размножении вирусов в качестве ферментов и т.д. см. далее.
Углеводы вирусных частиц часто находятся на поверхности вирусных частиц и могут помогать вирусным частицам проникать в клетки.
Отдельная вирусная частица и вирусные частицы данного вида вирусов содержат только один вид НК – или ДНК, или РНК.
Вирусы, в вирионе которых находится ДНК, называются ДНК-овые вирусами,
а вирусы, в вирионе которых находится РНК, называются, РНК-овыми вирусами.
ДНК вируса может быть не только двухцепочечной, но и ОДНОЦЕПОЧЕЧНОЙ.
РНК вируса может быть как одноцепочечной (как в клетках), так и ДВУХЦЕПОЧЕЧНОЙ.
Размножение вирусов, синтез их нуклеиновых кислот.
Синтез нуклеиновых кислот вирусов происходит разными способами. –
1) Наряду с репликацией ДНК (см. п. 78),
2) у вирусов есть репликация РНК
3) и обратная транскрипция (см. п.80).
Какой бы ни была нуклеиновая кислота в самом вирионе,
при размножении вируса происходит синтез вирусных матричных РНК для синтеза вирусных белков (для трансляции).
Где размножается вирус?
Синтез вирусных нуклеиновых кислот и синтез вирусных белков может происходить только внутри клеток,
так как для синтезов нужны среда, рибосомы (осуществляются синтез белка), нуклеотиды и аминокислоты и т.д.
Поэтому размножаться вне клеток вирусы не могут. –
Пока вирус не проник в клетку, он не может размножаться, не может как-то влиять на обмен веществ в организме.
Поэтому наличие вируса (вирионов) в крови
не означает, что человек будет болеть болезнью, которая вызывается этим вирусом.
Он может заболеть, только если вирусные частицы проникнут в клетки,
а если они не проникнут в клетки, то человек не заболеет, хоть и будет носителем вируса.
О видах вирусов
Вирусы, содержащие разные нуклеиновые кислоты (то есть с разными последовательностями нуклеотидов) и разные белки, относят к разным видам вирусов.
Вирусные частицы с одинаковыми (или очень похожими) последовательностями нуклеотидов в НК, относятся к вирусу одного и того же вида.
Кроме того, последовательность нуклеотидов нуклеиной кислоты вируса данного вида
может меняться, то есть вирус может мутировать.
В итоге получается другой ШТАММ данного вида вируса, но сам вирус относится к тому же виду вирусов, что и до мутации.
Вирусы, которые поражают бактерии, называются БАКТЕРИОФАГАМИ.
Бактериофаги могут использоваться для внесения в клетку бактерии чужих для неё генов для синтеза клеткой белков, кодируемых этими генами,
То есть бактериофаги могут играть роль векторов – это используется генной инженерией.
В эукариотические клетки вирусы попадают не так, как в бактериальные (далее).
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
При попадании вирусной частицы в организм её должны заметить и уничтожить клетки иммунной системы
(с помощью АНТИТЕЛ – специальных белков, задача которых – распознавание антигенов)
для того чтобы вирус не успел проникнуть в клетку, размножиться в ней, убить её и заражать новые клетки.
Как вирусная частица попадает в клетки.
Проникновение вирусной частицы в клетку начинается с того, что
вирус связывается с определённым белком на поверхности клетки,
который таким образом выполняет функцию РЕЦЕПТОРА клетки для этого вируса.
Роль рецептора вируса обычно играют белки, предназначенные для других целей –
например, ВИЧ использует рецепторы хемокинов.
Если рецепторы вируса отличаются от обычных так, что вирус не может с их помощью проникнуть в клетку, то вирус не приведёт к заболеванию.
Причиной отличия рецептора может быть мутация гена, который кодирует этот рецептор.
Что происходит с вирусной частицей после её попадания в клетку.
После попадания вирусной частицы внутрь клетки
вирусная нуклеиновая кислота высвобождается, после чего
могут синтезироваться новые молекулы вирусной нуклеиновой кислоты (см. п.77)
и новые молекулы вирусных белков (п.82).
После этого из молекул вирусных нуклеиновых кислот и молекул вирусных белков
могут образовываться новые вирусные частицы –
так происходит РАЗМНОЖЕНИЕ ВИРУСОВ.
Новые вирусные частицы могут покидать клетку, в которой образовались,
и поступать в новые клетки, заражая всё новые и новые клетки.
Если заражённые вирусом клетки подвергнутся АПОПТОЗУ (см. п. 79),
то распространение вирусных частиц может затормозиться.
Поэтому замедленный апоптоз способствует распространению вирусной инфекции.
Накопление вирусных частиц в клетке может приводить к РАЗРУШЕНИЮ КЛЕТКИ;
кроме того, оно нарушает нормальную жизнедеятельность клетки и организма –
всё это приводит к появлению симптомов вирусной инфекции.
Нуклеиновые кислоты некоторых вирусов (см. ВИЧ далее) могут использоваться
в качестве матриц для образования двухцепочечных ДНК (вирусных ДНК),
которые способны встраиваться в ДНК человека –
это встраивание называется интегрированием в геном,
оно относится к ПЕРЕСТРОЙКАМ генома – см. п.79.
86. 3. Онкогенные вирусы. См. п.87.
Некоторые вирусы способствуют появлению онкологических заболеваний.
Такие вирусы называются онкогенными вирусами.
Примеры онкогенных вирусов:
вирус папилломы человека способен приводит к раку матки,
вирусы гепатитов В и С приводят к раку печени.
Онкогенные вирусы относят к группе биологических мутагенов – см. п.79.
Почему некоторые вирусы могут приводить к онкологическим заболеваниям (см. п.87 и п.92, 98):
потому что онкогенные вирусы приводят к таким МУТАЦИЯМ,
которые способствуют появлению онкологических заболеваний.
Например, считается, что онкогенными являются те вирусы,
которые приводят к встраиванию вирусных ДНК в ДНК (геном) человека (интегрируется).
Потому что это встраивание может изменить тот участок ДНК,
в который встраивается вирусная ДНК (то есть привести к мутации).
В норме, до мутации, протоонкоген кодирует белки, которые стимулируют деление клеток и относятся к онкобелкам.
В норме активность онкобелков регулируется,
поэтому они стимулируют деление клетки только тогда, когда нужно –
и поэтому деление клетки (и образованных при её делении клеток) не приводит к образование опухоли.
Но после мутации протоонкогена он может измениться так, что
кодируемые им онкобелки не смогут регулироваться
и станут стимулировать деление клетки постоянно, без остановки,
что может привести к появлению опухоли,
если мутантные клетки не подвергнутся апоптозу
или не уничтожатся клетками иммунной системы.
86. 4. ВИЧ. См. п.77 и 80.
ВИЧ – это вирус иммунодефицита человека.
Размножение ВИЧ в организме человека может привести к развитию СПИДа –
Синдрома Приобретённого Иммунодефицита Человека.
ВИЧ повреждает клетки иммунной системы (Т-хелперы, макрофаги),
что приводит к дефициту иммунных клеток и снижению иммунитета (иммунодефициту).
1. После попадания ВИЧ в организм человека
ВИЧ, как и все вирусы, сначала связывается с рецепторами на поверхности клеток:
ВИЧ связывается с рецепторами хемокинов
(хемокиновыми рецепторами;
хемокины – это гормоны, относятся к цитокинам)
и СД4 рецепторами на поверхности клеток иммунной системы.
Связыванию ВИЧ с рецепторами помогают гликопротеины, расположенные на поверхности вирусной частицы ВИЧ.
Есть люди, в организме которых есть ВИЧ, но у которых не развивается СПИД –
то есть они являются носителями вируса, они могут заразить ВИЧ,
но больными они не являются.
Предполагают, что это связано с тем, что ВИЧ не может размножаться в организме этих людей,
поскольку не проникает в их клетки из-за особенностей строения рецепторов ВИЧ у этих людей:
возможно, из-за мутаций генов, кодирующих эти рецепторы.
2. В качестве нуклеиновой кислоты в ВИЧ содержится одноцепочечная РНК.
В клетках РНК вируса становится матрицей для синтеза комплементарной ей цепи ДНК
(комплементарной ДНК, кДНК),
который катализируется ферментом обратная транскриптаза
(потому что синтез ДНК на матрице РНК называется обратной транскрипцией),
который содержался в вирусной частице ВИЧ.
Затем на матрице первой цепи ДНК синтезируется вторая цепь ДНК,
в результате чего образуется двухцепочечная ДНК.
Эта вирусная ДНК способна встраиваться в ДНК человека
с помощью фермента ИНТЕГРАЗЫ, который тоже содержится в вирусной частице ВИЧ.
3. В некоторый момент вирусная ДНК, находящаяся в составе ДНК человека,
может использоваться для синтеза вирусных РНК (то есть для транскрипции – п.80).
4. Вирусные РНК могут использоваться для синтеза вирусных белков (для трансляции) с помощью рибосом самой клетки.
5. Один из ферментов ВИЧ осуществляет расщепление полипептидной цепи, синтезированной на вирусной РНК;
этот фермент называется ПРОТЕАЗОЙ.
В итоге образуются вирусные белки, в том числе уже названные протеаза, интеграза и обратная транскриптаза.
6. Объединение вирусных белков с вирусной РНК приводит
к появлению новых вирусных частиц ВИЧ,
которые могут разрушать клетки, поступать в кровь и проникать в новые клетки.
Диагностика ВИЧ
осуществляется методом ПЦР и с помощью иммуноферментного анализа.
Метод ПЦР быстрее и надёжнее.
СПИД пока считается неизлечимым заболеванием.
Но замедлить развитие СПИДа и продлить жизнь человека, инфицированного ВИЧ, можно за счёт замедления размножения ВИЧ в организме заражённого.
Размножение ВИЧ замедляется за счёт применения лекарств,
снижающих активность ферментов ВИЧ, участвующих в размножении ВИЧ (см. выше),
то есть за счёт применения ИНГИБИТОРОВ ферментов ВИЧ.
Чем раньше начинают лечение инфицированного ВИЧ – тем дольше он проживёт. Поэтому важно вовремя делать анализ на ВИЧ при наличии оснований предполагать, что человек мог заразиться ВИЧ.
При наличии ВИЧ у беременной есть шанс родить здорового ребёнка,
если вовремя сделать анализ на ВИЧ и провести лечение.
Прионами называют белки с особой структурой, которая приводит к так называемым прионовым болезням:
куру, болезни Крейцфельдта-Якобы, почесухе овец, коровьему бешенству.
У прионов есть способность
превращать молекулы нормальных белков в прионы
за счёт того, что под влиянием структуры уже имеющихся молекул прионов
структура молекул ряда других белов может измениться так,
что эти молекулы тоже становятся прионами –
нерастворимыми в воде молекулами,
под влиянием которых могут стать прионами другие молекулы белков –
то есть происходит как бы цепная реакция;
из-за этого число прионов в организме становится всё больше.
Из-за этого свойства прионы считаются инфекционными белками,
а прионовые болезни считаются заразными
(заражение происходит при попадании прионов в организм – обычно в качестве пищи).
В случае с прионами увеличение числа болезнетворных молекул
происходит не путём деления клеток
(в отличие от бактериальных и других инфекций, где бактерии размножаются делением)
и не путём синтеза нуклеиновых кислот (см. выше о размножении вирусов),
а под влиянием уже имеющихся молекул прионов.
Прионы могут оказаться в организме не только в результате заражения
(не только при съедении пищи, содержащей прионы),
но и в результате мутаций генов некоторых белков.
Из-за своей структуры прионы не уничтожаются и не теряют свои вредные свойства при сколь угодно долгой варке, поэтому варка не является способом сделать пищу безопасной и свободной от прионов. Единственный способ исключить возможность заражения прионами при эпидемиях коровьего бешенства – это не употреблять в пищу мясо, тушёнку, консервы, желатин и т.д.А единственный способ уничтожить прионы - только сжечь. Прионы устойчивы и к действию других факторов, которые разрушают структуру обычных белков, то есть прионы устойчивы к денатурации под действием излучений, ультразвука и т.д.

Вирусы — это микроскопические патогены, заражающие клетки живых организмов для самовоспроизводства. Они состоят из одного вида нуклеиновой кислоты (или ДНК или РНК, но не обе вместе), которая защищена оболочкой, содержащей белки, липиды, углеводы или их комбинацию. Размер типичного вируса варьируется от 15 до 350 нм, поэтому его можно увидеть только с помощью электронного микроскопа.
В 1892 году русский ученый Д.И. Ивановский впервые доказал существование ранее неизвестного типа возбудителя болезней, это был вирус мозаичной болезни табака. А в 1898 году Фридрих Лоффлер и Пол Фрош нашли доказательства того, что причиной ящура у домашнего скота была инфекционная частица, которая меньше, чем любая бактерия. Это были первые шаги к изучению природы вирусов, генетических образований, которые лежат где-то в серой зоне между живыми и неживыми состояниями материи. На текущий момент описано около 6 тыс. вирусов, но их существует несколько миллионов.
Строение вирусов
Вне клеток-хозяев вирусы существуют в виде белковой оболочки (капсида), иногда заключенного в белково-липидную мембрану. Капсид обволакивает собой либо ДНК, либо РНК, которая кодирует элементы вируса. Находясь в такой форме вне клетки, вирус метаболически инертен и называется вирионом.
Простая структура, отсутствие органелл и собственного метаболизма позволяет некоторым вирусам кристаллизоваться, т.е. они могут вести себя подобно химическим веществам. С появлением электронных микроскопов было установлено, что их кристаллы состоят из тесно прижатых друг к другу нескольких сотен миллиардов частиц. В одном кристалле вируса полиомиелита столько частиц, что ими можно заразить не по одному разу всех жителей Земли.
Формы вирусов
Вирусы встречаются в трех основных формах. Они бывают:
- Сферическими (кубическими или полигидральными). Вирусы герпеса, типулы, полиомы и т.д.
- Спиральными (цилиндрическими или стержнеобразными). Вирусы табачной мозаики, гриппа, эпидемического паротита и др.
- Сложными. Например, бактериофаги.
Проникновение вирусов в клетку-хозяина
Капсид в основном защищает нуклеиновую кислоту от действия клеточного нуклеазного фермента. Но некоторые белки капсида способствуют связыванию вируса с поверхностью клеток-хозяев, и работают, как ключики, вставляемые в нужные замочки. Другие поверхностные белки действуют как ферменты, они растворяют поверхностный слой клетки-хозяина и таким образом помогают проникновению нуклеиновой кислоты вируса в клетку-хозяина.
Жизненный цикл вирусов сильно отличается у разных видов, но существует шесть основных этапов жизненного цикла вирусов:
Присоединение к клетке-хозяину представляет собой специфическое связывание между вирусными капсидными белками и рецепторами на клеточной поверхности. Эта специфика определяет хозяина вируса.
Проникновение следует за прикреплением: вирионы проникают в клетку-хозяина через рецептор-опосредованный эндоцитоз или слияние мембран. Это часто называют вирусной записью.
Проникновение вирусов в клетку достигается за счет:
Размножение вирусов
После того, как вирусный геном освобождается от капсида, начинается его транскрипция или трансляция. Именно эта стадия вирусной репликации сильно различается между ДНК- и РНК-вирусами и вирусами с противоположной полярностью нуклеиновой кислоты. Этот процесс завершается синтезом новых вирусных белков и генома (точных копий внедрённых).
Механизм репликации зависит от вирусного генома.
- ДНК-вирусы обычно используют белки и ферменты клетки-хозяина для получения дополнительной ДНК, она транскрибируется в РНК-мессенджер (мРНК), которая затем используется для управления синтезом белка.
- РНК-вирусы обычно используют ядро РНК в качестве матрицы для синтеза вирусной геномной РНК и мРНК. Вирусная мРНК направляет клетку-хозяина на синтез вирусных ферментов и капсидных белков и сборку новых вирионов. Конечно, есть исключения из этого шаблона. Если клетка-хозяин не обеспечивает ферменты, необходимые для репликации вируса, вирусные гены предоставляют информацию для прямого синтеза отсутствующих белков.
Чтобы преобразовать РНК в ДНК, вирусы должны содержать гены, которые кодируют вирус-специфический фермент обратной транскриптазы. Она транскрибирует матрицу РНК в ДНК. Обратная транскрипция никогда не происходит в неинфицированных клетках. Необходимый фермент, обратная транскриптаза, происходит только от экспрессии вирусных генов в инфицированных клетках.
Вироиды
Вироиды заражают только растения. Одни вызывают экономически важные заболевания сельскохозяйственных культур, в то время как другие являются доброкачественными. Двумя примерами экономически важных вироидов являются кокосный cadang-cadang (он вызывает массовую гибель кокосовых пальм) и вироид рубцовой кожицы яблок, который безнадежно портит товарный вид яблок.
30 известных вироидов были классифицированы в две семьи.
- Члены семейства Pospiviroidae, названные по имени вироида клубневого веретена картофеля, имеют палочковидную вторичную структуру с небольшими одноцепочечными областями, имеет центральную консервативную область, и реплицируются в ядре клетки.
- Avsunviroidae, названный в честь вироида авокадо, имеет как палочковидную, так и разветвленную области, но не имеет центральной консервативной области и реплицируется в хлоропластах растительной клетки.
В отличие от вирусов, которые являются паразитами механизма трансляции хозяина, вироиды являются паразитами клеточных транскрипционных белков.
Бактериофаги

Существуют тысячи разновидностей фагов, каждый из которых может заразить только один тип или несколько близких типов бактерий или архей. Фаги классифицируются по ряду семейств вирусов; например:
Как и все вирусы, фаги являются простыми организмами, которые состоят из ядра генетического материала (нуклеиновой кислоты), окруженного капсидом белка. Нуклеиновая кислота может представлять собой либо ДНК, либо РНК, и может быть двухцепочечной или одноцепочечной.
Существует три основных структурных формы фага:
- Икосаэдрическая (20-сторонняя) головка с хвостом
- Икосаэдрическая головка без хвоста
- Нитевидная форма
Во время заражения фаг прикрепляется к бактерии и вставляет в нее свой генетический материал. После этого фаг обычно следует одному из двух жизненных циклов: литическому (вирулентному) или лизогенному (умеренному).
Литические, или вирулентные, фаги захватывают механизм клетки, чтобы скопировать компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые частицы фага.
Лизогенные, или умеренные, фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги могут индуцироваться в соответствии с литическим циклом.
Существуют и другие жизненные циклы, в т.ч. псевдолизогенез и хроническая инфекция. При псевдолизогении бактериофаг проникает в клетку, но не использует механизм репликации клеток и не интегрируется в геном хозяина, просто как бы прячется внутри бактерии, не нанося ей никакого вреда. Псевдолизогенез возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.
При хронической инфекции новые фаговые частицы образуются непрерывно и длительно, но без явного уничтожения клеток.
Вскоре после открытия фаги начали использовать для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Но фаговая терапия тогда не была успешной, и после открытия антибиотиков в 1940-х годах она была практически заброшена. Однако с появлением устойчивых к антибиотикам бактерий терапевтическому потенциалу фагов уделяется все больше внимания.
Наше время с антибиотиками заканчивается. В 2016 году женщина в штате Невада умерла от бактериальной инфекции, вызванной Klebsiella pneumoniae, которая была устойчивой ко всем известным антибиотикам. Бактерии, устойчивые к колистину, антибиотику последней инстанции, были обнаружены на свинофермах в Китае. В настоящее время бактерии приспосабливаются к антибиотикам быстрее, чем когда-либо.
Покажите ножницы которыми вирусы разрезают молекулу РНК что бы встроиться для мутации.Может что нибудь придумаете другое.К примеру деление цепочка аминокислот получив энергию из вне как одноименные заряды распадается на две. К каждой соединятся только те какие были ранее (другие проскочат мимо),казалось бы копии,но внутренняя энергия разная(уменьшается увеличивается) поэтому распад и создание. Вся химия углерода на этом построена 1000 орган соединений создает у других хим элементов этого свойства нет. Иммунная система делает накладку(интерференция)с помощью энергии интерферонов пытаясь разрушить цепочку РНК вируса.Надо помочь организму но не вакциной(вирус быстро мутирует)

Для лечения гриппа и других ОРВИ АМИКСИН ® может применяться у взрослых и детей с 7 лет.
Узнать подробнее про АМИКСИН ® …

Противовирусный препарат АМИКСИН ® направлен на борьбу с большинством распространенных респираторных вирусов, включая вирусы гриппа.
Узнать больше…

Современные противовирусные препараты, такие как АМИКСИН ® , могут способствовать снижению риска развития осложнений на фоне гриппа и других ОРВИ.
Подробнее…


Для лечения гриппа и других ОРВИ у детей старше 7 лет АМИКСИН ® выпускается в дозировке 60 мг.
Узнать подробнее о детском "Амиксине"…

АМИКСИН ® обладает не только иммуностимулирующим, но и противовирусным действием за счет подавления трансляции вирус-специфических белков.
Узнать подробнее…

Вирусы гриппа и других ОРВИ способны формировать устойчивость к некоторым противовирусным препаратам. АМИКСИН ® способствует стимулированию собственных ресурсов организма на борьбу с инфекцией…
Читать подробнее…

Механизм действия противовирусных средств
Иммунная система умеет распознавать зараженные клетки, поэтому многие противовирусные лекарственные средства направлены на стимулирование собственного иммунитета. Они называются иммуностимуляторами (иммуномодуляторами).
Вообще, создание эффективного противовирусного средства — задача нетривиальная, поскольку вирусы паразитируют внутри клеток, и как в этом случае уничтожить пришельца, не нанеся вреда организму хозяина?
На сегодня в России чаще всего применяется клинико-фармакологическая классификация, означающая, что разделение препаратов на группы производится в зависимости от того, на какие именно виды вирусов они воздействуют [2] . Внутри каждой узкоспециализированной группы препаратов обычно приводится классификация противовирусных средств по механизмам их действия. Давайте изучим вопрос на конкретном примере:
Как можно убедиться, спектр противовирусных лекарственных средств весьма широк. Большую его часть составляют препараты прямого противовирусного действия (ПППД), что означает их специфичность, направленность на конкретные виды вирусов. Однако эти лекарства зачастую оказывают разрушающее воздействие не только на геном вируса и его способность к репликации (размножению), но и на здоровые клетки хозяина. В общем случае можно констатировать, что чем мощнее противовирусный препарат, тем больше у него побочных эффектов. Это обязательно следует учитывать.
В то же время существует категория противовирусных средств неспецифичного (широкого) спектра действия. Преимущественно, это иммуностимуляторы (иммуномодуляторы), призванные активизировать резервные силы организма для борьбы с самыми разнообразными вирусами и другими микроорганизмами.
Итак, вот пример некоторых противовирусных препаратов, разрешенных детям:
Ограничения по возрасту могут быть вызваны не только составом средства, но и его формой выпуска. Например, таблетки не рекомендуются для приема детям до 3 лет, а капсулы — до 7 лет.
- прикрепление вирусов к клеткам;
- проникновение их в клетки;
- размножение;
- выход из клеток.
- 6619
- 5,5
- 0
- 5

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов [1]:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA). Рисунок из Википедии.
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).

Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте. Рисунок из [12].
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами*.
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции. Фото с сайта vkjournal.ru.
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24]. Фото с сайта flickr.com.
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева. Рисунок из [26].
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Статья написана в соавторстве с Евгенией Щепенок.
Читайте также:


