Фагами называют вирусы которые заражают
Вирусы (от лат. Virus - яд) - это особая группа микроорганизмов меньших размеров и более простой организации, чем бактерии. Вирусы не имеют клеточной структуры, величина их измеряется нанометрами. Вирусы открыты русским ботаником Д. И. Ивановским в 1892 г. при изучении мозаичной болезни листьев табака, которая причиняла большой ущерб табачным плантациям Крыма. Открытие Д. И. Ивановского заложило основу новой науки - вирусологии.
Вирусы — внутриклеточные паразиты, вызывающие многие болезни человека (оспу, грипп, бешенство, корь, полиомиелит и др.), животных (ящур, чуму крупного рогатого скота) и растений ("мозаики" и другого вида заболевания полевых и огородных культур).
Вирусы разнообразны по форме, размерам и химическому составу. Большинство из них имеет палочковидную или сферическую форму. Некоторые вирусы состоят только из белка и одной нуклеиновой кислоты - ДНК или РНК, другие содержат еще и липиды, полисахариды. Вирусная частица называется вирионом. Нуклеиновая кислота (в виде спирали) находится внутри вириона, снаружи он покрыт белковой оболочкой (капсидом), состоящей из отдельных морфологических субъединиц (капсомеров). Вирусы выращивают на живых клетках или культуре тканей, так как на искусственных питательных средах они, как правило, не развиваются.
Вирусы обладают разной устойчивостью к внешним воздействиям. Многие инактивируются при 60"С до 10 мин, другие выдерживают температуру 90°С до 10 мин. Вирусы довольно легко переносят высушивание и низкие температуры, но мало устойчивы ко многим антисептикам, ультрафиолетовым лучам, радиоактивным излучениям.
Фаги - это вирусы микроорганизмов, вызывающие гибель — распад (лизис) их клеток. Вирусы бактерий называются бактериофагами или просто фагами, актиномицетов — актинофагами, вирусы грибов — микофагами, сине-зеленых водорослей (цианобактерий) - цианофагами.
Впервые лизис сибиреязвенных бактерий наблюдал Н. Ф. Гамалея в 1898 г. Д. Эррель в 1917 г. установил явление лизиса у бактерий дизентерии, им впервые был выделен и описан бактериофаг ("пожиратель") бактерий.
Морфология фага изучена с применением электронного микроскопа. Большинство фагов состоит из головки и отростка. Головка фага может иметь разную форму, чаще всего это многогранник, покрытый белковой оболочкой (капсидом). Внутри капсида расположена нуклеиновая кислота, чаще всего одна — ДНК или РНК. Отросток фага имеет внутренний полый стержень, по каналу которого ДНК фага переходит в клетку хозяина. Стержень снаружи покрыт чехлом, способным к сокращению. Стержень и чехол отростка состоят из белковых субъединиц. У некоторых фагов отросток заканчивается базальной пластинкой, которая имеет выступы (зубцы) и нити.
Фаги могут быть и нитевидной формы, могут состоять из одной головки, а могут быть с аналогами отростка (очень коротким отростком). Некоторые фаги имеют длинные отростки с несокращающимся или сокращающимся чехлом.
Фаги широко распространены в природе. Многие из них обладают специфичностью — могут воздействовать на определенный вид или группу родственных видов микроорганизмов.
Взаимодействие фага с микробной клеткой происходит в несколько фаз. Сначала фаг адсорбируется восприимчивой клеткой, затем под действием фермента фага (сходного с лизоцимом) в стенке микробной клетки образуется отверстие, через которое в клетку проникает только нуклеиновая кислота; пустая белковая оболочка головки и отростка остается снаружи клетки, а затем разрушается.
Под влиянием попавшей в клетку нуклеиновой кислоты фага перестраиваются все обменные процессы микробной клетки на синтез фаговых частиц: синтезируются фаговая нуклеиновая кислота и белковые субъединицы оболочек. Вначале формируются раздельно головки и отростки, которые затем объединяются в зрелые фаговые частицы. Через определенное время клетка хозяина погибает, разрушается и фаги выходят наружу.
Явление фаголизиса (растворение культур микроорганизмов) наблюдается на производствах, связанных с использованием микроорганизмов. Развитие фагов в культурах промышленных микроорганизмов приводит к тому, что клетки культуры лизируются, не успев синтезировать необходимые вещества. Это наносит предприятиям большой экономический ущерб. Так нередко лизируются молочно-кислые бактерии, входящие в состав заквасок для кисломолочных продуктов. Такие закваски не пригодны для употребления.
Бактериофаги, лизирующие зараженные ими бактерии, называют вирулентными. Некоторые фаги, однако, инфицируют бактерии, но не вызывают их лизиса; такие фаги называются умеренными. В клетке-бактерии - хозяина они не размножаются, но при делении бактерии передаются дочерним клеткам.
Фаги применяются в медицине для лечения и профилактики некоторых заболеваний, например дизентерии, холеры. Фаги исключительно удобны как модели для решения вопросов общебиологических, молекулярной биологии, генетики, медицины.
Поскольку бактериофаги не инфицируют клетки человека, они используются в медицинской терапии для лечения бактериальных заболеваний.
Факт 1: Бактериофаги имеют три основных типа структуры
Поскольку бактериофаги являются вирусами, они состоят из нуклеиновой кислоты (ДНК или РНК), заключенной в оболочку белка или капсид. У бактериофага также может быть хвост белка, прикрепленный к капсиду, с хвостовыми волокнами, простирающимися от хвоста.
Хвостовые волокна помогают фагу присоединяться к хозяину, а хвост обеспечивает ввод вирусных генов в хозяина. Бактериофаги могут иметь следующее строение:
- вирусные гены в капсидной головке и без хвоста;
- вирусные гены в капсидной головке с хвостом;
- нитевидный или стержневидный капсид с круглой одноцепочечной ДНК.
Факт 2: Бактериофаги упаковывают свой геном
Как вирусы укомплектовывают объемный генетический материал в свои капсиды? РНК-бактериофаги, вирусы растений и вирусы животных имеют механизм саморасширения, который позволяет вирусному геному вмещаться в контейнер капсида.
Похоже, что только у РНК вирусов этот механизм включает самосгибания. ДНК вирусы помещают свой геном в капсид с помощью специальных ферментов, известных как упаковочные ферменты.
Факт 3: Бактериофаги имеют два жизненных цикла
Бактериофаги способны воспроизводить либо лизогенные, либо литические жизненные циклы. Лизогенный цикл также известен как умеренный цикл, потому что хозяин не погибает. Вирус вводит свои гены в бактериальную хромосому. В этом цикле бактериофаг реплицируется внутри хозяина. Хозяин погибает, когда вновь реплицированные вирусы ломают или лизируют клетку-хозяина и освобождаются.
Факт 4: Бактериофаги переносят гены между бактериями
Бактериофаги помогают переносить гены между бактериями посредством генетической рекомбинации. Этот тип передачи генома известен как трансдукция. Трансдукция может быть достигнута либо литическим, либо лизогенным циклом. В литическом цикле, фаг вводит свою ДНК в бактерию, и ферменты разделяют бактериальную ДНК на кусочки. Гены фага направляют бактерии для получения большего количества вирусных генов и вирусных компонентов (капсиды, хвост и т.д.).
По мере того как новые вирусы начинают собираться, бактериальная ДНК может непреднамеренно входить в вирусный капсид. В этом случае фаг обладает бактериальной ДНК вместо вирусной. Когда этот фаг заражает другую бактерию, он вводит ДНК из предыдущей бактерии в клетку-хозяина. Затем донорская бактериальная ДНК встраивается в геном вновь инфицированной бактерии путем рекомбинации. В результате гены из одной бактерии переносятся в другую.
Факт 5: Бактериофаги могут создавать бактерии, вредные для человека
Бактериофаги играют роль в заболевании людей, превращая некоторые безвредные бактерии в возбудителей болезни. Некоторые виды бактерий, включая кишечную палочку, стрептококк пиогенес, холерный вибрион и шигеллы становятся вредными, когда гены, которые производят токсичные вещества, передаются им через бактериофаги. Эти бактерии могут заразить людей и вызвать пищевое отравление или даже смертельные заболевания.
Факт 6: Бактериофаги используются для борьбы с вредоносными бактериями
Ученые выделили бактериофагов, которые разрушают клостридиум диффициле, влияющих на пищеварительную систему, вызывая диарею и колит. Лечение этого типа инфекций бактериофагами дает возможность сохранить хорошие кишечные бактерии, уничтожая только клостридиум диффициле.
Бактериофаги рассматриваются в качестве отличной альтернативы антибиотикам. Из-за чрезмерного употребления антибиотиков устойчивые штаммы бактерий становятся все более распространенными. Бактериофаги также используются для уничтожения других вредоносных бактерий, включая лекарственно-устойчивые кишечную палочку и золотистый стафилококк.
Факт 7: Бактериофаги играют важную роль в углеродном цикле мира
Бактериофаги являются наиболее распространенным вирусами в океане. Фаги, известные как Pelagiphages, заражают и уничтожают бактерии группы SAR11. Эти бактерии превращают молекулы растворенного углерода в углекислый газ и влияют на количество углерода в атмосфере Земли. Pelagiphages играют важную роль в углеродном цикле планеты, уничтожая бактерии SAR11, размножающиеся с высокой скоростью и очень хорошо адаптирующиеся к различным инфекциям.

Вирусы — это микроскопические патогены, заражающие клетки живых организмов для самовоспроизводства. Они состоят из одного вида нуклеиновой кислоты (или ДНК или РНК, но не обе вместе), которая защищена оболочкой, содержащей белки, липиды, углеводы или их комбинацию. Размер типичного вируса варьируется от 15 до 350 нм, поэтому его можно увидеть только с помощью электронного микроскопа.
В 1892 году русский ученый Д.И. Ивановский впервые доказал существование ранее неизвестного типа возбудителя болезней, это был вирус мозаичной болезни табака. А в 1898 году Фридрих Лоффлер и Пол Фрош нашли доказательства того, что причиной ящура у домашнего скота была инфекционная частица, которая меньше, чем любая бактерия. Это были первые шаги к изучению природы вирусов, генетических образований, которые лежат где-то в серой зоне между живыми и неживыми состояниями материи. На текущий момент описано около 6 тыс. вирусов, но их существует несколько миллионов.
Строение вирусов
Вне клеток-хозяев вирусы существуют в виде белковой оболочки (капсида), иногда заключенного в белково-липидную мембрану. Капсид обволакивает собой либо ДНК, либо РНК, которая кодирует элементы вируса. Находясь в такой форме вне клетки, вирус метаболически инертен и называется вирионом.
Простая структура, отсутствие органелл и собственного метаболизма позволяет некоторым вирусам кристаллизоваться, т.е. они могут вести себя подобно химическим веществам. С появлением электронных микроскопов было установлено, что их кристаллы состоят из тесно прижатых друг к другу нескольких сотен миллиардов частиц. В одном кристалле вируса полиомиелита столько частиц, что ими можно заразить не по одному разу всех жителей Земли.
Формы вирусов
Вирусы встречаются в трех основных формах. Они бывают:
- Сферическими (кубическими или полигидральными). Вирусы герпеса, типулы, полиомы и т.д.
- Спиральными (цилиндрическими или стержнеобразными). Вирусы табачной мозаики, гриппа, эпидемического паротита и др.
- Сложными. Например, бактериофаги.
Проникновение вирусов в клетку-хозяина
Капсид в основном защищает нуклеиновую кислоту от действия клеточного нуклеазного фермента. Но некоторые белки капсида способствуют связыванию вируса с поверхностью клеток-хозяев, и работают, как ключики, вставляемые в нужные замочки. Другие поверхностные белки действуют как ферменты, они растворяют поверхностный слой клетки-хозяина и таким образом помогают проникновению нуклеиновой кислоты вируса в клетку-хозяина.
Жизненный цикл вирусов сильно отличается у разных видов, но существует шесть основных этапов жизненного цикла вирусов:
Присоединение к клетке-хозяину представляет собой специфическое связывание между вирусными капсидными белками и рецепторами на клеточной поверхности. Эта специфика определяет хозяина вируса.
Проникновение следует за прикреплением: вирионы проникают в клетку-хозяина через рецептор-опосредованный эндоцитоз или слияние мембран. Это часто называют вирусной записью.
Проникновение вирусов в клетку достигается за счет:
Размножение вирусов
После того, как вирусный геном освобождается от капсида, начинается его транскрипция или трансляция. Именно эта стадия вирусной репликации сильно различается между ДНК- и РНК-вирусами и вирусами с противоположной полярностью нуклеиновой кислоты. Этот процесс завершается синтезом новых вирусных белков и генома (точных копий внедрённых).
Механизм репликации зависит от вирусного генома.
- ДНК-вирусы обычно используют белки и ферменты клетки-хозяина для получения дополнительной ДНК, она транскрибируется в РНК-мессенджер (мРНК), которая затем используется для управления синтезом белка.
- РНК-вирусы обычно используют ядро РНК в качестве матрицы для синтеза вирусной геномной РНК и мРНК. Вирусная мРНК направляет клетку-хозяина на синтез вирусных ферментов и капсидных белков и сборку новых вирионов. Конечно, есть исключения из этого шаблона. Если клетка-хозяин не обеспечивает ферменты, необходимые для репликации вируса, вирусные гены предоставляют информацию для прямого синтеза отсутствующих белков.
Чтобы преобразовать РНК в ДНК, вирусы должны содержать гены, которые кодируют вирус-специфический фермент обратной транскриптазы. Она транскрибирует матрицу РНК в ДНК. Обратная транскрипция никогда не происходит в неинфицированных клетках. Необходимый фермент, обратная транскриптаза, происходит только от экспрессии вирусных генов в инфицированных клетках.
Вироиды
Вироиды заражают только растения. Одни вызывают экономически важные заболевания сельскохозяйственных культур, в то время как другие являются доброкачественными. Двумя примерами экономически важных вироидов являются кокосный cadang-cadang (он вызывает массовую гибель кокосовых пальм) и вироид рубцовой кожицы яблок, который безнадежно портит товарный вид яблок.
30 известных вироидов были классифицированы в две семьи.
- Члены семейства Pospiviroidae, названные по имени вироида клубневого веретена картофеля, имеют палочковидную вторичную структуру с небольшими одноцепочечными областями, имеет центральную консервативную область, и реплицируются в ядре клетки.
- Avsunviroidae, названный в честь вироида авокадо, имеет как палочковидную, так и разветвленную области, но не имеет центральной консервативной области и реплицируется в хлоропластах растительной клетки.
В отличие от вирусов, которые являются паразитами механизма трансляции хозяина, вироиды являются паразитами клеточных транскрипционных белков.
Бактериофаги

Существуют тысячи разновидностей фагов, каждый из которых может заразить только один тип или несколько близких типов бактерий или архей. Фаги классифицируются по ряду семейств вирусов; например:
Как и все вирусы, фаги являются простыми организмами, которые состоят из ядра генетического материала (нуклеиновой кислоты), окруженного капсидом белка. Нуклеиновая кислота может представлять собой либо ДНК, либо РНК, и может быть двухцепочечной или одноцепочечной.
Существует три основных структурных формы фага:
- Икосаэдрическая (20-сторонняя) головка с хвостом
- Икосаэдрическая головка без хвоста
- Нитевидная форма
Во время заражения фаг прикрепляется к бактерии и вставляет в нее свой генетический материал. После этого фаг обычно следует одному из двух жизненных циклов: литическому (вирулентному) или лизогенному (умеренному).
Литические, или вирулентные, фаги захватывают механизм клетки, чтобы скопировать компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые частицы фага.
Лизогенные, или умеренные, фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги могут индуцироваться в соответствии с литическим циклом.
Существуют и другие жизненные циклы, в т.ч. псевдолизогенез и хроническая инфекция. При псевдолизогении бактериофаг проникает в клетку, но не использует механизм репликации клеток и не интегрируется в геном хозяина, просто как бы прячется внутри бактерии, не нанося ей никакого вреда. Псевдолизогенез возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.
При хронической инфекции новые фаговые частицы образуются непрерывно и длительно, но без явного уничтожения клеток.
Вскоре после открытия фаги начали использовать для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Но фаговая терапия тогда не была успешной, и после открытия антибиотиков в 1940-х годах она была практически заброшена. Однако с появлением устойчивых к антибиотикам бактерий терапевтическому потенциалу фагов уделяется все больше внимания.
Наше время с антибиотиками заканчивается. В 2016 году женщина в штате Невада умерла от бактериальной инфекции, вызванной Klebsiella pneumoniae, которая была устойчивой ко всем известным антибиотикам. Бактерии, устойчивые к колистину, антибиотику последней инстанции, были обнаружены на свинофермах в Китае. В настоящее время бактерии приспосабливаются к антибиотикам быстрее, чем когда-либо.
Покажите ножницы которыми вирусы разрезают молекулу РНК что бы встроиться для мутации.Может что нибудь придумаете другое.К примеру деление цепочка аминокислот получив энергию из вне как одноименные заряды распадается на две. К каждой соединятся только те какие были ранее (другие проскочат мимо),казалось бы копии,но внутренняя энергия разная(уменьшается увеличивается) поэтому распад и создание. Вся химия углерода на этом построена 1000 орган соединений создает у других хим элементов этого свойства нет. Иммунная система делает накладку(интерференция)с помощью энергии интерферонов пытаясь разрушить цепочку РНК вируса.Надо помочь организму но не вакциной(вирус быстро мутирует)
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
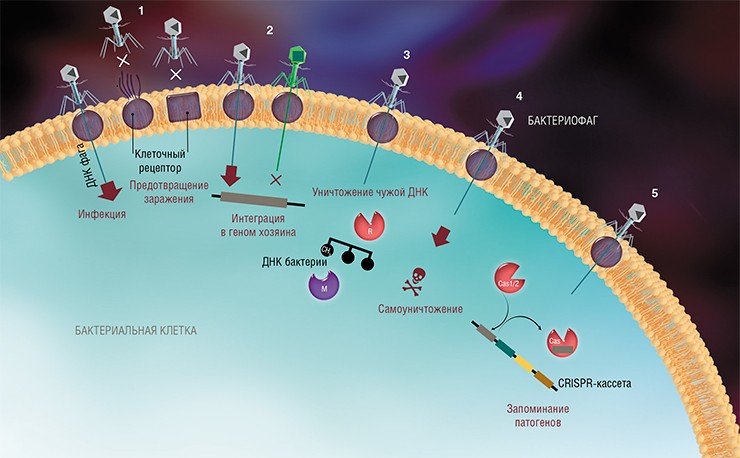
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Открытие вирусов
В 1892 году Д.И. Ивановский (см. Рис. 1), изучая мозаичную болезнь табака (см. Рис. 2), установил, что причиной заболевания является некое инфекционное начало, содержащееся в листьях больных растений, которое проходит через фильтр, задерживающий обыкновенные бактерии. Если профильтрованный сок внести в листья здоровых растений, то они также заболевают мозаичной болезнью.

Рис. 1. Д.И. Ивановский

Рис. 2. Мозаичная болезнь табака
В 1898 году независимо от Ивановского аналогичные результаты получил голландский микробиолог М. Бейеринк. Однако он предположил, что мозаичную болезнь табака вызывают не мельчайшие бактерии, а некое жидкое заразное начало, которое он назвал фильтрующим вирусом.
Размеры вирусов определяются нанометрами (20-200 нм), поэтому их изучение началось после открытия электронного микроскопа. В настоящее время описаны вирусы практически всех групп живых организмов.
Строение вирусов
Вирусы – неклеточные формы жизни. Они состоят (см. Рис. 3) из фрагмента генетического материала (РНК или ДНК), составляющего сердцевину вируса, и защитной оболочки, которая называется капсид. У некоторых вирусов (герпес, грипп) есть дополнительная липопротеидная оболочка – суперкапсид, которая возникает из плазматической мембраны клетки-хозяина.

Рис. 3. Строение вируса
Вирусы не способны к самостоятельной жизнедеятельности. Они могут проявлять свойства живого, только попав в клетку-хозяина. Они используют потенциал и энергию этой клетки для создания своих новых вирусных частиц, следовательно, вирусы являются внутриклеточными паразитами.
Размножение вирусов
Обычно вирус связывается с поверхностью клетки-хозяина и проникает внутрь. Каждый вирус ищет своего хозяина, то есть клетки строго определенного вида. Например, вирус – возбудитель гепатита (желтуха) проникает и размножается только в клетках печени, а вирус эпидемического паротита (свинка) – только в клетках околоушных слюнных желез человека.
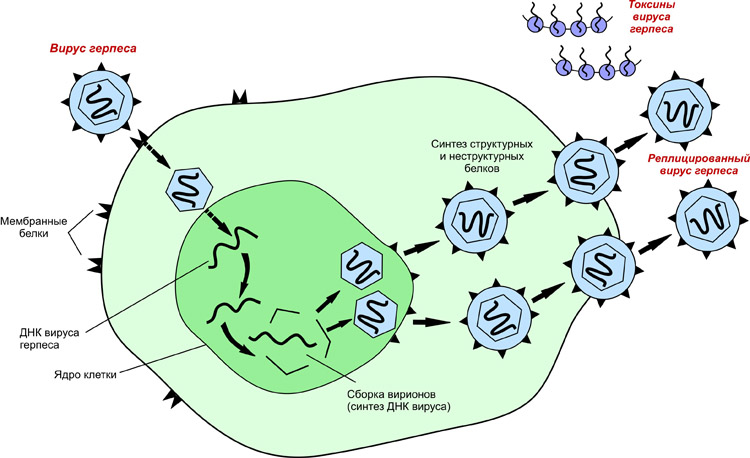
Проникнув внутрь клетки-хозяина, вирусная ДНК или РНК начинает взаимодействовать с ее генетическим аппаратом таким образом, что клетка начинает синтезировать белки, свойственные вирусу (см. Рис. 4).

Рис. 4. Схема репродукции вируса
При заражении ретровирусом (например, вирус иммунодефицита человека (ВИЧ)), у которого в качестве генетического материала используется молекула РНК, наблюдается другая картина. При попадании ретровируса в клетку-хозяина происходит обратная транскрипция. То есть на основе вирусной РНК синтезируется вирусная ДНК, которая встраивается в ДНК человека. Такой тип взаимодействия вируса с клеткой называется интегративным, а встроенная в состав хромосомы клетки ДНК вируса называется провирусом. Далее провирус реплицируется (удваивается) в составе хромосомы и переходит в геном дочерних клеток. Однако под влиянием некоторых физических и химических факторов провирус может выщепляться из хромосомы клетки и переходить к продуктивному типу взаимодействия, то есть синтезировать новые вирусные частицы.
При заражении ВИЧ человек чувствует себя здоровым, пока вирусный генетический материал встроен в хромосому человека. Однако при выщеплении этого вирусного генетического материала из клетки она начинает образовывать новые вирусные частицы, вследствие чего развивается смертельное заболевание – синдром приобретенного иммунодефицита (СПИД).
Вирусы являются возбудителями большого количества заболеваний человека: корь, грипп, оспа, краснуха, энцефалит, свинка, гепатиты, СПИД. Известен также целый ряд заболеваний растений, вызываемых вирусами, например мозаичная болезнь табака, томатов, огурцов или скручивание листьев картофеля. Всего описано около 500 видов вирусов, поражающих клетки позвоночных животных, и около 300 вирусов растений. Некоторые вирусы участвуют в злокачественном перерождении клеток и тем самым провоцируют онкологические заболевания.
ДНК- и РНК-содержащие вирусы
В зависимости от содержащегося генетического материала вирусы подразделяются на ДНК-содержащие и РНК-содержащие.
Одноцепочные РНК-содержащие вирусы подразделяются на:
1. Плюс-нитевые (положительные). Плюс-нить РНК этих вирусов выполняет наследственную (геномную) функцию и функцию информационной РНК (иРНК).
2. Минус-нитевые (отрицательные). Минус-нить РНК этих вирусов выполняет только наследственную функцию.
К РНК-содержащим вирусам относятся более 
вирусов, вызывающих респираторные заболевания, а также вирус гриппа, кори, краснухи, свинки, ВИЧ. Также существует специфическая группа вирусов – арбовирусы, которые переносятся членистоногими.
Двухцепочные ДНК-содержащие вирусы вызывают такие заболевания, как папиллома человека или герпес, гепатит В (гепатит А и гепатит С вызывается РНК-содержащими вирусами).
ДНК-содержащие вирусы поражают также растения. Они вызывают, например, золотую мозаику бобов или полосатость у кукурузы.
Вирус гепатита С
По своему строению вирус гепатита С – это РНК-содержащий вирус, имеющий сферическую форму, сложно устроенный (см. Рис. 5).
В качестве генетического материала такой вирус содержит линейную однонитчатую молекулу РНК.

Рис. 5. Гепатит С
Вопреки бытующим предрассудкам, подцепить вирус гепатита C невозможно через социальные контакты (поцелуи, объятия), через продукты или воду, через грудное молоко. Вы ничем не рискнете, если разделите с носителем вируса трапезу или напитки. Заразиться гепатитом C можно при контакте с кровью инфицированного человека либо половым путем.
В настоящее время для лечения гепатита С используют два препарата: Интерферон альфа и Рибавирин.
Бактериофаги

Рис. 6. Бактериофаг (Источник)
Особую группу вирусов составляют бактериофаги (или просто фаги), которые заражают бактериальные клетки (см. Рис. 6). Фаг укрепляется на поверхности бактерии при помощи специальных ножек и вводит в ее цитоплазму полый стержень, через который проталкивает внутрь клетки свою ДНК или РНК. Таким образом, генетический материал фага попадает внутрь бактериальной клетки, а капсид остается снаружи. В цитоплазме начинается репликация генетического материала фага, синтез его белков, построение капсида и сборка новых фагов. Уже через 10 мин после заражения в бактерии формируются новые фаги, а через полчаса бактериальная клетка разрушается, и из нее выходят около 200 заново сформированных вирусов – фагов, способных заражать другие бактериальные клетки (см. Рис. 7). Некоторые фаги используются человеком для борьбы с болезнетворными бактериями, вызывающими холеру, дизентерию, брюшной тиф.

Рис. 7. Схема размножения бактериофага (Источник)
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Читайте также:


