Иммунофлюоресцентный метод на грипп
В настоящее время широко применяются серологические реакции (СР), в которых участвуют меченые АГ или АТ. К ним относятся реакция иммунофлюоресценции, радиоиммунный и иммуноферментный методы, реакция иммуноблотинга, проточная цитометрия и электронная микроскопия.
1) для серодиагностики инфекционных заболеваний, т. е. для выявления АТ с помощью набора известных конъюгированных (химически соединённых) с различными метками (ферментами, флюорохромными красителями), антигенов;
2) для определения микроорганизма или его серовара с помощью стандартных меченных диагностических антител (экспресс-диагностика).
Готовят диагностические сыворотки иммунизацией животных соответствующим АГ, затем выделяют иммуноглобулины и конъюгируют их со светящимися красителями (флюорохромами), ферментами, радиоизотопами.
Диагностических моноклональных антител получают с помощью гибридных клеток, образованных путем слияния иммунного В-лимфоцита с миеломной клеткой. Гибридомы способны быстро размножаться in vitro в культуре клеток и продуцировать при этом иммуноглобулин, характерный для взятого В-лимфоцита.
Меченые СР по специфичности не уступают другим СР, а по своей чувствительности они превосходят все СР.
Реакция иммунофлюоресценции (РИФ)
В качестве метки используются светящиеся флюорохромные красители (изотиоционат флюоресцеина и др.).
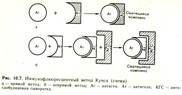
Существуют различные модификации РИФ. Для экспресс – диагностики инфекционных заболеваний - для выявления микробов или их антигенов в исследуемом материале применяется РИФ по Кунсу.
Выделяют два метода РИФ по Кунсу: прямой и непрямой.
Компоненты прямой РИФ:
1) исследуемый материал (испражнение, отделяемое носоглотки и др.);
2) меченая специфическая иммунная сыворотка, содержащая АТ к искомому антигену;
3) изотонический раствор хлорида натрия.
Мазок из исследуемого материала обрабатывают меченой антисывороткой.
Происходит реакция АГ-АТ. При люминесцентном микроскопическом исследовании в том участке, где локализуются комплексы АГ-АТ, обнаруживают флюоресценцию метки (рис.34).
Компоненты непрямой РИФ, предназначенной для экспреесс-диагностики гриппа А:
1) исследуемый материал смыв с носоглотки больного с подозрением на грипп;
2) специфическая антисыворотка с антителами против вируса гриппа А;
3) антиглобулиновая сыворотка (АТ против иммуноглобулина), меченная флюорохромом;
4) изотонический раствор хлорида натрия.
Мазок из исследуемого материала сначала обрабатывают иммунной сывороткой к искомому антигену, а затем – меченной антиглобулиновой сывороткой.
Иммунные комплексы АГ-АТ – меченные АТ обнаруживаются при помощи люминесцентного микроскопа.
Преимущество непрямого метода состоит в том, что нет необходимости приготовления широкого набора флюоресцирующих специфических сывороток, а применяется лишь одна флюоресцирующая антиглобулиновая сыворотка.
Для серологической диагностики гриппа А,то есть для определения антител против вируса гриппа А в сыворотке крови с помощью непрямой РИФиспользуют гриппозный диагностикум (антиген вируса гриппа А). Серодиагностика вирусных инфекций в основном носит ретроспективный характер и применяется для подтверждения диагноза и эпидемиологического анализа.
Иммуноферментный анализ (ИФА): конкуретный способ (определение HBs-АГ вируса гепатита В) и непрямой способ (серологическая диагностика ВИЧ - инфекции)
Иммуноферментный анализ (ИФА)
В качестве метки используются ферменты: пероксидаза, щелочная фосфатаза и др.
Индикатором реакции является способность ферментов вызывать цветные реакции при действии на соответствующий субстрат. Например, субстратом для пероксидазы является раствор ортофенилдиамина (ОФД) или тетраметилбензидин (ТМБ).
Наиболее широко применяется твердофазный ИФА (рис.35), непрямой и конкурентные способы (рис.36).
Результаты ИФА можно оценить визуально и измерением оптической плотности на спектрофотометре (ИФА – анализаторе).
К преимуществам ИФА следует отнести:
- простота методов оценки реакции;
- легко поддаётся автоматизации.
В качестве примеров приводятся следующие типы ИФА:
А) конкурентный тип
Предназначен для выявления поверхностного антигена вируса гепатита В (HBs Ag) в сыворотках и плазме крови при диагностики вирусного гепатита В и определения носительства HBs Ag.
1) исследуемый материал – сыворотка или плазма крови;
2) антитела к HBs Ag, адсорбированные на поверхности лунки полистиролого микропланшета;
3) конъюгат – мышиные моноклональные антитела к HBs Ag, меченые пероксидазой;
4) ортофенилендиамин (ОФД) – субстрат;
5) фосфатно – солевой буфер;
6) контрольные сыворотки:
- положительная (сыворотка с HBs Ag);
- отрицательная (сыворотка без HBs Ag).
1. Внесение контрольных и исследуемых сывороток.
2. Инкубация 1 час при 37°С.
3. Отмывание лунок.
4. Внесение конъюгата.
5. Инкубация 1 час при 37°С.
6. Отмывание лунок.
7. Внесение ОФД. При наличии HBs Ag раствор в лунках желтеет.
8. Учёт ИФА проводят по оптической плотности с помощью фотометра. Степень оптической плотности будет обратно пропорциональной концентрации исследуемых HBs Ag.
Реакция протекает в три фазы:
1. HBs Ag исследуемой сыворотки (плазмы) связывается с гомологичными АТ, адсорбированными на поверхности лунки. Образуется ИК АГ-АТ. (HBs Ag – anti HBs АТ).
2. Антитела к HBs Ag, меченые пероксидазой связываются с оставшимися свободными детерминантоми HBs Ag комплекса АГ-АТ. Образуется комплекс АТ-АГ-меченые АТ (anti HBs АТ - HBs Ag - anti HBs АТ, меченые пероксидазой).
3. ОФД взаимодействуют с пероксидазой комплекса АТ-АГ-АТ и происходит жёлтое окрашивание.
В) непрямой тип
Является основной тестовой реакцией диагностики ВИЧ – инфекции.
Цель: Серологическая диагностика ВИЧ-инфекции – обнаружение антител к антигенам ВИЧ.
1) исследуемый материал – сыворотка крови (АТ к АГ-м ВИЧ);
2) синтетические пептиды имитирующие 2-х антигенов ВИЧ: gp 120 и gр 41, адсорбированные на поверхности полистироловой лунки;
3) антиглобулиновая сыворотка, меченная пероксидазой, полученная путём иммунизации кроликов глобулинами человека (АТ к АТ);
5) фосфатно-солевой буфер;
6) контрольные сыворотки:
1. Внесение контрольных и исследуемых сывороток.
2. Инкубация 30 минут при 37°С.
4. Внесение антиглобулиновой сыворотки меченой ферментом.
5. Инкубация 30 минут при 37°С.
Реакция протекает в 3 фазы:
1. Антитела к ВИЧ исследуемой сыворотки связываются с гомологичными антигенами (gр 120 и gр 41), и на поверхности сорбента образуется ИК АГ-АТ ( АГ ВИЧ - АТ к ВИЧ).
2. Образование ИК АГ-АТ-АТ, меченое пероксидазой, т.к. АТ исследуемой сыворотки являются антигенами для антиглобулиновой сыворотки.
3. ОФД взаимодействует с пероксидазой комплекса АГ-АТ-АТ, и происходит жёлтое окрашивание раствора лунки. Степень ферментативной активности прямо пропорциональна концентрации исследуемых АТ.
Дата добавления: 2018-02-28 ; просмотров: 1397 ;
Р-ция имм.флюоресценции. Прямая: меченные Ат наносят на мазок и после промываются. Остаются лишь Ат-Аг, которые светятся в микроскопе.Меченая флюрохромная дифгностическая антисыворотка. Непрямой: используют немеченую диагностическую сыворотку, а присоеденения к антигену выявляют с помощью меченой антиглобулиновой сыворотки,выявляющий ИГ немеченой диогностической сыворотки,присоединившийся к искомому антигену. Для экспресс-диаг.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью.
Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток.
Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности.
Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета.
Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
36) Иммуноферментный анализ. Компоненты реакции, варианты ее использования в лабораторной диагностики инфекционных заболеваний.
Иммуноферментный анализили метод — выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (10 10 -10 12 г/л).
Твердофазный ИФА— вариант теста, когда один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания,
I. При определении антител (левый рисунок) в лунки планшеток с сорбированным антигеном последовательно добавляют сыворотку крови больного, антиглобулиновую сыворотку, меченную ферментом, и субстрат/хромоген для фермента.
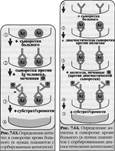
II. При определении антигена (правый рисунок) в лунки с сорбированными антителами вносят антиген (напр., сыворотку крови с искомым антигеном), добавляют диагностическую сыворотку против него и вторичные антитела (против диагностической сыворотки), меченные ферментом, а затем субстрат/хромоген для фермента.
Конкурентный ИФАдля определения антигенов: искомый антиген и меченный ферментом антиген конкурируют друг с другом за связывание ограниченного количества антител иммунной сыворотки.
Другой тест - Конкурентный ИФА для определения антител: искомые антитела и меченные ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Иммуноблоттинг — высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. Иммуноблоттинг используют как диагностический метод при ВИЧ-инфекции и др.
Выявление вируса гриппа серотипов А и В (Influenza virus A/B), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (РНК) вируса в образце биоматериала.
Синонимы английские
Influenza serotypes A/B, RNA [real-time polymerase chain reaction, RT-PCR, quantitative RT-PCR, qPCR, qRT-PCR].
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки) и носа, мокроту.
Как правильно подготовиться к исследованию?
- Рекомендуется употребить большой объем жидкости (воды) за 8-12 часов до сбора мокроты.
- Не принимать пищу, не пить и не полоскать горло в течение 2-3 часов до исследования.
- За 3-4 часа до взятия мазков из ротоглотки (зева) и носа не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не закапывать капли/спреи в нос, не жевать жевательную резинку, не курить. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
Общая информация об исследовании
Influenza virus – это оболочечный вирус, характеризующийся наличием сегментированного негативного РНК-генома и нуклеокапсида в форме спирали. Он относится к семейству Orthomixoviridae. На основании структурных различий нуклеопротеида выделяют 3 серотипа Influenza: A, B и С. Серотип A встречается как людей, так и у животных, в то время как варианты B и C поражают преимущественно людей. Именно серотип А ответственен за подавляющее большинство случаев сезонных (эпидемических) и пандемических вспышек гриппа.
Идентификация вируса гриппа должна быть осуществлена в кратчайшие сроки, что связано с высокой заразностью этого заболевания. Кроме того, эффективность противовирусных препаратов максимальна при их назначении в первые 48 часов после инфицирования, что также диктует необходимость своевременной постановки окончательного диагноза. Среди многих "быстрых" диагностических тестов особое место занимает полимеразная цепная реакция в режиме реального времени (РТ-ПЦР). Полимеразная цепная реакция в реальном времени (РТ-ПЦР) – это метод молекулярной диагностики, позволяющий выявлять в биологическом материале (например, в мокроте) фрагменты генетического материала (РНК) возбудителя инфекции. Благодаря высокой чувствительности и специфичности метода, а также возможности получить результат в наболее короткие сроки, РТ-ПЦР заменила другие, применяемые ранее, методы диагностики гриппа: выделение вируса в культуре клеток, а также серологические исследования и иммуноферментный анализ.
Многие прямые лабораторные тесты, разработанные для идентификации Influenza, основаны на выявлении белковых компонентов наружной оболочки вируса: гемагглютинина (H) и нейраминидазы (N). Эти белки являются основными факторами, определяющими степень болезнетворности вируса, а также используются для диагностики и классификации выявляемого вируса гриппа. Они обладают выраженной изменчивостью (известно 16 разновидностей N и 9 разновидностей H серотипа Influenza A) (чем вызваны ежегодные сезонные вспышки гриппа), а также создает определенные трудности при идентификации вируса гриппа с помощью этих методов. Структурное разнообразие антигенов H и N приводит к тому, что чувствительность большинства прямых лабораторных тестов (таких как прямая иммунофлюоресценция и ELISA) составляет около 65-75 %. Исследование РТ-ПЦР основано на выявлении консервативной последовательности ДНК, общей для разных штаммов вируса гриппа серотипов А и В, что обуславливает максимальную чувствительность этого теста (98-100 %).
В отличие от других тестов, чувствительность исследования РТ-ПЦР практически не изменяется при взятии материала на фоне начатой терапии противовирусными препаратами. Это связано с тем, что в реакции выявляется не сам вирусный агент, а фрагмент вирусной ДНК. По этой же причине положительный результат исследования не всегда указывает на наличие живого вируса (репликацию) и не всегда означает, что пациент остается заразным для окружающих.
В отличие от других лабораторных тестов (в первую очередь, экспресс-тестов для определения антигена вируса гриппа), результат РТ-ПЦР в меньшей степени зависит от распространенности гриппа среди населения. РТ-ПЦР характеризуется редкими ложноположительными и ложноотрицательными результатами как во время эпидемии, так и в период низкой заболеваемости гриппом.
Идентификация вируса гриппа с помощью РТ-ПЦР возможна в течение более длительного времени от начала заболевания по сравнению с большинством других тестов. Тем не менее взятие отделяемого носо/ротоглотки для исследования с помощью РТ-ПЦР должно быть произведено не позднее чем через 72-96 часов (оптимально в первые 48-72 часа). Это связано с тем, что интенсивная репликация Influenza при поражении верхних дыхательных путей происходит в течение первых 4 суток заболевания. У пациентов с вовлечением нижних отделов дыхательных путей вирусная нагрузка сохраняется высокой более длительный период. Исследование отделяемого носоглотки и мокроты дает лучшие результаты по сравнению с исследованием отделяемого ротоглотки.
При обследовании пациента с клиническими признаками Influenza-ассоциированной инфекции верхних дыхательных путей следует выполнить анализ отделяемого носо/ротоглотки. При обследовании пациента с признаками Influenza-ассоциированной инфекции нижних дыхательных путей анализ мазков из зева и носа необходимо дополнить исследованием мокроты. Исследование мокроты также должно быть осуществлено при отрицательном результате, который дал анализ отделяемого верхних дыхательных путей у пациента с клиническими признаками гриппа. Следует повторить РТ-ПЦР при отрицательном результате исследования мокроты у пациента с клиническими признаками Influenza-ассоциированной инфекции нижних дыхательных путей.
Для более точной диагностики Influenza рекомендуется сочетание РТ-ПЦР с дополнительными общеклиническими исследованиями. Кроме того, необходимо исключить бактериальную суперинфекцию.
Для чего используется исследование?
Когда назначается исследование?
- острой респираторной вирусной инфекции (внезапное острое начало болезни, лихорадка, боль в горле, боль в мышцах, головная боль, светобоязнь, сухой кашель, боль в грудной клетке, одышка);
- острой энцефалопатии в период эпидемии гриппа (судороги, атаксия, нарушение сознания).
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
Причины отрицательного результата:
- отсутствие Influenza-ассоциированной инфекции.
- Положительный результат исследования не означает, что пациент остается заразным для окружающих.
- Анализ не позволяет выявлять Influenza серотипа С.
Кто назначает исследование?
Инфекционист, педиатр, врач общей практики, анестезиолог-реаниматолог.
Литература
- Kamps B. S, Hoffmann C, Preiser W. Influenza Report 2006 / B. S. Kamps, С. Hoffmann, W. Preiser W. – Flying Publisher, 2006.
- Wang R, Taubenberger JK. Methods for molecular surveillance of influenza. Expert Rev Anti Infect Ther. 2010 May;8(5):517-27.
- Schuchat A, Bell BP, Redd SC. The science behind preparing and responding to pandemic influenza: the lessons and limits of science. Clin Infect Dis. 2011 Jan 1;52 Suppl 1:S8-12.
- Pregliasco F, Mensi C, Camorali L, Anselmi G. Comparison of RT-PCR with other diagnostic assays for rapid detection of influenza viruses. J Med Virol. 1998 Oct;56(2):168-73.
- WHO Global Influenza Surveillance Network. Manual for the laboratory diagnosis and virological surveillance of influenza. – World Health Organization, 2011.
Возбудители гриппа – РНК-содержащие вирусы, относятся к семейству Orthomyxoviridae, в котором выделяют три рода – Influenzavirus A, Influenzavirus В и Influenzavirus С, каждый из которых имеет по одному виду – Influenza A virus, Influenza В virus и Influenza С virus. Вирусы гриппа А и В ежегодно вызывают эпидемии большей или меньшей интенсивности практически во всех странах мира. Вирусы гриппа А широко распространены в природе, их выделяют от большинства зверей и птиц, в связи с чем они имеют высокий пандемический потенциал, так как способны преодолевать межвидовые барьеры. Вирусы гриппа В выделяли только от людей. Вирусы гриппа С вызывают спорадические заболевания в форме ОРЗ. Вирусы гриппа А, В и С дифференцируют друг от друга с помощью иммунологических и молекулярно-генетических методов. Вирусы гриппа А дополнительно типируют на подтипы (или субтипы) в соответствии с антигенной структурой поверхностных гликопротеинов: гемагглютинина – на 16 субтипов и нейраминидазы – на 9 субтипов.
После перенесенного гриппа нередко наблюдаются осложнения в виде отитов и синуситов, пневмонии, вследствие присоединения бактериальных инфекций. Наиболее опасен грипп возможным быстрым развитием вирусной пневмонии с геморрагическим синдромом, приводящей к острой дыхательной недостаточности, что характерно для гриппа А/H1N1pdm2009. Дифференциальная диагностика гриппа и других ОРВИ возможна только с помощью лабораторных методов исследования.
Показания к обследованию. Острое начало с высокой лихорадкой (выше 38°С), продолжающейся до 3-х дней и синдромом интоксикации (головная боль преимущественно в области лба, боль в глазных яблоках, ломота в мышцах, сильная слабость) с последующим развитием катаральных явлений.
Материал для исследований
- Мазки из носоглотки – культуральное исследование, обнаружение АГ;
- мокрота, плевральная жидкость, аспираты из зева, БАЛ – выявление РНК вирусов (поражение нижних дыхательных путей);
- мазки со слизистой носоглотки и ротоглотки – выявление РНК вирусов (поражение верхних дыхательных путей);
- сыворотка крови – обнаружение АТ.
Этиологическая лабораторная диагностика включает культуральное исследование, выявление РНК возбудителей и их АГ, обнаружение специфических АТ.
Сравнительная характеристика методов лабораторной диагностики. Культуральное исследование основано на изоляции вирусов в живых культурах клеток млекопитающих или на развивающихся куриных эмбрионах с последующим определением активности гемагглютинации (агглютинации вирусами эритроцитов) и идентификацией субтипов гемагглютинина в реакции торможения гемагглютинации с типоспецифическими сыворотками. Методы отличаются трудоемкостью и длительностью, во многом зависят от качества не стандартизованных реагентов, в связи с чем для рутинной диагностики практически не используется, но применяется в эпидемиологических исследованиях.
При выявлении специфических АТ оценивают нарастание их титра в образцах крови полученных с интервалом в 2 недели (парные сыворотки) с использованием методов РТГА, РСК. Результаты в значительной степени зависят от состояния иммунной системы пациента.
Показания к применению различных лабораторных исследований. Выявление РНК вирусов гриппа методом ПЦР используется для быстрой этиологической диагностики гриппа и скрининга клинического материала в целях эпидемиологического надзора. Выявление АТ используется для определения уровня коллективного гуморального иммунитета, ретроспективной диагностики и ретроспективного анализа природы эпидемических вспышек гриппа.
Особенности интерпретации результатов лабораторных исследований. Исследования методом ПЦР позволяют обнаружить РНК вируса гриппа А, В или С и/или определить подтип вируса гриппа А. Несоблюдение техники получения мазков из носоглотки и ротоглотки или использование данного материала при диагностике вирусной пневмонии, может сильно снизить информативность исследования вплоть до получения отрицательного результата.
Учитывая возможность сочетанного инфицирования вирусами гриппа и другими возбудителями ОРЗ, желательно проведение исследования полного спектра возбудителей.
В связи с недостаточной чувствительностью тестов для выявления АГ методами РИФ и ИХА получение отрицательных результатов при их использовании не исключает возможного инфицирования.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Известно более 200 разновидностей вирусов, избирательно поражающих респираторный тракт человека (возбудителей ОРВИ).
У большинства возбудителей ОРВИ первичное размножение вирусов происходит в слизистой оболочке дыхательной системы, поэтому клиническая картина сходная, заболевание протекает в виде ринита, ринофарингита, как правило, в легкой форме. У детей раннего возраста вирусы могут поражать нижние отделы респираторного тракта, и болезнь протекает в более тяжелой форме в виде бронхитов, бронхиолитов, пневмоний. Наиболее тяжело протекающей острой вирусной респираторной инфекцией является грипп, который часто принимает эпидемическое распространение, характеризуется явлениями общей интоксикации, лихорадкой, поражением дыхательного тракта, нервной и сердечно-сосудистой систем. Максимальное число тяжелых форм течения инфекции наблюдается в период пандемий, обусловленных новым вариантом вируса гриппа.
Лаборатория оуществляет диагностику с помощью экспресс-методов, вирусологических и серологических методов исследования. Быстрая (экспресс) диагностика гриппа и ОРВИ:
1)метод флюоресцирующих антител (МФА) - основан на выявлении вирусных антигенов в клетках эпителия носовых ходов, конъюнктивы (при явлениях конъюнктивита). Исследуемый материал: мазки из носа, конъюнктивы, взятые в первые 3 дня и не позднее 5 дня болезни. Определяемые возбудители: - вирусы сезонного гриппа типа А (H1N1) - вирусы сезонного гриппа типа А (H3N2) - вирусы гриппа типа В - вирусы парагриппа 1, 2, 3 типов - аденовирусы - респираторно-синцитиальный вирус;
2) метод полимеразной цепной реакции (ПЦР)- основан на обнаружении в клинических пробах генетического материала вирусов (РНК или ДНК)- является наиболее современным, высокочувствительным методом.
Исследуемый материал: мазки из носа и зева, взятые в первые 3 дня и не позднее 5 дня болезни, секционный материал. Определяемые возбудители:
- вирусы пандемического высокопатогенного гриппа типа А (H1N1)
- вирусы гриппа типа А
- вирусы гриппа типа В - вирусы парагриппа 1, 2, 3,4 типов
- аденовирусы - респираторно-синцитиальный вирус;
Вирусологическая диагностика - выделение вируса на чувствительной клеточной культуре с последующей идентификацией в реакции нейтрализации или ПЦР.
Этот метод отличается трудоемкостью и длительностью и используется, главным образом, для эпидемиологических и научных целей (изучается изменчивость вирусов, что помогает прогнозировать эпидемические подъемы гриппа, отбираются актуальные штаммы, пригодные для изготовления вакцин) Исследуемый материал: мазки из носа и зева (в первые 3 дня и не позднее 5 дня болезни).
- вирусы гриппа типа А (разные серотипы)
- вирусы гриппа типа В Серологическая диагностика является ретроспективной. Она выявляет прирост титров антител к возбудителям заболевания в парных сыворотках крови, что позволяет установить точную этиологию даже при отрицательных результатах других методов лабораторной диагностики, а также при бессимптомном или атипичном течении гриппа, широко применяется и для эпидемиологических целей. Исследуемый материал: сыворотки крови, взятые в начале заболевания и через 10- 14 дней.
Возбудители к которым определяется прирост титров антител:
- вирусы сезонного гриппа типа А (H1N1)
- вирусы сезонного гриппа типа А (H3N2) - вирусы гриппа типа В
- вирусы парагриппа 1, 2, 3 типов
В период подьема заболевамости гриппом и ОРВИ (в октябре- декабре 2009г.) вирусологической лабораторией обследовано методом флюоресцирующих антител (МФА) 432 человека. У 27% заболевших был выявлен аденовирус, у 8,3% - вирус парагриппа 3 типа, у 8% - респираторно-синцитиальный вирус, у 2% - вирусы парагриппа 1, 2 типов, у 0,2% - вирус сезонного гриппа типа А (H1N1).
При обследовании методом ПЦР 565 больных с подозрением на высокопатогенный грипп типа А (H1N1) РНК вируса обнаружена у 213 человек (в 38% проб). По даннным серологического обследования 67 больных ( в октябре и ноябре) заболевания гриппозной этиологии составили 4,3 % (грипп А(H1N1) сезонный - 2 человека), парагрипп 3 типа — 4,5% ( 3 человека), парагрипп 2 типа — 1,5% ( 1человек).
Читайте также:


