Использование вирусов в биотехнологии реферат
Массовое выращивание клеток в культуре является центральным звеном любого технологического процесса, основанного на использовании клеток животных, и, в первую очередь, производства вирусных препаратов. Эта стадия определяет массу и качество клеток и, тем самым, в целом технологию получения вирусного сырья. Выбор способа культивирования вируса в значительной мере определяется способностью клеток размножаться на поверхности плотного субстрата или в суспензионной культуре. Трудно определить верхние и нижние границы крупномасштабного или промышленного выращивания вирусов в клеточных культурах. Все зависит от масштабов производства вирусных препаратов. В одних случаях речь идет о получении сотен литров, в других — десятков и даже сотен тысяч литров культурального вируса в год. Это зависит от вида вакцин и масштабов их применения. Изготовление живых вакцин при прочих равных условиях всегда требует меньших объемов вирусного сырья, нежели приготовление инактивированных, в особенности концентрированных вакцин.
Отсутствие эффективных вакцин для профилактики некоторых заболеваний объясняется, прежде всего, отсутствием экономичного способа получения иммуногенного материала в достаточном количестве.
В отличие от инактивированных вакцин против ящура и полиомиелита, выпускаемых в больших количествах, при многих заболеваниях человека и животных применяют живые вакцины, для изготовления которых не требуется большого количества вирусного сырья. Это, прежде всего, относится к тем вакцинам, которые перед применением разводят. Ежегодно производство таких вакцин, связанное с получением сотен литров культурального вируса, удовлетворяется использованием статических или вращающихся культуральных сосудов. Однако такие методы культивирования вирусов не могут удовлетворить крупномасштабное производство ряда вирусных вакцин. Например, при изготовлении противоящурной вакцины перевиваемые клетки выращивают в суспензии в реакторах с рабочим объемом более 1000 л. Крупные научно-производственные центры Южной Америки ежегодно вырабатывали до 600 млн. доз моновалентной инактивированной противоящурной вакцины. Для этой цели необходимо еженедельно получать около 20 000 л суспензионной культуры клеток ВНК-21.
До недавнего времени производство большинства вирусных препаратов основывалось на использовании первичных культур клеток из нормальных тканей различных видов домашних и лабораторных животных. Кроме того, в качестве клеточных субстратов для производства вакцин, применяемых в медицине, использовали немногие линии диплоидных клеток с ограниченной жизненной потенцией. Широкое применение таких препаратов в медицине и ветеринарной практике дало возможность достичь больших успехов в борьбе со многими опасными вирусными болезнями человека и животных. Однако первичные культуры клеток во многих отношениях не являются перспективными клеточными субстратами. Их приготовление связано с периодическим убоем животных и необходимостью выделения клеток из тканей.
Первичные культуры отличаются нестандартностью, таят в себе опасность в отношении эндогенной контаминации различными вирусами и микроорганизмами. Наконец, их сложно выращивать в условиях крупносерийного производства. Отмеченные трудности значительно возрастают в связи с тенденцией постоянного увеличения масштабов изготовления противовирусных препаратов. Кроме того, в последнее время все более широкое развитие получает разработка концентрированных и субъединичных вакцин, при изготовлении которых требуется большое количество вирусного материала. Естественно, что стоящая задача может быть решена лишь путем использования постоянных (перевиваемых) линий клеток, отличающихся способностью к бесконечной пересеваемости вне организма, высокой стандартностью, низкой стоимостью, относительной простотой трансфекции рекомбинантной ДНК и последующего клонирования высокоэффективных продуцентов, высокой вероятностью правильного посттрансляционного процессинга вновь синтезируемых белков, кодируемых трансфецирующей ДНК.
Ветеринарная наука в течение последней четверти века накопила большой опыт в изготовлении вирусных вакцин с использованием в качестве субстрата для размножения вирусов культур постоянных линий клеток животных. Особый успех достигнут в изготовлении инактивированной противоящурной вакцины. Производство вакцин против ящура имеет наиболее цитируемую технологию. Она основана на использовании линии трансформированных клеток новорожденного хомяка, выращиваемых в суспензии. Эта технология достаточно экономична, ее выполняют в биореакторах большой емкости. Накоплены определенные доказательства безопасности некоторых постоянных клеточных линий, используемых в качестве субстрата в производстве ряда биологических препаратов. Например, инактивированную противоящурную вакцину готовят из вируса, выращенного в культуре постоянной линии клеток почки новорожденного хомяка (линия ВНК-21). Более чем за 20-летний период этой вакциной привито свыше 100 млн. голов крупного рогатого скота и не обнаружено каких-либо нарушений у привитых животных, по крайней мере, в течение 2—4 лет после введения вакцины. Имеется много других примеров безопасности применения инактивированных и даже живых вакцин против ряда болезней животных, приготовленных из вирусов, размноженных в культурах различных постоянных линий клеток. Применение биологических препаратов, полученных на основе перевиваемых клеточных линий, в медицине началось намного позже, чем в ветеринарной практике.
Несмотря на очевидные преимущества постоянных линий клеток, медицинская практика до недавнего времени воздерживалась от их применения в производстве вирусных вакцин. Причина заключалась в том, что, согласно существовавшему мнению, для изготовления медицинских вирусных вакцин можно было использовать клетки из тканей только клинически здоровых животных. Производство таких вакцин ограничивалось использованием первичных и диплоидных культур клеток. В диплоидных линиях клеток человека никогда не были обнаружены латентные вирусы или спонтанная трансформация клеток. Основное возражение против использования постоянных клеточных линий для репликации вирусов и векторных рекомбинатов в производстве вирусных вакцин медицинского назначения заключалось в их возможной онкогенности из-за контаминации вакцин клеточной ДНК или генными продуктами (регуляторными белками). Интеграция гетерогенной ДНК может привести к предзлокачественным изменениям в результате активации протоонкогенов, запуску онкогенов и инактивации генов опухолевой супрессии. В процессе репродукции вакцинных штаммов для живых вакцин с использованием клеточных линий, латентно контаминированных другими вирусами, могут появляться вирусные гибриды с неожиданными свойствами.
Этот вопрос рассматривался неоднократно на различных научных форумах в Европе и Северной Америке. Ценность постоянных клеточных линий в качестве субстратов стала особенно очевидной благодаря успехам, достигнутым в последнее время в области фундаментальных биологических исследований, а также в связи с перспективой их использования в рекомбинантной ДНК-технологии и получении генно-инженерных биопрепаратов. Общая тенденция к применению постоянных клеточных линий в производстве медицинских иммунобиологических препаратов наметилась на рубеже 70—80-х годов. Так, в 1978 г. в Лейк-Плесиде (США) было предложено использовать лимфобластоидные клетки человека для крупномасштабного производства альфа-интерферона. В 1981 г. Комитет экспертов ВОЗ по стандартизации биологических препаратов одобрил применение неопухолевых и неконтаминированных вирусами постоянных клеточных линий для производства инактивированной полиомиелитной вакцины, а затем также для инактивированной вакцины против бешенства. Такое решение дало возможность в короткий срок разработать методы крупномасштабного выращивания вирусов с использованием микроносителей и создать высокоэффективные вирусные вакцины.
В истории создания биологических препаратов ключевая роль всегда принадлежала выбору приемлемо безопасных вариантов. Решение о применении людям биопрепаратов, полученных с использованием постоянных клеточных линий, основывалось на оценке различными комитетами выгод и риска, связанных с созданием новых препаратов, по сравнению с существующими. Важнейшие потенциальные факторы риска, связанные с биологическими препаратами, производимыми на постоянных клеточных линиях, можно разделить на три категории: примесь гетерогенной ДНК, вирусы и трансформирующие белки.
Одним из основных вопросов, требующих самого пристального внимания, является потенциальная долгосрочная опасность, связанная с присутствием в препаратах примесей гетерогенных ДНК, особенно в тех случаях, когда последние могли содержать потенциально онкогенные кодирующие или регуляторные последовательности.
Реферат на тему: Вирусы и бактерии
Подавляющее большинство ныне живущих на Земле организмов состоит из клеток, и лишь вирусы не имеют клеточного строения.
По этому важнейшему признаку все живое в настоящее время делится учеными на две части:
- доклеточные (вирусы и фаги),
- клеточные (все остальные организмы: бактерии и близкие к ним группы, грибы, зеленые растения, животные и человек).
Вирусы — мельчайшие организмы, их размеры колеблются от 12 до 500 нанометров. Мелкие вирусы равны крупным молекулам белка. Вирусы — резко выраженные паразиты клеток.
Важнейшими отличительными особенностями вирусов являются следующие:
1. Они содержат в своем составе только один из типов нуклеиновых кислот: либо рибонуклеиновую кислоту (РНК), либо дезоксирибонуклеиновую (ДНК), — а все клеточные организмы, в том числе и самые примитивные бактерии, содержат и ДНК, и РНК одновременно.
2. Не обладают собственным обменом веществ, имеют очень ограниченное число ферментов. Для размножения используют обмен веществ клетки-хозяина, ее ферменты и энергию.
3. Могут существовать только как внутриклеточные паразиты и не размножаются вне клеток тех организмов, в которых паразитируют.
Наиболее примитивные вирусы состоят из молекулы РНК (либо ДНК), окруженной снаружи белковыми молекулами, создающими оболочку вируса. Некоторые вирусы имеют еще одну — внешнюю, или вторичную, оболочку; более сложные вирусы содержат ряд ферментов.
Нуклеиновая кислота (НК) является носительницей наследственных свойств вируса. Белки внутренней и внешней оболочек служат для ее защиты.
В клетке-хозяине осуществляется раздельный синтез оболочки и НК вируса. В дальнейшем они объединяются и образуют новый вирион (полностью сформированный зрелый вирус). Эта особенность была подмечена учеными, которые даже проводили следующий эксперимент.
Они разрушали вирус табачной мозаики на две его составные части — НК и белок. Затем смешивали их и… получали жизнеспособный исходный вирус со всеми его биологическими свойствами. Клетки же, как мы знаем, размножаются делением. Расчленение клетки на составляющие ее части (ядро, оболочку, цитоплазму, митохондрии, рибосомы) и последующее смешивание их не приведет к подобному эффекту — клетку восстановить не удастся.
Вирусы не размножаются на искусственных питательных средах — они чересчур разборчивы в пище. Обычный мясной бульон, который устраивает большинство бактерий, для вирусов не годится. Им нужны живые клетки, и не любые, а строго определенные.
Науке известны вирусы бактерий, растений, насекомых, животных и человека. Всего их более 1000. Связанные с размножением вируса процессы чаще всего, но не всегда, повреждают и уничтожают клетку-хозяина. Размножение вирусов, сопряженное с разрушением клеток, ведет к возникновению болезненных состояний в организме.
Ученые установили, что в организме человека живет много вирусов, но проявляют они себя не всегда. Воздействиям болезнетворного вируса подвержен лишь ослабленный организм.
Пути заражения вирусами самые различные: через кожу при укусах насекомых и клещей; через слюну, слизь и другие выделения больного; через воздух; с пищей; половым путем и другие.
У животных вирусы вызывают ящур, чуму, бешенство; у насекомых — полиэдроз, грануломатоз; у растений — мозаику или иные изменения окраски листьев либо цветков, курчавость листьев и другие изменения формы, карликовость; наконец, у бактерий — их распад.
Известен целый ряд вирусов, которые не являются носителями болезней. Многие из них проникают в организм человека, но при этом не вызывают никаких клинически обнаруживаемых заболеваний. Они могут продолжительно и без всяких внешних проявлений существовать в клетках своего хозяина.
Каких еще полезных дел можно ожидать в будущем от вирусов? Давайте перенесемся в область предположений.
Прежде всего, стоит напомнить о генной инженерии. Вирусы могут оказать ученым неоценимую пользу, захватывая нужные гены в одних клетках и перенося их в другие.
Наконец, существует еще одна возможность использования вирусов. Учеными открыт вирион, который способен избирательно разрушать некоторые опухоли мышей. Получены также вирусы, убивающие опухолевые клетки человека. Если удастся лишить эти вирусы болезнетворных свойств и сохранить при этом их свойство избирательно разрушать злокачественные опухоли, то в будущем, возможно, будет получено мощное средство для борьбы с этими тяжелыми заболеваниями. Поиски таких вирусов ведутся, и сейчас эта работа уже не кажется фантастической и безнадежной.
Бактерии — это микроскопически малые организмы не имеющие ограниченного оболочкой ядра. По форме и особенностям объединения клеток различают несколько морфологических групп настоящих бактерий: кокки, имеющие шарообразную форму; стрептококки образованы кокками, объединенными в цепочки; стафилококки — скопления кокков в виде виноградной грозди; бациллы, иди палочки, — вытянутые по форме клеток бактерии; вибрионы — дугообразно изогнутые бактерии; спириллы — бактерии с вытянутой шпорообразно извитой формой и т. д. На поверхности некоторых клеток бактерий заметны разного рода жгутики и ворсинки. С помощью жгутиков и ворсинок бактерии передвигаются. Некоторые бактерии перемещаются, выбрасывая слизь. Клеточная стенка Прочная, у многих бактерий сверху окружена слоем слизи, образующим капсулу, защищающую организм от неблагоприятных воздействий. В цитоплазме бактерий иногда заметны включения запасных питательных веществ. Бактерии способны в неблагоприятных условиях образовывать споры.
Бактериальная клетка состоит из клеточной стенки, наружной цитоплазматической мембраны, кольцевой молекулы ДНК, рибосом, включений и мезосомы (запас мембраны).
Большинство бактерий гетеротрофы. Сапрофиты — используют для питания готовые органические вещества мертвых организмов или продукты жизнедеятельности животных и растений. Паразиты — живут за счет питательных веществ других организмов, в теле которых они обитают. К ним относятся все болезнетворные бактерии. Другие гетеротрофные бактерии получают энергию путем кислородного или бескислородного окисления органических соединений (молочнокислые бактерии, маслянокислые бактерии, метанообразующие)
Автотрофных бактерий подразделяют на фототрофов, для которых источником энергии служит солнечный свет, и хемотрофов, использующих для синтеза собственных органических соединений энергию реакций окисления или восстановления неорганических молекул.
1. Бактерии молочнокислого брожения (гетеротрофные сапротрофы). Положительное значение: приготовление молочнокислых продуктов (творог, простокваша, масло, сметана), силосование кормов, закваска капусты, засолка огурцов и помидоров. Отрицательное значение: порча продуктов.
2. Бактерии уксуснокислого брожения (гетеротрофные сапротрофы). Положительное значение: окисление спирта в уксусную кислоту, которая применяется для маринования, консервирования плодов и овощей. Отрицательное: порча продуктов
3. Бактерии гнилостные (гетеротрофные сапротрофы). Положительное значение: санитарная роль — минерализация органических остатков. Отрицательное значение: порча продуктов; во избежание гниения применяют сушку, соление, маринование, стерилизацию, пастеризацию, засахаривание
4. Бактерии болезнетворные (гетеротрофные паразиты). Вызывают инфекционные заболевания человека, животных. Для борьбы с ними применяют антибиотики, бактериофаги, прививки, а также организуют профилактическую работу по ликвидации очагов заражения, закаливают организм, соблюдают правила санитарии и гигиены организма
5. Бактерии клубеньковые (гетеротрофные симбионты). Клубеньковые бактерии проникают в корни бобовых растений (клевер, люпин, люцерна и др.) и вступают с ними в симбиоз. В результате на корнях образуются опухоли — клубеньки, заполненные бактериями, которые из атмосферного азота синтезируют азотистые соединения, доступные как растению-хозяину, так и другим растениям. Это природное обогащение почвы азотными удобрениями учитывается при составлении полевых севооборотов, куда обязательно включают бобовые растения
1. Богданова Т.Л.. Биология. Задания и упражнения. М.,1991.
2. Голубев Д.Б., Солоухин В.З. Размышления и споры о вирусах. М.: Молодая гвардия, 1989.
3. Майер В., Кенда М. Невидимый мир вирусов. М.: Мир, 1981.
4. Черкес Ф.К., Богоявленская Л.Б., Бельская Н.А. Микробиология. М.: Медицина, 1987.
Автор работы: Пользователь скрыл имя, 06 Мая 2013 в 08:22, реферат
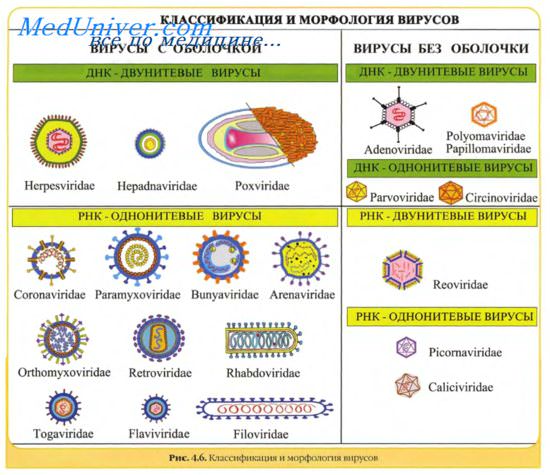
Просто организованные вирусы представляют собой нуклеопротеиды, т.е. состоят из нуклеиновой кислоты (ДНК или РНК) и нескольких белков, образующих оболочку вокруг нуклеиновой кислоты.
Именно благодаря способности проникать в соответствующие виды клеток и интегрироваться в их геном вирусы начали использоваться в биотехнологии.
В данной работе рассмотрены основные возможности применения вирусов в различных направлениях биотехнологии.
Введение
Вакцины
1.1. Виды вакцин
1.2. Методы получения
Векторы
2.1. Виды векторов
Вирусы в нанобиотехнологии
Фаготерапия
Вирусотерапия
Вывод
Список литературы
Значение вирусов для решения общебиотехнологических проблем.doc
Министерство образования и науки Российской Федерации
федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Пермский национальный исследовательский
Значение вирусов для решения общебиотехнологических проблем
Федорова Мария Сергеевна
- Вакцины
- 1.1. Виды вакцин
- 1.2. Методы получения
- Векторы
2.1. Виды векторов
- Вирусы в нанобиотехнологии
- Фаготерапия
- Вирусотерапия
Новейшая биотехнология (биоинженерия) – это наука о генно-инженерных и клеточных методах и технологиях создания и использования генетически модифицированных растений, животных и микроорганизмов в целях интенсификации производства и получения новых продуктов различного назначения.
Основная цель и задачи биотехнологии направлены на разработку методов и приемов, позволяющих получить биологически активные соединения (ферменты, гормоны, аминокислоты, вакцины, лекарственные препараты), а также конструирование молекул новых веществ и создание форм организмов, отсутствующих в природе (химерные гибридные молекулы, химерные животные и растительные ткани и организмы).
Другими словами, биотехнология – это наука об использовании биологических процессов в технике и промышленном производстве.
Объектами биотехнологии являются: клетки растений, животных и человека, бактерии, вирусы, грибы, некоторые вещества биологического происхождения (например, ферменты, нуклеиновые кислоты и др.), молекулы. Отсюда следует, что объекты биотехнологии относятся либо к микробам, либо к растительным или животным клеткам.
Однако применение в биотехнологии нашли и вирусы. Вирусы – это неклеточная форма жизни. Они являются облигатными паразитами, т.е. могут функционировать только внутри организма. Ни один из известных вирусов не способен к самостоятельному существованию.
Просто организованные вирусы представляют собой нуклеопротеиды, т.е. состоят из нуклеиновой кислоты (ДНК или РНК) и нескольких белков, образующих оболочку вокруг нуклеиновой кислоты.
Именно благодаря способности проникать в соответствующие виды клеток и интегрироваться в их геном вирусы начали использоваться в биотехнологии.
В данной работе рассмотрены основные возможности применения вирусов в различных направлениях биотехнологии.
Вакцины - это препараты, якобы способствующие созданию активного специфического иммунитета, приобретенного в процессе прививания и необходимого для защиты организма от конкретного возбудителя болезни. Вакцины не всегда могут быть использованы, как для профилактики, так и для лечения инфекционных заболеваний.
Вакцины изготавливают путем сложных биохимических процессов из микроорганизмов, продуктов их жизнедеятельности или отдельных компонентов микробной клетки.
Различают следующие виды вакцин[7]:
Вакцина адсорбированная (v. adsorptum) её антигены сорбированы на веществах, усиливающих и пролонгирующих антигенное раздражение.
Вакцина антирабическая (v. antirabicum; анти- + лат. rabies бешенство) изготовлена из штамма фиксированного вируса бешенства в суспензии тканей головного мозга животных или в культуре клеток и предназначенная для предупреждения заболевания у лиц, укушенных (ослюненных) животными, больными бешенством (подозреваемыми на заболевание).
Вакцина ассоциированная (v. associatum; син.: В. комбинированная, В. комплексная, поливакцина) - препарат, состоящий из нескольких В. различного типа, предназначенный для одновременной иммунизации против нескольких инфекционных болезней.
Вакцина живая (v. vivum) - B., содержащая жизнеспособные штаммы патогенного микроорганизма, ослабленные до степени, исключающей возникновение заболевания, но полностью сохранившие антигенные свойства, обусловливающие формирование специфического иммунитета у привитого.
Вакцина поливалентная (v. polyvalens; греч. poly - много + лат. valens, valentis сильный) - В., изготовленная на основе нескольких серологических вариантов возбудителя одной инфекционной болезни.
Вакцина убитая (v. inactivatum) - В., изготовленная из микроорганизмов инактивированных (убитых) воздействием физических или химических факторов.
Вакцина фенолизированная (v. phenolatum) - убитая В., изготовленная из микроорганизмов, инактивированных фенолом.
Вакцина формалинизированная (v. formalinatum; син. формолвакцина) - убитая В., изготовленная из микроорганизмов, инактивированных формалином.
Вакцина химическая (v. chemicum) - В., состоящая из специфических антигенов, извлеченных из микроорганизмов, и очищенная от балластных веществ.
Вакцина эмбриональная (v. embryonale) - В., изготовленная из вирусов или риккетсий, выращенных на эмбрионах птиц (кур, перепелок).
Вакцина этеризованная (v. aetherisatum) - убитая В., изготовленная из микроорганизмов, инактивированных эфиром.
1.2. Получение вакцин.
Наиболее просты в изготовлении живые вакцины, так как технология в основном сводится к выращиванию аттенуированного вакцинного штамма с соблюдением условий, обеспечивающих получение чистых культур штамма, исключение возможностей загрязнения другими микроорганизмами (микоплазы, онковирусы) с последующей стабилизацией и стандартизацией конечного препарата. Вакцинные штаммы бактерий выращивают на жидких питательных средах (гидролизаты казеина или другие белково-углеводные среды) в аппаратах - ферментаторах емкостью от 0,1 м 3 до 1-2 м 3 . Полученная чистая культура вакцинного штамма подвергается лиофильному высушиванию с добавлением протекторов.
Вирусные и риккетсиозные живые вакцины получают выращиванием вакцинного штамма в эмбрионах кур или перепелов, свободных от вирусов лейкоза, либо в культурах клеток, лишенных микоплазм. Используют или первично-трипсинизированные клетки животных или перевиваемые диплоидные клетки человека. Живые аттенуированные штаммы бактерий и вирусов, применяемые для приготовления живых вакцин, получены, как правило, из природных штаммов путем их селекции или пассажей через биологические системы (организм животных, эмбрионы кур, культуры клеток, питательные среды).[5]
В связи с успехами генетики и генетической инженерии появились возможности целенаправленного конструирования вакцинных штаммов. Получены рекомбинантные штаммы вируса гриппа, а также штаммы вируса вакцины со встроенными генами протективных антигенов вируса гепатита В.
Инактивированные корпускулярные бактериальные вакцины или цельновирионные инактивированные вакцины получают соответственно из культур бактерий и вирусов, выращенных на тех же средах накопления, что и в случаях получения живых вакцин, и затем подвергнутых инактивации нагреванием (гретые вакцины), формалином (формолвакцины), ультрафиолетовым излучением (УФ-вакцины), ионизирующим излучением (радиовакцины), спиртом (спиртовые вакцины). Инактивированные вакцины ввиду недостаточно высокой иммуногенности и повышенной реактогенности не нашли широкого применения.
Производство молекулярных вакцин - более сложный технологический процесс, т. к. требует извлечения из выращенной микробной массы протективных антигенов или антигенных комплексов, очистки и концентрирования антигенов, введения в препараты адъювантов. Выделение и очистка антигенов с помощью традиционных методов (экстракции трихлоруксусной кислотой, кислотного или щелочного гидролиза, ферментативного гидролиза, высаливания нейтральными солями, осаждения спиртом или ацетоном) сочетаются с применением современных методов (скоростного ультрацентрифугирования, мембранной ультрафильтрации, хроматографического разделения, аффинной хроматографии, в т.ч. на моноклональных антителах). С помощью этих приемов удается получать антигены высокой степени очистки и концентрирования.[8]
К очищенным антигенам, стандартизированным по числу антигенных единиц, с целью повышения иммуногенности добавляют адъюванты, чаще всего сорбенты-гели (гидрат окиси алюминия и др.).
Препараты, в которых антиген находится в сорбированном состоянии, называют сорбированными или адсорбированными (дифтерийный, столбнячный, ботулинический сорбированные анатоксины). Сорбент играет роль носителя и адъюванта. В качестве носителя в синтетических вакцинах предложены всевозможные полимеры.
Интенсивно разрабатывается генно-инженерный способ получения протективных белковых антигенов бактерий и вирусов. В качестве продуцентов используют обычно эшерихии, дрожжи, псевдомонады со встроенными в них генами протективных антигенов. Получены рекомбинантные штаммы, продуцирующие антигены возбудителей гриппа, коклюша, кори, герпеса, гепатита В, бешенства, ящура, ВИЧ-инфекции и др.
Вирусные вектора являются широко используемым инструментом в биотехнологии для доставки генетического материала в клетки. Этот процесс может быть осуществлен как внутри живого организма, так и в культуре клеток. [13]
Есть вирусы, которые не ведут к гибели клетки, но встраиваются в геном клетки-хозяина и размножаются вместе с ней, либо вызывают ее неконтролируемый рост, т.е. превращают в раковую. К таким относятся ДНК-вирусы SV-40 и вирус полиомы. Внедрение некоторых опухолевых РНК-вирусов ведет к отпочковыванию вирусных частиц от клетки без ее лизиса. К таким вирусам относятся, например, ретровирусы (вирус саркомы Рауса и СПИДа). Для бактериальных клеток в качестве вектора часто используют бактериофаги.
Вирусы являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильных вирусных промоторов, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования.
В последние годы сконструированы многочисленные "челночные" векторы и их рекомбинантные производные, способные к репликации в животной и бактериальной клетке и эффективно экспрессирующие клонируемый ген в животной клетке. Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче всего вирусы вводятся в бактерии. Недостатком вирусов как векторов является их небольшая емкость. Кроме того, вирусы заражают небольшой круг хозяев.[3]
2.1. Виды вирусных векторов
В исследованиях в основном используются вирусные векторы трех типов: ретровирусные, аденовирусные и аденовирусоассоциированные, хотя сейчас изучается применение в этом качестве и других вирусов.
Таблица 1. Генотерапевтические векторы и их характеристики
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Вирусы являются паразитами и могут размножаться только в клетках других организмов. Вне клеток вирусы представляют собой комплексы нуклеиновой кислоты (ДНК или РНК) с белком. Они не являются организмами в полном смысле слова, так как не имеют свойственных клеткам органелл, не обладают собственным обменом веществ и живут и размножаются в клетках животных, человека, растений, бактерий, используя для своей жизнедеятельности ресурсы и обменные процессы этих клеток.
Бактерии являются доядерными организмами (прокариотами), так как у них имеется примитивное ядро без оболочки, ядрышка, гистонов, а в цитоплазме отсутствуют высокоорганизованные органеллы <митохондрии, лизосомы, аппарат Гольджи и др.)
К растениям относятся водоросли, являющиеся водными организмами, и высшие растения, обитающие преимущественно на суше. Водоросли не имеют органов и тканей и состоят из недифференцированных (одинаковых) клеток. Высшие растения являются многоклеточными организмами, имеющими специализированные органы - корни, стебли, листья. Они состоят из тканей, образованных специализированными клетками. Растения служат поставщиками питательных веществ для других организмов.
Грибы сочетают в себе черты клеток растений и животных. Они имеют клеточное ядро и, как у растений, прочную клеточную стенку. Как клетки животных, они способны синтезировать полисахариды - хитин и гликоген и нуждаются в некоторых витаминах. Особенно интересны для биотехнологии микроскопические грибы - дрожжи, плесневые и другие микроорганизмы, применяемые в хлебопекарной, пивоваренной и молочной промышленности, а также для получения органических кислот, спиртов, антибиотиков, кормового белка, различных биологически активных веществ.
Животные состоят из двух основных групп: простейших (одноклеточных) и высших (многоклеточных). Их клетки, как и клетки растений, являются ядерными. Поскольку многие простейшие являются паразитами и возбудителями болезней высших животных и человека, культивирование их на искусственных средах затруднено. Они используются в основном в токсикологических исследованиях.
Основными технологическими принципами, используемыми в биотехнологии, являются:
а) брожение (ферментация);
б) биоконверсия (превращение одного вещества в другое);
в) культивирование бактерий, вирусов, растительных и животных клеток;
г) генетическая инженерия.
Простейшим способом получения биотехнологической продукции является использование животных и их органов и тканей. Ткани высших животных являются источниками белка, липидов, некоторых витаминов. Например, иммунные сывороточные препараты получают из крови иммунизированных животных (лошадей, кроликов); гормон инсулин - из поджелудочных желез крупного рогатого скота и свиней. Гормон роста получают из гипофиза умерших людей; для получения препаратов крови используют донорскую, плацентарную и абортную кровь.
Сырье животного происхождения является наиболее дорогим. В связи с этим в настоящее время все чаще используются культуры клеток животных или человека, выращиваемых на искусственных средах. Примером такой технологии является получение противовирусного препарата интерферона, применяющегося для профилактики и лечения гриппа и других вирусных инфекций. Наиболее перспективным способом производства биологически активных веществ является генная инженерия. В частности, так получают человеческий инсулин - гормон белковой природы.
Для получения многих лекарственных средств (сердечных, мочегонных, противовоспалительных и т.д.) используют растения. Несмотря на то, что традиционные методы извлечения физиологически активных и лекарственных соединений из растений (экстракция, перегонка, фильтрация) по-прежнему широко используются, все большее значение приобретают технологии получения биологически активных веществ из клеточных культур, а также производство продуктов из генетически модифицированных растений.
Из водорослей получают агар-агар и альгинаты - полисахариды, используемые в пищевой промышленности, а также для изготовления микробиологических сред.
Бактерии наиболее часто используются в биотехнологических процессах. Из биомассы бактерий получают различные органические вещества - аминокислоты, белки, в том числе ферменты. Бактерии являются удобным объектом для генетических исследований. Наиболее изученной и широко применяемой в генноинженерных исследованиях является кишечная палочка Escherichia coli (Е. coli), обитающая в толстом кишечнике человека.
Читайте также:


