Как организм борется с вирусами и бактериями
Уже давно на улице стоит холодная погода, а значит начинается сезон простуды, гриппа, ангины и так далее и тому подобное. Многие люди настолько бояться подхватить какую-нибудь простудную заразу, что объявляют вирусам настоящую войну. Но насколько эффективны все наши потуги застраховаться от вирусных заболеваний путем борьбы с вирусами и бактериями? На самом деле, множество способов, обещающих полностью очистить ваш дом от бактерий, не более чем мифы, которые абсолютно не помогают сохранить здоровье. Предлагаем вашему вниманию шесть таких популярных мифов.
Миф №1. Мы скорее заболеем гриппом или простудой, если будем сидеть на сквозняке или в плохо отапливаемом помещении
На самом деле, не существует абсолютно никакой связи между холодом и бактериями, и ваша иммунная система вполне способна справиться с достаточно низкой температурой без каких-либо негативных последствий для вашего организма. Конечно, пик заболеваний гриппом и простудой приходится на холодный период времени года, но причина может заключаться в том, что человек в этот период проводит как раз слишком много времени не на холодной улице, а в протопленной квартире. Именно в закрытом помещении бактерии легко передаются от одного человека к другому. Вы можете поставить самую совершенную систему отопления, потратив на нее много денег, но это, увы, не сделает вас более защищенным от вирусов и бактерий. Разве что, можно начать вести отшельнический образ жизни и ни с кем не встречаться!
Миф №2. Использование антибактериальных средств для рук поможет оградиться от гриппа и простуды
Сейчас стали очень популярны всякого рода антибактериальные гели для рук, салфетки, спиртовые растворы, которые предлагается использовать для санитарной обработки кожи рук, если рядом нет мыла и крана с водой. Несомненно, такие кардинальные средства позволят вам уничтожить большинство бактерий, обитающих на ваших руках; но, как показывает статистика, те, которые регулярно пользуются такими средствами, болеют ничуть не меньше остальных! Все объясняется очень просто – действительно, антибактериальные средства очищают ваши руки, но заболеваем мы от бактерий, которые передаются, в основном, воздушно-капельным путем. К примеру, вирус гриппа передается, когда болеющий человек чихнет или закашляется, рассеивая множество болезнетворных бактерий вокруг себя. От них нам, увы, не удастся избавиться с помощью всех этих популярных антибактериальных средств.
Миф №3. Бактерии выходят из тела вместе с потом
Существует очень популярное заблуждение, согласно которому, если хорошенько пропарить тело, то простуда выйдет вместе с капельками пота. Многие люди, почувствовав проявление симптомов простуды в организме, набирают горячую ванну и пытаются пропотеть как можно сильнее. К сожалению, горячая ванна (сауна, баня) могут помочь лишь расслабиться и снять стресс (что, кстати, также очень полезно при простуде), но уж никак не выпарить вирусы из тела вместе с капельками пота. И уже тем более не стоит залезать в горячую ванну или сауну, если у вас повышенная температура – это лишь усугубит развитие болезни.
Миф №4. Бактерии и вирусы можно "вымыть" из дома антибактериальными средствами
Антибактериальное мыло и другие чистящие средства, которые содержат достаточно внушительный спектр ингредиентов (к примеру, таких как триклозан или бензойно-кислый натрий) , многие считают, чуть ли, не панацейным средством избавления своего дома от бактерий. Но проблема заключается в том, что, к примеру, грипп переносят не бактерии, а вирусы. Действительно, антибактериальное мыло способно справиться с бактериальными инфекциями, типа стафилококков или кишечной палочки. Но это же мыло не способно аналогичным образом справляться с вирусами. Если вы действительно хотите избавиться от вирусов так же, как от бактерий, тогда вам придется обработать свой дом большим количеством хлористого раствора.
Миф №5. Болезнетворные микроорганизмы возможно уничтожить, если обработать помещение ультрафиолетовой лампой
Ультрафиолетовые дезинфицирующие лампы стали очень популярны в последние годы. К ним, почему-то, люди стали проявлять гораздо больше доверия, чем, к примеру, к обычным моющим и чистящим средствам. Принцип работы этих ламп заключается в том, что они воздействуют на болезнетворные микроорганизмы посредством ультрафиолетового излучения, которое убивает их. Действительно, лампы начали выпускаться в промышленных масштабах; их применяли, главным образом, для обработки помещений в больницах (операционные, палаты). Люди пользовались такими лампами почти сотню лет! Лампы действительно позволяют убивать вирусы, но избавляться полностью от болезнетворных вирусов и бактерий не удавалось. Причина в том, что лампы должны были обрабатывать каждый квадратный сантиметр помещения, что реально только в небольшом и идеально круглом помещении, посередине которого установлена круглая лампа. Ультрафиолетовые дезинфицирующие лампы имеют, как вы знаете, форму длинной палки. К тому же, ультрафиолетовое излучение не способно полностью уничтожить переносимые по воздуху болезнетворные бактерии, которые являются главными причинами заболеваний гриппом и простудой.
Миф №6. Можно предотвратить рецидив простудного заболевания, если поменять свою зубную щетку
Поверьте, нет никакой необходимости менять свою зубную щетку, если только ее щетинки не износились со временем. А что касается простуды или гриппа, то каждое следующее заболевание имеет новый штамм. А та простуда, или грипп, которым вы переболели, вам уже не страшны, так как ваш организм уже выработал именно на эту комбинацию вируса иммунитет. Так что, самое главное, это соблюдать гигиену и не пользоваться чужой зубной щеткой – даже после пропаривания ее в горячей воде.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
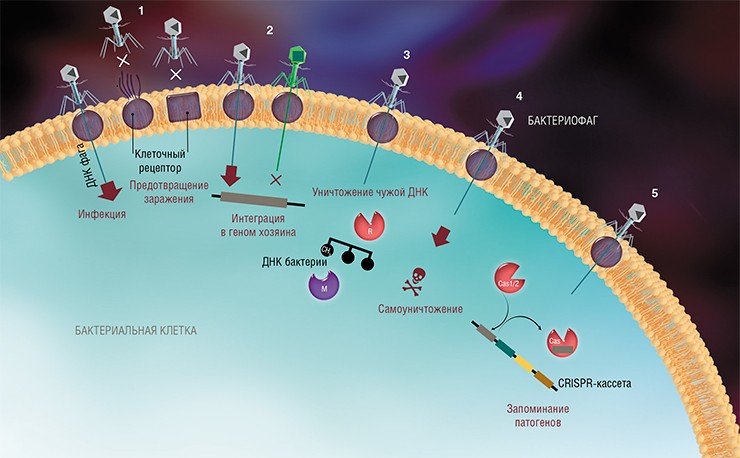
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
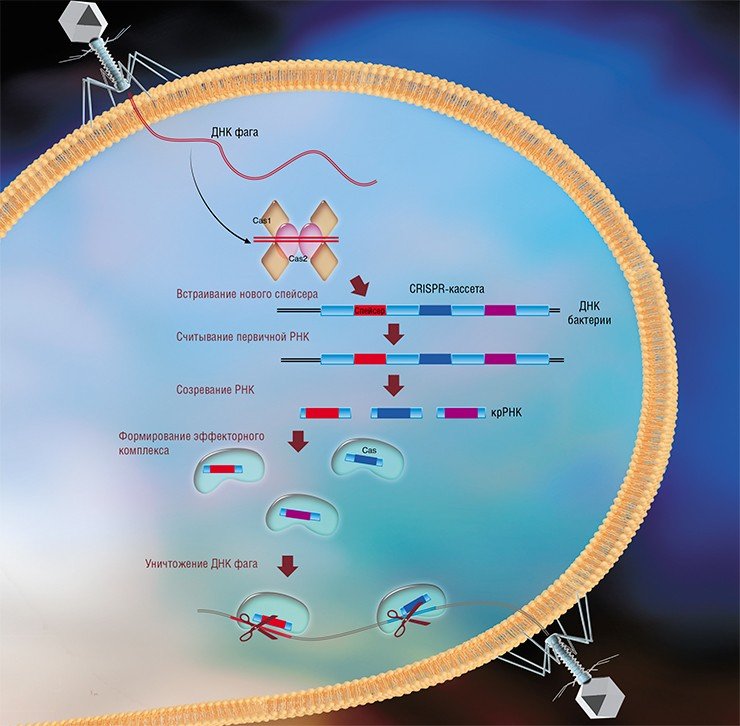
Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
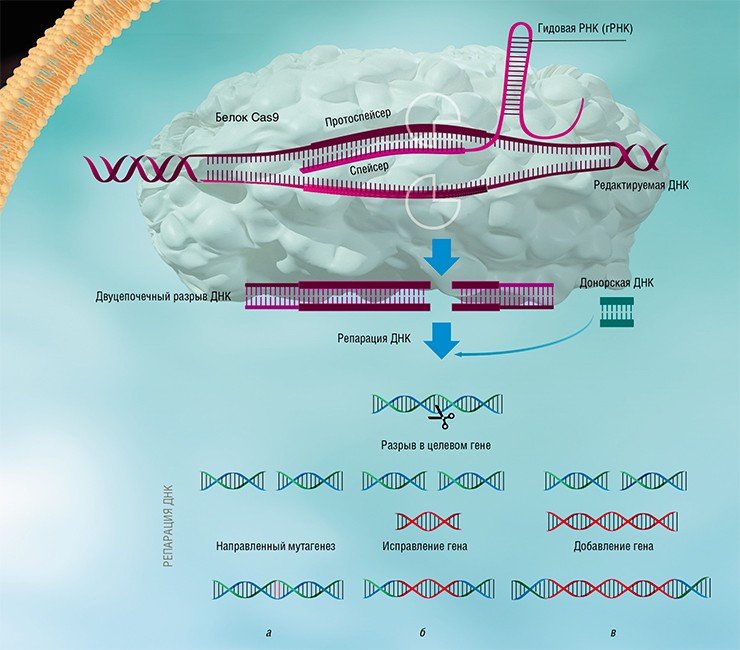
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Как ученые создают новые лекарства? Рассказывает молекулярный биолог Константин Северинов
За эпидемиями экзотических вирусов в СМИ следят как за концом света, хотя ученые уже умеют с ними работать: геном китайского коронавируса был расшифрован за десять дней. При этом люди каждый день лечат банальную простуду антибиотиками из аптеки, даже не выясняя, какая у них инфекция — вирусная или бактериальная. Даже примитивные бактерии теперь становятся для нас смертельно опасны: они научились игнорировать антибиотики.
Текст:
Даниил Давыдов, Кирилл Руков
Пневмонию (то есть воспаление легких) могут вызвать и вирусы, и бактерии, но вот бороться с ними нужно совершенно по-разному.
Бактерии — это живые одноклеточные организмы. Попадая в человека, они размножаются, попутно повреждая клетки и ткани — так развивается болезнь. Чтобы бороться с бактериями, ученые разрабатывают специальные яды — антибиотики, которые убивают сам возбудитель внутри тела. Но чем чаще мы их используем, тем быстрее бактерии вырабатывают устойчивость к антибиотикам.
Вирусы — совсем другое, их даже вряд ли можно назвать живыми. Это просто оболочка, внутри которой гены — ДНК или РНК. Попадая в организм, вирус внедряет генетический материал в клетки и заставляет их штамповать свои копии. Очистить уже зараженное тело от вируса лекарствами невозможно, яды-антибиотики на них не действуют. Поэтому ученые придумали прививки — чтобы при встрече организм здорового, привитого человека сразу узнал вирус и не дал ему размножиться.

У большинства новых экзотических вирусов первоначальными хозяевами были животные ( как и у нового коронавируса из Китая — Прим. ред.). Возрастающее давление человека на дикую природу увеличивает количество контактов между людьми и экзотическим зверями — там, где они еще остались. Сначала эти новые вирусы высокопатогенны, то есть сильно вредят здоровью заразившегося. Но, адаптировавшись к человеку, они, как правило, становятся менее опасными, ведь для успешной эпидемии вирусу важно не убить зараженного хозяина, а распространиться на как можно большее количество особей.
Для обычных россиян вероятность подцепить бактериальную инфекцию, которая будет устойчива ко всем основным антибиотикам, сейчас гораздо выше, чем заразиться экзотическим вирусом, вспышка которого произошла в Африке или Китае.
Проблема с вирусами в том, что мы не умеем направленно уничтожать их внутри пациента. В этом принципиальное отличие от бактериальных болезней, где антибиотики действительно убивают возбудителя. Поэтому лучший способ предотвращения вирусных инфекций — вакцинация еще здоровых людей.
Современные методы молекулярной биологии позволяют создавать потенциальные вакцины против новых вирусов за полгода или даже за меньший срок. Однако затем потребуются еще несколько лет, чтобы доказать безопасность и эффективность вакцины, сертифицировать ее, ввести в график прививок, произвести в достаточных количествах и так далее. К тому времени про сегодняшний вирус все забудут, возникнет другой. Поэтому поголовное вакцинирование жителей России пока еще несуществующей вакциной от уханьского вируса, — дело совершенно ненужное. Хотя понятно, что деятельность по такой разработке очень выгодна и политикам, и ученым, и промышленникам, которые получают на нее контракты.
Ученые отделяют кусочки оболочки от вируса (поверхностные белки) таким же способом, каким создают и столь нелюбимые многими ГМО. Потом эти высокоочищенные препараты вводят в организм в надежде получить иммунный ответ — то есть антитела организма, которые будут узнавать эти кусочки, а следовательно, и вирус. Затем, чтобы доказать, что вакцина работает, необходимо продемонстрировать, что после прививки не будет происходить заражения и не разовьется болезнь. Делать это на людях неэтично: для китайского вируса вам пришлось бы провакцинировать группу здоровых людей, затем заразить их вирусом, а контрольную группу заразить без вакцинирования (из последних многие бы умерли). Поэтому опыты ставят на клеточных культурах или на животных, например крысах. Но даже это не гарантирует успех, ведь человек и модельное животное не одно и то же.
Это сложно и дорого. В основном ученые стремятся модифицировать уже существующие антибиотики. Но это нельзя делать до бесконечности, рано или поздно приходится искать новые (фармкомпании неохотно берутся за это, такой проект рискованный с точки зрения финансовых вложений: в среднем разработка одного успешного зарубежного лекарства занимает десять лет и обходится в 2,6 миллиарда долларов. — Прим ред.) .
Сама эта устойчивость у бактерий возникает в результате искусственного отбора — антибиотики широко применяются в сельском хозяйстве ( до 80 % всех антибиотиков вообще используют для лечения скота, причем примерно 97 % были куплены без рецепта , — прим. ред. ), в клиниках, а также обычными людьми в странах, где их отпускают без рецепта. Количество чувствительных к антибиотикам бактерий падает, количество устойчивых — увеличивается (например, самый первый антибиотик — пенициллин — сейчас уже не используется: у бактерий к нему развилась практически полная устойчивость. — Прим. ред.) .
С этой целью используют, например, бацитрацин, монензин и неомицин.
В лаборатории Северинова с этой целью используют стратегию биоинформатического геномного поиска: ищут в образцах генома бактерий участки, ответственные за синтез антибиотиков. Это очень медленный процесс, но в результате был найден принципиально новый антибиотик — клебсазолицин.
Принесла вам тут бактериологического оружия немножк в ленту.
Предвосхищая все вопросы. Не из моего учреждения, ничего конкретного об этом случае не знаю. pic.twitter.com/kYFv2ty5r4
Пока что имеющиеся антибиотики все еще работают в большинстве случаев. Но повсеместное распространение бактерий с устойчивостью приведет к катастрофическим с точки зрения современного человека последствиям, потому что мы вернемся в другую благословенную доантибиотиковую эру — с крайне высокой детской смертностью, смертностью от внутрибольничных инфекций, простых ран и тому подобного.
Правительства развитых стран должны обеспечивать проведение исследований в области наук о жизни на передовом уровне. Дело не только в финансировании, но и в создании условий для продуктивной работы ученых, в инфраструктуре, быстром обмене данными — то есть в том, без чего невозможна передовая наука. Сейчас оборудование и реагенты, которые нужны для быстрого определения новых возбудителей, создают и производят лишь в США, Великобритании и с недавнего времени в Китае. Понятно, что другие страны, которые полностью зависят от иностранных приборов и технологий, не смогут с ними конкурировать.
Все как всегда: соблюдайте правила гигиены, избегайте поездок в экзотические места, ведите размеренный и материально благополучный образ жизни — нужно иметь доступ к квалифицированным врачам. И постарайтесь ограничить использование антибиотиков.
- 16125
- 9,3
- 2
- 4
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Рисунок 5. Схема развития феномена ADE при вирусных инфекциях. а — Взаимодействие между антителом и рецептором FcR на поверхности макрофага. б — Фрагмент С3 комплемента (компонент комплемента, после присоединения которого весь этот комплекс приобретает способность прилипать к различным частицам и клеткам) и рецептор комплемента (complement receptor, CR) способствуют присоединению вируса к клетке. в — Белки комплемента С1q и С1qR способствуют присоединению вируса к клетке (в составе молекулы C1q имеется рецептор для связывания с Fc-фрагментом молекулы антитела). г — Антитела взаимодействуют с рецептор-связывающим сайтом вирусного белка и индуцируют его конформационные изменения, облегчающие слияние вируса с мембраной. д — Вирусы, получившие возможность реплицироваться в данной клетке посредством ADE, супрессируют противовирусные ответы со стороны антивирусных генов клетки. Рисунок с сайта supotnitskiy.ru.
Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:


