Какой белок является противовирусным фибриноген интерферон фибрин актин
Маркер связан с изменением уровня фибриногена в крови. Исследуется для выявления генетической предрасположенности к инсульту, патологии беременности (привычному невынашиванию, фетоплацентарной недостаточности). Имеет прогностическое значение в оценке риска инсульта на фоне повышенного артериального давления.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 4q31.3
Ген FGB кодирует бета-полипептидную цепь белка фибриногена, растворимого белка плазмы крови, который относится к группе глобулинов (фактор I свертывания крови). Под действием фермента тромбина этот белок способен превращаться в фибрин и образовывать тромб.
Генетический маркер G(-455)A
Участок ДНК в регуляторной области гена FGB, в которой происходит замена гуанина (G) на аденин (А) в позиции -455, обозначается как генетический маркер G(-455)A. Наличие замены влияет на интенсивность синтеза белка фибриногена.
Возможные генотипы
Встречаемость в популяции
Встречаемость минорного (А) аллеля в европейской популяции составляет примерно 20 %.
Ассоциация маркера с заболеваниями
- Ишемический инсульт
- Патологии беременности (привычное невынашивание, фетоплацентарная недостаточность)
- Тромбозы
Общая информация об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что обеспечивает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений или тромбообразования.
Фибриноген– белок, вырабатываемый в печени и циркулирующий в плазме крови. При активации системы свертывания крови он подвергается ферментативному расщеплению ферментом тромбином. Образующийся фибрин-мономер под действием активного фактора свертывания крови F13 выпадает в осадок в виде белых нитей фибрина-полимера. Фибрин представляет собой основу сгустка крови и впоследствии образует тромб, завершая процесс свертывания.
Ген FGB кодирует бета-полипептидную цепь белка фибриногена. Замена G (гуанина) на A (аденин) в регуляторной области гена FGB ассоциирована с повышенной концентрацией в плазме крови белка фибриногена.
Эффект от присутствия А-аллеля сильнее выражен у женщин в период после менопаузы. Курение также усугубляет негативный эффект носительства аллеля А, поэтому у курильщиков концентрация фибриногена в плазме крови выше.
Некоторые исследования показывают, что носители аллеля А (генотип G/A и A/A) имеют повышенный риск ишемического инсульта и наличие этого аллеля можно считать его прогностическим фактором, особенно у курильщиков и людей, страдающих артериальной гипертонией, повышенным уровнем инсулина и глюкозы крови. Повышенный уровень фибриногена в крови, вызванный присутствием в генотипе аллеля А, может приводить к атеросклеротическим изменениям в сосудах головного мозга, вызывая тем самым инсульты. Причем у гомозигот по аллелю А (генотип А/А) чаще наблюдается повреждение сосудов, по сравнению с гетерозиготами (генотип G/A). Также была показана ассоциация наличия в генотипе аллеля А с двукратным увеличением вероятности развития аневризмы брюшной аорты.
Женщины с генотипом А/А чаще встречаются среди пациенток с привычным невынашиванием. Но частоты аллелей в группах женщин с привычным невынашиванием и здоровых женщин достоверно не отличаются, поэтому можно предположить, что эффект полиморфизма гена FGB на самом деле не очень существенный. Изменения в гене фибриногена связаны с риском венозных тромбозов во время беременности и в послеродовом периоде.
Исследование полиморфизма гена FGB имеет прогностическое значение при оценке рисков инсульта на фоне повышенного артериального давления и возможных осложнений беременности. Выявление носительства неблагоприятного варианта гена позволит провести своевременные профилактические мероприятия, связанные с контролем уровня фибриногена, артериального давления, с коррекцией образа жизни.
Оценка генотипа по маркеру:
- G/G – нормальная концентрация фибриногена
- G/A – концентрация фибриногена умеренно повышена
- A/A – концентрация фибриногена значительно повышена
Результат исследования должен интерпретироваться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Генетический маркер входит в исследование:
Для данного маркера не существует понятия "норма" и "патология", т. к. исследуется полиморфизм гена.
Из этого урока вы узнаете о функциях белков, познакомитесь с классификацией белков, а также с белками, которые выполняют структурную, сократительную, транспортную, защитную, регуляторную, запасающую и энергетическую функции. Узнаете о гормонах и токсинах белковой природы, факторах иммунитета, переносчиках кислорода и других жизненно важных веществ.
Тема: Основы цитологии
Урок: Функции белков
Введение
На предыдущем уроке, мы с вами рассмотрели аминокислоты, строение белков; показали уровни организации белковой молекулы. Белки имеют первичную, вторичную, третичную и четвертичную структуру.
На этом уроке мы с вами разберем классификацию белков по форме молекулы, а также охарактеризуем некоторые функции белков.
Классификация белков
По форме молекулы белки делятся на фибриллярные белки, или волокнистые; глобулярные белки (Рис. 1), то есть белковая молекула имеет форму глобулы (шара); и промежуточные белки, то есть белки фибриллярной формы, но при этом растворимы в воде.


Рис. 1. Схематическое изображение третичной и четвертичной структуры белков
Фибриллярные белки.
Наиболее важна для них вторичная структура. Третичная структура складчатая. Обладают высокой механической прочностью, нерастворимы в воде.
Фибриллярные белки представляют собой длинные параллельные полипептидные цепи, скреплённые друг с другом поперечными сшивками, образуют длинные волокна, или слоистые структуры (Рис. 2).
Как правило, фибриллярные белки выполняют в организме структурные функции.



Рис. 2. Фибриллярные белки
Глобулярные белки.
Это полипептидные цепи, свёрнутые в компактные глобулы. В отличие от фибриллярных белков, они растворимы, легко образуют коллоидные суспензии, выполняют различные функции в клетке (Рис. 3).



Рис. 3. Примеры глобулярных белков
Промежуточные белки имеют фибриллярную форму, но растворимы в воде.
Функции белков
Белки выполняют целый ряд функций, как в клетке, так и в организме. Функция определяется структурой и формой белковой молекулы.
Структурная функция белков
В первую очередь эту функцию выполняют белки, которые входят в состав биологических мембран.
Кроме этого к структурным белкам относятся белки межклеточного матрикса, такие как коллаген и ретикулин. Одним из основных компонентов связок является эластин, кожи – коллаген. Коллаген также входит в состав костей, сухожилий, хряща (Рис. 4).
Волосы и ногти в основном состоят из очень прочного белка – кератина. Кстати кератин, является ещё компонентом перьев.



Рис. 4. Структурные белки
Сократительные белки
Некоторые клетки организма способны сокращаться и перемещаться, благодаря наличию сократительных белков. К сократительным белкам относятся актин и миозин, которые вызывают сокращение мышц и сокращение мышечной ткани (Рис. 5).

Рис. 5. Сократительные белки актин и миозин
Другим белком, обеспечивающим перемещение клеток, является тубулин, входящий в состав микротрубочек (основных компонентов ресничек и жгутиков клетки) (Рис. 6). Как и предыдущие белки, они имеют фибриллярную структуру.

Рис. 6. Белок тубулин, обеспечивающий движение компонентов клетки
Транспортные белки
Ряд белков выполняет функции переноса веществ из одного компартмента клетки в другой или между органами целого организма. Например, гемоглобин переносит кислород от легких к тканям, и углекислый газ от тканей в легкие. Эти белки имеют глобулярную структуру (см. видео).
В крови есть специальные транспортные белки – альбумины, которые переносят различные вещества. Сывороточный альбумин крови переносит как биологические активные вещества, так и жирные кислоты, и липиды.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны (см. видео).
Защитные белки. Факторы иммунитета и токсины.
Специфические белки выполняют так называемую защитную функцию, они предохраняют наш организм от вторжения чужеродных организмов или чужеродных белков и от различных повреждений. К таким защитным белкам относятся антитела. То есть, они вырабатываются в ответ на чужеродные воздействия. Они взаимодействуют с микроорганизмами, попавшими в кровь, и их инактивируют.
Другие белки – интерфероны, они специфически связываются с вирусами, инактивируют их и не дают возможность воссоздать им свою структуру, то есть размножиться внутри организма человека.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб. Фибриноген является примером белка промежуточного типа, поскольку он имеет фибриллярную структуру, но при этом растворим в воде (Рис. 7).

Рис. 7. Нити фибрина тромба, оплетающие эритроциты, под микроскопом
Многие живые существа для обеспечения защиты выделяют белки – токсины, которые в большинстве случаев представляют сильнейшие яды. Токсические белки представлены токсинами ядов змей, скорпионов, пчёл. Они характеризуются довольно низкой для белков молекулярной массой. Токсины растений и микроорганизмов более разнообразны по форме и молекулярной массе. Наиболее распространенные из токсинов микроорганизмов – это дифтерийный и холерный токсин.
Некоторые организмы способны вырабатывать антитоксины, которые подавляют действие токсических веществ.
Регуляторная функция белков. Гормоны
В организме человека существует ряд белков, которые выполняют регуляторную функцию. К ним относятся различные гормоны белково-пептидной природы. Одним из таких гормонов является инсулин. Он вырабатывается поджелудочной железой и регулирует уровень глюкозы в крови.
Кроме этого к таким гормонам относится кальцитонин, который регулирует уровень кальция в крови костной ткани, а также так называемый соматотропный гормон, или соматотропин, который влияет на рост и развитие человека.
Запасные белки
Белки могут быть запасными питательными веществами. Например, альбумин куриного яйца, казеин молока. В семенах многих растений, белки также могут выполнять запасающую функцию.
Энергетическая функция белков
Белки могут выполнять в клетке или организме энергетическую функцию, поскольку при расщеплении одного грамма белков образуется 17,6 кДж энергии. Для этой цели белки используются в исключительных случаях – в качестве источника энергии обычно используется либо углеводы, либо липиды.
Таким образом, мы начали рассмотрение различных функций белков, а на следующем занятии обсудим белки-ферменты.
Настоящая голубая кровь
В живых организмах медь была обнаружена в 1808 году французским химиком Луи Вокленом. Он является основоположником химического анализа.
Гемоцианин, медьсодержащий белок кальмаров, улиток, раков и пауков. Так же, как и гемоглобин позвоночных, он переносит кислород, при этом кровь окрашивается в голубой цвет, и наблюдается флуоресценция. С окисью углерода гемоцианин, так же как и гемоглобин, взаимодействует обратимо, образуя бесцветное соединение.
Способность к переносу кислорода у гемоцианина значительно ниже, по сравнению с гемоглобином. Поэтому у высших позвоночных животных в крови наблюдается гемоглобин, а не гемоцианин.
Интерфероны
Интерфероны – это белки, которые вырабатываются в ответ на проникновение в организм различных чужеродных агентов, в том числе и вирусных частиц. Интерфероны блокируют (инактивируют) вирусы, то есть они запускают химические реакции, которые прекращают воспроизведение ДНК- и РНК-содержащих вирусов.
Интерфероны имеют широкий спектр действия:
противовирусное действие;
противоопухолевое действие;
радиопротекторное действие;
иммуномодулирующее действие.
В связи с этим интерфероны широко используются для лечения различных вирусных заболеваний (например, заболевания гриппа, ОРВИ, заболевания герпеса), используются в комплексной терапии такого сложного заболевания как гепатит, используются в комплексной терапии для лечения СПИДа, а также, поскольку они обладают противоопухолевым действием, в комплексной терапии для лечения раковых заболеваний.
Если у человека наблюдается герпес, то обычно смазывается поражённый участок.
При различных формах простудных заболеваний, интерферон используется в виде капель в нос.
Соматотропный гормон
Соматотропин, или соматотропный гормон, контролирует рост и развитие организма как животных, так и человека. Соматотропин вырабатывается передней долей гипофиза и секретируется в кровь. Он является полифункциональным гормоном. Основной дефект развития организма человека и животных, в условии недостаточности соматотропина – задержка роста костей.
Избыток соматотропина в растущем организме может приводить к гигантизму, а у взрослых к ненормальному увеличению отдельных органов и тканей.



Домашнее задание
1. Какие вещества называют белками?
2. Из чего состоят белки?
3. Какие классификации белков вам известны?
4. Перечислите основные функции белков.
5. Приведите примеры белков, которые выполняют различные функции.
6. Сравните функции гемоглобина и гемоцианина.
7. Каковы функции интерферона?
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
2. Школа цифрового века (Источник).
3. Портал для семейного просмотра (Источник).
Список литературы
1. Каменский А. А., Криксунов Е. А., Пасечник В. В. Общая биология 10-11 класс Дрофа, 2005.
2. Биология. 10 класс. Общая биология. Базовый уровень / П. В. Ижевский, О. А. Корнилова, Т. Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
3. Беляев Д. К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
4. Агафонова И. Б., Захарова Е. Т., Сивоглазов В. И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 


Что такое фибрин?

Фибрин — это высокомолекулярный белок, который является производным синтезируемого печенью фиброгена. Имеет форму длинных поперечноисчерченных или гладких волокон. Сгустки этих волокон составляют основу тромба, который образуется во время свертывания крови.
В отличие от фиброгена, который является первым фактором свертывания крови, фибрин не находится в плазме постоянно. Он появляется из-за неординарных ситуаций, которые активируют систему гомеостаза — способность организма соблюдать постоянство вне зависимости от факторов внешней среды. Такими неординарными ситуациями являются раны и воспаления, возникающие из-за нарушения целостности тканей и сосудов.
Процесс образования фибрина

Процессы образования фибрина и фибриногена
Образование фибрина — сложный химический процесс. Он состоит из нескольких этапов:
- Отщепление от фиброгеновой молекулы двух пептидов А и двух пептидов Б под действием тромбина с последующим образованием фибрин-мономера. Полученный мономер состоит из двух одинаковых частиц, соединенных между собой дисульфидными мостиками. Каждая частица при этом состоит из 3-х отличающихся между собой полипептидных цепей.
- Самопроизвольное превращение фибрин-мономера в сгусток, который называется фибрин-агрегат или нестабилизированный фибрин. Этот процесс ускоряют вещества, которые несут в себе положительный заряд и тормозят вещества с отрицательно заряженными частицами. Во время агрегации мономера молекулы из глобул трансформируются в фибриллы — нитевидные белки. В создании нестабилизированного фибрина участвуют разные виды химических связей и силы гидрофобного воздействия. Они могут ослабляться в средах, вызывающих денатурацию. Из-за денатурации фибрин-агрегат может восстановиться в мономер.
- На нестабилизированный фиброген воздействует фибринстабилизирующий фактор, из-за которого структура агрегата меняется. Из-за появления ковалентных связей в полипептидных цепях фибрин-агрегат стабилизируется в фибрин-полимер.
Если человек страдает от врожденных или хронических болезней, сопровождаемых дефицитом фибринстабилизирующего фактора, агрегатная форма не сможет стабилизироваться в полимер. Тогда из фибрине не образуется сгусток.
Множество молекул фибрина-полимера кооперируются в нити. Они захватывают тромбоциты и другие клетки крови и формируют из них губчатое вещество. Оно сбивается, становится плотнее и образовывает тромб.
Функции белка фибрина

Фибрин участвует в регенерации нервных волокон
У белка фибрина не много физиологических функций, но каждая из них очень важна для организма. Всего их несколько:
- Остановка кровотечений. Когда ткань повреждается и начинается кровотечение, происходит быстрая (при отсутствии патологий свертываемости крови) трансформация фиброгена в фибрин. Из фибрина формируется кровяной сгусток, который закупоривает сосуд и препятствует кровопотере.
- Противовоспалительный эффект. Попадая в очаг воспаления фибрин обволакивает болезнетворные агенты и не дает им попадать в здоровые ткани.
- Участие в процессе регенерации нервных тканей.
Когда фибрин выполняет свою биологическую функцию, организм стремится уменьшить его концентрацию в крови. Этот процесс называется фибринолизом — процесс растворения кровяных сгустков и тромбов.
Роль фибрина в воспалении

Фибриновые сети ограничивают очаг воспаления
Фибриновый синтез начинается сразу после контакта фиброгена с ферментом тромбокиназа, которая высвобождается из поврежденных или разрушенных тканей. После этого происходит реакция фиксации, во время которой фибрин захватывает патологические вещества и блокирует их. Таким образом фибрин не дает воспалению перекинуться на здоровую ткань.
Также фибрин не дает расти самому очагу воспаления. На самых начальных его этапах, когда еще не началось активное деление лейкоцитов и их миграция к очагу воспаления, молекулы фибрина окружают очаг в круг и препятствуют его распространению.
Избыток и недостаток фибрина — опасно ли?

Недостаток фибрина осложняет заживление ран
На самом деле понятия нормы касательно количества фибрина не существует. В первую очередь врачи смотрят на результаты коагулограммы и уровень фиброгена.
Если в зоне поражения тканей будет мало фибрина, это повлечет за собой нежелательные последствия:
- расширение очага воспаления из-за нарушения свертывания крови и отсутствия качественного фибринового каркаса;
- замедленное затягивание ран, часто сопровождаемое вторичным натяжением (так называется самостоятельное заживление раны с последующим образованием большого рубца);
- повышается риск кровотечений.

Фибриновые сгустки без фибринолиза затрудняют процессы регенерации
Бывают случаи, когда во время воспалений количество фибрина наоборот значительно превышает норму, а фибринолиз еще не начинается. Это чревато развитием таких патологических процессов:
- обострение характера воспаления с появлением сильных болей, сильной отечностью и даже полным прекращением кровообращения в очаге воспаления;
- сильная задержка регенерации;
- сдавливание сосудов из-за закупорки тромбами и кровяными сгустками;
- нарушение фагоцитоза (клеточное питание) и массовая гибель клеток.
У здорового человека уровень фибрина (скорее фиброгена) тоже не должен сильно колебаться. При повышенной концентрации этого белка человек становится более предрасположенным к возникновению тромбов. Эти тромбы могут отрываться и бесконтрольно блуждать по сосудам. Случается, что тромб попадает в какой-то важный сосуд и закупоривает его, из-за прекращения кровообращения человек может умереть. При пониженной концентрации фибрина появляется предрасположенность к кровотечениям. При таком нарушении можно потерять много крови даже из-за банального пореза.
Фибрин – это белок, являющийся конечным результатом свертывания крови. Он образуется в результате воздействия на фиброген тромбина.
Фибрин – это нерастворимый протеин, вырабатывающийся в организме в качестве ответной реакции на кровотечение. Этот белок является твердым элементом, состоящим из волокнистых нитей. Прародителем фибрина является фибриноген. Это белок, вырабатываемый печенью. Он находится в крови. При повреждении тканей происходит кровотечение. Чтобы его остановить, начинает работать тромбин. Он оказывает воздействие на фибриноген, тем самым провоцируя его превращение в фибрин.
Сначала молекулы белка объединяются в длинные нити, которые опутывают тромбоцит, создавая грубую массу. Постепенно она затвердевает и сжимается, образуя кровавый сгусток. Процесс уплотнения стабилизируется фибринстабилизирующим фактором.

Роль фибрина при воспалении
Выработка фибрина и воспаление – это два тесно связанных процесса. Белок играет важную роль при контакте с разрушающейся, поврежденной тканью. Освободившаяся из ткани тромбокиназа вступает в контакт с фибриногеном.
При свертывании крови все токсические вещества оказываются закупоренными в сгустке. Эта особенность воздействия белка при воспалительном процессе защищает организм от дальнейшего распространения токсинов и их негативного воздействия. Подобная реакция получила название фиксации. Таким образом, фибрин – это еще и защитник организма от токсинов.
Защита организма
Образование нерастворимого фибрина позволяет защитить организм от кровопотери, а также от воспалительных процессов. Однако подобная реакция вызывает боль и отечность, повреждение тканей, нарушение их функциональности. Впоследствии это устраняется репаративными процессами. На их ранней стадии вырабатываются специальные вещества, которые вызывают деполимеризацию фибрина. Подобная реакция даже в самом начале воспалительного процесса способна тормозить воздействие белка на патологический очаг.
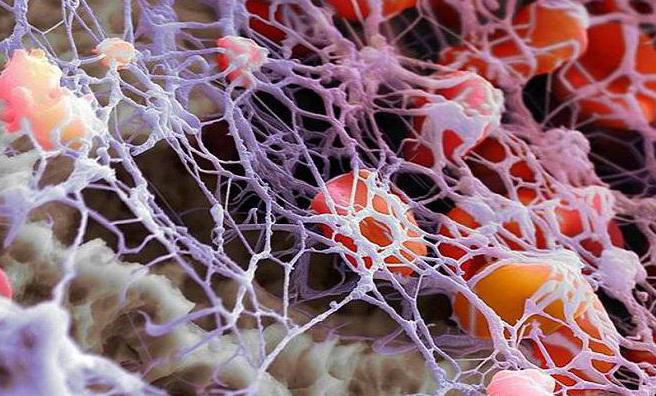
Функция фибрина
При превращении фибриногена в фибрин особые ферменты, расположенные в очаге воспаления, начинают воздействовать как ингибиторы. Этот процесс проявляется полимеризацией фибриногена в фибрин. Исходя из этого, определяется функция протеаз, которая состоит в разжижении материалов, методом расщепления фибрина и иных протеиновых молекул на пептиды и аминокислоты. Также функция протеаз заключается в торможении выработки крупных молекул нерастворимого типа.
Проведенные опыты
Ученые проводили эксперименты на животных, в ходе которых выяснилось, что введенные извне протеазы до воспалительного процесса способны предотвратить его развитие полностью, а в некоторых случаях патология протекала в легкой форме. Опыт показал, что использование триптических веществ в большинстве случаев прекращает развитие воспалительных процессов в начале заболевания.
При введении профилактических доз ферментов образование белка снижалось.
Фибрин – это не просто белок, а создатель защитного барьера вокруг патологического очага, который защищает от заболевания. Впоследствии этот нерастворимый компонент служит для построения соединительной ткани. Также он участвует в процессах регенерации. От длительности сохранения и количества выработки фибрина организмом зависит образование рубцовой ткани.
Так что такое фибрин и для чего он нужен? Это вещество образуется клетками организма в таком количестве, которое необходимо для быстрой остановки кровотечения и которое поможет быстро восстановить поврежденные ткани. В некоторых случаях фибрин – это вредитель. Если он вырабатывается и откладывается в больших количествах, то белок способен нанести вред организму. Насколько известно, фибринолиз – это длительный процесс, не способный растворить весь излишек белка. Тем более что для этого процесса необходимы определенные условия.
Чтобы избавиться от избытка фибрина, назначают специальное лечение ферментами.
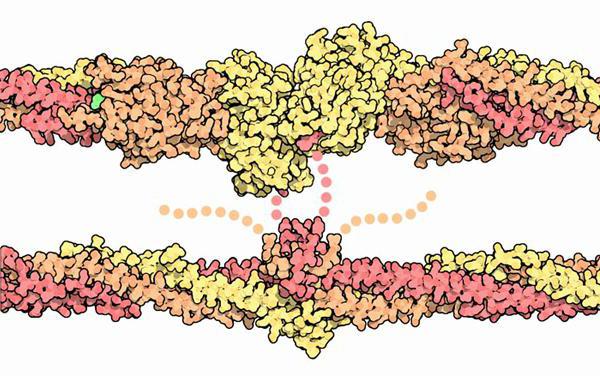
Лечение ферментами
В последнее время особое внимание уделяется свойствам ферментов. Особенно это касается протеаз. Для лечения фибрина ферменты используются вещества именно этого типа. Они помогают растворить излишний белок, тем самым предотвратив серьезные осложнения в виде образования тромбов.
Свойства протеолитических ферментов разные. Они способны оказывать фибринолитическое и иммуномодулирующее воздействие на организм, а также улучшать кровообращение, работать в качестве противоотечных, противовоспалительных веществ.

Так как тромбообразование строится на выработке фибрина, то необходима протеаза, которая вызывает реакцию расщепления этого вещества. Без такого фермента невозможно разбить протеин на молекулы, следовательно, улучшения микроциркуляции крови не будет.
При местном воздействии протеазы возможно удаление некротического налета, рассасывание фибринозного образования, разжижение вязкого секрета.
Читайте также:


