Лечения рака вакцинами и вирусами
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
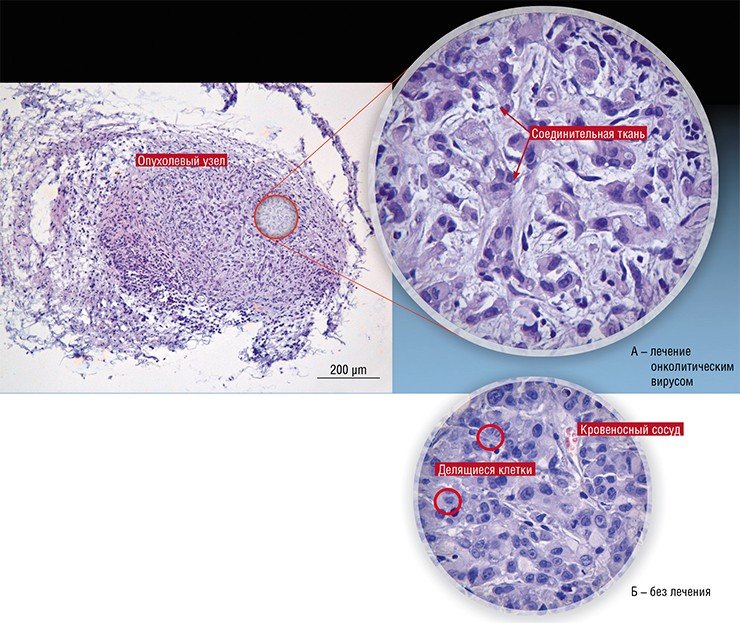
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
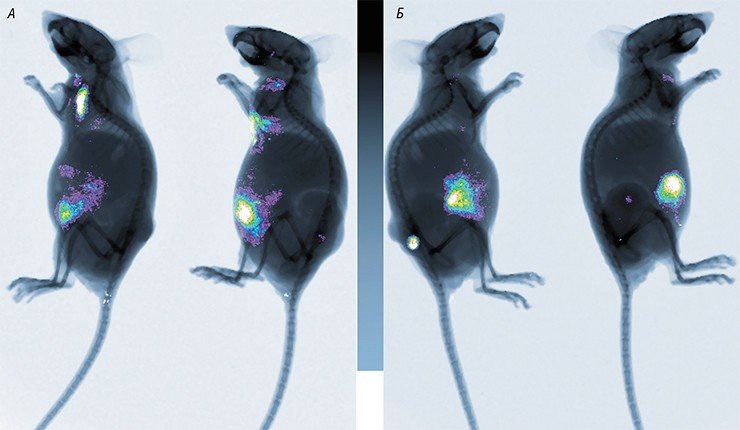
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.

Рак является причиной смерти №1 в мире.
На протяжении долгих десятилетий ученые разрабатывают противоопухолевые вакцины, вирусы, наночастицы и иммунотерапию для лечения рака.
Но насколько мы близки к победе над смертельной болезнью?
Всемирная организация здравоохранения (ВОЗ) отмечает, что каждая шестая смерть на планете связана с онкологическими заболеваниями. Только в России за 2015 году от рака умерло почти 287 тысяч человек, в США — почти 600 тысяч.
Сегодня наиболее распространенными видами лечения рака являются лучевая терапия, химиотерапия, хирургическое лечение и — в случае рака предстательной железы и рака молочной железы — еще и гормональная терапия.
На фоне традиционного лечения набирают силу новые, способные существенно улучшить результаты, а зачастую имеющие меньше побочных эффектов.
- Побочные эффекты агрессивной терапии
- Частые рецидивы заболевания после операции
- Устойчивость опухолей к химиопрепаратам
Сегодня мы расскажем о самых последних исследованиях рака, которые позволяют надеяться на скорую победу над болезнью и появление эффективной профилактики.
Иммунотерапия рака
Если раньше наука оказалась бы бессильной, то сегодня ответ нашелся быстро: новые препараты для иммунотерапии рака блокируют молекулы, маскирующие опухоль, тем самым полностью восстанавливая контроль иммунной системы над болезнью.
Терапевтические вирусы и вакцины против рака
В январе 2018 мы рассказывали о достижении швейцарских ученых, которые обучают дендритные вакцины прямо в теле пациента. Для этого достаточно ввести в клетку особые пузырьки (везикулы) с антигенами рака, и она начинает распознавать чужака.
В последнее время врачи понимают, что иммунотерапия наилучшим образом работает в тандеме с химиотерапией. Особенно, если курс химиотерапии предшествует назначению иммунотерапевтических средств. Проблема заключается в том, что эта комбинация увеличивает вероятность побочных эффектов.
Ученые из двух ведущих институтов Северной Каролины (США) нашли решение. Разработанный в начале 2018 года гелеобразный материал может использоваться для доставки химиотерапии и иммунотерапии в опухоль, без системных реакций.
Наночастицы доставляют химиопрепараты
Если говорить о точности доставки химиопрепаратов и обнаружении невидимых микроопухолей, то настоящую революцию в этом деле произвели нанотехнологии.
Наночастицы — это крошечные частицы, соизмеримые по своим размерам с молекулами. Они широко используются в разных областях медицины, включая диагностику и лечение рака. По мнению ведущих онкологов США, следующие 10 лет сделают наночастицы повседневной реальностью онкологии.
В чем секрет их успеха?
Начнем с главного: убить рак огромной дозой токсичного химиопрепарата, в принципе, не проблема. Проблема — не убить при этом человека.
Наночастицы служат идеальными транспортными средствами для доставки химиотерапевтических средств по нужному адресу. Чем точнее доставка яда, тем меньше его потребуется для лечения.
Тем ниже риск общих (системных) побочных явлений.
Но есть и другие области применения наночастиц. Например, их можно использовать для гипертермии, когда частицы сначала насыщают опухоли, а затем под действием внешнего излучения нагреваются, вызывая массовую гибель раковых клеток.
Врачи заставят рак голодать
Другая стратегия, недавно предложенная учеными – лишать рак питательных веществ, необходимых для бесконтрольного деления клеток и роста опухоли.
Авторы первого проекта научились лишать рак глутамина – жизненно важной аминокислоты, которую активно используют опухоли легких, груди и кишечника. Блокируя доступ клеток к глутамину, исследователям удалось усилить окислительный стресс и уменьшить опухоли.
Второй способ победить рак молочной железы – это лишить опухолевые клетки эссенциального фермента, который помогает им вырабатывать энергию.
Что обещают нам исследования рака?
Исследования рака проводятся на полной скорости, с применением всех доступных технических достижений Большинство из этих проектов все еще находятся на ранней стадии экспериментов in vitro и in vivo. Им предстоит пройти долгий путь до клинических испытаний на пациентах.
Это не значит, что мы должны потерять надежду.
Медицина находится на том этапе, где можно утверждать: рак излечим.
Остальное – это вопрос техники и нескольких лет времени.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик

Вакцина против рака
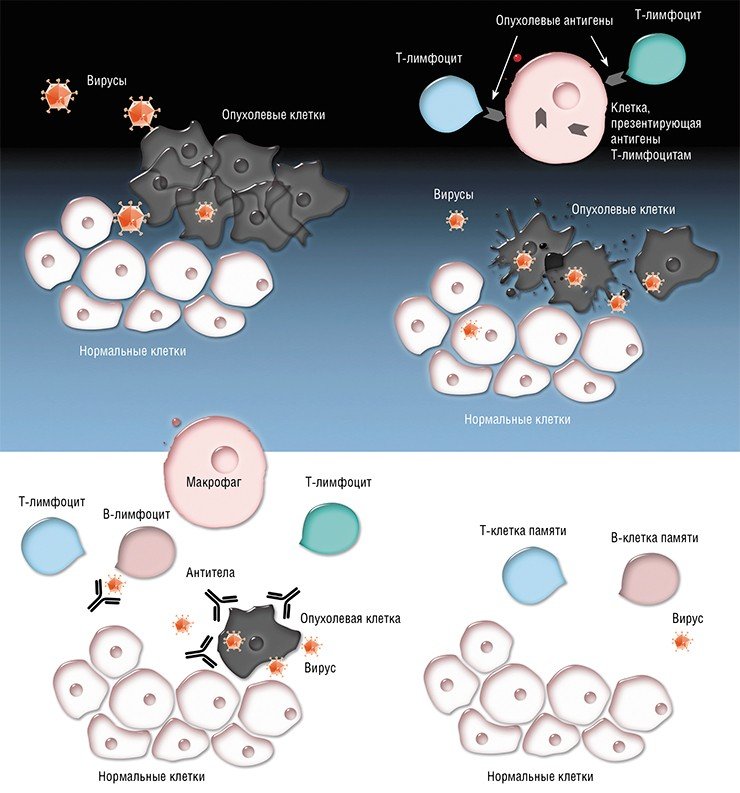
В онкологии лечение вакцинами предназначено для лечения рака, который уже диагностирован, а не для предотвращения его возникновения. Вакцина от рака воздействует на антигены, связанные с раком, чтобы усилить реакцию иммунной системы на опухолевые клетки пациента. Раковые антигены могут быть белками или молекулами другого типа, найденными на поверхности или внутри раковых клеток, которые могут стимулировать В-клетки-киллеры или Т-клетки, чтобы атаковывать их.
В настоящее время в стадии разработки находятся некоторые вакцины, которые нацелены на целевые антигены, находящиеся на или во многих типах раковых клеток. Эти вакцины против рака проходят апробацию в клинических испытаниях у пациентов с различными видами рака, в том числе рак простаты, рак толстой кишки, легких, молочной железы и рак щитовидной железы.
Другие противоопухолевые вакцины нацелены на антигены, которые являются уникальными для определенного типа рака. Тем не менее, целый ряд вакцин предназначен для борьбы с конкретным антигеном опухоли, чтобы лечить конкретного пациента путем “настройки” на имеющийся тип рака.
Вот, например, вакцина для лечения одного типа рака, которая уже получила одобрение FDA, Sipuleucel-T (сипулейцел-Т). Это тип вакцины, который настраивается под конкретный тип рака. Кстати, в ходе его клинических испытаний, была выявлена способность сипулейцела увеличивать продолжительность жизни мужчин с метастатическим раком (одним из видов) предстательной железы на 4 месяца.
Из-за ограниченной токсичности противораковых вакцин, они также проходят клинические испытания в сочетании с другими формами терапии, такими как гормональная терапия, химиотерапия, лучевая терапия, и целевая терапия.
Что такое БЦЖ терапия?
БЦЖ (BCG или бацилла Кальметта – Герена) была первым вариантом биологической терапии, одобренной FDA. Она ослабляла форму живой бактерии туберкулеза, которая не вызывает заболевания у людей. Впервые БЦЖ была использована медициной как вакцина против туберкулеза. Когда введенная непосредственно в мочевой пузырь с помощью катетера, БЦЖ стимулирует общую иммунную реакцию, которая направлена не только против самой внешней бактерии, но также и против раковых клеток мочевого пузыря.
Как и почему БЦЖ оказывает этот противоопухолевый эффект не очень хорошо понятно, но эффективность лечения хорошо документирована. Примерно 70 процентов пациентов с ранними стадиями рака мочевого пузыря испытывают ремиссию после БЦЖ-терапии.
В настоящее время использование БЦЖ также изучается в лечении других видов рака.
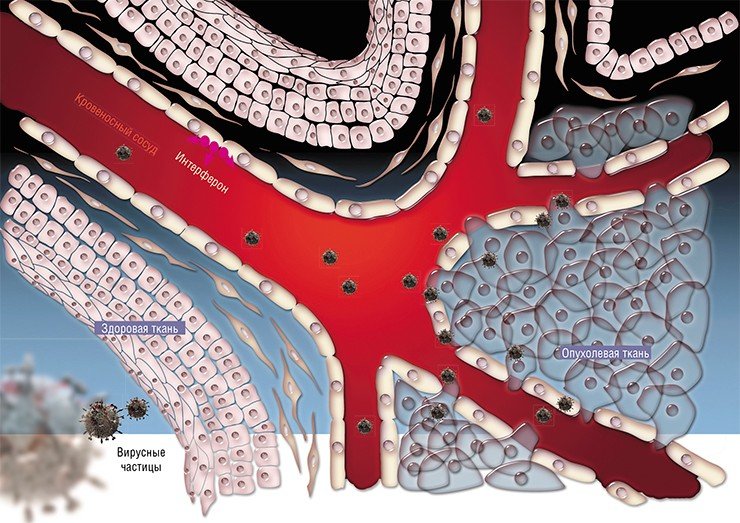
Что дает онколитический вирус в лечении рака?

Некоторые вирусы, такие как реовирус, болезнь Ньюкасла, и вирус эпидемического паротита, естественно онколитические, в то время как другие, в том числе вирус кори, аденовирус, вирус коровьей оспы могут быть адаптированы или модифицированы, чтобы эффективно воспроизводиться только в раковых клетках. Кроме того, онколитические вирусы могут быть изменены с помощью генной инженерии, чтобы предпочтительно инфицировать и воспроизводиться в раковых клеток, которые продуцируют специфический рак, связанный с антигенами, такими как EGFR или HER-2.
Одной из проблем в использовании онколитических вирусов является то, что они сами могут быть уничтожены иммунной системой пациента, прежде чем будут иметь шанс атаковать рак. Исследователи методов вирусной терапии разработали несколько стратегий, чтобы преодолеть эту проблему, например, введение комбинации иммунного подавления препаратов химиотерапии, таких как циклофосфамид вместе с вирусом или “маскировка” вируса внутри защитной оболочки. Но иммунная реакция у пациента может на самом деле иметь преимущества: хотя это может затруднить лечение онколитическим вирусом в момент доставки вируса, но это может улучшить разрушение раковых клеток после заражение вирусом опухолевых клеток.
Нет, онколитический вирус не был одобрен для использования в Соединенных Штатах, хотя H101, модифицированная форма аденовируса, была утверждена в Китае в 2006 году для лечения пациентов с раком головы и шеи. Несколько онколитических вирусов в настоящее время проходят клинические испытания. Исследователи также изучают, могут ли онколитические вирусы быть объединены с другими видами терапии рака или могут ли быть использованы для увеличения чувствительности опухолей пациентов при использовании дополнительной терапии.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.
Начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы
У нас работы в данном направлении были начаты в 1970-х годах профессором М. К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.


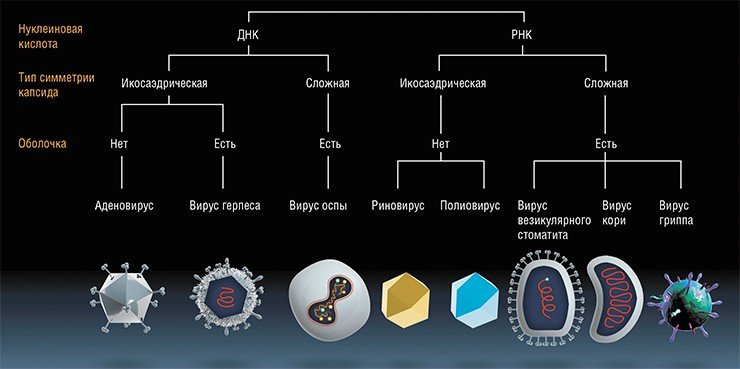
Известные на сегодня семейства вирусов, убивающих раковые клетки
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П. М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П. М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН им. В. А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.

Современное лечение рака вакциной
Иммунотерапия рака быстро превращается в динамичный инструмент для борьбы с болезнью, особенно с заболеванием, которое трудно поддается лечению. С помощью иммунотерапии ищутся средства для борьбы с опухолями новыми способами. Иммунотерапия может напрямую стимулировать иммунную систему, либо с помощью искусственных белков или антигенов обучить иммунную систему изнутри выявлять и атаковать раковые опухоли.
Некоторые виды рака могут быть замедлены вакцинами
Вакцины для лечение рака являются одной из форм иммунотерапии, которая используется для лечения раковых заболеваний, которые уже существуют в теле пациента.
В более общем плане, вакцинами для лечения рака являются биопрепараты, или биофармацевтические препараты. Другие биопрепараты включают компоненты крови, генную терапия, аллергены и другие вакцины.
Лечение рака вакциной Provenge
В настоящее время единственная вакцина против рака, которую одобрило FDA называется Provenge для лечения рака простаты.
Как лечение рака происходит посредством вакцины?
Антигены представляют собой вещества, которые вызывают иммунный ответ системы. Многие вакцины для лечения рака обеспечивают поставку ассоциированных антигенов дендритных клеток. Эти дендритные клетки являются клетками иммунной системы, которые находятся непосредственно в месте инъекции (дермы) и вырабатывают антиген. Кроме того, иммуностимулирующие молекулы, присутствующие в вакцине при необходимости увеличивают производство молекул, необходимых в конечном счете, чтобы взаимодействовать с Т-клетками. Следует отметить, что ассоциированные раковые антигены, могут быть специфическими либо для одного типа рака или для группы из нескольких видов рака.
 |
 |
Эти активированные дендритные клетки мигрируют в лимфатические узлы, которые являются небольшими сгустками иммунологической ткани, расположенной по всему телу.
После того, как эти активированные дендритные клетки достигают лимфатический узел, они атакуют рак специфическими антигенными Т-клеткам. Активированные Т-клетки затем путешествуют по всему организму, выявляя раковые клетки и пытаются разрушить их. Более технически, активированные CD4 + Т-клетки продуцируют цитокины, которые способствуют созреванию клеток CD-8, который после созревания распространяется по всему телу.
В качестве альтернативы, вакцина для лечения рака может быть приготовлена с использованием ДНК или РНК, которые кодируют антигены. Этот генетический материал затем вводят в клетки, которые затем продуцируют антигены. Есть надежда на то, что эти модифицированные клетки будут производить достаточное количество раковых ассоциированных антигенов, чтобы вызвать активную иммунную реакцию, чтобы убить раковые клетки.
Три критерия должны быть выполнены для опухолевых клеток, подлежащих уничтожению с помощью вакцины:
- Достаточно большое количество иммунных клеток с выраженным сродством к раковым клеткам должны быть произведены;
- Эти Т-клетки должны быть способны проникать в опухоль;
- Эти Т-клетки должны начать работать на месте опухоли, чтобы вызвать повреждения конкретного участка.
Насколько эффективны противораковые вакцины?
Лечение дендритными клетками. Терапия дендритной клеткой представляет собой новый и перспективный иммунотерапевтический подход для лечения рака предстательной железы, а также для профилактики рака.
На протяжении десятилетий исследователи рака были заинтересованы в иммунологическом лечении рака, но с небольшим успехом. Тем не менее, недавние успехи приводят к успешному внедрению терапии дендритной клеткой с сообщениями о полных ответах даже у пациентов с раком стадии IV, которые провалили все другие методы лечения.
Дендритная клеточная вакцина - это новая и эффективная форма иммунной терапии, используемой для лечения рака. В течение последних нескольких лет, сотни вакцин с дендритными клетками были протестированы.
Тем не менее, уровень "ответов" на эти вакцины у других типов рака был низким, около 2,6 процента. На самом деле, другие виды иммунотерапии оказались гораздо более эффективными, что повлияло на многих экспертов, которые теперь ставят под сомнение пользу терапевтических вакцин против рака.
Перспектива вакцины против рака
И что, если раковые терапевтические вакцины редко бывают эффективны в организме человека, мы, все же, продолжаем вкладывать ресурсы и время в разработку вакцин от рака? Есть по крайней мере три причины, объясняющие наш интерес к этому виду вмешательства.
Во-первых, вакцины были эффективными в предотвращении рака, и этот успех переносится на лечение рака с помощью вакцин. Другими словами, работа, которую мы сделали разрабатывая вакцины для профилактики рака научила нас многому о иммунологии раковых клеток и обеспечила теоретическую основу для разработки вакцин для лечения рака.
Есть в настоящее время две вакцины, которые предотвращают рак: вакцина против гепатита В предотвращает рак печени, и вирус папилломы человека (ВПЧ) вакцина предотвращает рак горла, шейки матки, анальный и другие виды рака.
Во-вторых, терапевтические вакцины против рака просты находятся под пристальным изучением, потому что вызвают несколько серьезных побочных эффектов.
В-третьих, исследования часто смещены в их интерпретации результатов испытаний, связанных с раком и терапевтических вакцин, которые разносят ажиотаж вокруг этого вида вмешательства. В частности, исследователи, как правило, сосредоточены на бессмысленных гистологических, или клеточных изменениях, или самих клетках lymphocte (Т-клеток) inflitration опухолей вместо того, чтобы сосредоточиться на реальных изменениях: уменьшение размера опухоли или улучшения клинических симптомов.
На соответствующую отсылку, были отнесены исследования вакцины против рака на животных, ведь, много было сделано выводов для основных медицинских практик с использованием животных. Мыши, как можно заключить по их размеру, модели поведения и пушистому внешнему виду, отличаются от человеческих существ. Таким образом, любой успех, который мы видим в лечении этих животных, болеющих раком, терапевтическими вакцинами, совсем не обязательно приводит к таким же результатам налюдях.
Более конкретно, хотя вакцины от рака, как было доказано, были эффективными на животных, не удалось обнаружить любой такой эффект у людей. В частности, существует только один случай положительного эффекта при использовании терапевтических вакцин от рака, одобренных FDA для лечения рака простаты у человека: вакцина Provenge (Провендж). Тем не менее, есть еще одна вакцина против рака простаты, в настоящее время она находится в 3-й фазе испытаний, которые доказали свою эффективность: вакцина Prostvac.
Вакцина от рака Provenge (Провендж) и Prostvac
Вакцина от рака простаты
Из-за широкого тестирования простат-специфического (PSA) антигена, биомаркера для рака простаты, мы были в состоянии обнаружить случаи рака простаты раньше, на стадии, когда он еще ограничивался расположением на предстательной железе. На самом деле мужчины узнают о раке простаты, когда уже рак имеет метастазы или распространиться на кости и становится смертельным.
Что такое противораковая вакцина Provenge (Провендж)?
Provenge или Sipuleucel-Т представляет собой вакцину дендритных клеток, которая была одобрена FDA в 2010 году. Provenge - это аутологичная клеточная иммунотерапия, использующаяся для лечения метастатического заболевания, которое не распространилось еще очень далеко (минимально инвазивные формы). Кроме того, Провендж лечит рак простаты, который не чувствителен к гормонам (гормон огнеупорный рак).
Рак гормонрефрактерного типа реагирует на гормон-депривационную терапию, или препараты, которые вызывают чехарду с андрогенами, или половыми гормонами (медицинская кастрация).
Причина, по которой GM-CSF дается с антигеном PAP - исследователи полагают, что GM-CSF облегчает введение антигена. Следует отметить, что мононуклеарными клетками периферической крови служат дендритные клетки, к которым представлен антиген.
К сожалению, Provenge продлевает жизнь всего на несколько месяцев, около 4 месяцев. Тем не менее, это может позволить человеку, привести свои дела в порядок и провести немного больше времени со своей семьей.
Побочные эффекты от противораковой вакцины
Побочные эффекты Provenge включают в себя следующее:
- лихорадка;
- озноб;
- усталость;
- боль в спине;
- головная боль;
В ходе клинических испытаний Provenge, несколько человек испытали более серьезные побочные эффекты, включая затрудненное дыхание, боль в груди, нерегулярное сердцебиение, обмороки головокружение и колебания артериального давления. Таким образом, люди с проблемами сердца и легких, могут применять вакцину после обсуждения с их лечащим врачом.
Что такое противораковая вакцина Prostvac?
Механизм Prostvac отличается от Provenge.
Prostvac состоит из поксвирусного вектора (птичьей оспы), простат-специфического антигена (ПСА) и костимулирующего комплекса под названием TRICOM. Эта вакцина PSA-TRICOM заражает антиген-представляющих клеток, побуждая их синтезировать простат-специфический антиген белков на их поверхности. Эти комплексы антиген-представляющих клеток затем обучают Т-клетки, как атаковать клетки рака простаты.
При изучении Prostvac во второй фазе клинических испытаний были включены 82 участника, из которых 42 получили Prostvac.
Prostvac продлил жизнь в экспериментальной группе на 8,5 месяцев. В настоящее время Prostvac находится в 3-й фазе клинических испытаний, и исследователи не только пытаются подтвердить эффективность применения препарата, но и пытаются выяснить, следует ли GM-CSF добавлять к вакцине.
Во время 2-й фазы клинических испытаний, были выявлены побочные эффекты Prostvac следующее:
|  |
Как используются вакцины от рака простаты?
Вакцины от рака простаты не предназначены для использования в качестве первой линии лечения рака предстательной железы. Вместо этого их вводят в дополнение к химиотерапии.
Вероятно, следует отметить, что в 2015 году FDA одобрило Imlygic, онколитическую вакцину для лечения злокачественной меланомы, неоперабельного типа. Хотя Imlygic технически не является терапевтической вакциной против рака, Imlygic имеет второстепенные эффекты, похожие на эффект от терапевтических вакцин против рака.
Онколитические вирусы представляют собой тип иммунотерапии, где генетически сконструированный вирус вводится непосредственно в опухоль меланому разрывает опухолевые клеток уменьшая раковые образования. В дополнение к разрушению клеток, эти вирусы имеют более общий эффект - продуцирование противоопухолевого эффекта, аналогичного противораковым вакцинам.
Что терапевтические вакцины от рака означают для меня?
В настоящее время использование вакцин от рака в клинических условиях ограничено. Кроме того, как уже упоминалось ранее, было действительно трудно найти раковые вакцины, которые не имеют никакого второстепенного влияния на человека. Маловероятно, что мы увидим, раковые вакцины, используемые для лечения различных видов рака в самое ближайшее время.
Тем не менее, противораковые вакцины представляют собой достижения иммунной системы на поле иммунотерапии. Чем лучше мы понимаем специфику иммунной системы, тем лучше мы можем создать целевую терапию, которая могла бы когда-нибудь спасти жизнь.
Читайте также:


