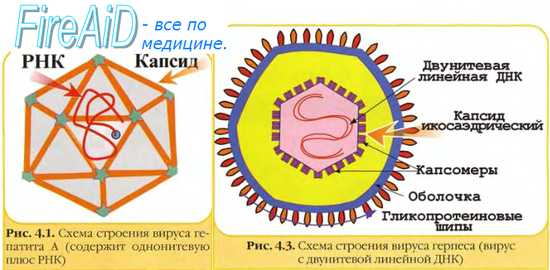
Метод выявления генетического материала вируса называется
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
Полимеразная цепная реакцияпозволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру.
Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций.
Рестрикционный анализ.Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее.
В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК.
В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы.
Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера.
Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом, можно получить рестрикционную карту определенного вида микробов.
Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям.
Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации.
Метод молекулярной гибридизациипозволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда.
Зондомназывается одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК.
Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль.
Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК.Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
Опосредованная транскрипцией амплификация рРНКиспользуется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа:
1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы.
2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами.
3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА).
Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации.
Для диагностики инфекционных заболеваний генетическими методами маркером возбудителя является его геном. Методы индикации нуклеиновых кислот применяют для диагностики вирусных инфекций, для идентификации бактерий (особенно таких, которые трудно выделить) и для определения точного таксономического положения микроорганизмов. Методы позволяют обнаружить микроорганизм в исследуемом материале (воде, продуктах, материале от больного) по наличию ДНК без его выделения в чистую культуру.
Метод молекулярной гибридизацииоснован на способности ДНК и РНК специфически соединяться (гибридизироваться) с комплементарными олигонуклеотидными фрагментами, искусственно синтезированными и меченными ферментом, флюорохромом или изотопом. Эти фрагменты называются зондами .
Для проведения молекулярной гибридизации молекулу исследуемой ДНК расплетают, одну нить закрепляют на специальном фильтре, который помещают в раствор, содержащий меченый зонд. Создаются условия, благоприятные образованию двойных спиралей. При наличии комплементарности между зондом и исследуемой ДНК они образуют между собой двойную спираль. После окончания гибридизации и отмывания несвязавшихся продуктов проводится детекция образовавшегося комплекса при помощи соответствующей метки.
Рис. Схема реакции молекулярной гибридизации для обнаружения в образцах ДНК или РНК возбудителя специфическим меченным зондом. (Иммунология инфекционного процесса. Под ред. В.И. Покровского, С.П. Гордиенко и В.И. Литвинова.-М., 1994.)
Полимеразная цепная реакция (ПЦР)основана на многократном увеличении числа копий (амплификации) определенного участка ДНК, катализируемое ферментом ДНК-полимеразой. ПЦР - это очень чувствительный метод, теоретически для получения результата достаточно наличие в материале одной молекулы ДНК.
ПЦР состоит из трех основных этапов: подготовки исследуемой пробы (изоляция ДНК или РНК), собственно ПЦР и детекции продукта ПЦР (амплифицированной ДНК). При использовании РНК в качестве матриц для ПЦР предварительно на этой РНК-матрице посредством фермента РНК-зависимой ДНК-полимеразы (обратной транскриптазы или ревертазы) синтезируют комплементарную ДНК, которая затем используется в качестве матрицы в ПЦР. После того, как из бактерий Thermous thermophilis удалось получить ДНК-полимеразу, которая наряду с полимеразной обладает еще и обратно-транскриптазной активностью, удалось совместить эти две реакции. Этот вариант ПЦР широко применяется для детекции РНК-содержащих вирусов, определения экспрессии вирусных, бактериальных и клеточных генов по их РНК.
Для проведения ПЦР необходимы пять основных компонентов:
- фермент ДНК-полимераза;
- пара олигонуклеотидных праймеров;
- набор нуклеотидов;
- копируемая ДНК;
- ионы Mg +2 , необходимые для функционирования ДНК-полимеразы.
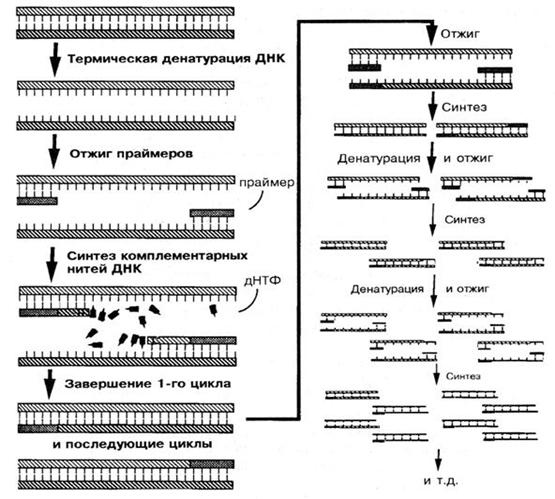
Рис. Схема полимеразной цепной реакции. дНТФ - дезоксинуклеотидтрифосфат (Из: Schaechter M ., Medoff G ., Eisenstein B . Mechanisms of microbial diseases , 2 nd ed ., Williams & Wilkins , 1993).
Для амплификации (т.е. синтеза ДНК-матрицы) отбирают наиболее консервативную часть, уникальный ген. Для запуска синтеза на ДНК-матрице используют 2 праймера (короткие, длиной 20-30 оснований одноцепочечные фрагменты ДНК), комплементарные 3 ¢ -концам ДНК искомого гена. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на две нити. Добавляют праймеры, затем смесь ДНК и праймеров охлаждают. При этом праймеры при наличии в смеси ДНК искомого гена связываются с его комплементарными участками ( отжиг ). Добавляют ДНК-полимеразу и нуклеотиды. При температуре, оптимальной для функционирования ДНК-полимеразы, нуклеотиды присоединяются к 3' -концам праймеров, формируется специфический фрагмент (ампликон). После этого цикл повторяют снова, при этом количество ДНК гена будет увеличиваться каждый раз в 2 раза. Рассчитано, что за 30-40 циклов из одной матрицы можно получить 10 8 ампликонов. Реакцию проводят в специальных приборах - амплификаторах. После 30-80 циклов накопления копий ДНК проводят их идентификацию методом гель-электрофореза и визуализацию в УФ свете после окрашивания этидием бромида. Для подтверждения принадлежности ДНК возбудителю можно провести ДНК-гибридизацию.
РАЗДЕЛ V . ИНФЕКЦИЯ

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.


Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
|