Методы индикации вирусов в культуре клеток
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Для заражения используются чувствительные к данному вирусу культуры с хорошо развитым монослоем клеток, находящиеся в пробирках (флаконах).
Перед заражением клеток питательную среду удаляют и в каждую пробирку (лунку планшета или флакон) вносят по 0,1-0,2мл взвеси испытуемого материала, предварительно обработанного антибиотиками. После 30 - 60 мин. контакта вируса с клетками удаляют избыток материала, вносят по 1,0 - 1,5мл на пробирку поддерживающей среды и оставляют в термостате до выявления признаков репродукции вирусов.
ФЕНОМЕНЫ, ПОЗВОЛЯЮЩИЕ ВЫЯВИТЬ ВИРУС В КУЛЬТУРЕ КЛЕТОК
1. Цитопатический эффект (действие) – (ЦПЭ или ЦПД), который является следствием поражения клеток под действием размножающегося в них вируса.
ЦПД может быть трех основных типов:
а) кругло- или мелкоклеточная дегенерация;
б) образование гигантских многоядерных клеток - симпластообразование;
в) образование внутриядерных или цитоплазматических включений вирусспецифических или неспецифических.
Феномен гемадсорбции (РГадс)
Образование бляшек - феномен Дюльбекко
Феномен интерференции
Принцип метода: феномен интерференции используется для обнаружения вирусов, не дающих отчетливого ЦПД в культуре клеток. Исследуемую культуру повторно заражают вирусом, регулярно вызывающим ЦПД. Индикаторным является ВВС - вирус везикулярного стоматита. При наличии в исследуемом материале нецитопатогенного вируса ЦПД у индикаторного ВВС также будет отсутствовать (клетка "занята" исследуемым вирусом).
3) ЛАБОРАТОРНЫЕ ЖИВОТНЫЕ
Используют преимущественно новорожденных белых мышей, хомяков, морских свинок, крысят. Заражение животных проводится по принципу цитотропизма вируса: пневмотропные вирусы вводятся интраназально, нейротропные - интрацеребрально, дерматотропные - на кожу. Индикация вируса основана на проявлении признаков заболевания у животных, их гибели, патоморфологических изменениях в тканях и органах, а также на положительной реакции гемагглютинации с экстрактами из органов.
СЕРОЛОГИЧЕСКИЙ МЕТОД.
а). Для ранней диагностики заболевания определяют наличие IgM в сыворотке с помощью ИФА или непрямой РИФ.
Диагностически значимым считают нарастание титра в 4 и более раз.
ОСНОВНЫЕ СЕМЕЙСТВА ВИРУСОВ (контрольная)
ДНК- содержащие
| Простые (без оболочек) ДНК- содержащие вирусы 1.Аденовирусы Adenoviridae 2-х нитчатая ДНК 2.Папилломавирусы Papillomaviridae 2-х нитчатая ДНК 3.Полиомавирусы Poliomaviridae 2-х нитчатая ДНК 4. Цирциновирусы Circinoviridae 1- нитчатая ДНК 5.Парвовирусы Parvoviridae 1- нитчатая ДНК | Сложные (с оболочками) ДНК- содерж. вирусы * Поксвирусы Poxviridae 2-х нитчатая ДНК * Герпесвирусы Herpesviridae 2-х нитчатая ДНК * Гепаднавирусы Hepadnaviridae 2-х нитчатая кольцевая ДНК с 1 нитчатым участком |
РНК- содержащие
| Простые (без оболочек) РНК- содержащие вирусы 1.Пикорнавирусы Picornaviridae 1-нитчатая РНК 2.Калицивирусы - Caliciviridae - 1-нитчатая РНК 3.Астровирусы - Astroviridae - 1-нитчатая РНК 4.Реовирусы - Reoviridae - 2-нитчатая РНК фрагментированная | Сложные (с оболочками) РНК- содержащие вирусы *Ортомиксовирусы Orthоmyxoviridae 1-нитч.РНК *Парамиксовирусы Paramyxoviridae 1-нитч. РНК *Тогавирусы Togaviridae 1-нитчатая РНК *Рабдовирусы Rhabdoviridae 1-нитчатая РНК *Филовирусы Filoviridae 1-нитчатая РНК *Флавивирусы Flaviviridae 1-нитчатая РНК *Ретровирусы Retroviridae 1-нитчатая РНК *Аренавирусы Arenaviridae 1-нитчатая РНК *Коронавирусы Coronaviridae 1-нитчатая РНК *Буньявирусы Bunyаviridae 1-нитчатая РНК |
ДЕМОНСТРАЦИИСреды для культивирования клеток: среда 199, раствор Хенкса, сыворотка, гидролизат лактальбумина, трипсин, раствор Версена, лейкоцитарный интерферон.
Читайте также:
|
| Ингредиенты опыта (в мл) | № пробирок | ||||||||
| Разведения вируссодержащего материала | Контроль клеток | ||||||||
| 10 -1 | 10 -2 | 10 -3 | 10 -4 | 10 -5 | 10 -6 | 1 доза | ½ доза | ¼ доза | |
| Вируссодержащий материал | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | - | - | - |
| Взвесь клеток (1 доза) | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 |
| Питательная среда | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,5 | 0,5 | 0,5 |
| Вазелиновое масло | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 |
| Возможные результаты | |||||||||
| Цвет среды в пробирках (красный или жёлтый) | К-4 | К-4 | К-3 Ж-1 | К-2 титр Ж-2 | К-1 Ж-3 | Ж-4 | Ж-4 | Ж-2 К-2 | К-4 |
| Обозначения: | К-4 – красного цвета 4 пробирки; Ж-3 – жёлтого цвета 3 пробирки |
Дата добавления: 2015-04-15 ; просмотров: 67 ; Нарушение авторских прав
Существуют следующие основные методы индикации вируса в культуре клеток: по цитопатическому эффекту или цитопатическому действию (ЦПЭ, ЦПД); по положительной реакции гемадсорбции (РГАд); по образованию бляшек; по обнаружению внутриклеточных включений; по выявлению вирусов в реакции иммунофлуоресценции (РИФ); по обнаружению интерференции вирусов; по подавлению метаболизма клеток (цветная проба); электронной микроскопией и др.
ЦПД Наиболее широко и часто о размножении вируса в культуре клеток судят по цитопатическому эффекту или цитопатическому действию. ЦПД называются любые изменения клеток в культуре клеток под влиянием размножающегося в них вируса. Физиологические изменения клеток установить довольно сложно, а морфологические изменения обнаруживаются довольно легко. Для этого достаточно положить на предметный столик микроскопа пробирку или матрас слоем клеток вверх и, используя малое увеличение (объектив х8-10, окуляр х7-10), осмотреть слой. Полезно сравнить клетки, зараженные вирусом, с такими же клетками в пробирке, не подвергавшимися заражению. В этом случае практически любые наблюдаемые в микроскоп отличия зараженной культуры клеток от контрольной можно считать проявлением ЦПД. Эти отличия могут захватывать весь монослой или отмечаться только в виде небольших очажков измененных клеток в слое нормальных клеток. Интенсивность ЦПД выражается тем, какая часть клеточного монослоя изменена вирусом. Хотя общепринятой системы оценки интенсивности ЦПД нет, ее часто оценивают в крестах или баллах. Так, если изменению (по сравнению с контролем) подвергся весь монослой в пробирке или матрасе, ЦПД оценивают на четыре креста, если 3 /4 - на три, если V2 - на два креста, V4 - на один крест. Но эти оценки весьма условны.
Наиболее существенно различаются между собой три формы ЦПД: фрагментация клеток, округление клеток, симпластообразование.
Фрагментация - разрушение клеток на отдельные фрагменты, которые отделяются от стекла и переходят в культуральную жидкость в виде клеточного детрита (вирус везикулярного стоматита).
Округление - потеря клетками способности прикрепляться к стеклу, вследствие чего клетки, обычно распластанные по стеклу, принимают шаровидную форму, отделяются от стекла и свободно плавают в культуральной жидкости, где и погибают (энтеровирусы, аденовирусы и др.).
Симпластообразоеание - растворение клеточных оболочек, вследствие чего цитоплазмы соседних клеток сливаются, образуя одно целое, в котором располагаются (главным образом по периферии) ядра клеток. Такие образования из цитоплазматической массы с многими клеточными ядрами называются симпластами (гигантские многоядерные клетки).
РГАд. Гемадсорбция - соединение эритроцитов с поверхностью пораженных вирусом клеток - впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатиче- ских изменений в инфицированных клетках.
Методика РГАд состоит в следующем. На 3-4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2-3 капли 0,5-процентной суспензии отмытых эритроцитов. Обе пробирки оставляют на 5-10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной.
В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким:
Каждый вирус способен адсорбировать эритроциты крови животных определенных видов.
Самостоятельная работа студентов
- 1) Студенты проводят микроскопию клеточных культур (живая культура клеток, фиксированная).
- 2) Изучают методы обнаружения вирусов в зараженных клеточных культурах (по ЦПД, по гемадсорбции эритроцитов на монослое, по обнаружению бляшек, по обнаружению телец-включений).
Культивирование вирусов - выращивание вирусов в искусственных условиях.
Гальтье впервые осуществил в 1879 г. культивирование вируса бешенства, заразив кролика мозгом больной собаки. Способность вируса вакцины (коровьей оспы) репродуцироваться в тканевой культуре была доказана Паркером и Наем в 1925 г. В 1931 г. Вудрафф и Э. Гудпасчер показали возможность культивирование вирусов на хорион-аллантоисной оболочке эмбрионов кур (вирус оспы птиц).
Методы культивирования:
• На лабораторных животных
• В куриных эмбрионах
• В тканевых культурах
Клеточная культура – система клеток, получаемая из ткани, находящаяся в виде слоя клеток, прикрепленных к стеклу, или в виде суспензии. Подразделяются на:
1) Первичные культуры – могут быть получены практически из любого органа (почки, легкие, кожа, тимус), однако даже при систематической смене питательной среды существуют лишь до первого пересева.
2) Стабильные (перевиваемые) линии – полностью адаптированные к существованию вне организма; их получают из нормальных и раковых тканей; размножаются неограниченно долгое время. Бывают 2 типов:
а) Нормальные клетки. В качестве стабильной культуры используют почки барана (ПКБ) и сердце обезьяны циномольгус (СОЦ);
б) Опухолевые клетки. В качестве опухолевых используют культуру клеток Hela - рак шейки матки, Hep-1 - эпидермоидный рак гортани, Дейтройт 6 - костный мозг больного раком легкого.
3) Диплоидные (эмбриональные) культуры – получаемые из эмбриональных тканей человека и животных, сохраняющие диплоидный набор хромосом до 50 пересевов.
Наиболее практическое применение получили однослойные культуры первично-трипсинизированных и перевиваемых линий клеток.
Приготовление первичных (трипсинизированные) культур клеток. Берется орган → разрушается межклеточная ткань и происходит разобщение клеток путём воздействия на ткань протеолитических ферментов (трипсина, панкреатина) для последующего получения монослоя клеток на стекле.
В питательной среде должен присутствовать необходимый набор из неорганических ионов, аминокислот и витаминов. Различают искусственные (полусинтетические и синтетические) и естественные питательные среды.
Естественные питательные среды - это биологические жидкости (сыворотка крови, эмбриональный экстракт, асцитическая жидкость, коровья амниотическая жидкость, тканевые экстракты и др.). Питательные среды из естественных компонентов применяют редко, только для выращивания вновь изолированных тканей в начале культивирования и для поддержания очень прихотливых тканей животных.
Полусинтетические питательные среды представляют собой естественные среды, подверженные первичной ферментативной обработке. К таким средам относят гемогидролизаты, гидролизат лактальбумина, аминопептид и др.
Лучшими средами для культивирования культуры клеток являются синтетические питательные среды: 199 (содержит 60 компонентов: 10 аминокислот, 17 витаминов, 8 минеральных солей, 10 компонентов, входящих в состав нуклеиновых кислот и др.), Игла, Хенкса, Эрла (эти среды имеют аминокислоты, витамины, глюкозу, минеральные соли). Смена питательной среды проводится через 2-3 дня.
В зависимости от назначения среды подразделяются на: ростовые и поддерживающие. Ростовые применяются в первой фазе культивирования клеток, когда необходимо стимулировать клетки на максимально ускоренный рост и размножение. Они богаты питательными веществами, что способствует активному размножению клеток. Поддерживающие применяют во второй фазе культивирования клеток после заражения культуры клеток вирусами. Они поддерживают жизнеспособность клеток.
О наличии вируса в зараженной культуре клеток можно судить по цитопатическому действию (ЦПД) – это патологические изменения морфологии клеток, вплоть до их гибели, возникающие в результате репродукции вирусов, и наблюдаемые под микроскопом. Проявления ЦПД:
1. Дегенерация клеток (наблюдаются округления, изменения формы, разрушения).
2. Появление включений (Липшются – вирус герпеса; Гварниери – вирус натуральной оспы) и телец Бабеша-Негри – вирус бешенства).
3. Разрушение пласта клеток (парамиксовирусы).
4. Образование гигантских многоядерных клеток - симпластов (вирус кори).
Основные методы индикации вирусов в культуре тканей:
а. “+” гемагглютинация. Реакция гемагглютинации – склеивание эритроцитов при добавлении вирусосодержащего материала (есть вирус – эритроциты оседают в виде “зонтика”; нет вируса – в виде “диска”).
б. “+” гемадсорбция. Реакция гемадсорбции – адсорбция эритроцитов на поверхности пораженных вирусом клеток и образуют характерные скопления (вирус гриппа вызывает агглютинацию эритроцитов островкового типа).
в. Реакция нейтрализации вирусов в культуре тканей.
г. Цветная реакция Солка - основана на изменении цвета питательной среды. В результате жизнедеятельности клетки в питательную среду выделяются продукты клеточного метаболизма и происходит сдвиг рН в кислую сторону, о чем свидетельствует изменение цвета среды из красного в желтый. Если вирус присутствует и реплицируется в культуре, то вследствие разрушающего действия вируса клетки дегенерируются (разрушаются, т.е. их нет), и подавляется их метаболизм, т.е. цвет среды неизменяется.
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
- гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
- очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
- симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому - Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
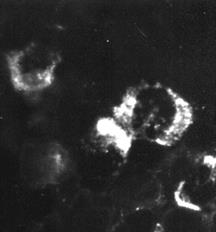
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
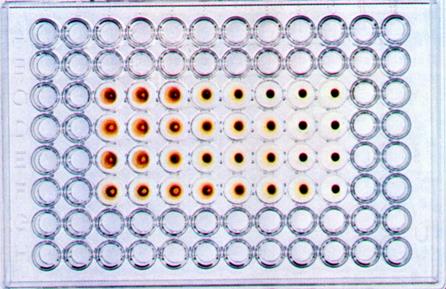
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов .
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (4 0 , 20 0 , 37 0 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
- выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
- электронно-микроскопическое изучение вирусов (см. выше).
Читайте также:
- Вирус из рода папилломавирусов семейства паповавирусов
- Могли ли вирусы появиться раньше всего
- Бешенство матки у детей
- Кровный вирус в китае
- Malicious moderate confidence что за вирус