Методы исследования генома вирусов
L К нам относятся туберкулоцины, пестицины, вибриоцины.
L Плазмиды, не имеющие такой частицы и неспособные к самопередаче незываются неконъюгативными.
L У конъюгативных плазмид в структуре есть генетический элемент трансмиссивности, обеспечивающий передачу генетической информации.
Фактор передачи
L Плазмиды несут факторы фертильности, резистентности, токсигенности, гемолизиса.
L Плазмиды несут необязательные для клетки-хозяина гены и придают бактериям дополнительные свойства, которые могут им обеспечить преимущества по сравнению с бактериями, не имеющими плазмид.
ПЛАЗМИДЫ
L Это внехромосомная генетическая структура бактерий, представляющая замкнутое кольцо двунитевой ДНК, находящейся в цитоплазме в автономном состоянии и ориентирующаяся на передачу хромосомы, будучи с нею в интегрированном состоянии.
Конъюгативная плазмида
l Плазмиды – это очень удобная модель для генной инженерии.
За последние несколько лет наблюдался взрывообразный рост числа опубликованных сообщений по различным аспектам генетики эукариотических систем вообще, и системы клетка — вирус животных в частности.
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 106 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у sv40, настолько сходна с таковой генов эукариотической клетки, что пблучила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА КЛЕТКИ
В составе генома имеются структурные гены, кодирующие определенные* биополимеры (белки или РНК), и регуляторные гены, которые контролируют функцию структурных генов. Регуляция происходит с помощью белковых продуктов регуляторных генов — репрессоров, подавляющих активность структурных генов. Регуляторными участками генов, контролирующих транскрипцию, являются усилитель транскрипции (enhancer) и промотор — область, предшествующая структурным генам и определяющая место специфического связывания РНК-полимеразы.
Характерной особенностью генов эукариотической клетки является их мозаичная структура, т. е. прерывистость гена. В составе гена, кодирующего один белок, кодирующие участки прерываются вставочными последовательностями, которые не несут никакой кодирующей информации и не транслируются. Кодирующие участки гена называются экзонами, а вставки — нитронами (рис. 25).
Строение эукариотического гена и его транскрипция.
а_ строение эукариотического гена 8У40: 1—усилитель транскрипции; 2—
промотор; 3— инициация репликации ДНК вируса (origin); 4— интроны; 5— экзоны (кодирующие области гена); 6— терминирующая последовательность ААТААА; стрелка обозначает участок начала транскрипции, б — схема сплайсинга при созревании иРНК: 1—экзоны, 2—интроны, 3—зрелая иРНК.
Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus , Orthomyxovirus , Arenavirus и Reovirus ) или несегментированным.
Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом.
У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. Такой тип РНК определяют как минус-нить и обозначают -РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а -РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК.
Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующийся в клеточный геном.
ИНФОРМАЦИОННОЙ ЕМКОСТИ ВИРУСНОГО ГЕНОМА
У многих вирусов молекулярная масса синтезирующихся белков превышает теоретически рассчитанную. Этот феномен объясняется наличием у вирусов механизмов, позволяющих получить развернутую генетическую информацию при максимальной экономии генетического материала; подобные механизмы выработаны в процессе эволюции вирусов как генетических паразитов.
Способами увеличения генетической информации являются: 1) двукратное считывание одной и той же иРНК, но с другого инициирующего кодона; 2) сдвиг рамки трансляции; 3) сплайсинг; 4) транскрипция с перекрывающихся областей ДНК и др.
2) Трансляция может происходить без сдвига рамки и со сдвигом рамки. Генетический код является триплетным, это означает, что три нуклеотида, составляющих триплет, или кодон, кодируют одну аминокислоту. В том-случае, если триплеты сохранены и генетический код не изменился, то при трансляции с двух разных инициирующих кодонов будут синтезироваться полипептиды, представляющие собой укороченную копию первого полипептида (трансляция без сдвига рамки).
В том случае, если произошел сдвиг на один или два нуклеотида, образуются новые триплеты (кодоны) и появляется новый генетический код. В этом случае одна молекула иРНК может транслироваться с образованием двух уникальных белков, т. е. таких белков, у которых нет идентичных аминокислотных последовательностей.
3) Сплайсинг со сдвигом рамки широко используется у ряда вирусов (вирусы гриппа, парамиксовирусы, буньяви-русы, аденовирусы, паповавирусы, парвовирусы и др.). Один и тот же ген парамиксовирусов (вирус Сендай) кодирует два уникальных белка: структурный белок Р и неструктурный белок С.
Одним из способов экономии генетического материала является нарезание полипептида-предшественника на участки разной длины, в результате чего образуются разные полипептиды с перекрывающимися аминокислотными последовательностями. Таким образом, число реальных генов превосходит молекулярную массу генома. Основанный на длине генома расчет числа генов неизменно приведет к ошибочным результатам. Более точные представления о числе генов можно получить путем биохимического и генетического анализов.
Конечная цель генетического изучения вирусов животных — понимание деталей структуры и функции вирусного генома и каждого из генных продуктов вируса.
Методы исследования генетики вирусов.
На раннем этапе генетические исследования вирусов животных сдерживались из-за отсутствия подходящих методов исследования индивидуального потомства при смешанном заражении. Решение этой проблемы было найдено Дульбекко [32, 33], который разработал метод бляшек для цитоцидных вирусов. Использование метода бляшек позволило точно определять количество потомства, получать чистые клональные штаммы вируса и очищать вирусы от других примесных вирусов и дефектных интерферирующих частиц того же типа вируса. С помощью этого метода была получена система, пригодная для анализа условно-летальных мутаций. Таким образом, в значительной степени генетика вирусов животных началась с введения в практику метода бляшек. В настоящее время применимость метода бляшек рассматривают как необходимое условие для начала исследований генетики новой группы вирусов подобно тому, как разработка метода фокусов трансформации для нецитолитических, трансформирующих вирусов [151] послужила ключом к развитию генетических исследований этих вирусов.
При изучении регуляции синтеза вирусных нуклеиновых кислот и белков во многих системах, например у герпесвирусов, с успехом использовали ингибиторы белкового синтеза, такие как пуромицин или циклогексимид, а также ингибиторы синтеза РНК, например актиномицин Е) Разработка электрофоретических систем с высоким разрешением для анализа белков и нуклеиновых кислот позволила провести генетические исследования вирусов с сегментированным РНК-геномом, используя в качестве маркеров полиморфизм электрофоретической подвижности РНК-сегментов и белков Применение рестрикционных эндонуклеаз сыграло аналогичную роль для ДНК-содержащих вирусов с использованием в качестве генетических маркеров полиморфизма подвижности фрагментов ДНК и белков.
Методы исследования транскрипции и трансляции in vitro вирусов доказали свою эффективность при построении физических карт, особенно в системах, где отсутствует генетическая рекомбинация. В последнее время генетические приемы используют для изучения вирусного патогенеза и иммунного ответа хозяина на вирусную инфекцию, если хотят сопоставить специфические свойства вируса с индивидуальными вирусными генами и генными продуктами. Иными словами, современный генетик, изучающий вирусы животных, охотно заимствует методы у биохимика и применяет их в генетическом анализе. Наряду с этим генетики и другие специалисты используют генетический анализ для ответа на вопросы, которым традиционно не уделялось должного внимания. Такое слияние дисциплин очень помогло генетикам и в значительной мере определило быстрый прогресс этой науки в последние несколько лет.
Что такое молекулярно-генетическая диагностика
Итак, молекулярно-генетическая диагностика — сравнительно новый метод обследования организма, позволяющий точно и быстро выявить вирусы и инфекции, мутации генов, вызывающих патологию, оценить риски наследственных и иных заболеваний. И это далеко не полный спектр возможностей исследования ДНК.
Важнейшим достоинством молекулярно-генетической диагностики является минимальная степень медицинского вмешательства, поскольку исследование проводят in vitro. Метод успешно применяют даже для диагностики заболеваний у эмбрионов, а также у ослабленных и тяжелобольных пациентов. Самый распространенный материал для исследования — кровь из вены, однако возможно выделение ДНК/РНК из других жидкостей и тканей: слюны, соскоба слизистой рта, выделений из половых органов, околоплодной жидкости, волос, ногтей и т.д.
Молекулярная диагностика — значительный шаг к персонализированной медицине, она позволяет учитывать все особенности конкретного пациента при обследовании и терапии.
Итак, исследование ДНК/РНК используется во многих разделах медицины. Давайте рассмотрим задачи и области, в которых активно применяют молекулярную диагностику:
- Выявление существующих патологий. Например, к молекулярной диагностике прибегают в тех случаях, когда инфекционное или вирусное заболевание не может быть определено обычными методами. Она позволяет обнаружить болезнь даже на ранней стадии, когда внешних проявлений нет.
- Исследование аллергических реакций. Молекулярная диагностика успешно применяется для определения аллергии: в отличие от традиционных методов, она более точна и при этом безопасна для пациента, так как отсутствует непосредственный контакт с аллергеном.
- Индивидуальная оценка рисков развития наследственных заболеваний. Молекулярная диагностика помогает выявить у взрослых и детей опасность в будущем подвергнуться различным патологиям. Нужно отметить, что есть болезни, которые вызваны исключительно мутацией гена (моногенные) и те, которые обусловлены в том числе генетическими особенностями (мультифакторные). Информация о первых позволяет, к примеру, оценить риски передачи наследственных заболеваний от родителей к ребенку. Знание о предрасположенности к мультифакторной патологии необходимо еще и для профилактики болезней с помощью изменения образа жизни.
- Перинатальная медицина. Как уже было сказано, молекулярная диагностика способна дать информацию о состоянии здоровья и генетических предрасположенностях человека. Это относится и к эмбрионам: анализ ДНК еще не родившегося ребенка позволяет распознать синдромы Дауна, Эдвардса, Патау, Тернера, Клайнфельтера. Также молекулярная диагностика применяется в области вспомогательных репродуктивных технологий: она позволяет установить генетические причины бесплодия и невынашивания беременности.
- Фармакогенетика. Молекулярная диагностика объясняет, почему на некоторых действуют одни препараты, а на других — иные: все дело в генетических особенностях пациентов. Возможность определения эффективности веществ имеет особое значение при лечении тяжелых заболеваний, например, онкологических.
- Спортивная медицина. Настоящие чудеса исследования ДНК и РНК творят и в области оценки спортивных перспектив. Например, родители малышей могут узнать о том, какой вид занятий принесет ребенку наибольшую пользу для здоровья или позволит достичь спортивных результатов.
Итак, обращение к генетическим исследованиям актуально в тех случаях, когда пациент стремится получить сведения о состоянии своего организма. Обычно это необходимо в следующих ситуациях:
Отдельной группой стоит выделить исследования ДНК, которые проводят в связи с планированием или рождением ребенка. Чаще всего родители обращаются в лабораторию, чтобы:
- изучить свою генетическую совместимость, оценить риски наследственных заболеваний потомства;
- исследовать состояние плода, выявить синдромы и опасные патологии;
- диагностировать заболевания (и оценить риски) и аллергические реакции у малыша;
- определить, какие спортивные занятия, какое питание и образ жизни будут наиболее полезны для ребенка, а чего стоит избегать;
- установить отцовство или материнство.
Независимо от выбранного метода молекулярно-генетического исследования, оно будет включать в себя следующие этапы:
- взятие биоматериала. Как уже было сказано, чаще для исследования используют кровь пациента. Полученный материал маркируют и транспортируют в лабораторию;
- выделение ДНК/РНК;
- проведение исследований в соответствии с выбранным методом;
- изучение и интерпретацию результатов;
- выдачу заключения.
Цитогенетический анализ позволяет выявить наследственные заболевания, психические отклонения, врожденные пороки развития. Суть метода — в изучении хромосом с помощью специальных микроматриц, нанесенных на ДНК-чипы. Для этого из образца крови выделяют лимфоциты, которые затем помещают на 48–72 часа в питательную среду и по истечении этого времени исследуют. Назначают такой анализ нечасто, в основном для изучения причин бесплодия и невынашивания беременности, для уточнения диагноза у детей при подозрении на врожденные заболевания. Анализ очень точен, но достаточно трудоемок и длителен (результат можно получить лишь через 20–30 дней после сдачи).
Достоинство и в то же время недостаток метода — в его специфичности: цитогенетика может выявить лишь небольшое количество патологий (например, аутизм), однако делает это практически без погрешностей.
Полимеразная цепная реакция — метод, изобретенный в 1983 году, по сей день самый популярный и фундаментальный в молекулярной диагностике. Характеризуется высочайшей точностью и чувствительностью, а также скоростью проведения исследования. Молекулярная диагностика ДНК/РНК методом ПЦР позволяет выявить такие патологии, как ВИЧ, вирусные гепатиты, инфекции, передающиеся половым путем, туберкулез, боррелиоз, энцефалит и многие другие.
Для анализа выбирают участок ДНК и многократно дублируют его в лаборатории с помощью специальных веществ. Для диагностики подходит большой перечень биоматериалов: кровь, слюна, моча, выделения из половых органов, плевральная и спинномозговая жидкость, ткани плаценты и т.д.
В данном молекулярном методе объектом исследования становятся уникальные нуклеотидные соединения отдельно взятой хромосомы или ее участок. Для этого используются меченые флуоресцентными маркерами короткие ДНК-последовательности (зонды), которые позволяют выявить фрагменты с атипичными генами. Биоматериал для анализа может быть любой: кровь, костный мозг, плацента, ткани эмбриона, биопсия и т.д. Важно, чтобы образец был доставлен в лабораторию сразу после его изъятия.
Метод особенно активно используют в онкологии (например, для наблюдения за остаточными злокачественными клетками после химиотерапии), а также в пренатальной диагностике (для определения риска развития у плода врожденных пороков), гематологии. FISH-метод очень чувствителен и точен для выявления поврежденных фрагментов ДНК (погрешность около 0,5%), при этом достаточно быстр: результат придется ждать не более 72-х часов. Однако у него есть и недостатки: FISH еще более специфичен, чем микроматричный цитогенетический анализ, и может служить лишь для подтверждения или опровержения предполагаемого диагноза.
Этот метод похож на предыдущий — здесь так же используются меченные флуоресцентом последовательности ДНК. Однако эти зонды сначала выделяют из проб, полученных от пациента, и затем сравнивают с образцами, нанесенными на микрочипы. ДНК-микрочип представляет собой основание (стеклянное, пластиковое, гелевое), на которое может быть нанесено до нескольких тысяч микротестов длиной от 25 до 1000 нуклеотидов. Полученные после очистки биоматериала пробы (зонды) совмещают с микротестами на чипе и наблюдают за реакцией маркёров. Результаты исследования готовы через 4–6 дней после забора материала.
Для анализа используется любой биоматериал, из которого можно получить образец ДНК/РНК. Используют такой метод в онкологии и кардиологии (в том числе для изучения генетической предрасположенности), он точен и чувствителен, однако в России его применяют редко — в этом его главный минус.
Итак, молекулярная диагностика — неинвазивный и точный метод обследования организма с широким спектром применения в разных областях медицины. Если на Западе исследования ДНК/РНК уже распространены повсеместно, то в России подобную услугу предлагают далеко не все клиники.
Сегодня медицина позволяет уже во время планирования беременности узнать о возможных рисках для будущего малыша, поэтому не пожалейте времени и средств — пройдите генетическое исследование еще до зачатия ребенка или, если беременность стала для вас сюрпризом, во время вынашивания. Так вы сможете избежать множества проблем для себя и для малыша в будущем.
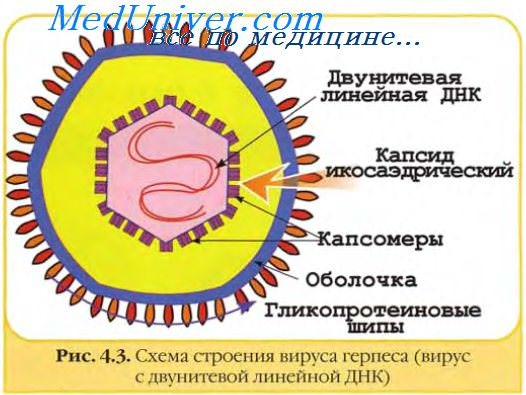
Образование зрелых вирионов стало рассматриваться как завершающий этап цикла репродукции вируса, определяемый вирусным геномом. Некоторые гены вирусов кодируют синтез вирусспецифических белков, из которых формируется капсид, заключающий внутри себя вирусный геном. У некоторых вирусов капсид покрывается оболочкой, по составу и строению сходной с клеточными мембранами, но содержащей также и некоторые вирусспецифические белки.
Несмотря на простоту организации, вирусы отличаются от животных и растений большим разнообразием генома. Животные и растения содержат одновременно две формы нуклеиновой кислоты: двухцепочную ДНК и одноцепочную РНК. Вирусы содержат только одну форму нуклеиновой кислоты — ДНК или РНК, которые могут быть представлены одно- или двухцепочными молекулами. В случае с РНК-содержащими вирусами вся генетическая информация содержится в РНК, что является уникальным явлением в биологии. Все вирусы животных, за исключением ретровирусов, гаплоидны, т.е. содержат наследственную информацию в одном экземпляре.
Вирусные ДНК или РНК могут иметь линейную или кольцевую форму. Геном РНК-содержащих вирусов может быть представлен одной единой молекулой или молекулой, разделенной на 2—12 фрагментов (фрагментированный геном), а также двумя идентичными молекулами нуклеиновой кислоты (диплоидный геном). Вирусы также значительно различаются между собой по стратегии реализации генетической информации и репродукции вирусных частиц.
Вирусные нуклеиновые кислоты реплицируются с помощью полимераз, которые синтезируются в инфицированной клетке и кодируются вирусным геномом или привносятся в клетку в виде вирионных компонентов. В некоторых случаях в процессе репликации вирусного генома принимают участие предсуществующие клеточные полимеразы.
Репродукция вирусов состоит из репликации вирусного генома с образованием многочисленных копий родительской ДНК или РНК и индуцированного ими синтеза вирусных белков. Из вновь синтезированных вирусных компонентов путем самосборки формируются вирусные частицы (вирионы). В основе самосборки вирусных частиц лежит процесс, связанный с уменьшением свободной энергии системы, ибо упорядоченный капсид обладает меньшей свободной энергией, чем вирионные пептиды.
Самосборка вирусных частиц, как и всякий процесс, ведущий к уменьшению свободной энергии системы, протекает самопроизвольно. Строгая упорядоченность в формировании капсида является следствием взаимодействия вирусной нуклеиновой кислоты и вирионных полипептидов с образованием максимального количества стабильных нековалентных связей между субъединицами. Нуклеиновая кислота (вирусный геном) выполняет роль морфопоэтического фактора, направляющего процесс самосборки в сторону образования капсида и формирования вирусных частиц.
Если попытаться расположить вирусы по степени их сложности в гомологичный ряд, то они, по существу, могут легко заполнить пропасть между неживой органической материей и клеточными формами жизни. В самом начале этого ряда будут стоять простые минимальные вирусы, состоящие только из белка и нуклеиновой кислоты одного типа (ДНК или РНК). Далее следуют сложные вирусы, содержащие кроме этого углеводы и липиды. За ними следуют одноклеточные микроорганизмы - хламидий, в составе которых, как и у клеточных форм жизни, присутствуют одновременно оба типа нуклеиновой кислоты и имеется рибосомальный аппарат.
Наконец, группа хламидий плавно смыкается с другими одноклеточными микроорганизмами из царства бактерий — микоплазмами и риккетсиями. Последних роднит с вирусами отсутствие собственного синтетического аппарата и облигатный внутриклеточный паразитизм. Риккетсии всего лишь вдвое больше самых крупных вирусов. Подобно вирусам, они способны размножаться только в живых клетках. Они отличаются от вирусов более сложным химическим строением и способностью синтезировать некоторые простые питательные вещества. Отличительные свойства мельчайших одноклеточных микроорганизмов и вирусов приведены в статьях.
- 6599
- 5,5
- 0
- 5

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов [1]:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA). Рисунок из Википедии.
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).

Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте. Рисунок из [12].
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами*.
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции. Фото с сайта vkjournal.ru.
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24]. Фото с сайта flickr.com.
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева. Рисунок из [26].
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Статья написана в соавторстве с Евгенией Щепенок.
Читайте также:


