Онколитические вирусы в терапии злокачественных глиом

Цена:
Авторы работы:
Научный журнал:
Год выхода:
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, 2012, том 46, № 6, с. 874-886
УДК 577.2:616-006; 61:578.7
ОНКОЛИТИЧЕСКИЕ ВИРУСЫ В ТЕРАПИИ ГЛИОМ
Новосибирский национальный исследовательский государственный университет, Новосибирск, 630090 Россия 2Государственный научный центр вирусологии и биотехнологии "Вектор", Кольцово, Новосибирская обл., 630559 Россия 3Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук, Москва, 119991 Россия
4Cleveland Clinic Foundation, Cleveland, ОН 41195 USA 5Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, 630090 Россия 6Научно-исследовательский институт патологии кровообращения им. академика Е.Н. Мешалкина Министерства здравоохранения РФ, Новосибирск 630055 Россия
Поступила в редакцию 28.05.2012 г.
Принята к печати 14.06.2012 г.
Несмотря на достижения современной медицины, излечение больных с опухолями глиального происхождения остается трудно достижимой задачей. Инвазивный характер и расположение в жизненно важных областях головного мозга делают этот тип новообразований сложным для хирургического вмешательства, а адъ-ювантная терапия не приносит ожидаемых результатов. Частые рецидивы и злокачественность глиом обусловлены наличием стволовых клеток, обладающих повышенной инвазивностью и устойчивостью к радио-и химиотерапии. Совершенствование технологий конструирования рекомбинантных вирусов позволило создать штаммы, проявляющие онколитическую активность в отношении глиальных опухолей. Большинство этих штаммов прошли первую стадию клинических испытаний и показали безопасность их использования. Несмотря на очевидную перспективность данного подхода, существующие штаммы недостаточно эффективны, что указывает на необходимость их совершенствования. В представленном обзоре рассмотрены наиболее успешные варианты онколитических вирусов, дошедших до клинических испытаний, а также обсуждаются перспективы новых подходов в виротерапии глиом.
Ключевые слова: глиомы, онколитические вирусы, противоопухолевая терапия, молекулярная онкология.
ONCOLYTIC VIRUSES IN THE THERAPY OF GLIOMAS, by N. V. Gubanova15*, A. S. Gaytan6, I. A. Razumov1,2,5, V. A. Mordvinov5, A. L. Krivoshapkin5,6, S. V. Netesov1,2, P. M. Chumakov1,3,4 ^Novosibirsk State University, Novosibirsk, 630090 Russia; *e-mail: nat@bionet.nsc.ru; 2Vctor State Research Center of Virology and Biotechnology, Koltsovo, Novosibirsk Region, 630559 Russia; 3Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, Moscow, 119991 Russia; 4Lerner Research Institute, Cleveland Clinic Foundation, Cleveland, OH 44195, USA; 5Institute of Cytology and Genetics, Siberian Division, Russian Academy of Sciences, Novosibirsk, 630090 Russia; 6Meshalkin Institute of Circulation Pathology, Novosibirsk, 630055 Russia). Despite the advances of modern medicine, malignant glioblastoma cure remains an elusive goal. Both the invasive nature and location in vital areas of the brain make this type of tumors difficult for surgical treatment, while the current adjuvant therapy is not as successful as expected. Frequent recurrence and invasiveness of malignant gliomas is due to resistance of glioma stem cells to conventional radiation and chemotherapy. Technological advances in constructing recombinant viruses have allowed creating strains with high oncolytic activity toward glial tumors. Many of these strains have passed Phase I of clinical trials and demonstrated high safety. Despite the obvious potential of the approach, efficiency of the existing strains is still far from being sufficient for effectively curing the disease and require further improvement. The review summarizes results obtained with the most successful variants of oncolytic viruses that come down to the clinical trials and discusses the prospects for new approaches in virotherapy of malignant gliomas.
Keywords: gliomas, oncolytic viruses, cancer therapy, molecular oncology.
Принятые сокращения: МРТ — магнитно-резонансная томография; EGFR — рецептор фактора роста эпидермиса; СКГ — стволовые клетки глиобластомы; ВБН — вирус болезни Ньюкасла; БОЕ — бляшкообразующая единица; Ad — аденовирус (при названии серотипа); PKR — РНК-зависимая протеинкиназа R; ТЦП — титр цитопатичности; eIF2a — фактор инициации трансляции 2a; RR — рибонуклеотид-редуктаза; ВКМ — внеклеточный матрикс.
* Эл. почта: nat@bionet.nsc.ru
Злокачественные опухоли головного мозга составляют сравнительно небольшую часть всех онкологических заболеваний (1—1.5%), причем происходят они преимущественно из клеток глии (более 60%) [1]. Среди злокачественных глиом в 70% случаев диагностируются мультиформные глиобластомы, реже (15%) — анапластические астроцитомы; остальные 15% приходятся на менее агрессивные глиомы [2]. Злокачественные глиомы имеют исключительно неблагоприятный прогноз, а их лечение представляет особую сложность. Средний безрецидивный период у больных глиобластомой составляет 6 мес., а средняя продолжительность жизни не превышает 9—12 мес. Несмотря на очевидный прогресс в понимании механизмов возникновения и прогрессии злокачественных глиом, а также внедрение множества новых методов лечения, за последние 30 лет средняя продолжительность жизни больных увеличилась всего лишь на 2—3 мес. [3, 4]. В подавляющем большинстве случаев терапевтические воздействия по-прежнему остаются паллиативными. Инфильтративный характер роста и расположение в функционально значимых областях головного мозга делают эти опухоли крайне сложными для радикального хирургического удаления. Про-грессирование заболевания и неизбежный рецидив после проведенного лечения обусловлены, по-видимому, уцелевшими стволовыми клетками глиомы (СКГ), обладающими повышенной инва-зивностью и устойчивостью к радио- и химиоте-рапическим воздействиям [5, 6].
В современной нейроонкологической практике принят комплексный мультидисциплинарный подход, включающий хирургическое удаление опухоли с последующим применением адъювант-ных методов лучевого и химиотерапевтического воздействия. Принцип хирургического метода состоит в максимальном удалении опухолевой ткани без создания нового неврологического дефицита. Для решения данной задачи применяются высокотехнологические нейронавигационные станции [7], все шире внедряются интраопераци-онные высокопольные МРТ-установки. Получил также мировое признание метод микрохирургического удаления злокачественных глиом с применением интраоперационной флуоресценции метаболитов 5-аминолевулиновой кислоты (5-А^), избирательно накапливающихся в клетках злокачественных глиом [8]. Этот метод позволяет с большей точностью вычленять границы распространения глиомы и способствует ее оптимальному удалению [9].
Наряду с продолжающимися исследованиями, направленными на улучшение эффективности хирургического и химиолучевого лечения, продолжаются поиски новых методов. Большие надежды возлагают на такие подходы, как таргетная терапия [10] — генная терапия, иммунотерапия,
избирательное радиологическое воздействие на злокачественные клетки, применение онколити-ческих вирусов.
Значительный интерес вызывают подходы к терапии злокачественных глиом, в которых используются онколитические вирусы. Углубленное понимание механизмов репликации вирусов, их взаимодействия с клеточными системами, достижения в технологии конструирования реком-бинантных вирусов позволили сконструировать вирусные штаммы, обладающие терапевтическими свойствами. Большое число таких штаммов прошло первую стадию клинических испытаний и показало безопасность их использования в предлагаемых концентрациях, но, к сожалению, пока еще низкую эффективность при терапии злокачественных глиом. В представленном обзоре проанализированы свойства наиболее перспективных штаммов онколитических вирусов, дошедших до стадии клинических испытаний и рассмотрены возможности новых подходов в ви-ротерапии злокачественных глиом головного мозга.
ПАТОМОРФОЛОГИЧЕСКАЯ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА
Среди первичных опухолей центральной нервной системы у взрослых большинство составляют глиальные опухоли, которые различаются по уровню клеточной дифференцировки и злокачественности. Анапластическая астроцитома (III степень по классификации ВОЗ) и глиобла-стома (IV степень по классификации ВОЗ) образуют основную группу злокачественных глиом. Анапластическая астроцитома представляет собой инфильтрирующее новообразование, для которого характерны фокальные или дисперсные анаплазии и более высокий индекс пролиферации по сравнению с астроцитомами более низкой градации (пилоцитарная и фибриллярная астроцитомы — степень злокачественности I и II по классификации ВОЗ соответственно). Гистологический диагноз этого заболевания основан на атипичности ядер и повышенной митотической активности клеток опухоли.
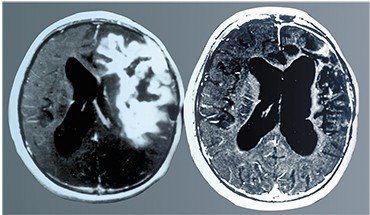
На гистологическом уровне глиобластомы представляют собой ткань с пролиферирующими кровеносными сосудами, содержащую области некроза [11]. Как правило, глиобластома возникает de novo, хотя примерно в 10% случаев ее появление обусловлено прогрессией глиальных опухолей головного мозга с более низкой градацией — фибриллярных астроцитом (II степень злокачественности) или анапластических астро-цитом (III степень), в таких случаях глиобластомы считают вторичными. При МРТ-исследова-
нии глиобластома характеризуется высококонтрастной периферической зоной с нерегулярным контуром, которая окружает гетерогенную область с признаками некротических изменений. Перифо-кальный отек, как правило, значительно выражен.
Развитие опухоли обусловлено наследственными или соматическими мутациями в ряде генов, которые контролируют важные биологические процессы. Мутации или хромосомные аберрации могут приводить к активации онкогенов и/или инактивации генов опухолевых супрессо-ров. Некоторые генетические нарушения сопровождаются потерей гетерозиготности, при которой один аллель может содержать мутации, а другой утрачивается в ре
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
БАБКИН И.В., БАЙКОВ И.К., МОРОЗОВА В.В., НЕТЕСОВ С.В., ТИКУНОВА Н.В., ЧУМАКОВ П.М. — 2012 г.
Сдвиг виден и в активности крупных фармацевтических корпораций. В феврале компания Merck выделила 394 миллиона долларов на покупку австралийской компании, работающей с вирусами, которые убивают опухолевые клетки. Тогда это казалось огромной суммой. Но уже 2 мая рекорд был перекрыт другим фармацевтическим гигантом. Компания Johnson & Johnson объявила, что потратит на приобретение фирмы, разрабатывающей онколитические вирусы, до одного миллиарда долларов.
Одним из немногочисленных методов виротерапии опухолей, получившим одобрение для клинического применения, стал препарат RIGVIR (ECHO-7), созданный под руководством Айны Муциниеце в Латвии. В своих исследованиях 1960-х – 1970-х годов в Институте микробиологии имени А. Кирхинштейна Латвийской академии наук Айна Муциниеце выделила разновидность эховирусов, которые не вызывали опасной инфекции, но оказывали онколитическое действие. В 2004 году Государственное агентство лекарственных средств Латвии официально зарегистрировало препарат RIGVIR для лечения меланомы. Но многие онкологи указывают, что до сих пор в ходе клинических испытаний не было получено достаточно убедительных подтверждений его эффективности. Более того, производителей препарата обвиняют в неэтичной рекламе, а американский онколог Дэвид Горски прямо называет производство RIGVIR шарлатанством. В начале 2017 года Ассоциация онкологов, Ассоциация химиотерапевтов и Ассоциация редких болезней Латвии, а также фармацевтический факультет Рижского университета имени Страдыня обратились в министерство здравоохранения Латвии и агентство лекарственных средств с просьбой исключить препарат RIGVIR из списка лекарств, компенсируемых государством, так как его эффективность не доказана. Но министерство здравоохранения ответило, что RIGVIR останется в списке лекарственных средств и что соотношение риска и пользы при его применении оно оценивает как приемлемое.
В наши дни возможность модифицировать вирусный геном дала специалистам по виротерапии опухолей принципиально новые возможности. Хотя по-прежнему использовать химиотерапию намного дешевле, уже сейчас есть области онкологии, где виротерапия потенциально имеет преимущества. В первую очередь это лечение опухолей головного мозга. Как известно, в организме имеется гемато-энцефалический барьер – систему, которая препятствует проникновению из крови в мозг различных патогенов. Но этот барьер не пускает к клеткам мозга и препараты, направленные на лечение опухолей, а среди вирусов есть такие, кому гемато-энцефалический барьер не страшен. Поэтому именно лечение опухолей мозга сейчас самое перспективное направление в разработке онколитических вирусов.
Правда, в самом большом клиническом испытании Imlygic не показал статистически значимого увеличения выживаемости пациентов по сравнению с другими средствами, но показанных им результатов хватило для положительного решения FDA. К тому же испытания доказало, что Imlygic борется не только с той опухолью, куда была сделана инъекция препарата, но и с опухолями в других частях организма.
На подходе еще несколько методов вирусной терапии. В Университете Дьюка уже прошли первые испытания на пациентах модифицированного вируса полиомиелита в качестве средства борьбы с опухолью мозга – глиобластомой (подробнее об этом также рассказано в отдельном очерке). Вирус бешенства, который распространяется по нервной системе, также пытаются приспособить для прохождения гемато-энцефалического барьера и лечение опухолей мозга. Но тут пока опыты проводятся на лабораторных мышах.
Важным достижением стали свидетельства, полученные преимущественно в исследованиях на животных, что онколитические вирусы особенно эффективны в сочетании с другим методом терапии – применением ингибиторов контрольных точек, которые стимулируют иммунный ответ протии опухоли. Контрольными точками иммунного ответа (immune checkpoint inhibitors) называют особые молекулы, выделяемые опухолями, чтобы защититься от иммунной системы. Ингибируя их, то есть останавливая их действие, ученые активизируют защиту организма.
В клиническом исследовании 2017 года с участием 21 пациента с меланомой поздней стадии препарат Imlygic вместе с ингибитором контрольной точки, который называется pembrolizumab, вызвал значительное сокращение опухолей у 13 участников и полностью уничтожил их у семерых.
Жан-Симон Диалло именно с ингибиторами контрольных точек связывает новый этап развития вирусной терапии рака. Правда, когда ученые пытались совмещать ингибиторы контрольных точек с другими видами терапии, они не всегда добивались успеха. Некоторые комбинации, от которых теоретически ожидалась высокая эффективность, во время клинических испытаний не показывали обнадеживающих результатов. Подобное может происходить и в сочетании ингибиторов контрольных точек с онколитическими вирусами. Но пока большинство исследователей разделяет осторожный оптимизм относительно перспектив такого метода.

Действие онколитического вируса в борьбе с раком
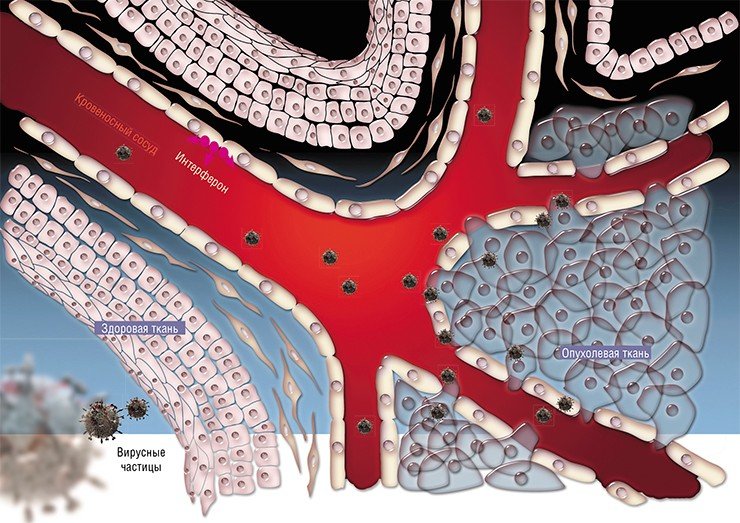
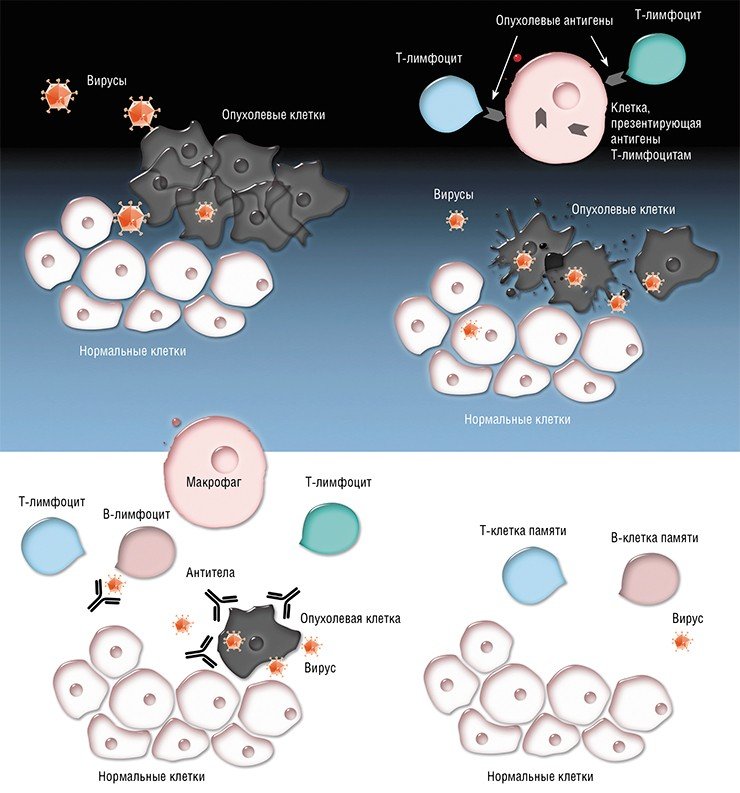
В рамках нового исследования, проведенного специалистами UC в Сан-Франциско, было установлено, что онколитический вирус, или вирус смерти от рака, способен выступать в качестве противоракового агента – наряду с уничтожением некоторых клеток онкологии данный вирус способен сигнализировать иммунной системе о наличии злокачественного новообразования, что провоцирует мощный иммунный ответ, уничтожающий клетки раковых тканей вне пределов пораженной онкологией зоны в значительном радиусе.
Применяя новые методики анализа механизмов атаки онколитическим вирусом раковых опухолей в рамках исследования, ученые определили способность вирусной инфекции взаимодействовать с иммунной системой организма для борьбы с клетками раковых тканей. Результаты научной работы были опубликованы в издании Cancer Research. Медики акцентируют внимание на возможности комбинирования данной формы терапии с медикаментами, входящими в лечебный курс при борьбе с онкологией, представленными ингибиторами контрольных точек, раскрывающими потенциал иммунной системы для победы над онкологией.
Сама идея на тему способности вирусов организма побеждать рак зародилась в умах специалистов еще в начале 20-го века. Тогда медики наблюдали резкое наступление ремиссии по факту получения пациентом вирусных инфекций. Онколитические вирусы разрабатываются с 1980-ых годоы, а после одобрения Imggic (T-Vec) Amgen FDA для использования разработки в роли первого агента для онколитического вирусного лечения в США подобные вирусы стали объектом наблюдения многих лабораторий.
При этом специалисты все еще заняты изучением основ и механизмов действия вирусных агентов, которые уничтожают раковые клетки – требуется оптимизировать их работу для эффективного результата в рамках противораковой терапии. В различных случаях вирусы могут атаковать злокачественные опухоли по разным сценариям: прямым заражением с высвобождением раковых белков, провоцирующих мощный иммунный ответ, и посредством повреждения кровеносной системы раковой опухоли.
Для получения более точных данных о действии основных механизмов вирусной терапии специалисты сотрудничали с ученым UCSF Дональдом Макдональдом, являющимся доктором медицинских наук, а также медиками, представляющими биотехнологическую компанию SillaJen Biotherapeutics Inc., Сан-Франциско, бывшую ранее Jennerex Biotherapeutics, Inc., и дочернюю компанию SillaJen, Inc., штаб-квартира которой базируется в Корее.
SillaJen занимается разработкой онколитической вирусной терапевтической программы под названием Pexa-Vec – разработки на данный момент находятся в фазе III и Ib / II клинических испытаний, что позволяет применять лечение для борьбы с первичной онкологией печени и колоректальным раком.
Pexa-Vec представлен инженерным вирусом, который базируется на безопасном вирусе коровьей оспы и является платформой для разработки оригинального типа вакцины для борьбы с оспой. Ранние наблюдения демонстрируют способность вируса наносить частичный ущерб кровеносной системе раковых опухолей, посредством которых происходит питание злокачественного новообразования. Это привело к совместной работе лабораторий SillaJen и Макдональда, специалисты которых являются экспертами в области изучения кровеносных систем раковых опухолей на животных моделях.
Как отметил доктор Макдональд, являющийся членом Объединенного онкологического центра семьи имени Хелен Диллер и Института исследования сердечнососудистых патологий в UCFS, данный вопрос вызвал интерес медиков по той причине, что вирус может быть интегрирован системно посредством внутривенного введения, что отличается от методики внедрения других онколитических вирусов, вводимых в раковую опухоль и ограничивающих терапевтические возможности при борьбе с раком, поражающим и распространяющимся в различные зоны организма.
Автором разработки вируса Pexa-Vec является Майкл Мастранджело, доктор медицинских наук, а также Эдмунд Латтиме, доктор философии, практикующий в Университете Томаса Джефферсона, Филадельфия. Последний из них также разработал безопасный вирус вакцинии, посредством применения которого осуществляется инфицирование исключительно клеток раковых опухолей, а также других клеток, которые характеризуются повышенными показателями скорости деления, и стимуляция иммунной системы с целью повышения эффктивности иммунного ответа организма для борьбы с раковыми опухолями.
Для изучения методики атаки модифицированным вирусом раковых опухолей специалистами лаборатории Макдональда были использованы мышиные модели, которым были внедрены раковые клетки, которые подверглись генной модификации для возможности развития нейроэндокринного рака поджелудочной железы. Медики выявили, что вирус не способен инфицировать здоровые клетки организма или вызывать бешенство у животных моделей, при этом он смог воздействовать на кровеносную систему злокачественных новообразований. Первичное инфицирование провоцировало появление брешей в сосудах, что позволяло вирусу проникать в раковые клетки. В ходе научной работы специалисты смогли инфицировать и уничтожить незначительную часть раковых клеток, однако в пятидневный срок в организме была вызвана мощная иммунная реакция, которая позволила организму самостоятельно уничтожить оставшиеся клетки раковых тканей.
По словам доктора Макдональда, изначально наблюдалось инфицирование только малого количества раковых клеток, после чего основная часть раковых тканей была уничтожена. Медики смогли продемонстрировать способность вируса провоцировать иммунную реакцию в организме, что помогает бороться с раком. По словам специалиста, это исследование уникально и ранее никем не проводилось.
Медики выявили, что при уничтожении некоторых раковых клеток вирус атакуется белками раковых клеток, которые идентифицируются агентами иммунной системы, что и вызывает мощную реакцию защитных сил против оставшихся раковых тканей. Ученые явно продемонстрировали этот результат посредством временного удаления клеток, уничтожающих онкологию, под названием CD8+, или цитотоксические Т-клетки – это позволило доказать, что при их отсутствии вирус может уничтожить только 5% клеток раковой опухоли.
Команда лаборатории доктора Макдональда поставила цель определить возможность оптимизации вируса посредством добавления второго препарата сунитиниба – он отвечает за блокирование роста сосудов кровеносной системы раковой опухоли, а также способствует изменению иммунной реакции. Комплексный подход позволил ученым получить более эффективные результаты при борьбе со многими раковыми опухолями. В ходе работы медики определили способность сунитиниба влиять на показатели гиперчувствительности иммунной системы относительно белков раковой опухоли, которые высвобождаются вирусом.
Полученные результаты свидетельствуют о том, что комбинированное применение Pexa-Vec позволяет пробуждать ресурсы иммунной системы к тем признакам онкологии, которые ранее ею игнорировались. Это достигается посредством использования в работе ингибиторов контрольных точек нового поколения, которые высвобождают полный потенциал иммунной системы – эта методика может стать мощным комбинированным лечение в борьбе с онкологией.
По словам доктора Макдональда, вопрос разработки новых методик иммунотерапии всегда был актуален. Медики задавались вопросом, по какой причине иммунные силы организма не направляются на борьбу с онкологией. Использование подобных вирусов можно сравнить с действием механизма бомбы, блокирующей иммунные ресурсы. Вирус способствует высвобождению опухолевых антигенов, провоцируя мощный иммунный ответ.
В рамках исследования впервые были найдены .
Учеными, представляющими детскую .
Исследователями Университета Сан-Паулу USP, .
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
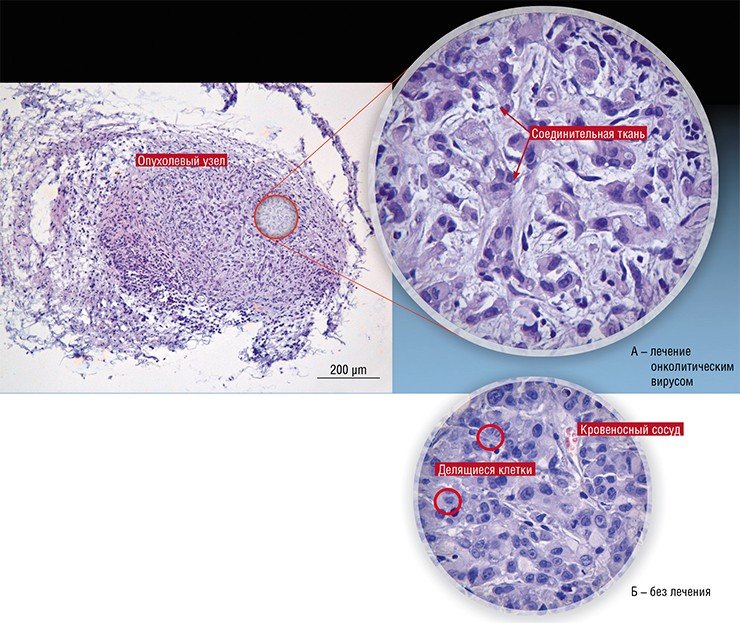
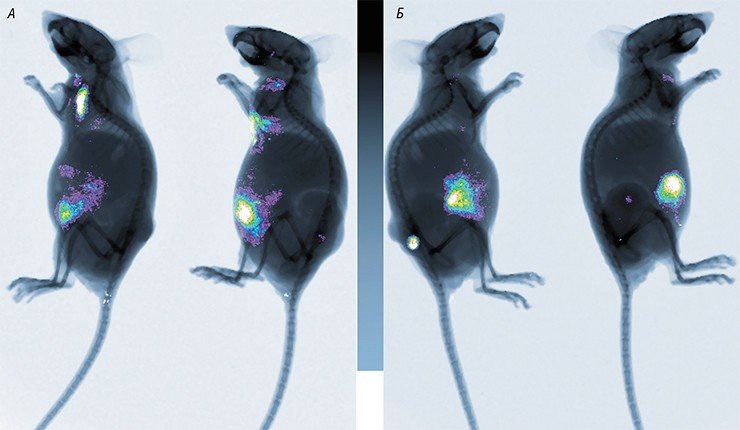
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.
Читайте также:


