Полипептидная цепь у вирусов
Основное различие между Пептидом и Белком состоит в том, что Пептид представляет собой короткую последовательность аминокислот с первичной структурой , тогда как Белок представляет собой полипептид, с гораздо большей структурой, имеющей различные уровни организации, такими как вторичная, третичная и четвертичная структура. Кроме того, пептидные связи возникают между аминокислотами в полипептидной цепи, в то время как различные полипептидные цепи белка связаны водородными связями и дисульфидными мостиками.
Пептид и Белок — это два типа структур, состоящих из аминокислот. Как правило, это незаменимые органические соединения, которые выполняют различные функции внутри клетки.
- Обзор и основные отличия
- Что такое Пептид
- Что такое Белок
- Сходство между Пептидом и Белком
- В чем разница между Пептидом и Белком
- Заключение
Пептид представляет собой простую молекулу, состоящую из аминокислот с количеством до 50. Если имеется более чем 50 аминокислот то эта молекула является белком. Существует два основных типа пептидов, в зависимости от количества аминокислот. Это олигопептиды, которые содержат 2-10 аминокислот, и полипептиды, которые содержат 10-50 аминокислот.
Каждая аминокислота присоединена к цепи через пептидную связь. Поскольку пептиды имеют меньшее количество аминокислот, они являются линейными молекулами.
Биологическая функция пептидов заключается в регулировании активности других молекул.
Белок является одним из четырех типов биологических макромолекул, имеющихся в организме. Он состоит из ряда аминокислот, определяемых по информации, закодированной в соответствующем гене. Синтез белка происходит в два этапа: транскрипция и трансляция . Связи, которые связывают аминокислоты вместе, являются пептидными связями.

Уровни организации белковой структуры
Первичные, вторичные и третичные структуры белка состоят из одной полипептидной цепи. Однако в первичной структуре эта полипептидная цепь является линейной. Чтобы сформировать вторичные структуры, такие как альфа-спирали и бета-структуры, первичная структура образует водородные связи между аминокислотами. Они также образуют третичные структуры, такие как глобулярные белки и нитчатые белки, посредством образования гидрофобных и гидрофильных взаимодействий, водородных связей, ионных связей и дисульфидных мостиков. В конечном счете, ассоциации двух или более полипептидных цепей образуют четвертичную структуру белков.
Белки выполняют различные функции в организме. Обычно они участвуют в формировании структур, включая мышцы, хрящи, волосы, ногти и компоненты клеточной мембраны. Более того, большинство глобулярных белков служат ферментами, гормонами и транспортными белками в крови. Другие глобулярные белки, называемые антителами, служат ключевыми молекулами в иммунной системе.
- Пептид и белок — два типа органических соединений, которые имеются в клетке.
- Оба состоят из аминокислот.
- Кроме того, пептидные связи возникают между аминокислотами каждого типа соединения.
- Они также подвергаются посттрансляционным модификациям, таким как фосфорилирование, гидроксилирование, сульфирование, пальмитоилирование и гликозилирование
- Они выполняют определенные функции внутри клетки.
Пептид относится к короткой цепи аминокислот, которые связаны друг с другом в определённой последовательности пептидной связью, в то время как белок относится к полимеру аминокислот с различными функциями внутри клетки.
Более того, пептид представляет собой короткую цепь аминокислот, содержащую приблизительно 50 или менее аминокислот, тогда как белок представляет собой полипептид, содержащий более 50 аминокислот. Хотя Пептиды состоят как из незаменимых аминокислот, так и из других встречающихся в природе аминокислот, Белки состоят только из 20 незаменимых аминокислот.
Пептиды имеют первичную структуру белка, в основном представляющую собой прямую цепь аминокислот, хотя и были обнаружены структуры напоминающие верёвку. Напротив, Белки имеют вторичную, третичную или четвертичную структуру.
Пептидные связи возникают между аминокислотами, тогда как водородные связи и дисульфидные связи встречаются между полипептидными цепями аминокислот.
Кроме того, функционально Пептиды играют ключевую роль в регуляции активности других молекул, особенно белков, тогда как Белки служат структурными молекулами, ферментами и гормонами.
Пептид — это короткая цепь аминокислот. Как правило, он содержит менее 50 аминокислот. Он может содержать как незаменимые аминокислоты, так и другие природные аминокислоты. Пептиды, обычно, имеют линейную структуру. Тогда, как Белок — это полипептид, содержащий более 50 аминокислот. Белки также могут иметь вторичную, третичную или четвертичную структуры. Однако они содержат только незаменимые аминокислоты. В основном, белки играют структурную и регулирующую роль в клетке, в то время как Пептиды регулируют функции белков. Следовательно, основное различие между Пептидом и Белком заключается в их размере, форме и функции.
Мономеры аминокислот, входящие в состав полипептидов, называют аминокислотными остатками. Аминокислотный остаток, имеющий свободную аминогруппу, называют N-концевым и записывают слева пептидной цепи, а имеющий свободную α-карбоксильную группу – С-концевым, и записывают справа. Цепь повторяющихся атомов –СН – СО – NH– в полипетидной цепи называется пептидным остовом.
Полипептидная цепь имеет следующий общий вид:

где R1, R2, R3, … Rn – радикалы аминокислот, образующие боковую цепь.
В проявлении биологических функций пептидов и белков большую роль играет электронное и пространственное строение пептидной группы:

Наличие р-π-сопряжения в пептидной группе приводит к частичной двоесвязанности связи С – N. Длина пептидной связи
С – N равна 0,132 нм, а длина связи N – Сα составляет 0,147 нм. Одинарная связь С – N в пептидах примерно на 40% имеет характер двойной связи, а двойная связь С = О приблизительно на 40% является одинарной. Это обстоятельство приводит к двум важным последствиям:
1) иминогруппа (– NH –) пептидной связи не обладает заметно выраженной способностью отщеплять или присоединять протон;
2) свободное вращение вокруг связи C – N отсутствует.
Частичая двоесвязанность связи С – N означает, что пептидная группа представляет собой плоский участок пептидной цепи. Плоскости пептидных групп расположены под углом друг к другу:
Схема пептидной цепи
Вокруг связей С – Сα и N – Сα возможно вращение, хотя и ограниченное размерами и характером радикалов, что позволяет полипептидной цепи принимать различные конфигурации.
Пептидная связь является единственной ковалентной связью, при помощи которой аминокислотные остатки соединяются друг с другом, образуя остов белковой молекулы.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные(схема) атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся в пространстве на наиболее удаленном расстоянии друг от друга.
Hоменклатура пептидов
При названии полипептида к названию всех аминокислотных остатков, кроме последнего, добавляют суффикс -ил, концевая аминокислота имеет окончание -ин. Например, пептид мет-асп-вал-про имеет полное название метиониласпарагилвалилпролин.
ГЛАВА 9.БЕЛКИ
Классификация белков
Как уже было отмечено ранее, трудно провести четкую границу между пептидами и белками. Обычно к белкам относят, как правило, высокомолекулярные пептиды, выполняющие основные биологические функции.
По мере развития химии белковых тел число различных белков, выделенных из растений, микробов, низших и высших животных, чрезвычайно возросло и в настоящее время достигло более двух тысяч. Возникла необходимость дать рациональную классификацию белков.
Молекулы белков представляют собой линейные полимеры, состоящие из α--аминокислот (которые являются мономерами). На первый взгляд может показаться, что использование в большинстве белков всего 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи .Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна:-COOH или –NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца. Последовательность аминокислот в белке соответствует информации,содержащейся в гене данного белка.
В зависимости от укладки пептидных цепей в молекулах различают белки глобулярные, имеющие округлую или эллипсоидную форму и фибриллярные, имеющие форму тончайших нитей. К группе фибриллярных белков принадлежат, например, фиброин шелка, кератин, коллаген. К группе глобулярных белков относятся альбумины, глобулины, большинство ферментов. Глобулярные белки встречаются в физиологических жидкостях и в тканях организма. Фибриллярные белки встречаются в сухожилиях, коже, мышцах, волосах. В большинстве случаев они не растворимы в воде.
Белки делят на две большие группы: простые и сложные.
1. Простые белки (протеины):
2. Сложные белки (протеиды).
Это системы, состоящие из простого белка и небелкового соединения, называемого простетической группой. Функцию этой группы могут выполнять различные углеводы, липиды, витамины, гормоны. В настоящее время группу сложных белков принято разделять на две большие подгруппы: стабильные с прочными химическими связями между белком и простетической группой и лабильные, имеющие непрочные связи белка с простетической группой (водородные связи, адсорбционные и др).
Структура белков
Первичная структура
Строго определенная последовательность аминокислот, связанных пептидными связями, образует первичную структуру белка.
Первичная структура каждого индивидуального белка матрицы закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на м-РНК, а затем, используя м-РНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка. Каждый белок организма человека имеет уникальную для него первичную структуру. При нарушении аминокислотной последовательности белков возникают многие генетические болезни. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания.
Вторичная структура
Вторичная структура белков это пространственная структура, образующаяся в результате взаимодействий между функциональ-ными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-складчатая структура.
Спираль определяется пространственным расположением следующих атомов аминокислот:
а) атомом углерода карбонильной группы;
б) α-углеродным атомом;
в) атомом азота α-аминогруппы.
Наиболее устойчивой из различных типов спиралей является правовращающая α-спираль, которая была впервые предложена в 1950 году Полингом и Кори на основании теоретических расчетов.
2. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи. Если N- и С-концы полипептидных цепей совпадают (т.е. цепи направлены параллельно друг другу) в этом случае образовавшуюся структуру называют параллельным
β-складчатым листком. Если же С-концы полипептидной цепи не совпадают с N-концами возникает антипараллельная β-структура.
В отличие от α-спиралей, разрыв водородных связей, формирующих β-структуры, не вызывает удлинения полипептидных цепей. Как α-спираль, так и β-складчатый листок встречаются и в глобулярных, и в фибриллярных белках.
Третичная структура
Это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
При укладке полипептидная цепь белка стремится принять энергетически выгодную конформацию.
В формировании третичной структуры белка участвуют связи:
1) Ионные возникают между отрицательно заряженными карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными группами радикалов лизина, аргинина и гистидина.
2) Водородные возникают между гидрофильными незаряженными группами (такими как ОН, СОNH2, SH.)
4) Слабые гидрофобные взаимодействия. Одна из причин гидро- фобных взаимодействий заключается в проявлении слабых сил притяжения Ван-дер-Ваальса, которые действуют между неполяр-ными боковыми цепями аминокислотных остатков.
Последнее изменение этой страницы: 2017-02-08; Нарушение авторского права страницы
Белки
Среди органических соединений клетки белки являются наиболее важными. Содержание белков в клетке колеблется от 50 % до 80 %.
Белки – это высокомолекулярные органические соединения, которые состоят из углерода, водорода, кислорода, серы и азота. В состав некоторых белков входит фосфор, а также катионы металлов.
Белки являются биополимерами, которые состоят из мономеров аминокислот. Их молекулярная масса варьируется от нескольких тысяч до нескольких миллионов, в зависимости от количества аминокислотных остатков.
В состав белков входит всего 20 типов аминокислот из 170, найденных в живых организмах.
Аминокислоты

Рис. 1. Аминокислота
В зависимости от радикала аминокислоты делят на (см. Рис. 2):
1. кислые (в радикале карбоксильная группа);
2. основные (в радикале аминогруппа);
3. нейтральные (не имеют заряженных радикалов).

Рис. 2. Классификация аминокислот
Аминокислоты соединяются друг с другом посредством пептидной связи. Эта связь образуется путем выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь – пептидной связью.

Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид (см. Рис. 3). На одном конце его молекулы находится аминогруппа, а на другом – свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие молекулы. Если таким образом соединяется много аминокислот, то образуется полипептид (см. Рис. 4).

Рис. 4. Полипептид
Полипептидные цепи бывают очень длинными и могут состоять из различных аминокислот. В состав белковой молекулы может входить как одна полипептидная цепь, так и несколько таких цепей.
Многие животные, включая человека, в отличие от бактерий и растений не могут синтезировать все аминокислоты, которые составляют белковые молекулы. То есть существует ряд незаменимых аминокислот, которые должны поступать с пищей.
К незаменимым аминокислотам относятся: лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин.
Значение свободных аминокислот
Ежегодно в мире производится более двухсот тысяч тонн аминокислот, которые используются в практической деятельности человека. Они применяются в медицине, парфюмерии, косметике, сельском хозяйстве.
В большей степени производят глутаминовую кислоту и лизин, а также глицин и метионин.
1. Глутаминовая кислота
Используется в психиатрии (при эпилепсии, для лечения слабоумия и последствий родовых травм), в комплексной терапии язвенной болезни и при гипоксии. Также она улучшает вкус мясных продуктов.
2. Аспарагиновая кислота
Аспарагиновая кислота способствует повышению потребления кислорода сердечной мышцей. В кардиологии применяют панангин – препарат, содержащий аспартат калия и аспартат магния. Панангин применяют для лечения различного рода аритмий, а также ишемической болезни сердца.
3. Метионин
Защищает организм при отравлениях бактериальными эндотоксинами и некоторыми другими ядами, в связи с этим используется для защиты организма от токсикантов окружающей среды. Обладает радиопротекторными свойствами.
4. Глицин
Является медиатором торможения в центральной нервной системе. Используется как успокаивающее средство, применяется при лечении хронического алкоголизма.
5. Лизин
Основная пищевая и кормовая добавка. Используется в качестве антиоксидантов в пищевой промышленности (предотвращает порчу пищевых продуктов).
Пептиды
Отличие между белками и пептидами заключается в количестве аминокислотных остатков. В белках их более 50, а в пептидах менее 50.
В настоящее время выделено несколько сотен различных пептидов, которые выполняют в организме самостоятельную физиологическую роль.
К пептидам относятся:
1. Пептидные антибиотики (грамицидин S).
2. Регуляторные пептиды – вещества, регулирующие многие химические реакции в клетках и тканях организма. К ним относятся: пептидные гормоны (инсулин), окситоцин, стимулирующий сокращение гладкой мускулатуры.
Классификация белков
В зависимости от строения различают простые и сложные белки.
1. Простые белки состоят только из белковой части.
2. Сложные имеют небелковую часть.
Если в качестве небелковой части используется углевод, то это гликопротеиды.
Если в качестве небелковой части используются липиды, то это липопротеиды.
Если в качестве небелковой части используются нуклеиновые кислоты, то это нуклеопротеиды.
Структуры белка
Белки имеют 4 основных структуры: первичную, вторичную, третичную, четвертичную (см. Рис. 5).

Рис. 5. Структура белка
1. Под первичной структурой понимают последовательность аминокислотных остатков в полипептидной цепи. Она уникальна для любого белка и определяет его форму, свойства и функции.
Значительное совпадение первичной структуры характерно для белков, выполняющих сходные функции. Замена всего лишь одной аминокислоты в одной из цепей может изменить функцию молекулы белка. Например, замена глутаминовой кислоты на валин приводит к образованию аномального гемоглобина и к заболеванию, которое называется серповидноклеточная анемия.
2. Вторичная структура – упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей.
3. Третичная структура – укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
4. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникнуть при воздействии температуры, химических веществ, при нагревании и облучении.
Если при денатурации не нарушены первичные структуры, то при восстановлении нормальных условий белок способен воссоздать свою структуру. Этот процесс носит название ренатурация (см. Рис. 6). Следовательно, все особенности строения белка определяются первичной структурой.

Рис. 6. Денатурация и ренатурация
Серповидноклеточная анемия
Серповидноклеточная анемия – это наследственная болезнь, при которой эритроциты, участвующие в переносе кислорода, выглядят не в виде диска, а принимают форму серпа (см. Рис. 7). Непосредственной причиной изменения формы является небольшое изменение химической структуры гемоглобина (основного компонента эритроцита).

Рис. 7. Внешний вид нормального и серповидного эритроцита
Симптомы: потеря трудоспособности, постоянная отдышка, учащенное сердцебиение, пониженный иммунитет.
Одним из признаков серповидноклеточной анемии является желтизна кожных покровов.
Заключение
Существуют различные формы заболевания. В самой тяжелой форме у человека происходит задержка развития, такие люди не доживают до подросткового возраста.
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R-CO-NH-R связь, называемая пептидной связью. При этом происходит отщепление молекулы воды.
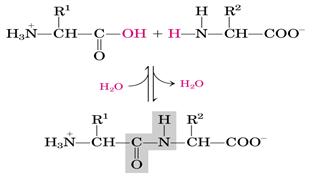
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и являются ковалентными.
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов – окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики – грамицидин, пептиды, обладающие обезболивающим действием (энкефалины (5) и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
Окситоцин выделяется в кровь во время кормления ребёнка, вызывает сокращение миоэпителиальных клеток протоков молочных желёз и стимулирует выделение молока. Кроме того, окситоцин влияет на гладкую мускулатуру матки во время родов, вызывая её сокращение.
В отличие от окситоцина, основное физиологическое действие вазопрессина — увеличение реабсорбции воды в почках при уменьшении АД или объёма крови (поэтому другое название этого гормона — антидиуретический). Кроме того, вазопрессин вызывает сужение сосудов.
Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами. Существуют общие правила, по которым идёт формирование пространственных структур белков.
Первичная структура белка – это ковалентная структура остова полипептидной цепи – линейная последовательность аминокислотных остатков, соединенных друг с другом пептидными связями. Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка. Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру.
Инсулин является первым белком, первичная структура которого была расшифрована. Инсулин — белковый гормон; содержит 51 аминокислоту, состоит из двух полипептидных цепей (цепь А содержит 21 аминокислоту, цепь В — 30 аминокислот). Инсулин синтезируется в β-клетках поджелудочной железы и секретируется в кровь в ответ на повышение концентрации глюкозы в крови. В структуре инсулина имеются 2 дисульфидные связи, соединяющие 2 полипептидные цепи А и В, и 1 дисульфидная связь внутри цепи А
Вторичная структура белков– это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами -NH и -СО. Существует два основных способа укладки цепи — α-спираль и β-структура.
α–Спираль
Вданном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами водорода аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка.
α-Спиральная структура — наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования α-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
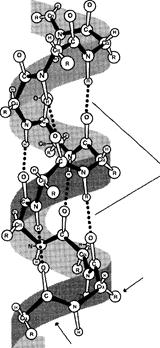
Радикалы аминокислот находятся на наружной стороне α -спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование α-спирали.
К ним относятся:
- пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
- участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
- участки с близко расположенными объёмными радикалами, механически нарушающими формирование а-спирали, например метионин, триптофан.
β -Структура
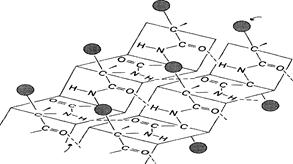
Складчатый слой фиброина шелка: зигзагообразные антипараллельные складки.
Содержат много остатков Глицина и Аланина
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Третичная структура белков — трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Третичная структура свернутой полипептиднойцепи стабилизируется рядом взаимодействий между радикалами аминокислот: это гидрофобные взаимодействия, электростатическое притяжение, водородные связи, а также дисульфидные -S-S- связи.
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей.
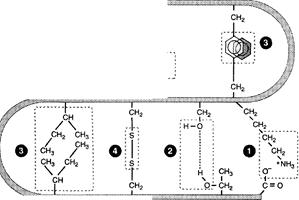
Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 — ионные связи; 2 — водородные связи; 3 — гидрофобные связи; 4 — дисульфидные связи.
Ионные связи (электростатическое притяжение)могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина.
Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -CONH2, SH-группы) и любыми другими гидрофильными группами. Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов.
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют кон-формацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Четвертичная структура белков. Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
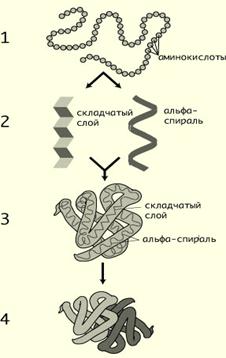 |
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Способ упаковки двух или более отдельных глобулярных белков в молекуле является четвертичной структурой белка.
Отдельные полипептидные цепи в таком белке носят название мономеров, или субъединиц. Белок, содержащий в своём составе несколько мономеров, называют олигомерным. Олигомерные глобулярные белки обычно имеют крупные размеры и часто выполняют в ферментативных комплексах регуляторные функции.
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом.
Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка под воздействием органических растворителей, ультразвука, температуры, pH ,и т.д. приводит к разрушению её нативной конформации. Развертывание цепей без разрушения их ковалентных связей называется денатурацией. Такой белок биологически неактивен. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается, однако его функция утрачивается.
Читайте также:


