Про вирус лейкоза крс пцр
1.1. Определение болезни………………………………………….стр.3
2.1. Характеристика вируса………………………………………..стр.3
2.2.Общая характеристика семейства:…………………………………. стр.4
2.3.Антигенная структура и антигенная вариабельность………..стр.5
2.4.Гемаггютинирующие и гемадсорбирующие свойства……. стр.5
2.1.1.Характеристика болезни……………………………………………стр. 6
2.1.5.Патологоанатомические изменения………………………. стр.10
3. Лабораторная диагностика:…………………………………………. стр.10
- Признаки положительной биопробы
-Идентификация выделенного вируса
III.Особенности иммунитета и специфическая профилактика………..стр.12
3.1..Длительность иммунитета у переболевших животных…….стр.12
3.2.Биопрепраты для специфической профилактики……………стр.12
Список использованной литературы……………………………………стр.15
Лейкоз крупного рогатого скота (лат. – Bovine leucosis; англ. – Leukaemia in cattle; гемобластоз, хроническая инфекционная болезнь опухолевой природы) – хроническая болезнь опухолевой природы, протекающая бессимптомно или характеризующаяся лимфоцитозом и злокачественным разрастанием кроветворных и лимфоидных клеток в различных органах.
В настоящее время лейкоз крупного рогатого скота диагностируют практически во всех странах мира. Наиболее широко он распространен в США, в ряде стран Центральной Европы, Дании, Швеции, странах Ближнего Востока и Африки, а также в Австралии. В нашей стране возникновение лейкоза связано с завозом племенного скота в 1940, 1945–1947 гг. из Германии. В дальнейшем лейкоз распространился повсеместно.
В настоящее время гемобластозы рассматривают как болезнь, которая представляет потенциальную опасность для генофонда племенного молочного скота и при отсутствии планомерной борьбы имеет тенденцию к дальнейшему нарастанию. Экономический ущерб от лейкоза складывается из потерь в результате выбраковки инфицированных и больных животных, утилизации туш, сдачи на мясо молодняка от больных коров и расходов на проведение оздоровительных мероприятий.
Прямая возможность заражения людей от больного лейкозом скота не установлена.
Вирус лейкоза крупного рогатого скота – РНК-содержащий вирус подсемейства Oncornavirinae (опухолевые вирусы) семейства Retroviridae.
Род: Deltaretrovirus.Типовой: Bovine leukemia virus (BLV) (вирус лейкемии (лейкоза) КРС).
Характеристика вириона (тип нуклеиновой кислоты и структура, форма, размер, тип симметрии):
РНК-димер, односпиральная, линейная, плюс-нитевая (в цикле репродукции есть этап обратной транскрипции, вирус имеет фермент обратная транскриптаза или ревертаза), форма сферическая, 80-100 нм, спиральный тип симметрии, наличие суперкапсидной оболочки.
Репродукция – в ядре и цитоплазме
1. Адсорбция вируса на клетке
2. Проникновение вируса в клетку
4. Синтез 2 – нитчатого ДНК-провируса (обратная транскрипция)
5. Интеграция ДНК-провируса с клеточным геномом
6. Синтез и – РНК (транскрипция)
7. Синтез вирусных белков (трансляция)
8. Синтез дочерних вирусных плюс-РНК (репликация)
9. Сборка вириона
10. Выход вируса из клетки
После проникновения вируса в здоровый организм, он внедряется в субпопуляцию B-лимфоцитов. Геном возбудителя интегрируется с геном лимфоцита, вирус не является патогенным для клетки. Происходит репродукция вируса и выделение вирионов из клетки путем почкования от клеточной мембраны и отделением от лимфоидной клетки в межклеточное пространство. Лимфоидные клетки могут передавать геном вируса дочерним клеткам во время деления лимфоцита. Передача вируса из клетки в клетку может происходить и без продуцирования вирионов. Через 3-8 недель после заражения животных в сыворотке крови появляются антитела против ВЛКРС
ВЛКРС – это экзогенный вирус в отношении крупного рогатого скота и других чувствительных видов животных. Репликация вируса ограничивается клетками лимфоидной популяции и не выявлена в других тканях организма.
ВЛКРС репродуцируется в перевиваемых, хронически инфицированных культурах клеток тканей животных разных видов.
Установлено, что ВЛКРС чувствителен к температурным воздействиям, разрушается при повторяющихся замораживаниях и оттаиваниях и при прогревании при 56 «С в течение 15 мин. Пастеризация молока (74 °С в течение 16 с) разрушает ВЛКРС. Полная инактивация вируса в молоке или вируссодержащей жидкости (кровь, молозиво) установлена при 50 «С в течение 70 с, при 70…74 «С – за 17 с. Прямой солнечный свет инактиви-рует ВЛКРС в течение 4 ч, УФ-лучи – в течение 30 мин. Вирус полностью теряет активность в 2%-ных растворах гидроксида натрия и формальдегида и других дезинфектантов в общепринятых концентрациях.
Таким образом, решающее этиологическое значение ВЛКРС при возникновении гемобластозов крупного рогатого скота доказано. Вместе с тем при изучении вирусной этиологии опухолей и лейкозов животных накапливались достоверные данные о том, что канцерогенный эффект вирусов проявляется в зависимости от иммунобиологического состояния организма и воздействия стресс-факторов. Отмечается также более выраженная генетическая устойчивость отдельных пород и линий животных к ВЛКРС.
2.2.Общая характеристика семейства:
Основным признаком всех представителей семейства Retroviridae является наличие в вирионе обратной транскриптазы. В состав подсемейства Oncornavirinae входят три рода, дифференцируемые на основании морфологии вирионов: вирусы типов С, В и D. Вирусы типа С делят на два подрода: вирусы типа С млекопитающих и вирус лейкоза крупного рогатого скота (ВЛКРС).
Вирус лейкоза крупного рогатого скота относится к семейству ретровирусов (в это же семейство входят родственные ВЛКРС вирусы Т - клеточного лимфолейкоза и ВИЧ). Ретровирусным инфекциям свойственен ряд общих признаков: длительность инкубационного периода, хроническое или латентное течение, пожизненное вирусоносительство и строго ограниченный круг восприимчивых животных Ретровирусы проникают в клетку, РНК освобождается и превращается в двухцепочечную ДНК - копию, которая встраивается как провирус в ДНК клетки хозяина. Встроенный в геном хозяина провирус остается не доступным для воздействия специфических антител и в организме на протяжении всей жизни животного.
В благоприятных условиях встроенный провирус формирует новые вирионы; которые отпочковываются от клеточной мембраны для инфицирования новых клеток.
2.3.Антигенная структура и антигенная вариабельность:
Электрофорез очищенных вирионов ВЛКРС в SDS - ПА и гельфильтрация в присутствии гидрохлорида гуанидина показывают в составе вирионов 4 главных негликозилированных белка и 2 гликозилированных.
Заражение животных ВЛКРС сопровождается выработкой антител к структурным белкам вируса. Антитела и вирус циркулируют в организме у зараженных животных на протяжении всей жизни. Это позволяет применять серологические методы для диагностики инфекции, вызываемой этим вирусом.
Антигенная вариабельность и родство:
В АГ отношении ВЛКРС отличается от известных вирусов типа С. Не выявлено с помощью ИФ и иммунодиффузии АГ родства между главным внутренним белком ВЛКРС р24 и группоспецифическими АГ вирусов лейкозов мышей и кошек, опухолей молочных желез мышей, вирусов бабуинов, Мезон-Пфайзера, шерстистых обезьян ВЛКРС, являясь экзогенным ретровирусом КРС, отличается от известных ретровирусов по АГ свойствам, морфогенезу, способности индуцировать синцитий в монослойных культурах клеток и по свойствам ревертазы. Кроме того, в отличие от большинства других лейкемогенньгх вирусов, он присутствует у инфицированных животных в непродуктивном состоянии.
2.4.Гемаггютинирующие и гемадсорбирующие свойства:
ВЛКРС агглютинирует только эритроциты мышей. Максимальная ГА наблюдается при рН 6 и температуре 4°С. После обработки вируса тритоном Х100 или ультразвуком ГА активность вируса повышается в 6-16 раз. Обработка трипсином, KI04 или нейраминидазой значительно снижает ГА-активность ВЛКРС. Эти данные указывают на то, что ГА ВЛКРС является гликопротеином gp51, который после очистки обладает высокой ГА- J активностью. Обработка мышиных эритроцитов нейраминидазой в 4 раза повышает их способность агглютинироваться. ГАд свойства не установлены.
Вирус лейкоза впервые удалось обнаружить в культурах лимфоцитов крови инфицированных животных. ВЛКРС репродуцируется в перевиваемых хронически инфицированных культурах клеток тканей животных разных видов. Наибольшее распространение получила перевиваемая линия клеток FLK-BLV, которую получил в 1974 г. Van der Maaten путём сокультивирования эмбриональных клеток почки овцы с лимфоцитами лейкозной коровы. Эта линия клеток используется для биохимических, морфологических и серологических исследований. В настоящее время получены и широко используются перевиваемые хронически инфицированные ВЛКРС линии клеток: фибробласты легкого эмбриона коровы (АИД-15), почки эмбриона коровы (ПЭК); почки эмбриона овцы (FLK-BLV); легкого эмбриона летучей мыши (T61-Lu); легкого макаки-резус (BLV-Simian); селезенки овцы (FLS, J-1228); тимуса эмбриона коровы (ТЭК-МВА-766 LmTT). Способность ВЛКРС индуцировать в монослойных куътурах клеток образование синцитиев (многоядерных клеток) была использована для разработки специфичного, чувствительного и быстрого диагностического теста для вьывления инфекционного вируса и ВНА. Этот тест обеспечивает количественные результаты и применяется для прямого выявления ВЛКРС - инфекции у животных.
Изобретение относится к области ветеринарии и вирусологии, в частности к методам лабораторной диагностики вируса лейкоза крупного рогатого скота (ВЛ КРС).
Лейкоз КРС - злокачественное вирусное лимфопролиферативное заболевание. Ретровирус ВЛ КРС, относящийся к семейству Retroviridae, роду Deltaretrovirus, интегрируется в ДНК лейкоцитов хозяина и пребывает в латентном состоянии в большом количестве клеток в течение длительного периода времени, что затрудняет его определение и выявление заболевших животных.
Известны различные диагностические методы для тестирования образцов крови КРС на наличие вируса ВЛ КРС, в частности и серологические методы (РИД, ИФА), и метод полимеразной цепной реакции (ПЦР). Однако с помощью серологических методов невозможно выявить ВЛ КРС на ранних стадиях инфекции, что особенно важно для своевременной изоляции здоровых телят от ВЛ КРС инфицированных животных. ПЦР является более чувствительным методом, но при низкой нагрузке провируса ВЛ КРС на начальных стадиях заболевания этот метод не всегда эффективен (см. патенты РФ №2377962; 2379683; 2445370).
Известен также синцитиальный тест, который используется для исследований вируса лейкоза крупного рогатого скота (КРС) в Научно-исследовательском Ветеринарном Институте в Пулавы, Польша (Jan Stec, Leokadia Bicka, Bozenna Kozaczynska, Jacek Kuzmak. Lymphoproliferation assay in cattle naturally infected with bovine leukemia virus (BLV) and bovine immunodeficiency virus (BIV). Bulletin of Veterinary Institute. Pulawy 45, 117-123, 2001). Однако данный метод имеет ряд недостатков. Во-первых, при малейшем нарушении стерильности возможна контаминация образцов, тем более, если в одном культуральном планшете их находится несколько. Кроме того, в связи с тем, что культура клеток СС81 чувствительна к нескольким вирусам семейства Retroviridae, для подтверждения диагноза на ВЛ КРС инфекцию по методике необходимо проводить контрольный иммунопероксидазный тест, что требует дополнительных манипуляций, времени и дорогостоящих расходных материалов и растворов (при общем времени диагностики 10-11 суток).
Задачей изобретения является создание способа подготовки биоматериала для ПЦР диагностики вируса лейкоза крупного рогатого скота, позволяющего определить наличие ВЛ КРС в образцах крови телят на ранних стадиях инфекции и проводить диагностику с использованием существующей серийной аппаратуры и тест-систем и не требующего дополнительного специального обучения и стажировки сотрудников диагностических лабораторий при сокращении общего времени постановки диагноза, способного выявлять заболевание у телят с 15-30 дневного возраста.
Поставленная задача решается за счет особенностей клеточной линии фибробластов легкого кошки СС81 формировать синцитий при наличии в образцах вируса ВЛ КРС, увеличивая копийность вируса за счет репликации вириона в исследуемых образцах для повышения точности выявления вируса с помощью ПЦР, при этом способ подготовки биоматериала для ПЦР диагностики вируса лейкоза крупного рогатого скота (ВЛ КРС), включающий взятие образцов крови животного, подготовку образца для исследований и диагностику подготовленного образца, характеризуется тем, что для подготовки к ПЦР диагностике используют образцы биоматериала в виде клеточной культуры СС81, культивированной на среде Игла MEM в виде многоядерных клеточных образований - синтициев, при этом для культивирования клеток СС81 используют питательную среду Игла MEM с L-глутамином и двойным набором аминокислот с добавлением эмбриональной телячьей сыворотки, причем концентрация сыворотки в питательной среде равна 10%, а для стерилизации сыворотки используют прогревание при температуре 56°C в течение 30 минут, причем культуру культивируют в пластиковых флаконах при температуре 37°C с полной сменой среды 3 раза в неделю, а при заражении СС81 в среду Игла MEM с 10% эмбриональной сывороткой КРС вместе с лейкоцитами добавляют три антибиотика: пенициллин 100 ЕД/см 3 , стрептомицин 100 мкг/см 3 , амфотерицин 5 ЕД/мл, а также глутамин, при этом в качестве отрицательного контроля используют лейкоциты от животного, отрицательного по ВЛ КРС, а также незараженную культуру.
Предложенный способ подготовки биоматериала для ПЦР диагностики вируса лейкоза крупного рогатого скота основан на известных наблюдениях аргентинского ученого Ferrer J.F., который описал способность культуры клеток к образованию синцития под воздействием вируса ВЛ КРС (см. Ferrer J.F., Piper С.Е., Abt D.A., Marshak R.R. Diagnosis of bovine leukemia virus infection: evaluation of serologic and hematologic tests by a direct infectivity detection assay. American Journal of Veterinary Research, 1997; Dec. 38(12): 1977-81).
Разработанный способ выявления ВЛ КРС с помощью культуры клеток СС81 в отличие от прототипа включает ряд существенных изменений, что и является новизной изобретения.
В отличие от методики, которая послужила прототипом для данного изобретения, последующую концентрацию эмбриональной сыворотки КРС в среде снижают до 6% и 2%, вместо 8% и 6% (через 2 и 4 дня после заражения соответственно). По наблюдениям используемые концентрации сыворотки положительно влияют на заражение клеточной культуры вирусом, предположительно содержащимся в лейкоцитах ВЛ КРС положительного животного.
Также новизной является то, что вместо затратного по времени и экономически невыгодного пероксидазного теста для подтверждения наличия вируса ВЛ КРС в образцах с образованием синцития в способе используется дополнительный уточняющий тест клеточной культуры в 7-й день после заражения методом полимеразной цепной реакции (ПЦР).
Более подробно проведение синцитиального теста описывается в следующей последовательности в приведенном примере:
Предварительно готовят клеточную культуру СС81, раскапывают по 2 мл на лунку в 12-луночную плашку и инкубируют в течение 2-х дней при 37°C в СО2-термостате. Через 2 суток в сформировавшийся монослой СС81 добавляют лейкоцитарную взвесь, полученную из образцов крови исследуемых КРС следующим образом:
Параллельно с подготовкой клеточной культуры СС81 у животных с подозрением на лейкоз проводят забор крови в вакуумные пробирки с ЭДТА объемом 10 мл. Взятую кровь центрифугируют при 2600 об/мин в течение 30 мин. Далее нужно удалить пипеткой супернатант и собрать интерфазу светлого цвета на границе плазмы и эритроцитов, содержащую лейкоциты. В данную жидкость добавляют 4 мл стерильной дистиллированной холодной воды, охлажденной до температуры 4-8°C, перемешивают в течение 30 сек и добавляют 1 мл стерильного 4,5% хлорида натрия с последующим перемешиванием. После этого повторяют центрифугирование при 2600 об/мин в течение 30 мин. Пипеткой удаляют супернатант и ресуспендируют осадок в 8 мл стерильного фосфатного буфера. Проводят центрифугирование при 1500 об/мин в течение 15 мин. Удаляют супернатант и повторно промывают осадок путем добавления 8 мл фосфатного буфера, сильно взбалтывают. Еще раз центрифугируют при 1500 об/мин в течение 15 мин. Полученную лейкоцитарную взвесь ресуспендируют в 6 мл 10% среды с добавлением 3-х антибиотиков: пенициллин, стрептомицин (по 100 ЕД (мкг/см 3 ), амфотерицин (5 ЕД/мл) и глутамина. Все этапы центрифугирования проводят при комнатной температуре. В качестве положительного контроля используют лейкоциты от животного, положительного по ВЛ КРС. В качестве отрицательного контроля используют лейкоциты от животного, отрицательного по ВЛ КРС, а также незараженную культуру. Лейкоцитарную взвесь, ресуспендированную в 10% среде с антибиотиками, раскапывают в лунки планшета, содержащие 2-дневный монослой (по три лунки на каждую пробу) (фиг. 1).
Приготовление фосфатного буфера (без Са ++ и Mg ++ ), который используется для получения лейкоцитарной взвеси, проводят следующим образом:
Вода редистиллят - до 500 мл
Подсчет количества лейкоцитов производят в камере Горяева. Для заражения монослоя СС81 необходимо наличие не менее 5×10 6 клеток в 1 мл среды.
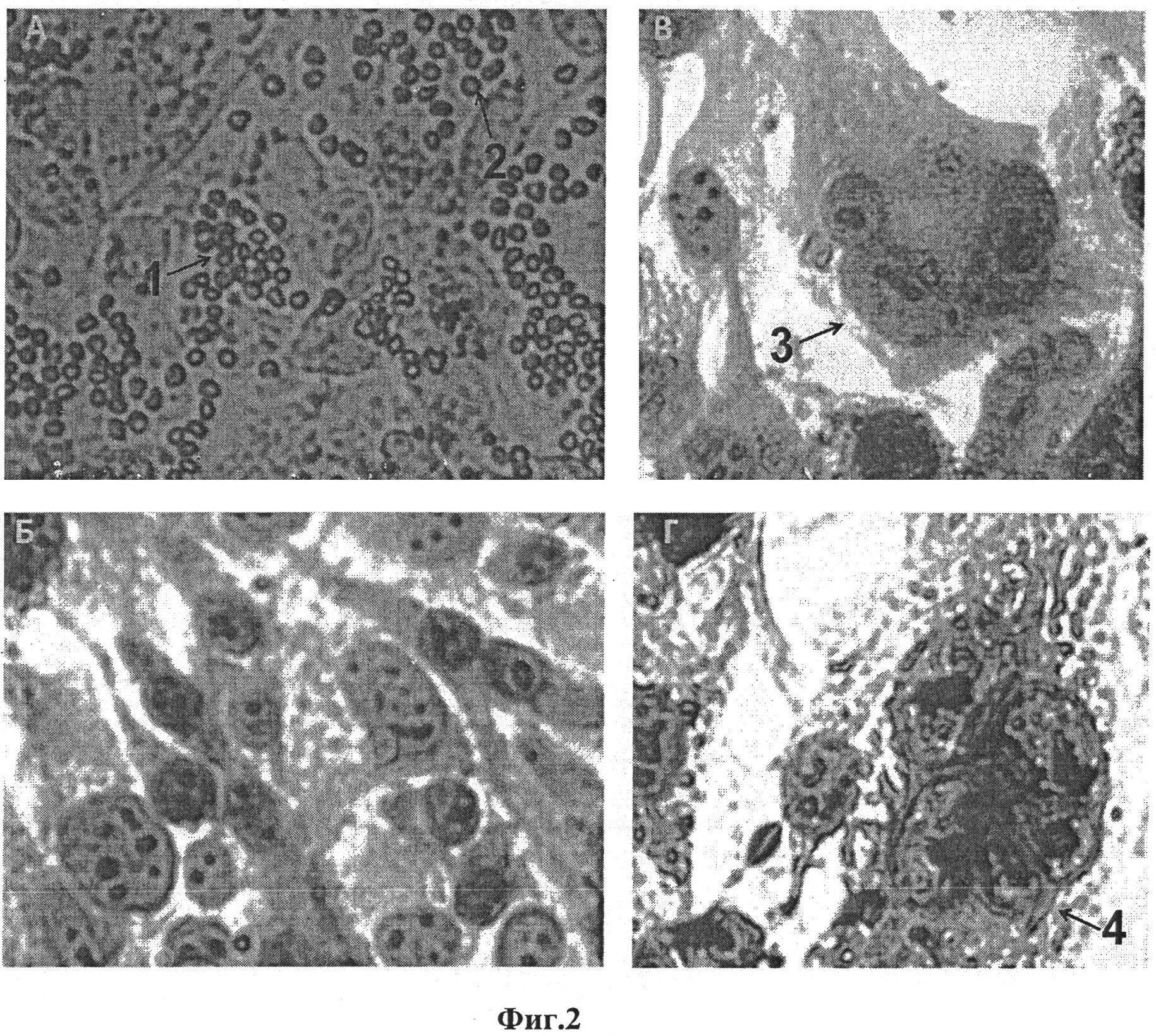
Через 2 и 4 дня после заражения культуры среду из лунок удаляют и добавляют свежую среду с концентрацией сыворотки 6% и 2% соответственно. На фиг. 2А изображен монослой СС81 через 2 дня после добавления питательной среды, содержащей лейкоциты от ВЛ КРС положительного барана. В 7-й день после заражения культуры клетки трехкратно промывают фосфатным буфером и окрашивают по методу Грунвальда-Гимза следующим образом:
Раствор Грунвальда добавляют на 3 минуты, при этом лунки должны быть полностью покрыты жидкостью. Далее раствор Грунвальда аккуратно удаляют дозатором и несколько раз промывают клетки дистиллированной водой. Затем добавляют на 15 минут свежий раствор Гимза (готовят из расчета 1,5 мл раствора и 23,5 мл дистиллированной воды). После этого планшет осторожно промывают водой. Окрашенную клеточную культуру исследуют с помощью микроскопа. ЦПД, вызванное ВЛ КРС, наблюдают в виде синцитиев - многоядерных клеточных образований (фиг. 2, В, Г). Монослой интактной клеточной культуры СС81 в качестве отрицательного контроля изображен на фиг. 2Б. Далее полученную клеточную культуру направляют на ПЦР диагностику.
На фиг. 1. Представлено схематическое изображение 12-луночного культурального планшета, содержащего 2-дневный монослой СС81 после добавления 10% среды Игла MEM (смотрите выше) в виде 12 розовых кружков. Маленькие желтые кружки изображают лейкоциты. Лунки A1, В1, С1: в среду добавлена лейкоцитарная взвесь от отрицательного животного по ВЛКРС (отрицательный контроль); лунки А2, В2, С2: в среду добавлена лейкоцитарная взвесь от исследуемого животного; лунки A3, В3, С3: в среду добавлена лейкоцитарная взвесь от положительного по ВЛ КРС животного (положительный контроль); лунки А4, В4, С4: незаряженный монослой в качестве дополнительного отрицательного контроля.
На фиг. 2 представлены изображения клеточной культуры СС81, полученные на инвертированном микроскопе Карл Цейс Axio Observer A1. А: монослой клеточной культуры СС81 через 2 суток после добавления 10% среды (смотрите выше), содержащей лейкоциты, полученные из крови барана, положительного по ВЛ КРС. Лейкоциты отмечены стрелками; Б: монослой незараженной культуры СС81 в 7-й день синцитиального теста. В, Г: примеры образования синцитиев в монослое клеточной культуры СС81 на 7-й день после заражения лейкоцитами от ВЛ КРС положительного барана. Стрелки указывают на образование синцитиев, содержащих 4 ядра (В) и 5 ядер (Г) соответственно. Клеточную культуру окрашивали по методу Грунвальда-Гимза. Ядра и цитоплазма окрашены в розовый и фиолетовый цвет соответственно.
Вторичные признаки способа, - как использование в качестве добавки вместе с лейкоцитами пенициллина, стрептомицина (по 100 ЕД (мкг/см 3 )), амфотерицина (5 ЕД/мл) и глутамина, концентрация эмбриональной сыворотки в питательной среде 10%, а также другие признаки, определены и обоснованы практически опытным путем и обеспечивают заявленный конечный результат.
Внедрение предложенного способа, который можно считать ранней диагностикой возбудителя лейкоза на основе ПЦР, позволит определить вирусоносителей у молодняка крупного рогатого скота уже с возраста 15-20 дней.
Разработанная ранняя диагностика лейкоза позволит повысить эффективность оздоровления сельскохозяйственных предприятий от инфекции.
Неочевидным эффектом предложенного способа является то, что за счет подготовки биоматериала для ПЦР диагностики по предложенной схеме с выращиванием культуры клеток СС81 на среде Игла MEM при заданных параметрах увеличивается копийность вируса, что повышает эффективность ПЦР диагностики и позволяет выявлять вирусоносителей среди телят эмбрионального заражения в возрасте 15-30 дней, снижая затраты на оздоровление стада.
Способ подготовки биоматериала для ПЦР диагностики вируса лейкоза крупного рогатого скота (ВЛ КРС), включающий взятие образцов крови животного, подготовку образца для исследований и диагностику подготовленного образца, характеризующийся тем, что для подготовки к ПЦР диагностике используют образцы биоматериала в виде клеточной культуры СС81, культивированной на среде Игла MEM в виде многоядерных клеточных образований - синтициев, при этом для культивирования клеток СС81 используют питательную среду Игла MEM с L-глутамином и двойным набором аминокислот с добавлением эмбриональной телячьей сыворотки, причем концентрация сыворотки в питательной среде равна 10%, а для стерилизации сыворотки используют прогревание при температуре 56°C в течение 30 минут, причем культуру культивируют в пластиковых флаконах при температуре 37°C с полной сменой среды 3 раза в неделю, а при заражении СС81 в среду Игла MEM с 10% эмбриональной сывороткой КРС вместе с лейкоцитами добавляют три антибиотика: пенициллин 100 ЕД/см, стрептомицин 100 мкг/см, амфотерицин 5 ЕД/мл, а также глутамин, при этом в качестве отрицательного контроля используют лейкоциты от животного, отрицательного по ВЛ КРС, а также незараженную культуру. 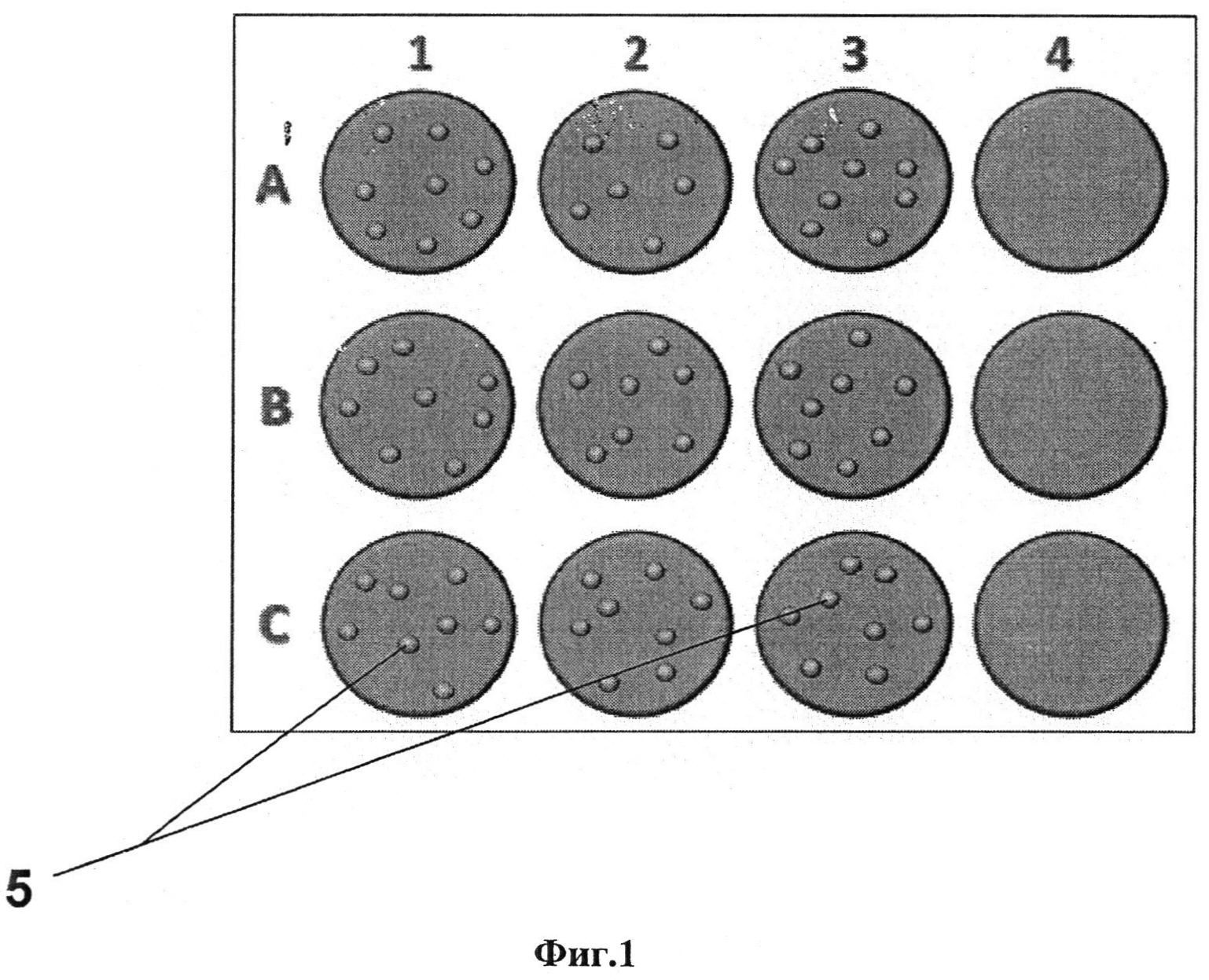
Н . В . Ковалюк , кандидат биологических наук зав. лабораторией биотехнологии СКНИИЖ, проректор Краснодарского регионального института агробизнеса
В . Ф . Сацук , кандидат сельскохозяйственных наук, директор ООО ИПСХП "Астер"
Е.В. Мачульская, младший научный сотрудник лаборатории биотехнологии СКНИИЖ
ДНК - обязательный компонент любого живого организма (исключение составляют лишь РНК- содержащие вирусы на определенных стадиях своего существования). У мыши и человека, кишечной палочки и слона ДНК устроена по одному принципу- это полимерная макромолекула, состоящая из звеньев - нук-леотидов. Нуклеотиды бывают 4 видов: А, Т, G и С. У всех живых существ A,T,G,C - нуклеотиды встречаются в составе ДНК, но в различных комбинациях. Чем ближе друг к другу виды расположены на эволюционной лестни-це, тем сильнее похожи их последовательности ДНК, в то же время даже у представителей одной семьи можно найти такие участки ДНК, которые будут строго индивидуальны.
Использование этого биологического свойства легло в основу метода полиме-разной цепной реакции (ПЦР), который по оценке американского журнала "Science" является самым выдающимся открытием последних лет.
Полимеразная цепная реакция (ПЦР)_это метод копирования участка ДНК, с помощью которого в течение нескольких часов можно выделить и размножить определенную индивидуальную последовательность ДНК в количестве, превышающем исходное в 10 миллионов раз. Некоторые области применения ПЦР _ выявление вирусных и бактериальных патогенов и высокоэффективный анализ вариаций нуклеотидных последовательностей (В. И. Глазко и др., 2000; Р. А. Волкова и др., 2000; А. А. Приймак, 1995).
Лейкоз крупного рогатого скота - хроническая инфекционная болезнь с длительным латентным периодом, поражающая органы кроветворной системы (А.П. Кузнецова, В.П. Смирнов 1998).
Вирус лейкоза крупного рогатого скота (ВЛКРС) является этиологическим фактором (первопричиной) лейкоза у коров, телят, реже у других животных: овец, коз и кроликов (Л. Б. Прохватилова и др., 2001; Н. В. Замараева, М. И. Гулюкин, Н. Н. Снежков, 1996; C.Olson et al., 1981). Имеются данные об экспериментальном заражении обезьян (Н. М. McClure, М.Е. Killing, P.Ph. Custer, 1974). Передача ВЛКРС восприимчивому крупному рогатому, скоту может осуществляться со всеми секретами и экскретами при попадании в них лимфоцитов, зараженных ВЛКРС. Установлено, что для экспериментального заражения телят достаточно ввести им внутрикожно 2500 лимфоцитов крови от зараженного животного (такое количество лимфоцитов содержится примерно в 0,0005 мл цельной крови). Среди основных факторов, обуславливающих передачу вируса лейкоза, наибольшее значение имеет перенос возбудителя через кровь и препаратов из нее, при ветеринарных и зоотехнических обработках, т.е. ятрогенный способ передачи инфекции (В. М. Авилов, В. М. Нахмансон, 1995).
В сперме инфицированных быков-производителей ВЛКРС не выявлен. Не наблюдается определенного влияния передачи ВЛКРС потомству от серопозитивных бы ков-производителей при естественном оплодотворении серонегативных коров. Однако у быков с воспалением генитальных органов в сперме могут быть л и м фо циты ,инфици ро ванные ВЛКРС.Э к-спериментальноустановлено, что коров можно инфицировать путем нанесения таких лимфоцитов на слизистую оболочку матки. Изучение возможности передачи вируса лейкоза при эмбриопересадках подтвердили отсутствие передачи ВЛКРС от коров доноров коровам-реципиентам через эмбрионы (Апалькин В.А., Гулюкин М.И., Петров Н.И., 2005).
Вирус лейкоза крупного рогатого скота относится к семейству ретро вирусов (в это же семейство входят родственные ВЛКРС вирусы Т -клеточного лимфолейкоза и ВИЧ). Ретрови-русным инфекциям свойственен ряд общих признаков: длительность инкубационного периода, хроническое или латентное течение, пожизненное вирусоносительство и строго ограниченный круг восприимчивых животных (Б. Г. Орлянкин, 1996; П. Н. Смирнов, В. В. Храмцов, В. В. Смирнова, 2000).
Ретровирусы проникают в клетку, РНК освобождается и превращается в двухцепочеч-ную ДНК - копию, которая встраивается как провирус в ДНК клетки хозяина (Б. Г. Орлянкин, 1996). Встроенный в геном хозяина провирус остается не доступным для воздействия специфических антител и в организме на протяжении всей жизни животного.
В благоприятных условиях встроенный провирус формирует новые вирионы; которые отпочковываются от клеточной мембраны для инфицирования новых клеток.
Для диагностики лейкоза применяют клинический, патологоанатомический, гистологический, гематологический, серологический и молекулярно - биологический методы.
Всё разнообразие клинических признаков лейкоза можно подразделить на специфические и неспецифические. Большинство исследователей указывают на первичное появление неспецифических признаков, а затем появляются специфические, по которым можно поставить диагноз (Н. В. Румянцева, Т.М. Шатерникова, 1963; Г.А. Симонян, 1963; Э.М. Ным и др., 1970). По мере развития заболевания у отдельных животных развивается понижение реактивности, вялость. Сравнительно рано у больных лейкозом животных регистрируют нарушение сердечно - сосудистой деятельности (глухие тоны сердца, иногда их раздвоенность), пульс слабого наполнения, возможна аритмия. К числу неспецифических признаков лейкоза относятся нерегулярная жвачка, поносы,'запоры.
Специфические клинические признаки характеризуются прогрессирующим увеличением поверхностных (околоушных, подчелюстных, предл о паточных, коленной складки, надвыменных), а также внутренних лимфатических узлов, экзофтальмии.(В. М. Лемеш и соавт., 1987). .
Гематологический метод позволят диагностировать лейкоз на более ранних стадиях развития заболевания. Сущность его заключается в обнаружении в периферической крови повышенного числа лейкоцитов (в основном лимфоидного ряда), слабо дифференцированных клеток, а также полиморфных, атипичных клеток кроветворных органов (Б.Г. Панков,1980; М. И. Гулюкин и др., 1996). Для оценки результатов исследований в различных странах предложено несколько вариантов "лейкозных ключей". В нашей стране в 1965 году был разработан отечественный "лейкозный ключ". Все димфоидные диагностические "ключи" основаны на количественных показателях.
Заражение животных ВЛКРС сопровождается выработкой антител к структурным белкам вируса. Антитела и вирус циркулируют в организме у зараженных животных на протяжении всей жизни. Это позволяет применять серологические методы для диагностики инфекции, вызываемой этим вирусом (Т.С. К'ос-тенко и др., 1989; А.Г. Берзяк, B.C. Ковалючко, В;С. Гротевич, Л.И. Киричук, 1990).
Разработанная и широко применяемая в ветеринарных лабораториях страны реакция иммунодиффузии в геле агара ( РИД ) с использованием антигена ВЛ в настоящее время остается основным диагностическим методом , по результатом которого проводят оздоровительные и профилактические мероприятия в неблагополучных по лейкозу хозяйствах . В действующих в настоящее время "Правилах по профилактике и борьбе с лейкозом КРС" приоритет отдается именно серологическим исследованиям сыворотки крови . По их результатам судят об инфици - рованности животных вирусом лейкоза . В зависимости от этого определяют мероприятия по оздоровлению .
Однако, как и любой диагностический метод, РИД не лишен недостатков.
Так, наличие у лейкоза латентной стадии, когда в крови отсутствуют антитела к вирусу) усложняет диагностику заболевания. Экспериментально установлено, что после заражения скрытый период инфекции (период от момента заражения до появления антител к вирусным антигенам) продолжается от 2 недель до нескольких месяцев, по этому, постепенно выводя из стада РИД
позитивных животных, теоретически возможно добиваться полного оздоровления хозяйства от лейкоза (A. Burny, Bruck С, Cleuter Y., 1985). Тем не менее, в оздоровленных стадах, не имевших контактов с другими, через несколько месяцев или даже лет выделяют животных с антителами к ВЛКРС (В. М. Нахмансон, 1986) . Это можно объяснить характерным для лейкоза явлением иммунологической толерантности, когда наблюдают вирусоносительство без ан-тителообразовани'я. Иммунологическая толерантность
это частичная или полная утрата способности организма вступать в иммунную реакцию со специфическими антигеном. При лейкозе КРС состояние толерантности может развиваться в случае внутриутробного заражения плода инфицированными лимфоцитами матери в период до проявления иммунной компетенции, то есть, в первые 3 месяца развития эмбриона; у отдельных животных, например, у глубоко стельных коров, когда иммуноглобулины накапливаются в секрете молочной железы и т. д. Кроме того, бывают случаи серонегативности при наличии сопутствующих инфекций, например, вирусной диареи (В. А. Белявская и др., 2003).
Метод не прямого иммуноферментного анализа (ИфА), основанный на применении антивидового конъюгата с использованием ферментов-маркеров, обладает значительно большей чувствительностью, по сравнению с РИД, позволяет автоматизировать процесс, то есть уйти от субъективной оценки результатов реакции. Кроме того, с помощью ИФА можно обнаружить антитела к ВЛКРС в молоке и моче (Н.Т. Джапаралиев, Л.Б. Прохва-тилова, А.И. Ломакин, П.К.Аянот,2000; К.Т. Carli, et al.1993; K.T.Carli , Sen А., Н. Batmaz, E.Kennerman,1999). Несмотря на очевидные достоинства, достоверность ИФА все же связана с иммунологическими реакциями, и поэтому не всегда адекватна.
В связи с изложенным выше , с целью ускорения полного оздоровления стад КРС от лейкоза , целесообразно совместно с РИД и не прямым ИФА использовать методы , выявляющие непосредственно вирус или провирус у инфицированных животных .
Перспективной в этом плане является по-лимеразная цепная реакция (ПЦР) (Мальцева Н.А. и др., 2004). Этот метод позволяет выявлять провирусную ДНК или вирусную РНК в образце крови животного. Анализ литературных данных,позволяет расположить методы-диагностики лейкоза в порядке возрастания чувствительности, точности и специфичности в следующий ряд: РИД Таким образом, возможны, по крайней мере, три области успешного применения метода ПЦР в диагностике лейкоза: выявление носителей провируснои ДНК среди РИД и ИфА-отрицательных животных, исследование вновь завозимых в хозяйство животных и выявление зараженных телят в раннем возрасте.
В лаборатории биотехнологии СКНИИЖ с использованием метода ПЦР исследовано 1013 образцов крови на наличие провируснои ДНК ВЛКРС. В таблице 1 приведены данные по инфицированности животных различных хозяйств ВЛКРС.
Анализируя полученные результаты, хотелось бы отметить следующее. Животные лишь одного из хозяйств (СЗАО СКВО) оказались полностью свободны от носи-тельства провируснои ДНК ЛКРС. Телки голштинской черно-пестрой породы в это хозяйство были завезены из Голландии и не имели контактов с местными животными. Среди других импортных животных (ОАО "Племзавод "Кубань" п=354, завезены из Венгрии) методом РИД не были выявлены положительно реагирующие, а с помощью ПЦР удалось обнаружить 1 носителя провируснои ДНК ЛКРС. Более того, провирусную ДНК выявили и в пробе крови теленка, полученного от ПЦР - позитивного животного. Носители провируса были удалены из стада. В хозяйстве ООО "Животноводческий комплекс "Ольгинский" из 97 проанализированных образцов 67 были получены от РИД - отрицательных животных. 15 из них оказались ПЦР _ положительными.
Анализируя данные по носительству про-вируса, установили, что процент инфицированных телят к 3-4 месяцам (на основании ПЦР - исследований) практически соответствует проценту РИД - позитивных животных того же хозяйства, но в более позднем воз-
расте (к 3 годам). Это, вероятнее всего, свидетельствует о том, что заражение животных происходит в ранние сроки жизни (транспла-центарно и до 3 мес), а первые иммунологические признаки болезни появляются у большинства животных после первой лактации. •
Следовательно, если проводить разделение телочек методом ПЦР на носителей провируса и здоровых в первые 2-3 недели жизни животного, можно оздоравли-вать хозяйства значительно быстрее.
Читайте также:


