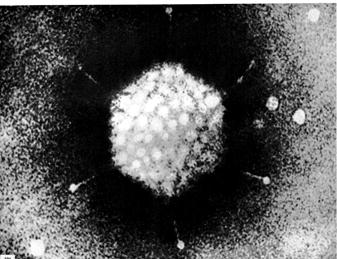
Размеры вирусов можно определить
Вирусы — это мельчайшие живые организмы, размеры которых варьируют в пределах от 20 до 300 нм; в среднем они раз в пятьдесят меньше бактерий. Их нельзя увидеть с помощью светового микроскопа, и они проходят через фильтры, не пропускающие бактерий.
Исследователи часто задаются вопросом, живые ли вирусы? Если считать живой любую структуру, обладающую генетическим материалом (ДНК или РНК) и способную к самовоспроизведению, то ответ должен быть утвердительным: да, вирусы — живые. Если же признаком живого считать наличие клеточного строения, то ответ будет отрицательным: вирусы не живые. К этому следует добавить, что вне клетки-хозяина вирусы неспособны к самовоспроизведению.
Вне клетки вирусы находятся в совершенно инертном состоянии, однако они обладают набором инструкций (генетическим кодом), необходимых для того, чтобы вновь проникнуть в клетку и, подчинив ее своим инструкциям, заставить производить много идентичных себе (вирусу) копий. Следовательно, логично предположить, что в процессе эволюции вирусы появились позже клеток.
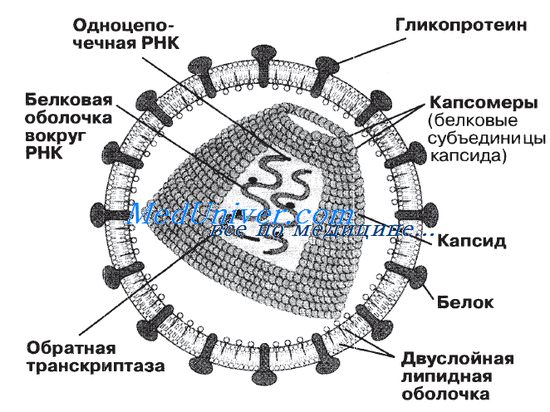
Строение вирусов очень простое. Они состоят из следующих структур:
1) сердцевины — генетического материала, представленного либо ДНК, либо РНК; ДНК или РНК может быть одноцепочечной или двухцепочечной;
2) капеида — защитной белковой оболочки, окружающей сердцевину;
3) нуклеокапсида — сложной структуры, образованной сердцевиной и капсидом;
4) оболочки — у некоторых вирусов, таких как ВИЧ и вирусы гриппа, имеется дополнительный липопротеиновый слой, происходящий из плазматической мембраны клетки-хозяина;
5) капсомеров — идентичных повторяющихся субъединиц, из которых часто бывают построены капсиды.
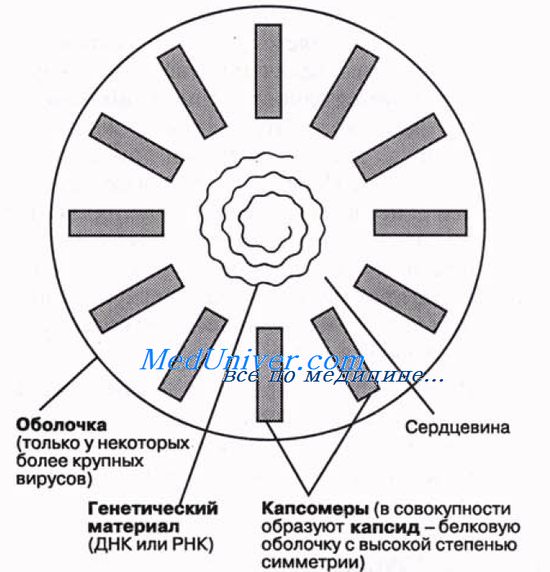
Общая форма капсида отличается высокой степенью симметрии, обусловливая способность вирусов к кристаллизации. Это дает возможность исследовать их как методом рентгеновской кристаллографии, так и с помощью электронной микроскопии. Как только в клетке-хозяине образуются субъединицы вируса, они сразу же могут путем самосборки объединиться в полную вирусную частицу. Упрощенная схема строения вируса показана на рисунке.
Для структуры капсида вируса характерны определенные типы симметрии, особенно полиэдрическая и спиральная. Полиэдр — это многогранник. Наиболее распространенная полиэдрическая форма у вирусов — икосаэдр, у которого имеется 20 треугольных граней, 12 углов и 30 ребер. На рисунке, А мы видим правильный икосаэдр, а на рисунке, Б — вирус герпеса, в частице которого 162 капсомера организованы в икосаэдр.
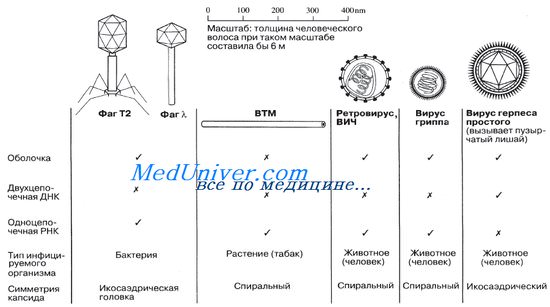
Наглядной иллюстрацией спиральной симметрии может служить показанный на рисунке, РНК-содержащий вирус табачной мозаики (ВТМ). Капсид этого вируса образован 2130 идентичными белковыми капсомерами.
ВТМ был первым вирусом, выделенным в чистом виде. При заражении этим вирусом на листьях больного растения появляются желтые крапинки — так называемая мозаика листьев (рис. 2.18, В). Вирусы распространяются очень быстро либо механически, когда больные растения или его части приходят в соприкосновение со здоровыми растениям, либо воздушным путем с дымом от сигарет, для изготовления которых были использованы зараженные листья.
Вирусы, атакующие бактерий, образуют группу, называемую бактериофагами или просто фагами. У некоторых бактериофагов имеются четко выраженная икосаэдрическая головка и хвост, обладающий спиральной симметрией). На рисунке приводятся схематические изображения некоторых вирусов, иллюстрирующие их относительные размеры и общее строение.

Вирусы — это микроскопические патогены, заражающие клетки живых организмов для самовоспроизводства. Они состоят из одного вида нуклеиновой кислоты (или ДНК или РНК, но не обе вместе), которая защищена оболочкой, содержащей белки, липиды, углеводы или их комбинацию. Размер типичного вируса варьируется от 15 до 350 нм, поэтому его можно увидеть только с помощью электронного микроскопа.
В 1892 году русский ученый Д.И. Ивановский впервые доказал существование ранее неизвестного типа возбудителя болезней, это был вирус мозаичной болезни табака. А в 1898 году Фридрих Лоффлер и Пол Фрош нашли доказательства того, что причиной ящура у домашнего скота была инфекционная частица, которая меньше, чем любая бактерия. Это были первые шаги к изучению природы вирусов, генетических образований, которые лежат где-то в серой зоне между живыми и неживыми состояниями материи. На текущий момент описано около 6 тыс. вирусов, но их существует несколько миллионов.
Строение вирусов
Вне клеток-хозяев вирусы существуют в виде белковой оболочки (капсида), иногда заключенного в белково-липидную мембрану. Капсид обволакивает собой либо ДНК, либо РНК, которая кодирует элементы вируса. Находясь в такой форме вне клетки, вирус метаболически инертен и называется вирионом.
Простая структура, отсутствие органелл и собственного метаболизма позволяет некоторым вирусам кристаллизоваться, т.е. они могут вести себя подобно химическим веществам. С появлением электронных микроскопов было установлено, что их кристаллы состоят из тесно прижатых друг к другу нескольких сотен миллиардов частиц. В одном кристалле вируса полиомиелита столько частиц, что ими можно заразить не по одному разу всех жителей Земли.
Формы вирусов
Вирусы встречаются в трех основных формах. Они бывают:
- Сферическими (кубическими или полигидральными). Вирусы герпеса, типулы, полиомы и т.д.
- Спиральными (цилиндрическими или стержнеобразными). Вирусы табачной мозаики, гриппа, эпидемического паротита и др.
- Сложными. Например, бактериофаги.
Проникновение вирусов в клетку-хозяина
Капсид в основном защищает нуклеиновую кислоту от действия клеточного нуклеазного фермента. Но некоторые белки капсида способствуют связыванию вируса с поверхностью клеток-хозяев, и работают, как ключики, вставляемые в нужные замочки. Другие поверхностные белки действуют как ферменты, они растворяют поверхностный слой клетки-хозяина и таким образом помогают проникновению нуклеиновой кислоты вируса в клетку-хозяина.
Жизненный цикл вирусов сильно отличается у разных видов, но существует шесть основных этапов жизненного цикла вирусов:
Присоединение к клетке-хозяину представляет собой специфическое связывание между вирусными капсидными белками и рецепторами на клеточной поверхности. Эта специфика определяет хозяина вируса.
Проникновение следует за прикреплением: вирионы проникают в клетку-хозяина через рецептор-опосредованный эндоцитоз или слияние мембран. Это часто называют вирусной записью.
Проникновение вирусов в клетку достигается за счет:
Размножение вирусов
После того, как вирусный геном освобождается от капсида, начинается его транскрипция или трансляция. Именно эта стадия вирусной репликации сильно различается между ДНК- и РНК-вирусами и вирусами с противоположной полярностью нуклеиновой кислоты. Этот процесс завершается синтезом новых вирусных белков и генома (точных копий внедрённых).
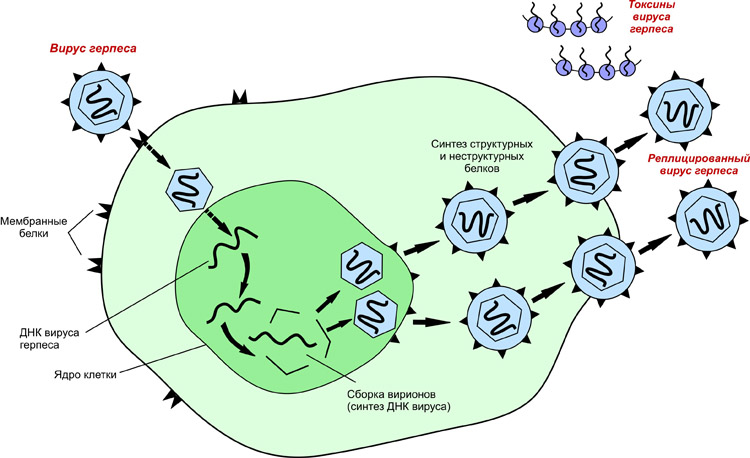
Механизм репликации зависит от вирусного генома.
- ДНК-вирусы обычно используют белки и ферменты клетки-хозяина для получения дополнительной ДНК, она транскрибируется в РНК-мессенджер (мРНК), которая затем используется для управления синтезом белка.
- РНК-вирусы обычно используют ядро РНК в качестве матрицы для синтеза вирусной геномной РНК и мРНК. Вирусная мРНК направляет клетку-хозяина на синтез вирусных ферментов и капсидных белков и сборку новых вирионов. Конечно, есть исключения из этого шаблона. Если клетка-хозяин не обеспечивает ферменты, необходимые для репликации вируса, вирусные гены предоставляют информацию для прямого синтеза отсутствующих белков.
Чтобы преобразовать РНК в ДНК, вирусы должны содержать гены, которые кодируют вирус-специфический фермент обратной транскриптазы. Она транскрибирует матрицу РНК в ДНК. Обратная транскрипция никогда не происходит в неинфицированных клетках. Необходимый фермент, обратная транскриптаза, происходит только от экспрессии вирусных генов в инфицированных клетках.
Вироиды
Вироиды заражают только растения. Одни вызывают экономически важные заболевания сельскохозяйственных культур, в то время как другие являются доброкачественными. Двумя примерами экономически важных вироидов являются кокосный cadang-cadang (он вызывает массовую гибель кокосовых пальм) и вироид рубцовой кожицы яблок, который безнадежно портит товарный вид яблок.
30 известных вироидов были классифицированы в две семьи.
- Члены семейства Pospiviroidae, названные по имени вироида клубневого веретена картофеля, имеют палочковидную вторичную структуру с небольшими одноцепочечными областями, имеет центральную консервативную область, и реплицируются в ядре клетки.
- Avsunviroidae, названный в честь вироида авокадо, имеет как палочковидную, так и разветвленную области, но не имеет центральной консервативной области и реплицируется в хлоропластах растительной клетки.
В отличие от вирусов, которые являются паразитами механизма трансляции хозяина, вироиды являются паразитами клеточных транскрипционных белков.
Бактериофаги

Существуют тысячи разновидностей фагов, каждый из которых может заразить только один тип или несколько близких типов бактерий или архей. Фаги классифицируются по ряду семейств вирусов; например:
Как и все вирусы, фаги являются простыми организмами, которые состоят из ядра генетического материала (нуклеиновой кислоты), окруженного капсидом белка. Нуклеиновая кислота может представлять собой либо ДНК, либо РНК, и может быть двухцепочечной или одноцепочечной.
Существует три основных структурных формы фага:
- Икосаэдрическая (20-сторонняя) головка с хвостом
- Икосаэдрическая головка без хвоста
- Нитевидная форма
Во время заражения фаг прикрепляется к бактерии и вставляет в нее свой генетический материал. После этого фаг обычно следует одному из двух жизненных циклов: литическому (вирулентному) или лизогенному (умеренному).
Литические, или вирулентные, фаги захватывают механизм клетки, чтобы скопировать компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые частицы фага.
Лизогенные, или умеренные, фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги могут индуцироваться в соответствии с литическим циклом.
Существуют и другие жизненные циклы, в т.ч. псевдолизогенез и хроническая инфекция. При псевдолизогении бактериофаг проникает в клетку, но не использует механизм репликации клеток и не интегрируется в геном хозяина, просто как бы прячется внутри бактерии, не нанося ей никакого вреда. Псевдолизогенез возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.
При хронической инфекции новые фаговые частицы образуются непрерывно и длительно, но без явного уничтожения клеток.
Вскоре после открытия фаги начали использовать для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Но фаговая терапия тогда не была успешной, и после открытия антибиотиков в 1940-х годах она была практически заброшена. Однако с появлением устойчивых к антибиотикам бактерий терапевтическому потенциалу фагов уделяется все больше внимания.
Наше время с антибиотиками заканчивается. В 2016 году женщина в штате Невада умерла от бактериальной инфекции, вызванной Klebsiella pneumoniae, которая была устойчивой ко всем известным антибиотикам. Бактерии, устойчивые к колистину, антибиотику последней инстанции, были обнаружены на свинофермах в Китае. В настоящее время бактерии приспосабливаются к антибиотикам быстрее, чем когда-либо.
Покажите ножницы которыми вирусы разрезают молекулу РНК что бы встроиться для мутации.Может что нибудь придумаете другое.К примеру деление цепочка аминокислот получив энергию из вне как одноименные заряды распадается на две. К каждой соединятся только те какие были ранее (другие проскочат мимо),казалось бы копии,но внутренняя энергия разная(уменьшается увеличивается) поэтому распад и создание. Вся химия углерода на этом построена 1000 орган соединений создает у других хим элементов этого свойства нет. Иммунная система делает накладку(интерференция)с помощью энергии интерферонов пытаясь разрушить цепочку РНК вируса.Надо помочь организму но не вакциной(вирус быстро мутирует)
Вирус – неклеточная форма жизни, обладающая геномом (РНК или ДНК), но лишенная собственного синтезирующего аппарата и, поэтому, способная к воспроизведению лишь в клетках более высокоорганизованных существ.
По химическому составу и потенциальной патогенности вирусы называют инфекционными нуклеопротеидами. Для вирусов характерны две формы существования: внеклеточная (покоящаяся) и внутриклеточная (репродуцирующаяся, вегетативная). Внеклеточная форма называется вирусной частицей или вирионом. Вирионы состоят из нуклеиновой кислоты, окруженной снаружи белковой оболочкой – капсидом (от лат. сapsa – футляр). Капсид вместе с заключенной в нем нуклеиновой кислотой называют нуклеокапсидом. Морфологическими субъединицами капсида, видимыми в электронный микроскоп, являются капсомеры – белковые субъединицы, состоящие из одной или нескольких молекул белка. Существуют три типа строения капсидов, основанных на расположении морфологических субъединиц (рис. 53):
1. вирионы со спиральной симметрией;
2. вирионы с кубической (икосаэдрической) симметрией;
3. вирионы, имеющие смешанный тип симметрии.
У первого типа капсомеры расположены в виде спирали, нуклеиновая кислота (преимущественно РНК) также скручена в виде пружины, располагаясь между витками белковых молекул. У вирусов с кубической симметрией капсомеры расположены в виде правильного икосаэдра со скрученной в клубок нитью ДНК или РНК. Икосаэдр имеет 20 граней (каждая представляет равносторонний треугольник), 12 вершин. Общее количество капсомеров (N) можно определить по формуле:
n – число капсомеров на одной стороне каждого равностороннего треугольника, которое у различных вирусов варьирует от 2 до 6. Так, аденовирус содержит 252, вирус герпеса – 162 капсомера.
К третьему типу относится вирус осповакцины. Вирус имеет внешнюю оболочку, состоящую из трех слоев, под оболочкой расположены два белковых тела, в центре вириона находится нуклеоид, в состав которого входит ДНК и внутренний белок.
Просто устроенные вирусы, такие как пикорна-, парвовирусы состоят из нуклеокапсида, сложноустроенные вирусы имеют еще дополнительную внешнюю оболочку – суперкапсид или пеплос (производное мембранных структур клетки-хозяина). Форма таких вирионов приближается к сферической. Суперкапсидные белки формируют морфологические субъединицы (пепломеры), которые в электронном микроскопе выглядят в виде шипов (тогавирус, коронавирус, ортомиксовирус и др.). Капсид и суперкапсид защищают вирионы от воздействий окружающей среды, обусловливают избирательное взаимодействие (адсорбцию) с определенными клетками, а также антигенные и иммуногенные свойства вирионов (рис. 53). Размеры вириона колеблются от 20–30 нм (пикорна-, парвовирусы) до 150–250 нм (герпес-, рабдовирусы) и даже 350–400 нм (поксвирусы).
Кроме обычных вирусов, известны и, так называемые, неканонические вирусы: прионы и вироиды. Прионы – это белковые инфекционные частицы, имеющие вид фибрилл размером 10-20х200 нм, они вызывают у животных и человека энцефалопатии в условиях медленной вирусной инфекции (болезнь Крейтцфельда –Якобы, куру и др.). Вироиды – это небольшие молекулы кольцевой, суперспирализованной РНК, не содержащие белка и вызывающие заболевание растений.
Методы исследования вирусов. Для характеристики вирусных частиц широко применяют физические и физико-химические методы. Пользуясь ими, можно определить размер, форму, коэффициент седиментации, коэффициент диффузии, плотность и молекулярный вес как самой вирусной частицы, так и ее компонентов.
Рис. 53. Строение и основные типы симметрии вирусов. А – безоболочечный вирус с икасаэдрическим типом симметрии; Б – оболочечный вирус с икасаэдрическим типом симметрии; В – безоболочечный вирус со спиральным типом симметрии; Г – оболочечный вирус со спиральным типом симметрии. (Медицинская микробиология Под редакцией Покровского В.И. и Поздеева О.К., М., 1998.)
Для определения размеров вирусных частиц используют: фильтрование вируссодержащего материала через мембраны, ультрацентрифугирование, электрофорез, электронную микроскопию.
Фильтрование через коллодиевые мембраны. Метод основан на пропускании вируссодержащего материала через мембраны с известным размером пор. Размер вирусной частицы в данном случае определяется весьма приблизительно.
Осаждение при ультрацентрифугировании. Многие способы определения размеров вирионов основаны на анализе скорости их движения в суспендирующей жидкости. Частицы, взвешенные в жидкости, оседают с разной скоростью, благодаря чему компоненты взвеси можно быстро разделить центрифугированием. Скорость осаждения частицы прямо пропорциональна разности плотности частиц и жидкости, квадрату угловой скорости и квадрату радиуса окружности и обратно пропорциональна вязкости жидкости. Скорость осаждения зависит от формы оседающих частиц. Сферическая частица радиуса r, находящаяся в жидкости с плотностью d0, будет седиментировать в гравитационном поле или поле центробежных сил, если плотность частицы d больше, чем d0.
r – радиус частицы, v – скорость осаждения частицы, ŋ – вязкость среды, с – центробежное ускорение, d – плотность частицы, d0 – плотность жидкости. Это равенство вытекает из формулы Стокса и описывает движение сферических частиц в жидкости при идеальных условиях. Величина S=v/s называется константой седиментации и характеризует поведение данной частицы в данной среде при данной температуре. Константа седиментации выражается в единицах Сведберга, одна единица Сведберга соответствует скорости седиментации в воде при 20 0 С под действием единицы центробежной силы. Так как центробежная сила, плотность среды и ее вязкость могут быть измерены, то можно определить радиус и массу сферической частицы при условии, если мы сможем измерить ее плотность и скорость осаждения в центрифуге. Вирусы хорошо седиментируют в скоростных ультрацентрифугах (60000 об/мин и выше). Используя аналитические роторы, в которых луч видимого или ультрафиолетового света проходит через центрифужные ячейки с прозрачными стенками, можно проводить измерения при движении центрифуги. При седиментации однородной популяции светопоглощающих частиц (вирионов) образуется резкая подвижная граница, положение которой определяют либо непосредственно путем измерения поглощения света, либо по положению области, где показатель преломления жидкости резко изменяется.
Прямое исследование в электронном микроскопе. Электронная микроскопия – наиболее широко применяемый метод определения размеров вирусных частиц. Для этого увеличение на электронных микрофотографиях должно быть откалибровано с использованием внутреннего маркера. С этой целью можно использовать частицы вируса табачной мозаики, имеющие среднюю длину 300 нм и шаг спирали 2,3 нм; сывороточный альбумин – 5 нм; глобулин – 7 нм; гемоцианин – 23 нм. Метод исключительно быстр, прост и позволяет судить не только о размере вирионов, но отчасти об их форме и характере симметрии.
Методы изучения морфологии вирусных частиц. Детали структуры вируса можно различить только в электронном микроскопе (рис. 54). Широко используется метод негативного контрастирования. Он сводится к смешиванию суспензий вирусных частиц с раствором соли тяжелого металла, нанесению тонкого слоя полученной суспензии на сетку из вольфрамовой пленки и высушиванию полученного препарата. Соль образует плотный слой, на фоне которого материал выглядит сравнительно прозрачным. Обычно соль проникает в различные компоненты вирусной частицы неодинаково, благодаря чему возникает достаточный контраст, способствующий выявлению тончайших деталей структуры вирусной частицы.К числу соединений, наиболее широко применяемых для негативного контрастирования, относятся уксуснокислый и муравьинокислый уранил, кремневольфрамовокислый натрий и молибдат аммония, натриевая или калиевая соль фосфорновольфрамовой кислоты (ФВК).
|
|
Рис. 54. Вид аденовируса (А) при электронной микроскопии (ув. 600000 раз) и его модель (Б). (Авакян А.А., Быковский А.Ф., М .,Атлас анатомии и онтогенеза вирусов человека и животных, 1970).
Важные сведения о структуре и морфогенезе вирусов дает также метод тонких срезов, используемый для изучения препаратов вирусов, находящихся в осадке. Для того чтобы установить локализацию специфических белков в вирусной частице используют вспомогательные методы, например радиоавтографию, обработку тонких срезов мечеными антителами.
В ряде случаев используется действие на вирионы поверхностно-активных веществ. При этом оценивают формы, оставшиеся после обработки и делаются выводы о том, какие компоненты из структуры были удалены.
Для изучения вирусных нуклеиновых кислот используют методы гибридизации нуклеиновых кислот.
Изучение физико-химических свойств вирусов
Электрофорез. Электрофоретические методы позволяют определить специфическую физическую характеристику вирусной частицы – относительную электрофоретическую подвижность под влиянием электрического поля. В противоположность коэффициентам седиментации и диффузии эта величина практически не зависит от массы частицы и основывается главным образом на суммарном заряде поверхности частицы. Расчет константы электрофоретической подвижности производится по формуле:
где χ – удельная проводимость, в Ω -1 .см -1 ; q – поперечное сечение электрофоретической колонки, в см; s – путь, пройденный частицей; i – сила тока в А; t – время пробега в сек. Подвижность выражается в см 2 /вольт/сек.
Классический метод электрофореза, или метод движущейся границы Тизелиуса, широко используемый для анализа белков применяется для физико-химической характеристики вирусных частиц – определения изоэлектрической точки и электрофоретической подвижности.
Фронтальный электрофорез – единственный метод, позволяющий определить электрофоретическую подвижность и изоэлектрическую точку с очень высокой точностью. Кроме того, этот метод широко используется при исследовании гомогенности и степени чистоты вирусных препаратов.
Еще более разрешающий метод – метод зонального электрофореза в градиенте плотности и в гелях. Его используют не только для изучения специфической электрофоретической подвижности вирусов, их дифференцировки и идентификации, но и для выделения генетически однородных штаммов и изучении изменчивости микроорганизмов.
Методы фракционирования вирусов. Эти методы позволяют проводить дезинтегрирование вирусных частиц на отдельные компоненты и их фракционирование. Выделенные компоненты в дальнейшем можно подвергнуть биохимическому анализу с целью изучения их тонкой структуры и свойств. Фракционирование компонентов вирусной частицы осуществляется при помощи центрифугирования в зональном и равновесном градиентах плотности, зонального электрофореза и хроматографии.
Хроматография. Для очистки и фракционирования вирусов применяют три типа хроматографии: адсорбционную, ионообменную и молекулярно-ситовую.
Метод адсорбционной хроматографии основан на различной степени адсорбции компонентов смеси при фильтровании через неподвижный твердый адсорбент. Решающее значение имеют поверхностные свойства вирусной частицы и адсорбента, а также состав буфера, в котором суспендирован вирус. При элюировании соответствующим буфером вирусные частицы можно отделить от примесей. В качестве адсорбентов для наполнения хроматографических колонок в вирусологической практике чаще всего используют фосфат калия и гидроксилапатит.
При ионообменной хроматографии вирусы пропускают через ионообменник. Ионообменниками называют такие соединения, которые содержат фиксированные функциональные группы и подвижные противоионы. Последние могут обратимо обмениваться с другими ионами того же заряда, не изменяя физические свойства нерастворимой матрицы. Ионообменниками могут быть органические и неорганические соединения. В качестве матрицы могут быть использованы алюмосиликаты, синтетические смолы, полисахариды, белки и целлюлоза.
(Хранение и передача генетической информации вирусами)
СОСТАВ, РАЗМЕРЫ И ФОРМА.
Если у всех организмов клеточного строения наследственное вещество — это двуцепочечные молекулы ДНК, то вирусы могут содержать не только ДНК, но и РНК, причем оба типа нуклеиновых кислот встречаются как в двуцепочечной, так и в одноцепочечной форме. Для каждого вируса характерна определенная форма нуклеиновой кислоты. Молекулы вирусных РНК и ДНК – неразветвленные (иногда кольцевые) полимеры, построенные из множества звеньев – нуклеотидов, в одной такой молекуле — от нескольких тысяч до нескольких сот тысяч нуклеотидов. Вирусные нуклеиновые кислоты представляют собой длинные нити, более гибкие в случае одноцепочечных молекул и более упругие в случае двуцепочечных.
Существует несколько основных вариантов "внешности" вирионов. Вирусы, построенные только из нуклеиновой кислоты и белка, могут походить на жесткую палочкообразную или гибкую нитевидную спираль, на шар, а также на структуру, имеющую как бы головку и хвостовой отросток. Липиды, если присутствуют, образуют внешнюю мембрану, в которую включаются и некоторые вирусные белки, и такая липопротеидная оболочка обволакивает белковую "сердцевину" с "запечатанной" в ней нуклеиновой кислотой.
Размеры вирусных частиц также существенно варьируют. Наиболее "худые" имеют диаметр около 10 нм, а их длина у самых протяженных достигает 2 мкм. Диаметр сферических вирионов колеблется от-20 до 300 нм. Самые крупные из известных вирусов — родственники вируса оспы, их вирионы могут иметь длину до 450 нм и 260 нм в ширину и толщину .
Крупнейший из когда–либо открытых вирусов был обнаружен в водонапорной башне в городе Брэдфорд в Англии. Он паразитирует в организмах амеб, но исследователи считают, что он способен также поражать людей. Размеры вируса – 400 нм, он крупнее, чем некоторые бактерии. Однако, некоторые ученые полагают, что исследователи видят не сам вирус, а какую – то бактерию, связанную с ним. Так или иначе, вирус представляет потенциальную опасность. Он уникален не только по размерам в физическом смысле, но и по своему геному, который содержит более 900 генов. Выяснилось, что у человека вырабатываются антитела на этот вирус, поэтому можно полагать, что он поражает и людей.
РАСПРОСТРАНЕНИЕ В ПРИРОДЕ.
Есть вирусы, размножающиеся в клетках животных, растениий,бактерий и грибов.
Особенности строения заражаемой клетки — один из факторов, от которых зависит форма вириона.
У некоторых вирусов "прописка" очень строгая. Например, вирус полиомиелита может жить и размножаться только в клетках (да и то не во всех) человека и приматов.
ХРАНЕНИЕ И ПЕРЕДАЧА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ.
Как известно, синтез белков осуществляется в рибосомах, а последовательность аминокислот синтезируемых белков задается молекулами матричных РНК (мРНК). При описании разнообразия способов хранения и передачи генетической информации у вирусов удобно обозначать молекулы мРНК как (+) РНК.
Есть обширная группа вирусов, генетический материал которых представляет собой мРНК. Геном таких вирусов называют положительным. Сюда, например, относят вирусы полиомиелита и клещевого энцефалита, а у растений — табачная мозаика. Попав в клетку хозяина, вирусная РНК обеспечивает синтез собственных белков. После этого начинается его размножение. На заключительной стадии из накопившихся вирусных белков и РНК монтируются вирионы.
Геном другой группы вирусов представлен молекулами не мРНК, а их комплиментарной копией, то есть молекулами (-) РНК. Среди них есть вирусы гриппа, кори, бешенства, желтой карликовости картофеля. Инфекционный процесс не может начаться с синтеза белков, записанных в зеркальной форме, т.к. рибосомы не распознают (-) РНК. Но и репликация вирусной РНК кажется невозможной, поскольку в клетке нет собственных ферментов, способных осуществить этот процесс. Вирусы с негативным РНК-геномом решают эту проблему так: они вводят в заражаемую клетку свой геном не в "голом" виде, как поступают вирусы первой группы, а в виде более сложных структур, содержащих, в частности, ДНК-зависимую РНК-полимеразу. Этот вирусный фермент, синтезированный в предыдущем цикле размножения, упакован в вирионе в удобной для доставки в клетку форме. Инфекционный процесс начинается с того, что вирусный фермент копирует вирусный геном, образуя комплиментарные молекулы РНК, то есть (+) РНК. Эти молекулы уже "находят общий язык" с рибосомами. Образуются вирусные белки, в том числе и ДНК-зависимая РНК-полимераза, которая, с одной стороны, обеспечивает размножение вирусного генома в данной клетке, а с другой — "консервируется впрок" во вновь образующихся вирионах.
Есть вирусы, которые близнецы форм с негативной РНК, в их геноме наряду с участками, соответствующими (-) РНК, есть последовательности позитивной полярности.
У третьей группы вирусов наследственная информация хранится в виде двуцепочечной (или ±) РНК. Вместе с вирусной РНК в клетку попадает и фермент ДНК-зависимая РНК-полимераза, который обеспечивает синтез молекул (+) РНК. В свою очередь, (+) РНК выполняет две работы: обеспечивает производство вирусных белков в рибосомах и служит матрицей для синтеза новых цепочек вирусной РНК-полимеразы. Цепочки (+) и (-) РНК, объединяясь друг с другом, образуют двунитевой (±) РНК - геном, который упаковывается в белковую оболочку.
Четвертая группа — вирусы с двуцепочечной ДНК. Хотя геном этих вирусов и можно условно изобразить как (±) ДНК, во многих случаях в каждой из двух цепочек ДНК имеются участки, соответствующие как позитивной, так и негативной полярности.
Следующая группа — вирусы с одноцепочечным ДНК-геномом, который может быть представлен молекулами как позитивной, так и негативной полярности. Попав в клетку, вирусный геном сначала превращается в двуцепочную форму, это превращение обеспечивает клеточная ДНК-зависимая ДНК-полимераза.
Шестая группа — ретровирусы, — включающая, в частности, такую "знаменитость", как вирус иммунодефицита человека (ВИЧ). Геном этих форм - одноцепочечная (+) РНК, но инфекционный процесс развивается по совершенно иному сценарию. В вирусном геноме закодирован необычный фермент (ревертаза), который обладает свойствами как ДНК-зависимой, так и ДНК-независимой ДНК-полимеразы. Этот фермент попадает в заражаемую клетку вместе с вирусной РНК и обеспечивает синтез ее ДНК-копии сначала в одноцепочечной форме [(-) ДНК], а затем и в двуцепочечной [(±) ДНК]. Далее события развиваются по обычному расписанию: синтез вирусных (+) РНК, синтез вирусных белков, формирование вирионов, выход из клетки.
Седьмая группа — ретроидные вирусы, из которых наиболее известен вирус гепатита В. В состав этих вирусов входит двуцепочечная ДНК, но реплицируется она иначе, чем у вирусов четвертой группы. Там вирусную ДНК копирует ДНК-зависимая ДНК-полимераза. Здесь же сначала с вирусной ДНК считывается (+) РНК, которая затем служит матрицей для синтеза двух компонентов вириона: белков и ДНК. Синтез ДНК осуществляет вирусный фермент с активностью ревертазы по схеме, которая реализуется у ретровирусов.
ТИПЫ ВЗАИМОДЕЙСТВИЯ С КЛЕТКОЙ.
В другом случае в зараженной клетке постоянно производятся новые и новые поколения вирионов, но клетка при этом не погибает.
РАСШИФРОВАН ГЕНОМ ВИРУСА АТИПИЧНОЙ ПНЕВМОНИИ.
Ученые из США и Канады заявили о полной расшифровке генома вируса, который вызывает заболевание атипичной пневмонией. Ожидается, что в результате этого открытия станет возможным проведение более точных тестов, по которым среди многих подозрений на болезнь можно будет с достоверностью выявить действительные случаи заражения. "Наличие подобной информации чрезвычайно важно для проведения более быстрых анализов и, конечно, должно помочь нам в разработке антител и вакцины", - сообщила Джули Гербердинг, директор федерального Центра по контролю и предотвращению заболеваний в американском штате Атланта.
В этом центре уже были проведены два теста на антитела к вирусу атипичной пневмонии, но они оказались недостаточно точными для повсеместного использования. "Открытие полной последовательности должно привести к более точным генетическим анализам", - отмечает Гербердинг.
Таким образом можно отметить, что и внутреннее содержание и форма, и поведение вирусов очень разнообразны и индивидуальны.
Вирусы с негативной РНК устроены намного сложнее т.к. вирион содержит не только РНК, но и ферменты, которые способны ее реплицировать. Введение в клетку не только собственной РНК, но и РНК – полимеразы обеспечивает наработку множества молекул (+) РНК (в том числе и мРНК), которые могут конкурировать с клеточным мРНК не только умением, но и числом.
Читайте также: