Размножение вирусов в культуре клеток
Культивирование вирусов человека и животных проводят с целью лабораторной диагностики вирусных инфекций, для изучения вопросов патогенеза и иммунитета, получения диагностических и вакцинных препаратов, применяют в научно-исследовательской работе. Поскольку вирусы являются абсолютными паразитами, их культивируют или на уровне организма, или на уровне живых клеток, выращиваемых вне организма в искусственных условиях. В качестве биологических моделей для культивирования используют лабораторных животных, развивающиеся куриные эмбрионы и культуры клеток. Лабораторные животные (белые мыши, хлопковые крысы, кролики, хомяки, обезьяны и др.) в начальный период развития вирусологии были единственной экспериментальной биологической моделью, которую использовали для размножения и изучения свойств вирусов. На основании развития типичных признаков заболевания и патоморфологических изменений органов животных можно судить о репродукции вирусов, т. е. проводить индикацию вирусов. В настоящее время применение этой модели для диагностики ограничено из-за невосприимчивости животных ко многим вирусам человека.
Куриные эмбрионы предложены в качестве экспериментальной модели для культивирования вирусов в середине 30-х годов Ф. Бернетом. К достоинствам модели относятся возможность накопления вирусов в больших количествах, стерильность объекта, отсутствие скрытых вирусных инфекций, простота техники работы. Для культивирования вирусов исследуемый материал вводят в различные полости и ткани куриного зародыша.
Индикацию вирусов осуществляют по характеру специфических поражений оболочек и тела эмбриона, а также феномену гемагглютинации – склеиванию эритроцитов. Явление гемагглютинации впервые было обнаружено в 1941 г. при культивировании в куриных эмбрионах вирусов гриппа. Позднее было установлено, что гемагглютинирующими свойствами обладают многие вирусы. На основе этого феномена была разработана техника реакции гемагглютинации (РГА) вне организма (in vitro), которая широко применяется для лабораторной диагностики вирусных инфекций. Куриные эмбрионы не являются универсальной биологической моделью для вирусов. Почти неограниченные возможности появились у вирусологов после открытия метода выращивания культур клеток.
Метод культур клеток – выращивание различных клеток и тканей вне организма на искусственных питательных средах -разработан в 50-х годах Дж. Эндерсом и сотр. Подавляющее большинство вирусов способно размножаться на культурах клеток. Для : приготовления культур клеток используют самые разнообразные ткани человека, животных и птиц. Большое распространение получили культуры клеток из эмбриональных и опухолевых (злокачественно перерожденных) тканей, обладающих по сравнению с нормальной тканью взрослого организма более активной способностью к росту и размножению.
В зависимости от техники приготовления и культивирования различают три основных типа культур клеток и тканей: однослойные культуры клеток; культуры суспензированных клеток; органные культуры.
Наибольшее практическое применение получили однослойные культуры, растущие на поверхности стекла лабораторной посуды в виде монослоя клеток. Однослойные культуры клеток в зависимости от числа жизнеспособных генераций в свою очередь подразделяются на первичные, или первично-трипсинизированные (способны размножаться однократно), перевиваемые,или стабильные (способны перевиваться в лабораторных условиях в течение неопределенно длительного срока), и полуперевиваемые (способны размножаться в течение 40-50 пассажей).; Культуры суспензированных клеток растут и размножаются во взвешенном состоянии при постоянном интенсивном перемешивании среды. Они могут быть использованы для накопления большого количества вирусов. Некоторые вирусы лучше размножаются в органных культурах, которые представляют собой кусочки органов животного или человека, выращиваемых вне организма и сохраняющих свойственную данному органу структуру. В зависимости от свойств вируса подбирают наиболее чувствительную к данному вирусу культуру клеток, на которой возможна его репродукция. О размножении вирусов в культуре клеток свидетельствуют I следующие признаки:
§ образование в клетках включений;
В.А. Сергеев, Е.А. Непоклонов, Т.И. Алипер, Вирусы и вирусные вакцины, 2007
Увеличение продукции вируса представляет собой большой практический интерес, особенно при массовом производстве вирусных препаратов. Изучению влияния различных факторов на репродукцию вирусов и накопление вирусных антигенов в культуре клеток посвящены многие исследования. Оказалось, что это зависит от ряда условий, оптимизация которых имеет важное технологическое значение.
Успех культивирования вирусов прежде всего зависит от удачного выбора клеточного субстрата. Основными критериями при этом являются высокий выход вируса и вирусного антигена, относительная неприхотливость к условиям культивирования и безопасность вакцины. Одни вирусы хорошо размножаются
в культурах клеток различного происхождения, другие - предпочитают клетки естественного хозяина или дифференцированные, либо требуют специфических условий культивирования (пониженную температуру, обработку трипсином, высокую или низкую множественность заражения), третьи — вообще пока не удалось размножить вне организма. При культивировании вирусов выявлен ряд особенностей, характерных для отдельных семейств и их представителей. Так, большинство пикорнавирусов, так же как и парвовирусов размножаются в культурах клеток естественного хозяина. Основная трудность в работе с ними — выбор чувствительной культуральной системы. Однако даже при оптимальном решении этой задачи, урожай различных представителей семейства пикорнавирусов различается очень сильно. Одни из них (полиовирус, вирус ящура) накапливаются в высоком титре (7,0—9,0 ТЦД50/мл), что соответствует выходу, примерно равному 10—1000 инфекционных единиц на одну клетку. В то же время другие представители семейства (риновирусы, некоторые энтеровирусы, вирус гепатита А) накапливаются в более низком титре (4,0—6,0 lg ТЦД50/мл). Вирус гепатита А хорошо размножается в культуре клеток печени обезьяны, а вирус гепатита В впервые in vitro удалось размножить в культуре клеток гепатомы человека HepG = 2. В культуральную жидкость выделялись полные частицы вируса, содержащие три оболочечных белка. Рабдовирусы обладают широким хозя- инным спектром in vitro. Вирус везикулярного стоматита, например, хорошо и быстро размножается практически во всех использованных для этой цели клеточных культурах, хотя некоторые представители этого семейства (вирус бешенства) размножаются медленно и накапливаются в меньшем титре.
Представители семейства парамиксовирусов значительно различаются между собой по широте хозяинного спектра клеточных культур. Одни из них (парамиксовирусы) обладают широким, другие (морбилливирусы) — узким хозяин- ным спектром. Респираторно-синцитиальный вирус (PC-вирус), как и другие представители семейства, размножается во многих клеточных культурах (но не в культуре куриного эмбриона), хотя накапливается в значительно более низких титрах. Например, разница в максимальном накоплении инфекционных частиц, если сравнить его с вирусом ньюкаслской болезни, достигает 5—6 lg. Вместе с тем следует отметить, что соотношение инфекционных и физических частиц у PC-вируса может достигать высоких значений (1:1000—1:10 000) [94]. Вирус диареи крупного рогатого скота обладает узким клеточным тропизмом и, так же как PC-вирус, накапливается в чувствительных культурах в невысоком титре (4,0—6,0 lg ТЦД50/мл). Первичная культура клеток почки телят оказалась более чувствительной к полевым изолятам вируса диареи, чем постоянная линия этих клеток [977]. Реовирусы размножаются в культурах клеток различного происхождения, но лучше, когда выращивание проводят при пониженной температуре (34°С). Однако представители одного рода этого семейства (ротавирусы) проявляют исключительную щепетильность в отношении клеточного субстрата. Одна из лучших культур для выделения и размножения ротавирусов — постоянная линия клеток почки эмбриона макаки резус (линия МА 104). Для аденовирусов
предпочтительным субстратом являются культуры эпителиальных клеток естественного хозяина. В эпителиоподобных клетках постоянных линий HeLa и КВ они накапливаются в более высоком титре, чем в диплоидных линиях фибробла- стоподобных клеток (WI-38 или MRC-5).
Культуры клеток беспозвоночных по сравнению с позвоночными во многих случаях оказались более продуктивными в отношении альфа- и флавивирусов.
Первичные культуры клеток, приготовленные из различных тканей одного вида животных или даже одного донора клеток, могут значительно различаться по чувствительности к данному вирусу. Большинство вирусов хорошо накапливаются в культуре клеток паренхиматозных органов, тогда как некоторые предпочитают клетки гемопоэтической системы (лимфопролиферативные вирусы, вирусы африканской чумы свиней, инфекционной анемии лошадей) или нервной ткани. Наиболее широким спектром чувствительности обладают первичные культуры, представленные преимущественно эпителиоподобными клетками. Такие культуры, как правило, получают из почечной ткани различных животных. Аденовирусы свиней серотипа 2 и 3 хорошо размножались в первичной культуре клеток почки (6,25—8,0 lg ТЦЦ50/мл), и значительно хуже в первичной культуре клеток тестикулярной ткани поросят [782]. Для вируса контагиозной эктимы овец и коз более чувствительной оказалась культура тестикулярной ткани овец и коз [1030]. Аналогичные результаты получены в опытах с вирусом вис- на-мэди. Вирус энцефаломиелита свиней размножается в культуре клеток почки свиньи с образованием синцития. В культурах клеток из других тканей свиньи вирус размножается без ЦПЭ.
Разработаны методы получения эпителиоподобных культур клеток из хорио- аллантоисной оболочки куриных эмбрионов. Они оказались более чувствительными и продуктивными для ряда вирусов, чем культуры фибробласто-подобных клеток из тканей куриного эмбриона. Например, клетки хориоаллантоисной оболочки более репродуктивны для вируса ньюкаслской болезни, чем клетки тела куриного эмбриона. Кроме того, клетки одной и той же ткани могут сильно отличаться друг от друга по репродукции вируса. Исследование репродукции вируса ньюкаслской болезни единичными клетками куриного эмбриона показало, что из числа продуцирующих вирус клеток только 20% синтезируют инфекционный вирус в большом количестве. Указанное соотношение клеток сохранялось в культуре из различных тканей эмбриона в течение трех пересевов.
В первичной культуре клеток почки эмбриона человека способностью поддерживать репродукцию цитомегаловируса человека обладают клетки, которые, вероятно, являются клетками-мишенями в организме хозяина [766]. Культуры клеток астроцитов из мозга плода человека обеспечивают размножение нейрот- ропного полиомавируса человека JCV и могут быть многократно пассированы без потери фенотипа астроцитов и снижения чувствительности к вирусу. Для реактивации вируса простого герпеса 1 (ВПГ-1) использовали эксплантаты кожи и подкожной ткани подушечек задних лап мышей, взятых через 6 мес после инфицирования. В процессе культивирования эксплантатов происходила реактива
ция вируса. Фокусы реактивации латентного вируса обнаруживали гибридизацией in situ, начиная с 5—6-го дня. По мере культивирования количество клеток и содержание в них вирусспецифических нуклеиновых кислот возрастали [504].
Культуры гепатоцитов, являясь элективным субстратом для размножения вирусов, вызывающих гепатиты, оказались чувствительными к другим вирусам. Так, в культуре клеток печени эмбриона кур хорошо размножались некоторые вирусы кур: инфекционного ларинготрахеита, бронхита, бурсита, ЕД5 и CELO. Первичные культуры гепатоцитов лесного северо-американского сурка оказались чувствительными к инфицированию вирусами гепатита сурка и суслика [221], а культуры гепатоцитов пекинских уток — к вирусу утиного гепатита В. Ге- патоциты печени сурка, полученные перфузией раствором коллагеназы, формируют монослой, сохраняющийся в течение 3 мес. [486].
Постоянные линии клеток, так же как первичные культуры, обладают различной чувствительностью к вирусам. Выбор наиболее чувствительного клеточного субстрата проводят на основе литературных данных или экспериментальным путем. Одни линии клеток являются хорошим субстратом для репродукции целого ряда вирусов. К ним прежде всего следует отнести постоянную линию клеток ВНК, высокочувствительную к таким возбудителям, как вирусы ящура, бешенства, катаральной лихорадки овец, болезни Ауески и др. Широкое применение для производственного культивирования вирусов получили постоянные линии клеток обезьян (Vero), свиней (СПЭВ, ППС, IBRS-2), крупного рогатого скота (МДВК) и других видов животных. Вирус бешенства, адаптированный к размножению в культурах клеток ВНК-21 и Vero, через 24 ч инфицировал практически все клетки, однако в продуктивную инфекцию включалось лишь около 10 % клеток обеих линий. На пятые сутки концентрация вируса достигала 7,2 lg ТЦД50/мл или ЛД59/мл (для 3—5-недельных мышей). Линия клеток легких хомяка HmLu-1 оказалась чувствительной для репликации вирусов эфемерной лихорадки, Ибараки и Акабане. Указанные вирусы размножались в этой культуре с выраженным ЦПЭ через 48—72 ч. Вирусы парагриппа человека типов 2 и 3 размножались с ЦПЭ в постоянной линии клеток почки африканской зеленой мартышки CV-1, достигая через 48—72 ч титра 7,0 lg БОЕ/мл.
Вирус гепатита В уток удалось размножить в линии клеток LMH гепатомы цыпленка. В этой линии клеток выход инфекционного вируса в 10—20 раз был выше, чем в линиях клеток гепатомы или гепатобластомы человека. Линия клеток рабдомиосаркомы человека (клон ЯД-9Н8) эффективно поддерживала размножение респираторного коронавируса человека. Из-за строгого тропизма парвовируса В19 к эритроидным клеткам-предшественникам его размножали лишь в эксплантатах костного мозга и печени плода человека. Его удалось размножить в линии клеток ИТ-7, полученной от больного мегакариоцитобласто- идной лейкемией [1410]. Высокое накопление вирулентного штамма вируса классической чумы свиней (8,0 lg ТЦЦ50/мл) наблюдали в статической культуре постоянной линии клеток почек свиньи (линия МРК). Вирус достигал высокого титра через 72 ч культивирования.
Увеличение продукции вируса представляет собой большой практический интерес, особенно при массовом производстве вирусных препаратов. Изучению влияния различных факторов на репродукцию вирусов и накопление вирусных антигенов в культуре клеток посвящены многие исследования. Оказалось, что это зависит от ряда условий, оптимизация которых имеет важное технологическое значение.
Успех культивирования вирусов прежде всего зависит от удачного выбора клеточного субстрата. Основными критериями при этом являются высокий выход вируса и вирусного антигена, относительная неприхотливость к условиям культивирования и безопасность вакцины. Одни вирусы хорошо размножаются в культурах клеток различного происхождения, другие - предпочитают клетки естественного хозяина или дифференцированные, либо требуют специфических условий культивирования (пониженную температуру, обработку трипсином, высокую или низкую множественность заражения), третьи — вообще пока не удалось размножить вне организма.
При культивировании вирусов выявлен ряд особенностей, характерных для отдельных семейств и их представителей. Так, большинство пикорнавирусов, так же как и парвовирусов размножаются в культурах клеток естественного хозяина. Основная трудность в работе с ними — выбор чувствительной культуральной системы. Однако даже при оптимальном решении этой задачи, урожай различных представителей семейства пикорнавирусов различается очень сильно. Одни из них (полиовирус, вирус ящура) накапливаются в высоком титре (7,0—9,0 ТЦД50/мл), что соответствует выходу, примерно равному 10—1000 инфекционных единиц на одну клетку.
В то же время другие представители семейства (риновирусы, некоторые энтеровирусы, вирус гепатита А) накапливаются в более низком титре (4,0—6,0 lg Т1ДД50/мл).
Вирус гепатита А хорошо размножается в культуре клеток печени обезьяны, а вирус гепатита В впервые in vitro удалось размножить в культуре клеток гепатомы человека HepG = 2. В культуральную жидкость выделялись полные частицы вируса, содержащие три оболочечных белка. Рабдовирусы обладают широким хозяинным спектром in vitro. Вирус везикулярного стоматита, например, хорошо и быстро размножается практически во всех использованных для этой цели клеточных культурах, хотя некоторые представители этого семейства (вирус бешенства) размножаются медленно и накапливаются в меньшем титре.
Представители семейства парамиксовирусов значительно различаются между собой по широте хозяинного спектра клеточных культур. Одни из них (парамиксовирусы) обладают широким, другие (морбилливирусы) — узким хозяинным спектром. Респираторно-синцитиальный вирус (PC-вирус), как и другие представители семейства, размножается во многих клеточных культурах (но не в культуре куриного эмбриона), хотя накапливается в значительно более низких титрах. Например, разница в максимальном накоплении инфекционных частиц, если сравнить его с вирусом ньюкаслской болезни, достигает 5—6 lg. Вместе с тем следует отметить, что соотношение инфекционных и физических частиц у PC-вируса может достигать высоких значений (1:1000—1:10 000).
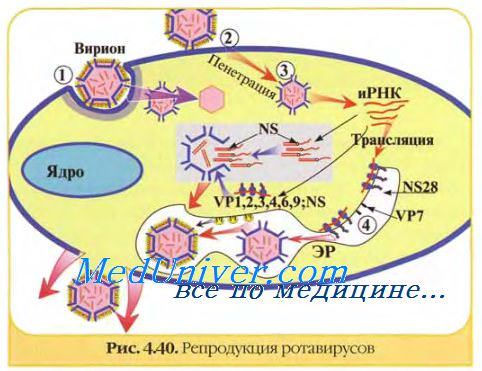
Вирус диареи крупного рогатого скота обладает узким клеточным тропизмом и, так же как PC-вирус, накапливается в чувствительных культурах в невысоком титре (4,0—6,0 lg ТЦД50/мл). Первичная культура клеток почки телят оказалась более чувствительной к полевым изолятам вируса диареи, чем постоянная линия этих клеток [977]. Реовирусы размножаются в культурах клеток различного происхождения, но лучше, когда выращивание проводят при пониженной температуре (34°С). Однако представители одного рода этого семейства (ротавирусы) проявляют исключительную щепетильность в отношении клеточного субстрата. Одна из лучших культур для выделения и размножения ротавирусов — постоянная линия клеток почки эмбриона макаки резус (линия МА 104). Для аденовирусов предпочтительным субстратом являются культуры эпителиальных клеток естественного хозяина.
В эпителиоподобных клетках постоянных линий HeLa и KB они накапливаются в более высоком титре, чем в диплоидных линиях фибробластоподобных клеток (WI-38 или MRC-5).
Культуры клеток беспозвоночных по сравнению с позвоночными во многих случаях оказались более продуктивными в отношении альфа- и флавивирусов.
Первичные культуры клеток, приготовленные из различных тканей одного вида животных или даже одного донора клеток, могут значительно различаться по чувствительности к данному вирусу. Большинство вирусов хорошо накапливаются в культуре клеток паренхиматозных органов, тогда как некоторые предпочитают клетки гемопоэтической системы (лимфопролиферативные вирусы, вирусы африканской чумы свиней, инфекционной анемии лошадей) или нервной ткани. Наиболее широким спектром чувствительности обладают первичные культуры, представленные преимущественно эпителиоподобными клетками. Такие культуры, как правило, получают из почечной ткани различных животных. Аденовирусы свиней серотипа 2 и 3 хорошо размножались в первичной культуре клеток почки (6,25—8,0 lg ТЦЦ50/МЛ), и значительно хуже в первичной культуре клеток тестикулярной ткани поросят. Для вируса контагиозной эктимы овец и коз более чувствительной оказалась культура тестикулярной ткани овец и коз.
Аналогичные результаты получены в опытах с вирусом висна-мэди. Вирус энцефаломиелита свиней размножается в культуре клеток почки свиньи с образованием синцития. В культурах клеток из других тканей свиньи вирус размножается без ЦПЭ.
Разработаны методы получения эпителиоподобных культур клеток из хориоаллантоисной оболочки куриных эмбрионов. Они оказались более чувствительными и продуктивными для ряда вирусов, чем культуры фибробласто-подобных клеток из тканей куриного эмбриона. Например, клетки хориоаллантоисной оболочки более репродуктивны для вируса ньюкаслской болезни, чем клетки тела куриного эмбриона. Кроме того, клетки одной и той же ткани могут сильно отличаться друг от друга по репродукции вируса. Исследование репродукции вируса ньюкаслской болезни единичными клетками куриного эмбриона показало, что из числа продуцирующих вирус клеток только 20% синтезируют инфекционный вирус в большом количестве. Указанное соотношение клеток сохранялось в культуре из различных тканей эмбриона в течение трех пересевов.
Культивирование вирусов - выращивание вирусов в искусственных условиях.
Гальтье впервые осуществил в 1879 г. культивирование вируса бешенства, заразив кролика мозгом больной собаки. Способность вируса вакцины (коровьей оспы) репродуцироваться в тканевой культуре была доказана Паркером и Наем в 1925 г. В 1931 г. Вудрафф и Э. Гудпасчер показали возможность культивирование вирусов на хорион-аллантоисной оболочке эмбрионов кур (вирус оспы птиц).
Методы культивирования:
• На лабораторных животных
• В куриных эмбрионах
• В тканевых культурах
Клеточная культура – система клеток, получаемая из ткани, находящаяся в виде слоя клеток, прикрепленных к стеклу, или в виде суспензии. Подразделяются на:
1) Первичные культуры – могут быть получены практически из любого органа (почки, легкие, кожа, тимус), однако даже при систематической смене питательной среды существуют лишь до первого пересева.
2) Стабильные (перевиваемые) линии – полностью адаптированные к существованию вне организма; их получают из нормальных и раковых тканей; размножаются неограниченно долгое время. Бывают 2 типов:
а) Нормальные клетки. В качестве стабильной культуры используют почки барана (ПКБ) и сердце обезьяны циномольгус (СОЦ);
б) Опухолевые клетки. В качестве опухолевых используют культуру клеток Hela - рак шейки матки, Hep-1 - эпидермоидный рак гортани, Дейтройт 6 - костный мозг больного раком легкого.
3) Диплоидные (эмбриональные) культуры – получаемые из эмбриональных тканей человека и животных, сохраняющие диплоидный набор хромосом до 50 пересевов.
Наиболее практическое применение получили однослойные культуры первично-трипсинизированных и перевиваемых линий клеток.
Приготовление первичных (трипсинизированные) культур клеток. Берется орган → разрушается межклеточная ткань и происходит разобщение клеток путём воздействия на ткань протеолитических ферментов (трипсина, панкреатина) для последующего получения монослоя клеток на стекле.
В питательной среде должен присутствовать необходимый набор из неорганических ионов, аминокислот и витаминов. Различают искусственные (полусинтетические и синтетические) и естественные питательные среды.
Естественные питательные среды - это биологические жидкости (сыворотка крови, эмбриональный экстракт, асцитическая жидкость, коровья амниотическая жидкость, тканевые экстракты и др.). Питательные среды из естественных компонентов применяют редко, только для выращивания вновь изолированных тканей в начале культивирования и для поддержания очень прихотливых тканей животных.
Полусинтетические питательные среды представляют собой естественные среды, подверженные первичной ферментативной обработке. К таким средам относят гемогидролизаты, гидролизат лактальбумина, аминопептид и др.
Лучшими средами для культивирования культуры клеток являются синтетические питательные среды: 199 (содержит 60 компонентов: 10 аминокислот, 17 витаминов, 8 минеральных солей, 10 компонентов, входящих в состав нуклеиновых кислот и др.), Игла, Хенкса, Эрла (эти среды имеют аминокислоты, витамины, глюкозу, минеральные соли). Смена питательной среды проводится через 2-3 дня.
В зависимости от назначения среды подразделяются на: ростовые и поддерживающие. Ростовые применяются в первой фазе культивирования клеток, когда необходимо стимулировать клетки на максимально ускоренный рост и размножение. Они богаты питательными веществами, что способствует активному размножению клеток. Поддерживающие применяют во второй фазе культивирования клеток после заражения культуры клеток вирусами. Они поддерживают жизнеспособность клеток.
О наличии вируса в зараженной культуре клеток можно судить по цитопатическому действию (ЦПД) – это патологические изменения морфологии клеток, вплоть до их гибели, возникающие в результате репродукции вирусов, и наблюдаемые под микроскопом. Проявления ЦПД:
1. Дегенерация клеток (наблюдаются округления, изменения формы, разрушения).
2. Появление включений (Липшются – вирус герпеса; Гварниери – вирус натуральной оспы) и телец Бабеша-Негри – вирус бешенства).
3. Разрушение пласта клеток (парамиксовирусы).
4. Образование гигантских многоядерных клеток - симпластов (вирус кори).
Основные методы индикации вирусов в культуре тканей:
а. “+” гемагглютинация. Реакция гемагглютинации – склеивание эритроцитов при добавлении вирусосодержащего материала (есть вирус – эритроциты оседают в виде “зонтика”; нет вируса – в виде “диска”).
б. “+” гемадсорбция. Реакция гемадсорбции – адсорбция эритроцитов на поверхности пораженных вирусом клеток и образуют характерные скопления (вирус гриппа вызывает агглютинацию эритроцитов островкового типа).
в. Реакция нейтрализации вирусов в культуре тканей.
г. Цветная реакция Солка - основана на изменении цвета питательной среды. В результате жизнедеятельности клетки в питательную среду выделяются продукты клеточного метаболизма и происходит сдвиг рН в кислую сторону, о чем свидетельствует изменение цвета среды из красного в желтый. Если вирус присутствует и реплицируется в культуре, то вследствие разрушающего действия вируса клетки дегенерируются (разрушаются, т.е. их нет), и подавляется их метаболизм, т.е. цвет среды неизменяется.
Существуют следующие основные методы индикации вируса в культуре клеток: по цитопатическому эффекту или цитопатическому действию (ЦПЭ, ЦПД); по положительной реакции гемадсорбции (РГАд); по образованию бляшек; по обнаружению внутриклеточных включений; по выявлению вирусов в реакции иммунофлуоресценции (РИФ); по обнаружению интерференции вирусов; по подавлению метаболизма клеток (цветная проба); электронной микроскопией и др.
ЦПД Наиболее широко и часто о размножении вируса в культуре клеток судят по цитопатическому эффекту или цитопатическому действию. ЦПД называются любые изменения клеток в культуре клеток под влиянием размножающегося в них вируса. Физиологические изменения клеток установить довольно сложно, а морфологические изменения обнаруживаются довольно легко. Для этого достаточно положить на предметный столик микроскопа пробирку или матрас слоем клеток вверх и, используя малое увеличение (объектив х8-10, окуляр х7-10), осмотреть слой. Полезно сравнить клетки, зараженные вирусом, с такими же клетками в пробирке, не подвергавшимися заражению. В этом случае практически любые наблюдаемые в микроскоп отличия зараженной культуры клеток от контрольной можно считать проявлением ЦПД. Эти отличия могут захватывать весь монослой или отмечаться только в виде небольших очажков измененных клеток в слое нормальных клеток. Интенсивность ЦПД выражается тем, какая часть клеточного монослоя изменена вирусом. Хотя общепринятой системы оценки интенсивности ЦПД нет, ее часто оценивают в крестах или баллах. Так, если изменению (по сравнению с контролем) подвергся весь монослой в пробирке или матрасе, ЦПД оценивают на четыре креста, если 3 /4 - на три, если V2 - на два креста, V4 - на один крест. Но эти оценки весьма условны.
Наиболее существенно различаются между собой три формы ЦПД: фрагментация клеток, округление клеток, симпластообразование.
Фрагментация - разрушение клеток на отдельные фрагменты, которые отделяются от стекла и переходят в культуральную жидкость в виде клеточного детрита (вирус везикулярного стоматита).
Округление - потеря клетками способности прикрепляться к стеклу, вследствие чего клетки, обычно распластанные по стеклу, принимают шаровидную форму, отделяются от стекла и свободно плавают в культуральной жидкости, где и погибают (энтеровирусы, аденовирусы и др.).
Симпластообразоеание - растворение клеточных оболочек, вследствие чего цитоплазмы соседних клеток сливаются, образуя одно целое, в котором располагаются (главным образом по периферии) ядра клеток. Такие образования из цитоплазматической массы с многими клеточными ядрами называются симпластами (гигантские многоядерные клетки).
РГАд. Гемадсорбция - соединение эритроцитов с поверхностью пораженных вирусом клеток - впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатиче- ских изменений в инфицированных клетках.
Методика РГАд состоит в следующем. На 3-4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2-3 капли 0,5-процентной суспензии отмытых эритроцитов. Обе пробирки оставляют на 5-10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной.
В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким:
Каждый вирус способен адсорбировать эритроциты крови животных определенных видов.
Самостоятельная работа студентов
- 1) Студенты проводят микроскопию клеточных культур (живая культура клеток, фиксированная).
- 2) Изучают методы обнаружения вирусов в зараженных клеточных культурах (по ЦПД, по гемадсорбции эритроцитов на монослое, по обнаружению бляшек, по обнаружению телец-включений).
Читайте также:


