Реал тайм вирус папилломы
Исследование для выявления онкогенного вируса папилломы человека (ВПЧ) 16 типа, в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (ДНК) вируса в образце биоматериала.
Вирус папилломы человека, ВПЧ, 16 тип, папиллома-вирус.
HPV-16 [Real-Time Polymerase Chain Reaction, quantitative RT-PCR, qPCR, qRT-PCR], OncogenicHPV, High-riskHPV, hrHPV.
Полимеразная цепная реакция с обратной транскрипцией в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Соскоб из прямой кишки, соскоб урогенитальный.
Общая информация об исследовании
В большинстве случаев рак шейки матки обусловлен инфекцией вирусом папилломы человека (ВПЧ). На сегодняшний день известно около 150 разновидностей ВПЧ, обладающих разной способностью к персистенции в эпителии шейки матки и разной степенью онкогенного риска. 16 тип ВПЧ относится к группе так называемых ВПЧ высокого онкогенного риска. Показано, что 50 % случаев рака шейки матки вызваны 16 типом ВПЧ. Также 16 тип ВПЧ может быть выявлен в подавляющем большинстве случаев рака вульвы, влагалища, ануса и полового члена. На сегодняшний день исследование РТ-ПЦР на ВПЧ 16 типа включено в программу скрининга рака шейки матки и предраковых состояний и наблюдения женщин с этими заболеваниями.
РТ-ПЦР является методом молекулярной диагностики, позволяющим выявлять в биологическом материале (например, в урогенитальном мазке) фрагменты генетического материала ДНК ВПЧ, а также производить количественную оценку вирусной нагрузки (в крестах).
Исследование РТ-ПЦР на ВПЧ рекомендуется в следующих ситуациях:
1. При выявлении в цитологическом мазке атипичных клеток плоского эпителия неясного значения;
2. При дальнейшем наблюдении женщин с патологическими признаками в цитологическом мазке, но нормальными результатами кольпоскопии/биопсии;
3. При оценке эффективности лечения ЦИН 2+ (дисплазия средней степени);
4. При проведении скрининга рака шейки матки и предраковых состояний в группе женщин старше 30 лет в сочетании с цитологическим мазком. Следует отметить, что на данный момент использование РТ-ПЦР в комбинации с цитологическим мазком рекомендовано только в группе женщин старше 30 лет. Использование РТ-ПЦР в качестве скринингового теста (отдельно или в комбинации с цитологическим мазком) в группе женщин младше 30 лет не рекомендовано. Также скрининг рака шейки матки не проводится в группе женщин старше 65 лет.
Традиционно для скрининга рака шейки матки используется цитологический мазок по Папаниколау. С помощью этого теста можно выявить наличие атипичных клеток и заподозрить предраковые изменения эпителия шейки матки на ранних стадиях (цервикальную интраэпителиальную неоплазию, ЦИН). При сравнении результатов скрининга с помощью цитологического мазка и исследования РТ-ПЦР было показано, что метод РТ-ПЦР позволяет выявлять женщин с диспластическими изменениями эпителия на более ранних стадиях. Метод РТ-ПЦР обладает очень высокой чувствительностью, превосходящей чувствительность цитологического мазка. Высокая чувствительность теста означает, что отрицательный результат на ВПЧ 16 в сочетании с отрицательным результатом исследования на другие онкогенные ВПЧ практически позволяет исключить риск развития рака шейки матки. Благодаря этому при использовании метода РТ-ПЦР в программе скрининга рака шейки матки интервал между повторными скрининговыми анализами может быть увеличен до 5 лет (по сравнению с 3 годами при использовании только цитологического мазка).
Метод РТ-ПЦР характеризуется очень высокой специфичностью и способен выявлять конкретный тип вируса. Это чрезвычайно важно, учитывая абсолютно разные подходы к ведению женщин с ВПЧ высокого и низкого онкогенного риска. Так, положительный результат на ВПЧ 16 типа свидетельствует о наличии именно 16 типа ВПЧ и будет отрицательным при наличии неонкогенных типов ВПЧ (например, 6 или 8). С другой стороны, опять же благодаря высокой специфичности, исследование РТ-ПЦР на ВПЧ 16 типа не дает никакой информации о наличии других типов ВПЧ высокого онкогенного риска, например ВПЧ 18.
Следует отметить, что специфичность РТ-ПЦР в отношении вируса и в отношении рака шейки матки – это не одно и то же. Действительно, специфичность теста в отношении вируса очень высокая. Однако из-за того, что многие, даже выраженные диспластические изменения эпителия шейки матки, связанные с ВПЧ, спонтанно и бесследно регрессируют, специфичность РТ-ПЦР в отношении рака шейки матки не такая высокая. Поэтому однократный положительный результат анализа РТ-ПЦР на ВПЧ-16 не всегда говорит о наличии риска рака шейки матки и предраковых состояний. Это особенно касается молодых женщин. С другой стороны, сохранение положительного результата РТ-ПЦР при повторных анализах на протяжении более 2 лет свидетельствует о высоком риске развития ЦИН высокой степени в ближайшие 5-10 лет.
Метод РТ-ПЦР не предназначен для скрининга злокачественных или предраковых заболеваний, вызванных ВПЧ 16 типа, у мужчин.
Следует отметить, что кроме 16 типа существует еще около 15 других типов ВПЧ высокого онкогенного риска. По этой причине отрицательный анализ РТ-ПЦР на ВПЧ 16 типа не позволяет полностью исключить риск рака шейки матки и должен быть дополнен другими лабораторными тестами.
Для чего используется исследование?
- Для скрининга рака шейки матки и предраковых состояний и наблюдения женщин с этими состояниями.
Когда назначается исследование?
- При выявлении в цитологическом мазке атипичных клеток плоского эпителия неясного значения (ACS-US);
- при дальнейшем наблюдении женщин с патологическими признаками в цитологическом мазке, но нормальными результатами кольпоскопии/биопсии;
- при оценке эффективности лечения ЦИН 2+;
- каждые 5 лет при проведении скрининга рака шейки матки и предраковых состояний в группе женщин 30-60 лет в сочетании с цитологическим мазком.
Что означают результаты?
Референсные значения: отрицательно.
- ВПЧ 16 типа (ВПЧ высокого онкогенного риска).
- норма;
- прекращение инфекции;
- неправильный сбор биоматериала для исследования.
Что может влиять на результат?
Наличие в образце биоматериала крови может препятствовать проведению реакции.
- Однократный положительный результат анализа РТ-ПЦР на ВПЧ-16 не означает наличие риска рака шейки матки и предраковых состояний;
- отрицательный анализ РТ-ПЦР на ВПЧ 16 типа не позволяет полностью исключить риск рака шейки матки.
13 Human Papillomavirus 31/33 (HPV 31/33), ДНК [ПЦР]
Молекулярно-генетическое исследование, в ходе которого выявляется ДНК вируса папилломы человека и количественно определяется вирусная нагрузка в материале.
Определяется количество только ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы) – без указания типа.
Вирус папилломы человека (ВПЧ), папиллома-вирус человека.
Синонимы английские
Human Papillomavirus, DNA, Quantitative; HPV, Viral Load.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок урогенитальный (с секретом предстательной железы), ректальный мазок.
Как правильно подготовиться к исследованию?
- Женщинам рекомендуется сдавать урогенитальный мазок или мочу до менструации или через 2 дня после её окончания.
- Мужчинам не следует мочиться в течение 3 часов до сдачи урогенитального мазка или мочи.
Общая информация об исследовании
Вирус папилломы человека – ДНК-содержащий вирус из семейства паповавирусов, ассоциированный с развитием кондилом, бородавок, предраковых изменений аногенитальной области, рака шейки матки. Существует более 100 типов ВПЧ, более 30 из них могут инфицировать половые пути, и около 14 генотипов связаны с развитием рака шейки матки, прямой кишки, полового члена и новообразований некоторых других локализаций (например, орофарингеальной карциномы).
Онкогенные папиллома-вирусы имеют в составе ДНК белки Е6/Е7, которые способны подавлять процессы апоптоза (запрограммированной гибели) в клетках с измененным генетическим материалом. Генотипы 1, 2, 3, 5 считаются неонкогенными, а генотипы 6, 11, 42, 43, 44 относятся к папиллома-вирусам низкого онкогенного риска. К ВПЧ высокого онкогенного риска относятся генотипы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68.
Основной путь распространения инфекции – половой, включая орально-генитальные и анальные контакты, также возможна вертикальная (от матери ребенку) и контактно-бытовая передача инфекции. В организм человека может попасть несколько типов ВПЧ одновременно. Заражение обычно происходит после начала половой жизни в возрасте 16-25 лет. При инфицировании онкогенными генотипами вируса между 25 и 35 годами вероятны интраэпителиальные поражения и, как следствие, через несколько лет рак. В 70 % случаев в течение первого года и в 90 % случаев через 2 года после инфицирования возможно самоизлечение.
Рак шейки матки (РШМ) по распространенности занимает 3-е место среди всех злокачественных опухолей у женщин (после рака молочной железы и рака толстой кишки). Частота инвазивного рака шейки матки в мире составляет 15-25 на 100 000 женщин. Новообразования шейки матки возникают в основном у женщин среднего возраста (35-55 лет), редко диагностируются у женщин моложе 20 лет и в 20 % случаев выявляются в возрасте старше 65 лет. 5-летняя выживаемость при локализованном (местном, in situ) раке шейки матки равна 88 %, в то время как выживаемость при распространенном раке не превышает 13 %. Кроме инфицирования онкогенными генотипами ВПЧ, риск развития рака шейки матки повышают курение, хламидийная или герпетическая инфекция, хронические воспалительные гинекологические заболевания, длительное применение противозачаточных препаратов, множественные роды, случаи рака шейки матки в семье, раннее начало половой жизни, частая смена половых партнеров, недостаточное поступление с пищей витаминов А и С, иммунодефициты и ВИЧ-инфекция. Несмотря на то что вирус папилломы человека не всегда приводит к новообразованиям, более 93 % случаев рака шейки матки ассоциированы с ним.
Полимеразная цепная реакция (ПЦР) с высокой чувствительностью и специфичностью выявляет ДНК вируса папилломы человека (ВПЧ) в более чем 90 % случаев рака и 75-85 % интраэпителиальной неоплазии с выраженной дисплазией. По данным исследований, количественное содержание вируса в материале коррелирует со степенью неоплазии: чем выше вирусная нагрузка, тем выраженнее цитологические изменения в эпителии. При обследовании необходимо учитывать генотип вируса, наличие и степень цитологических и гистологических изменений в тканях, увеличение или снижение вирусной нагрузки через несколько месяцев (6 месяцев и более) после предыдущего обследования.
Для чего используется исследование?
- Чтобы оценить риск развития новообразований, ассоциированных с ВПЧ (рак шейки матки, рак прямой кишки, рак аногенитальной области и других локализаций).
- Для контроля за эффективностью лечения предраковых заболеваний, ассоциированных с ВПЧ.
- Для мониторинга папиллома-вирусной инфекции и прогнозирования её течения.
Когда назначается исследование?
- При выявлении цитологических изменений в мазке на атипию, в мазке по Папаниколау, в гистологическом препарате.
- При кондиломах и других морфологических изменениях половых путей.
- При скрининге рака шейки матки у женщин старше 25-30 лет (в качестве дополнительного исследования).
- При наблюдении за инфицированными ВПЧ.
- При лечении рака и предраковых состояний, ассоциированных с ВПЧ.
Что означают результаты?
Референсные значения: отрицательно.
Уровень вирусной нагрузки интерпретируется с учетом результатов цитологического исследования мазков, гистологических изменений в биоптате и генотипа вируса, изменении его количества с течением времени.
- Количество ДНК ВПЧ не определяется при отсутствии вируса в исследуемом образце или его минимальном количестве (ниже детектируемого уровня) – риск развития патологического процесса, связанного с ВПЧ, минимальный.
- Клинически малозначимая концентрация вируса (менее 10 3 копий ДНК ВПЧ на 10 5 клеток) – минимальный риск развития дисплазии, транзиторное течение вирусного процесса.
- Клинически значимая концентрация вируса (более 10 3 копий ДНК ВПЧ на 10 5 клеток) – хроническая инфекция с высоким риском развития дисплазии и РШМ.
- Более 10 5 копий ДНК ВПЧ на 10 5 клеток при установленном факте персистентного течения инфекции (ВПЧ выявляется более 1 года) – усиленная вирусная нагрузка, ассоциированная с повышенным риском тяжелой дисплазии, часто встречается при РШМ.
- Снижение вирусной нагрузки в 10 раз за 6 месяцев – транзиторная инфекция.
- Рост вирусной нагрузки через 6 и более месяцев после лечения указывает на возможность рецидива.
Что может влиять на результат?
Недостоверный результат может быть получен при:
- неправильном взятии и хранении материала;
- загрязнении исследуемого материала.
- Инфицирование ВПЧ не всегда приводит к раку шейки матки.
- Возможно одновременное заражение несколькими генотипами ВПЧ.
- Результат анализа должен интерпретироваться с учетом заключений цитологического и гистологического исследований.
Кто назначает исследование?
Литература
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
Human papillomavirus 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59
Human papillomavirus 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59
Информация об исследовании
Вирус папилломы человека относится к семейству Papillomaviridae. Вирионы не имеют оболочки и содержат ДНК. Более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска. Основной путь передачи возбудителя — половой (генитально-генитальный, мануально-генитальный, орально-генитальный), однако возможна передача и при непосредственном соприкосновении (кожный контакт). Риск передачи даже при однократном половом контакте равен 80%, особенно у девушек, не достигших половой зрелости. В период полового созревания у девушек естественным состоянием шейки матки является биологическая трансформация эктопированного на влагалищную порцию шейки матки цилиндрического эпителия, что облегчает проникновение вирусных частиц в клетки. ВПЧ обладает тропностью к эпителиальным тканям (кожа, слизистые оболочки) вне зависимости от их локализации и проникает в клетку через микроскопические порезы и потертости (дефекты). Несмотря на то, что большинство людей на протяжении жизни инфицируются этим возбудителем, чаще всего инфицирование заканчивается самопроизвольной элиминацией вируса из организма. Тем не менее у 5–10% пациентов ВПЧ персистирует, что в конечном итоге может приводить к появлению доброкачественных или злокачественных изменений кожи и слизистых оболочек. Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. Перенесенная ПВИ не защищает от повторного инфицирования. Средняя продолжительность времени между первичным инфицированием ВПЧ и развитием РШМ составляет 20 лет. В целом персистирующая ПВИ заканчивается раком лишь в 1,5% случаев. Лучшей профилактикой рака шейки матки является организованный скрининг – систематическое тестирование у бессимптомных женщин, так как эффективных лекарственных препаратов от вируса папилломы, вызывающего заболевание, нет.
Факторы риска ВПЧ-инфекции:
- Сексуальное поведение (раннее начало половой жизни, большое количество половых партнеров);
- Другие ИППП (хламидиоз, гонорея, трихомониаз, сифилис, инфицированность вирусом простого герпеса, вирусом иммунодефицита человека, цитомегаловирусная инфекция и др.);
- Изменения иммунного статуса;
- Терапия сопутствующей патологии цитостатиками (онкологических заболеваний, состояний после трансплантации органов).
Анализ ВПЧ (типы 16,18,31,33,35,39,45,51,52,56,58,59) колич. позволяет:
- контролировать адекватность забора материала по наличию в образце достаточного количества эпителиальных клеток, что обеспечивает высокую чувствительность и специфичность теста;
- определять суммарное количество всех типов;
- динамически наблюдать за вирусной инфекцией и более точно прогнозировать ее развитие.
Исследование для выявления возбудителя папиллома-вирусной инфекции проводится с помощью метода полимеразной цепной реакции в реальном времени (Real-Time) определяется генетический материал (ДНК) вируса и его количество (вирусная нагрузка) в образце, полученном из урогенитального тракта.
Показания к назначению исследования
Определение группы риска по развитию рака шейки матки
женщинам от 21 года, находящимся в группе риска по заражению ВПЧ
Скрининговые программы с цитологическим исследованием для женщин старше 30 лет
Обследование при неопределенных и сомнительных результатах цитологических исследований
Контроль эффективности терапии тяжелой дисплазии шейки матки (CIN II ) через 6 месяцев после удаления пораженного эпителия
Проведение дифференциальной диагностики с заболеваниями не папилломавирусной этиологии
Подготовка к исследованию
За 2 недели исключить прием противовирусной терапии
За 3 дня влагалищные формы лекарственных средств, интравагинального УЗИ и кольпоскопии
За сутки исключить половой контакт
Не должно быть менструальных выделений (рекомендовано либо за 5 дней до начала менструации, либо через 5 дней после окончания)
Беременным до 22 недель берет медицинская сестра если нет угрозы, с 22-30 недели -если нет угрозы, берет гинеколог по записи, с 30 недели только принесенный материал.
Соскоб из урогенитального тракта (у мужчин - уретра) рекомендуется сдавать через 2 часа после последнего мочеиспускания.
С этим исследованием сдают
- 16.1. Гинекологический мазок на флору
- 14.11. Исследование соскобов с шейки матки (по Папаниколау, Рар-тест)
- 19.89.1. ВПЧ 6/11 типа, ДНК (HPV, ПЦР, определение генотипа) соскоб, кол.
Результаты исследования
Прием противовирусной терапии менее чем за 2 недели до исследования
Проведение менее чем за 3 дня вагинальные исследования, спринцевания
Для мужчин мочеиспускание менее чем за 2-3 часа до исследования
Результат в числовом значение – означает наличие ВПЧ с указанием конкретного типа.
Результат 0 - следует интерпретировать как отсутствие в образце специфических участков ДНК ВПЧ.

Общие сведения
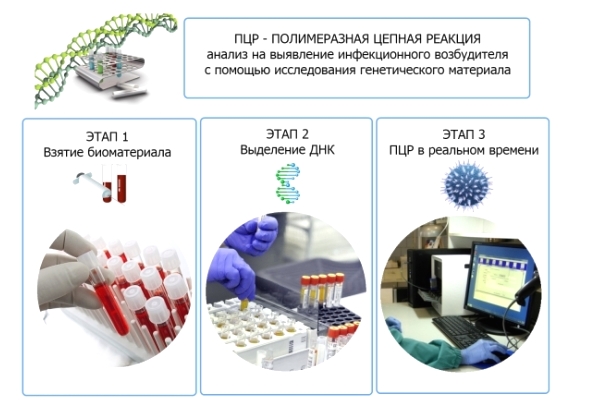
Анализ строится на исследовании ДНК пациента с целью обнаружения в ней присутствия чужеродных элементов. Любая ДНК строится на основе четырех нуклеотидов, располагающихся в определенной последовательности. Когда в организм попадает вирус, происходит изменение порядка в этой цепи, что позволяет оперативно отследить деятельность даже незначительных инородных частиц. Метод ПЦР диагностики проводится с использованием вирусных частиц, что обусловливает быстрое деление клеток.
Такая диагностика способна отследить активность ВПЧ не только в момент его протекания в скрытой фазе, но и в инкубационный период, когда папилломавирус еще не успел заявить о себе. ПЦР позволяет выявить:
- наличие ВПЧ;
- штаммы, которыми инфицирован больной;
- количественное содержание вируса в организме.
Большинство людей инфицированы папилломавирусом, однако сильный иммунитет подавляет его проявления и не дает размножаться. Поэтому обнаружение ВПЧ качественным методом может быть не всегда оправдано. Это не рационально в случае, если вирус присутствует в организме, но его воздействие минимально и никак не вредит человеку. Тем не менее качественный анализ покажет положительный результат, чем может вести пациента в замешательство.
Поэтому для диагностики чаще всего применяют количественный метод, позволяющий отследить количество вируса в организме и определить, насколько опасна его деятельность. Кроме того, важно установить штамм ВПЧ. Они делятся по степени онкогенности: одни совершенно безопасны и способны вызывать только косметические проблемы, другие могут стать причиной возникновения рака.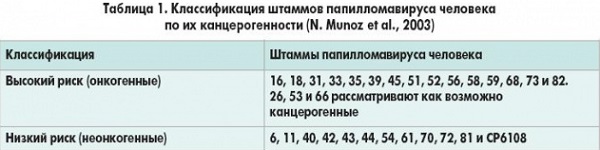
Каждая ситуация требует индивидуального подхода, поэтому прежде чем сдавать анализ, желательно проконсультироваться с врачом. Он подскажет, каким методом и на какие штаммы лучше всего проверяться, исходя из состояния пациента.
Показания для анализа
Инфицирование ВПЧ возможно только при непосредственном контакте с зараженным человеком. Вирус попадает в кровь и начинает размножение в области верхних слоев кожи, что обусловливает появление его характерных признаков – возникновение папиллом и кондилом. 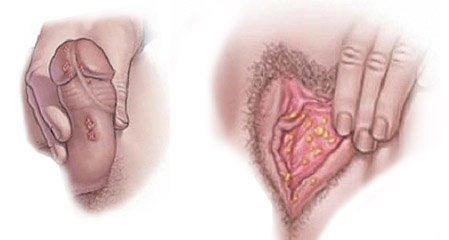
ВПЧ распространяется следующими путями:
- при незащищенных половых контактах;
- при естественных родах от инфицированной матери к ребенку;
- контактно-бытовым путем через предметы общего пользования, личные вещи, одежду и т.д.;
- во время тесного контакта с кожей больного.
Чаще всего диагностировать ВПЧ приходят люди, у которых видны внешние признаки болезни. Однако если они никак не проявляются, это не является гарантией отсутствия вируса. Он также может присутствовать в крови и развиваться бессимптомно. Это особенно характерно для высокоонкогенных типов вируса: 16 и 18 штамма, которые провоцируют возникновение рака. Направление на диагностику этих типов обычно происходит при обращении к профильным специалистам: гинекологу и урологу. 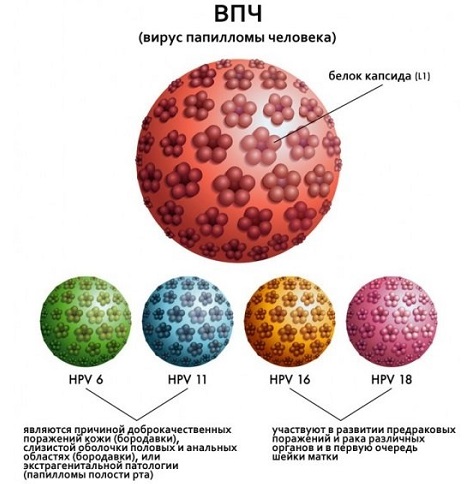
Преимущества метода
ПЦР считается одним из главных методов диагностики и остается самым востребованным среди врачей. Он используется не только для выявления ВПЧ, но также помогает обнаруживать другие заболевания, передающиеся половым путем, гепатиты, скрытые инфекции и т.д. ПЦР диагностика обладает рядом преимуществ по сравнению с другими методами выявления заболеваний. Среди них:
- Высокая специфичность. Тест помогает с большой вероятностью отделить следы чужеродной ДНК от ДНК человека в рамках собранного материала.
- Высокая производительность. ПЦР представляет собой автоматизированный процесс, помогающий провести диагностику непосредственно в день сдачи анализа. Такая скорость исследования позволяет пациенту не волноваться о результате на протяжении долгого времени и получить результат уже через несколько дней.
- Возможность сделать сразу несколько анализов. На основании одного собранного образца можно провести диагностику для выявления нескольких заболеваний. Например, одновременно можно выявить возбудителя хламидиоза и гонореи. При этом такая процедура не сможет отрицательно повлиять на достоверность результата.
- Высокая чувствительность. Тест позволяет обнаружить деятельность вируса даже в инкубационный период, когда его концентрация очень мало. Это поможет предупредить развитие патологического процесса и начать своевременное лечение.
Недостатки метода
Существуют, однако, и некоторые отрицательные моменты в проведении ПЦР диагностики. Главный из них – возможность получения ложноположительного результата. Это происходит в случае, если лечение уже проведено, инфекция побеждена, но мертвые клетки еще остаются внутри тканей. Для обновления клеток необходимо время.
Если провести анализ раньше 2-3 месяцев, ПЦР может показать положительный результат, в действительности принимая уже мертвые клетки за живые. Метод не делает различий между ними, он нацелен на поиск ДНК вируса, которую может найти даже в уже отмерших клетках. Все это приводит к получению ложноположительного результата. Избежать такой ситуации можно, если сдавать анализ в установленный лечащим врачом срок.
Также существует риск ложноотрицательного результата. В этом случае пациент никак не может повлиять на качество диагностики, так как ложноотрицательный анализ – просчет лаборатории. Он может возникнуть если:
- собранный материал неправильно транспортировался и хранился;
- нарушается стерильность, и в полученные пробы попадают другие микроорганизмы;
- реагенты были непригодными.
Для того чтобы исключить возможность получения ложноотрицательного результата, необходимо выбирать проверенную лабораторию с квалифицированным персоналом.
Виды методик
В рамках проведения ПЦР диагностики разработаны четыре метода тестирования. Каждый из них имеет свои особенности проведения и назначается, исходя из состояния пациента. Для выбора наилучшего способа необходимо проконсультироваться с врачом.
Такой способ позволяет установить концентрацию вируса в организме и отследить развитие ВПЧ. Считается наиболее информативным, так как позволяет определить тяжесть протекающего процесса, исходя из которой, подбирается лечение. Основан на определении количества вирусных клеток в рамках исследуемых 100 тысяч. Когда их совокупность превышает 5, это свидетельствует о высокой концентрации папилломавируса, что повышает возможность появления раковых клеток. Если количество клеток меньше 3, концентрация указывается как незначительная.
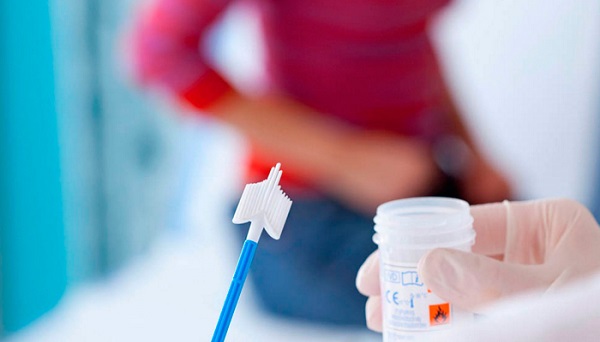
Как сдавать анализ
Специальной подготовки для проведения диагностики не требуется. Главное условие – не мочиться за несколько часов до процедуры. Желательно не вступать в половые контакты за 2-3 дня до обследования, а также не принимать алкоголь. При этом нельзя забывать о проведении процедур для поддержания интимной гигиены.
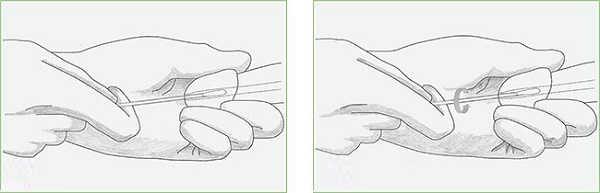
Головка полового органа вместе с мочеиспускательным каналом обрабатывается физ. раствором. Врач использует специальную щеточку, вставляемую примерно на 4 сантиметра. С помощью легкого вращения собирается материал для исследования с уретры. Полученный анализ оставляется в пробирке и отправляется на дальнейшее исследование в лабораторию. Биоматериал при этом может храниться не более 2 суток с момента получения.
Перед взятием анализа на шейку матки наносят стерильный раствор. Затем с помощью щеточки берется мазок из цервикального канала. Приспособление оказывается на глубине около сантиметра, потом врач делает соскоб со стенок вращательными движениями. Биоматериал помещается в пробирку, где находится примерно 15 секунд. Там врач обтирает его об стенки, а затем вынимает. После этого содержимое пробирки отправляется на диагностику.
Забор биоматериала
Расшифровка анализа ПЦР
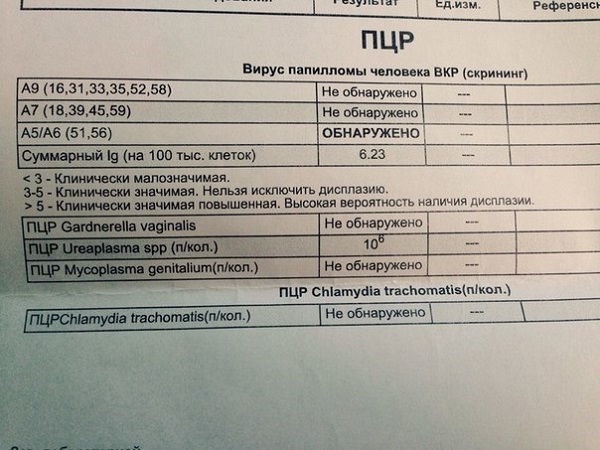
Если пациент использовал количественный метод, расшифровка будет следующей:
- Lg 5 и выше – показатель большой концентрации вируса;
- Lg 3−5 – уровень вируса значительный, но не критический;
- Lg меньше 3 – малозначимое количество вирусных клеток.
В любом случае точной расшифровкой должен заниматься врач, ведь на основании этого ставится диагноз. Кроме того, через какое-то время желательно повторить процедуру, чтобы исключить ложноотрицательный или ложноположительный результат.
ВПЧ – группа распространенных и генетически разнообразных вирусов, инфицирующих и поражающих эпителий кожных покровов (кожные типы ВПЧ) и слизистых оболочек ротовой полости и аногенитальной области (генитальные типы ВПЧ). Генитальные типы ВПЧ передаются преимущественно половым путем и через родовые пути от матери ребенку. Основными клиническими формами папилломавирусной инфекции гениталий являются остроконечные кондиломы, а также злокачественные формы изменения эпителиальных клеток, приводящие к раку шейки матки.
Исход инфекции зависит от типа вируса. Типы ВПЧ низкого канцерогенного риска (НКР, низкоонкогенные) связаны с остроконечными кондиломами и дисплазиями легкой степени. Типы ВПЧ высокого канцерогенного риска (ВКР, высокоонкогенные) – 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 – наряду с остроконечными кондиломами и дисплазиями легкой степени, также индуцируют злокачественную трансформацию эпителия, приводящую к инвазивному раку.
Дифференциальная диагностика. Поражения шейки матки, влагалища, вульвы, пениса, заднего прохода непапилломавирусной этиологии; в случае остроконечных кондилом – с проявлениями, связанными с вирусом простого герпеса, а также с истинными папилломами.
Лабораторная диагностика папилломавирусной инфекции включает выявление и количественное определение ДНК ВПЧ ВКР, генотипирование ВПЧ ВКР, выявление ДНК ВПЧ НКР.
Материал для исследования
- Соскобы эпителия цервикального канала, влагалища, вульвы, заднего прохода – для выявления, количественного определения и генотипирования ВПЧ;
- мазки из ротовой полости и гортани – выявления ВПЧ НКР у детей.
Выявление и определение концентрации вируса папилломы человека высокого канцерогенного риска
Показания к обследованию
- Определение группы риска по развитию рака шейки матки и рака заднего прохода;
- скрининговые программы с цитологическим исследованием одновременно или на первом этапе скрининга (до цитологического исследования) для женщин старше 30 лет;
- разрешение неопределенных и сомнительных результатов цитологических исследований (наличие ASCUS – атипичные плоские клетки неясного значения);
- контроль эффективности терапии тяжелой дисплазии (CIN2+) через 6 месяцев после удаления пораженного эпителия;
- проведение дифференциальной диагностики с заболеваниями непапилломарусной этиологии.
Сравнительная характеристика методов лабораторной диагностики. Для выявления ДНК ВПЧ ВКР используют МАНК (ПЦР, NASBA, TMA и др.) и методы амплификации сигнала (гибридный захват). Культивировать вирус не удается.
Гибридный захват является первым и наиболее охарактеризованным методом выявления ДНК ВПЧ. Применение метода позволяет определять концентрацию вируса в условных единицах оптической плотности, линейный диапазон небольшой (3–4 порядка). Образцы, в которых присутствует вирус в концентрации ниже порога клинической значимости, учитываются как отрицательные. Граница клинической значимости определяется путем тестирования эталонного образца (концентрация ДНК ВПЧ 1 пг/мл). Все сигналы, значения которых ниже эталонного, считаются отрицательными. Более современными, быстрыми и удобными для использования являются методы на основе АНК. МАНК, работающие в неколичественном формате, выявляют либо ДНК вируса (ПЦР, HDA и др.), либо мРНК транскрипты онкогенов E6 и E7 ВПЧ (NASBA, TMA). Для выявления только клинически значимых концентраций (по разным методикам учета – более 1 пг/мл или 1000 копий ДНК вируса на 100000 клеток человека) используют методики с чувствительностью, при которой образцы с низкой концентрацией учитываются как отрицательные. Наиболее целесообразно использовать ПЦР в реальном времени, которая позволяет точно определить концентрацию ДНК вируса. На основе полученных данных проводится не только оценка концентрации вируса, но, что важно, проводится градация результата по клинической значимости полученной концентрации на:
- положительный – выше порога клинической значимости;
- положительный – малозначимый (ниже порога значимости);
- отрицательный.
Различные наборы реагентов могут отличаться спектром выявляемых генотипов. К группе ВПЧ ВКР относятся 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 генотипы. Наиболее канцерогенными считаются 16 и 18 типы, наименее – 51, 56, 68. Для РФ и стран СНГ клинический смысл исследования сохраняется только при определении как минимум 10 генотипов из перечисленных выше. Выявление в смеси генотипов низкого или неустановленного риска существенно снижает специфичность выделения группы риска онкологической патологии и не может быть оправдано.
Показания к применению различных лабораторных исследований. Для проведения скринингового обследования на наличие предрака и рака шейки матки предпочтительным является использование мазков/соскобов эпителия цервикального канала и зоны трансформации, выполненных цервикальными цитологическими щеточками. Допускается использование для этих целей мазков из влагалища. Для скрининга рака шейки матки все тесты, вне зависимости от выбранной технологии, должны иметь сбалансированные аналитические и диагностические характеристики, удовлетворяющие следующим условиям – не менее 98% чувствительность по отношению к CIN2+ и не менее 90% специфичность относительно широко валидированного в скрининге теста (например, Hybrid Capture II). Для достижения оптимума аналитической чувствительности избирают подход отсечения образцов с концентрацией ДНК ВПЧ ниже порога клинической значимости. Для этого либо проводят искусственное снижение аналитической чувствительности, либо выбирают в качестве референтного контрольный образец с требуемой пороговой концентрацией. Предпочтительным является измерение концентрации ДНК ВПЧ методом ПЦР в реальном времени.
Особенности интерпретации результатов лабораторных исследований. Обнаружение ДНК ВПЧ в любой концентрации свидетельствует о наличии возбудителя, однако при интерпретации результатов тестирования следует учитывать, что более 80% инфицированных спонтанно излечиваются в течение 12–24 мес. Опасность представляет персистентная форма инфекции (сохраняющаяся более 12–24 мес.). Однократный положительный результат надежно указывает на принадлежность к группе риска развития рака шейки матки в случае, если исследование проводится в группе женщин старше 30 лет или вступивших в половую жизнь более 6–7 лет назад. Особая настороженность должна быть проявлена в отношении пациенток, у которых подтверждается персистенция вируса при повторном тестировании через 1 год. При скрининге с использованием количественных тестов принимают во внимание только клинически значимый результат. Для дифференциальной диагностики и наблюдения пациентов после проведения лечения дополнительная ценность одиночного количественного определения не показана. Перспективным в прогнозе риска рецидива CIN2+ является оценка динамики вирусной нагрузки после лечения (снижение или увеличение концентрации вируса).
Генотипирование вирусов папилломы человека. Цель генотипирования ВПЧ – отличие персистирующей инфекции от случая повторного инфицирования (сохранение генотипа в повторных тестах); уточнение тактики ведения больных в зависимости от онкогенности выявленных типов вируса.
Показания к обследованию. Пациенты с выявленной папилломавирусной инфекцией ВКР
Сравнительная характеристика методов лабораторной диагностики. Для генотипирования ВПЧ используют МАНК. Распространение получили методики с детекцией продуктов амплификации методом электрофореза (генотипирование по величине амплифицируемого фрагмента), гибридизации на плашках и стрип-полосках, ПЦР в реальном времени.
Классические методики, использующие принцип гибридизации со специфическими зондами позволяют определять наиболее широкий спектр генотипов (20–40). Однако использование для амплификации универсальных праймеров приводит к существенным различиям в аналитической чувствительности выявления различных генотипов ВПЧ, приводя к заметным искажениям результатов. Кроме того, широкий спектр определяемых генотипов необходим только для научных исследований. В клинической практике достаточным может считаться генотипирование ВПЧ ВКР (10–13 типов). Методики, основанные на применении типоспецифических олигонуклеотидов, позволяют проводить типирование спектра клинически значимых генотипов и в заметной степени лишены проблемы различий аналитической чувствительности по отношению к разным генотипам ВПЧ. Предпочтение должно отдаваться мультиплекс-методикам с использованием ПЦР в реальном времени как наиболее быстрым, контаминационно безопасным, предполагающим возможность автоматизации. Может проводиться сокращенное генотипирование с выявлением только наиболее онкогенных типов ВПЧ 16 и 18.
Особенности интерпретации результатов лабораторных исследований. Для установления персистенции вируса применяют подход повторного генотипирования через 12 месяцев. Персистенция подтверждается при сохранении генотипа/ генотипов при повторном исследовании, полная смена спектра генотипов указывает на излечение и повторное инфицирование альтернативными ВПЧ. Выявление наиболее онкогенных типов ВПЧ (16 и 18) может указывать на потребность в более агрессивной тактике ведения больных (более частые повторные визиты, более тщательное обследование для выявления предраковых изменений и др.).
Выявление вирусов папилломы человека низкого канцерогенного риска
Показания к обследованию
- Определение группы риска развития папилломатоза гортани у ребенка (беременные и новорожденные);
- дифференциальная диагностика с заболеваниями непапилломавирусной этиологии.
Сравнительная характеристика методов лабораторной диагностики. Для выявления ДНК ВПЧ НКР используют МАНК (ПЦР, NASBA, TMA и др.) и методы амплификации сигнала (гибридный захват). Предпочтение должно отдаваться быстрым и контаминационно-безопасным методикам, таким как ПЦР в реальном времени.
Клинически оправданным является определение двух генотипов 6 и 11 (более 90% случаев папилломатоза гортани у детей). Некоторую дополнительную ценность имеет выявление 42, 43 и 44 генотипов. Количественное определение не оправдано.
Особенности интерпретации результатов лабораторных исследований. Выявление 6 и/или 11 генотипов указывает на возможный риск развития папилломатоза гортани у ребенка (риск повышается, если вирус обнаружен в гортани). При планировании беременности может быть рекомендована выжидательная тактика. При сопутствующем наличии остроконечных кондилом – их лечение методом химической и/или физической деструкции. При наличии беременности ее прерывание или родоразрешение методом кесарева сечения не оправданы, так как риск развития папилломатоза гортани ниже риска возможных осложнений указанных операций.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Читайте также:


