Рнк вирусная инфекция что это
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
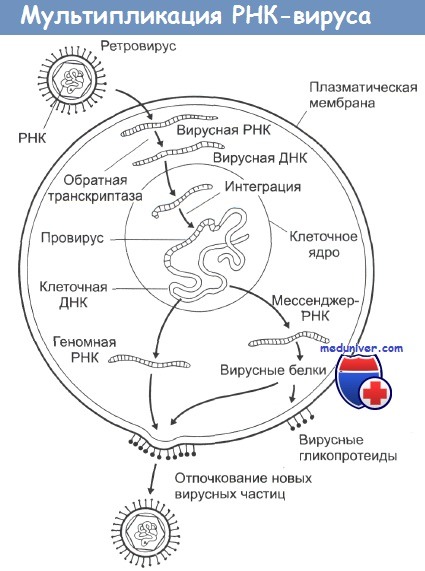
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
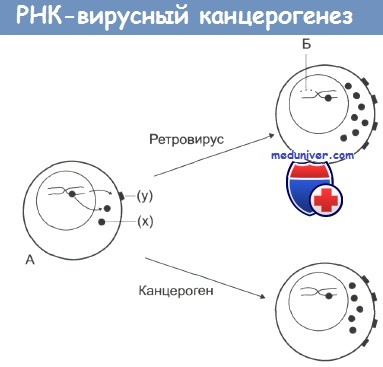
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
1. Реовирусы.Возбудителем американской горной клещевой (колорадской клещевой) лихорадки является вирус, относящийся к семейству реовирусов. Колорадская клещевая лихорадка встречается в горах, где распространен клещ Dermacentor andersoni (штаты Колорадо, Вайоминг, Монтана, Айдахо, Юта, Южная Дакота, Нью-Мексико, Калифорния, Орегон, Вашингтон, Альберта и Британская Колумбия). Пик заболеваемости приходится на конец мая — начало июля — период наибольшей активности взрослых клещей.
Вирус обладает тропизмом к элементам костного мозга, особенно к эритробластам. Эритроциты и ретикулоциты, содержащие вирус, попадают в кровоток. Так как вирус находится внутри клеток, он защищен от распознавания иммунокомпетентными клетками.
Заболевание характеризуется внезапным началом и сопровождается высокой лихорадкой, ознобами, сонливостью, головной болью, миалгией, светобоязнью и рвотой. Оно опасно развитием осложнений: менингоэнцефалита, геморрагического синдрома, перикардита, миокардита, пневмонии.
Клинический диагноз заболевания основан на его эпидемиологических особенностях, а специфический диагноз можно поставить путем выявления антигена в эритроцитах.
Ротавирусявляется основным возбудителем вирусного гастроэнтерита — одного из наиболее распространенных заболеваний в мире. Ежегодно в Азии, Африке и Латинской Америке наблюдается 3—5 млрд случаев гастроэнтерита. В развивающихся странах около 10—20 % смертей вследствие гастроэнтерита обусловлены ротавирусами.
Кроме ротавируса, вирусный гастроэнтерит вызывают калицивирусы, аденовирусы, астровирусы и некоторые неклассифицируемые вирусы.
Репликация ротавируса происходит в эпителиальных клетках, выстилающих слизистую оболочку тонкой кишки. Механизм развития диареи, вызываемой ротавирусами, не совсем ясен. Скорее всего он связан с повреждением щеточной каемки и снижением проницаемости стенки тонкой кишки для макромолекул (включая лактозу).
Клинические проявления заболевания включают лихорадку, рвоту и диарею с последующей дегидратацией организма.
Ротавирусная инфекция может быть причиной развития асептического менингита, некротизирующего энтероколита, острого миозита, абсцесса печени, пневмонии, синдрома внезапной детской смерти и болезни Крона.
Для распознавания ротавируса производятся специальные наборы, имеющие высокую степень специфичности.
2. Флавовирусы.Семейство флавовирусов включает 67 разновидностей вирусов, 29 из которых вызывают заболевания человека. Большинство флавовирусов переносится москитами или клещами. Инфекции, вызываемые флавовирусами, включают неспецифические лихорадки, лихорадку с артралгией и сыпью, геморрагическую лихорадку и инфекцию центральной нервной системы (асептический менингит и энцефалит).
Патогенез заболеваний связан с прямым повреждением вирусом зараженных клеток и последующим развитием воспаления.
Желтая лихорадка встречается в тропических районах Америки и Африки. Заболеваемость желтой лихорадкой резко увеличилась в последние годы. Переносчиками вируса являются москиты и некоторые виды комаров. Вирус попадает под кожу или в мелкие сосуды со слюной москита.
После репликации в лимфоидной ткани и гематогенного распространения вируса в организме печень становится основным очагом инфекции. Вслед за звездчатыми ретикулоэндотелиоцитами (клетками Купфера) поражаются гепатоциты, в которых наблюдается эозинофильная дистрофия (тельца Каунсилмена) и некроз, особенно в средней части долек с вовлечением клеток вокруг центральной вены и в портальных трактах. Развивается желтуха.
Появление острой почечной недостаточности может быть обусловлено снижением почечной перфузии, а затем некрозом эпителия почечных канальцев. Кроме того, вирусный антиген обнаружен в почечных клубочках.
Лихорадка денге чаще всего встречается в Юго-Восточной Азии, Индии и американских тропиках. Ежегодно в мире насчитывают до 100 млн случаев заболевания лихорадкой денге.
Патогенез геморрагической лихорадки денге и наиболее тяжелой ее формы — шокового синдрома денге — иммунологически обусловлен. Репликация вируса происходит в моноцитах-макрофагах, которые имеют Fc-рецепторы. После распознавания цитотоксическими Т-лимфоцитами пораженных вирусом моноцитов начинается выброс цитокинов, обладающих вазоактивным и прокоагулянтным действием (интерлейкины, ФНО, тромбоцитактивирующий фактор, урокиназа), активация комплемента и выброс -у-интерферона, который регулирует экспрессию Fc-pe-цепторов и усиливает антителозависимую репликацию вируса. Вазоактивные медиаторы вызывают нарушения кровообращения и диссеминированную внутрисосудистую коагулопатию.
Клинически лихорадка денге проявляется лихорадкой с ознобами, головной болью, ретроорбитальными и пояснично-крест-цовыми болями, миалгиями, болями в суставах и костях, генерализованной лимфаденопатией. При лабораторных исследованиях обнаруживаются лейкопения (нейтропения) и тромбоцитопения.
Флавовирусные энцефалиты делятся на японский (комариный) энцефалит, русский весенне-летний клещевой (дальневосточный, русский весенне-летний таежный) энцефалит и энцефалит Сент-Луи (американский энцефалит).
В основе развития энцефалита лежит проникновение вируса в центральную нервную систему после периода его экстраневраль-ной репликации. Инфицирование мозга ведет к деструкции нейронов, некрозу, нейрофагии, периваскулярной аккумуляции макрофагов и лимфоцитов. Поражение затрагивает кору большого мозга, ствол, мозжечок, спинной мозг и мягкие мозговые оболочки.
Энцефалитом Сент-Луи страдают люди старческого возраста, а японским энцефалитом — дети и люди пожилого возраста.
Экстраневральное поражение возникает вслед за попаданием вируса в организм со слюной москита или клеща. Начальная репликация вируса происходит в регионарных лимфатических узлах. Затем в процесс вовлекаются лимфоидная ткань, скелетные мышцы, соединительная ткань, миокард, эндокринные и экзокринные железы.
Вирус гепатита Сявляется одним из возбудителей хронического вирусного гепатита, в том числе посттрансфузионного. О гепатите С см. лекцию 12 "Болезни печени".
3. Парамиксовирусы. Вирусы парагриппаобнаружены во всем мире и вызывают распространенные инфекции у людей любого возраста.
Вирус проникает в организм через слизистые оболочки носа и глотки и может поражать также гортань, трахею и бронхи, вызывать ателектазы в легких и пневмонию.
Помимо острых респираторных заболеваний (см. лекцию 23 "Воздушно-капельные инфекции"), парамиксовирусы вызывают воспаление среднего уха, фарингит, конъюнктивит.
Вирус эпидемического паротитавызывает эпидемический паротит — острую генерализованную вирусную инфекцию, которая поражает детей школьного возраста и подростков. Основным симптомом заболевания является негнойное воспаление околоушных слюнных желез. Заражение происходит воздушно-капельным путем при попадании возбудителя на слизистую оболочку носа или рта.
При исследовании слюнной железы, пораженной вирусом, в ней обнаруживают диффузный интерстициальный отек, серозно-фибринозный экссудат, пронизанный мононуклеарными лейкоцитами. Нейтрофилы и тканевый детрит аккумулируются в протоках слюнной железы. Протоковый эпителий слущен. Многоядерные синцитиальные структуры и внутрицитоплазматические эозинофильные включения можно выявить в культуре ткани инфицированной слюнной железы.
Наиболее опасными осложнениями эпидемического паротита являются энцефалит и менингоэнцефалит. Кроме того, описаны эпидидимоорхит, оофорит и панкреатит.
Респираторно-синцитиальный вирус— главная причина заболеваний нижних дыхательных путей у детей младшего возраста. Эти заболевания могут проявляться в виде пневмонии, бронхиолита и трахеобронхита (см. лекцию 23 "Воздушно-капельные инфекции"). Они часто сопровождаются воспалением среднего уха.
При бронхиолите обнаруживаются лимфоцитарная перибронхиальная инфильтрация, отек стенок бронхиол и окружающих тканей, а также некроз эпителия бронхиол. Просвет бронхиол закрыт спущенным эпителием и секретом, содержащим слизь. Одновременно развиваются ателектазы. Нередко признаки бронхиолита и пневмонии сочетаются.
Вирус коривызывает корь — весьма контагиозное вирусное заболевание, которое характеризуется кашлем, насморком, лихорадкой и макулопапулезной сыпью.
Вирус кори способен проникать через респираторный эпителий в слизистую оболочку дыхательных путей, где и происходит его репликация. Во время первичной виремии вирус с помощью лейкоцитов проникает в систему моноцитарных макрофагов (СМФ). После гибели инфицированных макрофагов происходят выброс вируса в кровь и его вторичный захват лейкоцитами (вторичная виремия). После вторичной виремии вся слизистая оболочка респираторного тракта оказывается вовлеченной в процесс. Вирус кори может быть непосредственной причиной крупа, бронхиолита и пневмонии.
Наиболее важными осложнениями кори являются поражения дыхательного аппарата и центральной нервной системы, причем пневмония, сопровождающая корь, может быть обусловлена как прямым действием вируса кори на легкие, так и бактериальной суперинфекций. Энцефалит после кори может быть острым и хроническим.
4. Рабдовирусы.Бешенство — заболевание, вызываемое рядом тесно связанных рабдовирусов. Заражение человека происходит чаще через слюну больной собаки при укусе.
Вирус бешенства является выражение нейротропным. После инокуляции он, видимо, прилипает к поверхности мышечных клеток в том месте, где находятся никотиновые ацетилхолиновые рецепторы. Вирус способен проникать в периферические нервы.
Во время инкубационного периода в ацетилхолиновых рецепторах возле нервно-мышечных контактов происходит амплификация вируса до концентрации, достаточной для того, чтобы пересечь нервно-мышечное соединение и войти в нервную систему по немиелиновым чувствительным и двигательным терминалям. Вирусы проникают в центральную нервную систему по аксонам благодаря ретроградному аксоплазматическому току. Размножение вирусов происходит в телах нервных клеток спинного мозга. Распространение вируса по нервной системе осуществляется через синаптические связи с помощью аксонального транспорта и по межклеточным пространствам. Развивается быстропрогрес-сирующий энцефалит.
В клиническом течении заболевания выделяют инкубационный период, продромальный период, период острых неврологических расстройств и кому.
Большинство осложнений бешенства возникает в коматозный период и включает повышение внутримозгового давления, гипертензию, гипотензию, аритмии сердца, гипотермию.
В подавляющем большинстве случаев заболевание заканчивается смертельным исходом.
5. Филовирусы (марбургский вирус и вирусЭбола). Геморрагическая лихорадка, вызываемая филовирусами, начинается остро и сопровождается головной болью и миалгией. Затем появляются тошнота, рвота, боли в животе, понос, боли в груди, кашель и фарингит. Заболевание проявляется также светобоязнью, лимфаденопатией, желтухой и панкреатитом. Позже развиваются делирий и кома.
При прогрессировании заболевания появляются петехии, кровоизлияния под кожей и в слизистых оболочках.
Смерть больных наступает при явлениях диссеминированного внутрисосудистого свертывания крови и печеночной недостаточности. Смерть при заражении марбургским вирусом наступает у 25 % больных, а вирусом Эбола (суданский тип) — у 50 % больных, вирусом Эбола (заирский тип) — у 90 % больных.
Филовирусы обладают тропностью к эндотелиальным клеткам, макрофагам и клеткам паренхиматозных органов, чем и объясняется тяжесть заболевания.
6. Ортомиксовирусы.Грипп — острое, обычно ограниченное во времени, заболевание.
О гриппе см. лекцию 23 "Воздушно-капельные инфекции".
7. Ретровирусы.Важнейшим представителем этой группы вирусов является вирус иммунодефицита человека (ВИЧ), заражение которым может привести к развитию синдрома приобретенного иммунодефицита (СПИД).
О ВИЧ-инфекции см. лекцию 19 "ВИЧ-инфекция".
8. Пикорнавирусы.Пикорнавирусы делятся на четыре основные группы: афтовирусы, кардиовирусы, энтеровирусы и риновирусы. Энтеровирусы в свою очередь делятся на несколько подгрупп: полиовирусы, Коксаки-вирусы (группа А и В) и экховирусы.
Полиовирусывызывают полиомиелит — системное инфекционное заболевание, которое избирательно поражает центральную нервную систему и осложняется развитием паралича. Заражение полиомиелитом происходит фекально-оральным путем. Репликация вируса происходит в чувствительных к нему тканях глотки и дистальной части пищеварительного тракта. Через 1—3 дня после попадания в организм вирус обнаруживают в лимфоидной ткани подвздошной кишки.
После мультипликации в подслизистой лимфоидной ткани полиовирус проникает в регионарные лимфатические узлы (шейные, мезентериальные), возникает виремия.
Вирус может гематогенным путем попадать в СМФ (печень, селезенка, костный мозг, лимфатические узлы). Репликация вируса в СМФ сопровождается еще более значительной виремией. Массивная виремия приводит к распространению вируса по организму и проникновению в органы-мишени (мозговые оболочки, сердце и кожу). В этих тканях возникают некротические и воспалительные изменения.
Механизм проникновения вируса в центральную нервную систему остается невыясненным. Считают, что полиовирус может проникать из мышц в центральную нервную систему по периферическим нервам.
Полиовирус поражает двигательные и автономные нейроны. Разрушение нейронов сопровождается появлением воспалительного инфильтрата (полиморфно-ядерные лейкоциты, лимфоциты и макрофаги). Сильнее всего повреждаются серое вещество передних рогов спинного мозга и двигательные ядра моста и мозжечка.
Клинические симптомы заболевания зависят от тяжести повреждений центральной нервной системы.
Наиболее частым осложнением полиомиелита является дыхательная недостаточность, которая возникает в связи с развитием паралича дыхательных мышц и обструкцией верхних дыхательных путей вследствие вовлечения ядер черепных нервов и повреждения дыхательного центра.
Среди осложнений выделяют также миокардит и нарушения желудочно-кишечного тракта (кровоизлияния, паралич подвздошной кишки, расширение желудка).
Вирус гепатита Аявляется возбудителем острого инфекционного заболевания печени, которое чаще всего поражает детей.
О гепатите А см. лекцию 12 "Болезни печени".
Риновирусыраспространены по всему миру и являются возбудителями острого сезонного простудного заболевания, которое проявляется в виде насморка.
Полагают, что легкое повреждение эпителия, выстилающего слизистую оболочку носа, является пусковым механизмом для выброса медиаторов, что и является истинной причиной заболевания. Видимо, главную роль в развитии симптомов заболевания играют медиаторы брадикинин, лизилбрадикинин, простагландин, гистамин и интерлейкин-1, а также парасимпатические и а-адренергические нервы. Как правило, заболевание поражает молодых людей, а его продолжительность не превышает 7 дней.
Среди осложнений заболевания выделяют синуситы, воспаление среднего уха, острый бронхит.


Об этом "РГ" беседует с молекулярным вирусологом, и.о. директора Института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого, доктором биологических наук Андреем Васиным.
Андрей Владимирович, пандемия COVID-19 открыла нам глаза на то, что мир вирусов способен преподнести людям немало сюрпризов, хотя мы сталкиваемся с ними постоянно. Почему, на ваш взгляд, новый вирус оказался таким шоком для человечества?
Андрей Васин: Подавляющее большинство людей просто недооценивало опасность, которую представляют вирусы. Почти все слышали такие слова, как "Эбола", "птичий грипп", "вирус Зика", "атипичная пневмония". Но все это было в заголовках новостей и где-то далеко - в Африке, Юго-Восточной Азии, Южной Америке - и не касалось непосредственно нас. Не случайно, наверное, что страны Юго-Восточной Азии, которые сталкивались с некоторыми из перечисленных вирусов, оказались более подготовленными к реагированию на COVID-19, чем, например, страны Европы.
Охвативший весь мир "свиной грипп" (т.е. вирус гриппа A/H1N1), объявленный пандемией, воспринимался просто как осложненный грипп. Плюс к этому было много разговоров про то, что это все обман с целью отвлечения внимания людей от каких-то более важных проблем, "заговор фармкомпаний, чтобы продавать больше препаратов", и т.п. А сейчас оказалось, что угроза пандемии реальна и может затронуть всех. К такому повороту событий общество многих стран, мне кажется, не было готово.
Известно, что вирусы крайне изменчивы. Чем объясняется эта их способность?
Андрей Васин: В основе всей жизни на земле лежит процесс репликации, то есть копирования генома, который у всех клеточных форм жизни представлен молекулой ДНК. За этот процесс в клетках отвечают специальные ферменты, которые называются полимеразы. В процессе репликации ДНК (у человека размер генома, например, составляет 10 в девятой степени!) неизбежно возникают ошибки. Поэтому в процессе эволюции появились специальные ферменты, которые отвечают за репарацию, то есть за устранение этих ошибок. У вирусов геном может быть представлен молекулой как ДНК, так и РНК. При этом РНК-содержащие вирусы являются более изменчивыми и патогенными, чем ДНК-содержащие. В частности, к РНК-содержащим вирусам человека относятся ВИЧ, вирус Эбола, вирус Зика, вирусы гриппа и коронавирусы, в том числе COVID-19. Изменчивость РНК-содержащих вирусов связана с тем, что у них, как правило, нет систем репарации. В результате вирусная полимераза совершает ошибки довольно часто. Размер генома вируса гораздо меньше, поэтому у них на каждый цикл репликации приходится в среднем одна мутация. С учетом скорости размножения вируса и скорости его распространения в популяции число мутаций будет довольно велико, что и объясняет такую изменчивость.
А помимо постепенного накопления мутаций в геноме РНК-содержащих вирусов возможны и более резкие изменения, например, в процессе реассортации и рекомбинации. Реассортация - это перемешивание сегментов генома разных вирусов. Если эти сегменты были от вирусов разных хозяев (например, человека и птицы), такой новый вирус чаще всего бывает нежизнеспособным. Однако в редких случаях он все же получает возможность эффективно размножаться и передаваться от человека к человеку. Именно таким образом возникали все известные пандемии гриппа. Для некоторых вирусов с монолитным геномом возможна рекомбинация, то есть обмен фрагментами генома между разными штаммами.
В частности, такие механизмы встречаются у коронавирусов. Реассортация и рекомбинация приводят не к плавным, а к резким изменениям биологических свойств вируса. Такая изменчивость и является одним из ключевых факторов их способности ускользнуть от иммунитета человека.

В состоянии ли наука предсказать появление более опасных штаммов тех вирусов, которые давно циркулируют среди людей?
Андрей Васин: Наука в состоянии предположить, что может сделать уже известные вирусы более опасными, изучая их молекулярно-генетические механизмы. Мы можем предполагать, на какие вирусы стоит обратить особое внимание с точки зрения их пандемического потенциала. Но сказать, какое именно событие усилит патогенность вируса в реальности и тем более когда оно произойдет, к сожалению, пока невозможно.
Известно, что существует около 250 вирусов, вызывающих ОРВИ. Однако для них не создано ни тест-систем, ни вакцин. С чем это связано? И оправдано ли такое спокойствие человечества?


Андрей Васин: Сложно дать однозначный ответ. С одной стороны, обычные люди и даже многие медики считают, что вызванные вирусами респираторные заболевания в целом схожи друг с другом, и подход к их лечению примерно одинаковый. Единственное исключение составляет грипп, при этом многие люди гриппом называют все ОРВИ. Зачем тогда тратить время и деньги на их дифференциальную диагностику? Считается, что важно определить, вирус или бактерия вызвали заболевание, а если вирус, то грипп это или нет, а остальное неважно. Ведь специфических противовирусных препаратов для других респираторных вирусов нет - в отличие от множества антибиотиков против бактериальных инфекций. Но каждый вирус имеет свою собственную программу репликации в организме, поэтому и течение инфекции тоже будет отличаться, а значит, и схема лечения тоже должна иметь отличия. Как молекулярный вирусолог, я считаю, что ставить диагноз ОРВИ и не обращать внимания на то, какой вирус ее вызвал, неправильно. Возможно, медицинские вирусологи и инфекционисты не будут столь категоричны. Но я уверен, что по мере изучения респираторных вирусов нас ждет еще много сюрпризов, в том числе в механизмах их патогенеза и развития осложнений.
Но тест-системы на определение ОРВИ есть, они широко используются в системе надзора за гриппом и другими ОРВИ, осуществляемой, в частности, Национальным центром ВОЗ на базе НИИ гриппа им. Смородинцева Минздрава России. Что касается вакцин, то ОРВИ преимущественно вызваны РНК-содержащими, то есть сильно изменчивыми вирусами, и создать эффективную вакцину от них не так просто. Мы это видим на примере вакцины от гриппа, состав которой меняется ежегодно, и прививаемся мы ею не единожды в жизни, а практически каждый год. Попытки создать вакцины и против других ОРВИ предпринимались в 1960-е годы, но они оказались безуспешными. Ярким примером является респираторно-синцитиальная инфекция, вызывающая тяжелые заболевания нижних дыхательных путей, особенно у младенцев и детей младшего возраста. Была получена инактивированная вакцина, но на стадии клинических испытаний она не только не позволила защитить от инфекции, но и существенно утяжелила заболевание. После этого работы по вакцине против РС-инфекции были надолго закрыты. Только в наше время вновь вернулись к активной разработке этих вакцин, когда открыли молекулярные механизмы усиления инфекции, возникавшего при использовании вакцины в те годы, но уже с использованием новых технологий. Сейчас на стадии доклинических и клинических исследований находится несколько десятков вакцинных препаратов. Мы также проводим доклинические исследования нашего варианта вакцины против РС-инфекции в НИИ гриппа, работа финансируется Центром стратегического планирования и управления медико-биологическими рисками здоровью Минздрава России.
А были ли попытки создать вакцины от коронавирусов?
Андрей Васин: Среди сезонных респираторных вирусов встречается 4 типа коронавирусов: OC43, HKU1, NL63 и 229E. И если про коронавирусы SARS (атипичной пневмонии) и MERS (ближневосточного респираторного синдрома) люди еще слышали, то про эти четыре коронавируса ничего не знают. Против них не было разработано ни лекарств, ни вакцин. Если бы они были, мы чувствовали бы себя сейчас намного уверенней и смогли бы гораздо быстрее создать вакцину или лекарственный препарат от COVID-19.
На нашей памяти - эпидемия Эбола в Африке, вспышки других опасных вирусных лихорадок. Какие уроки были извлечены из них?


Андрей Васин: Вирус Эбола был хорошо известен специалистам и до эпидемии. Локальные вспышки заболевания фиксировались, но при чрезвычайно высокой летальности число заболевших было невелико. Эпидемия столь опасного вируса особенно в условиях бедных стран Африки - это событие чрезвычайное, требующее неотложных мер, что в конечном итоге и было сделано. На момент начала эпидемии различными лабораториями разрабатывался целый ряд препаратов против вируса Эбола, в том числе с использованием новых технологий. Был определенный задел и по вакцинам, который позволил оперативно инициировать их разработку. Эпидемия Эбола позволила апробировать целый ряд новых биотехнологических решений, которые можно применять в дальнейшем для борьбы и с другими вирусными инфекциями.
Как вы полагаете, какие изменения в нашей жизни, в организации санэпиднадзора и системы здравоохранения должны будут произойти после нынешней пандемии?
Андрей Васин: Основные изменения будут связаны скорее всего с экономическими последствиями пандемии. ВОЗ постоянно говорит о необходимости подготовки к пандемиям, разработаны соответствующие "дорожные карты". После пандемии COVID-19 эта работа будет усилена как на глобальном уровне, так и на уровне отдельных стран. А в обычной жизни, надеюсь, люди будут уделять гораздо больше внимания правилам личной гигиены, более ответственно относиться к респираторным заболеваниям и не приходить, например, на работу или в места скопления людей с ОРВИ, заражая окружающих. По крайней мере, хотя бы в первое время.
Многие годы нам рекомендовали в качестве профилактики вирусных инфекций то витамины, то модуляторы интерферонов. Теперь об этом что-то молчат. Установки изменились?
Андрей Васин: Возможно, появилась ответственность за то, что предлагаешь, так как спрос на эти предложения будет действительно серьезный. Надеюсь, что одним из положительных последствий ситуации будет и более серьезное отношение к тому, чем предлагается лечить ОРВИ. А также то, что число сторонников антипрививочного движения сократится. Ведь вакцины - это одно из величайших достижений человечества, позволившее спасти миллиарды человеческих жизней.
Как вы считаете, нужно ли все же выделить средства на изучение вроде бы не очень опасных респираторных вирусов, разработку тест-систем, доступную диагностику, вакцинопрофилактику и терапию?


Андрей Васин: Несомненно! В "мирное" время кажется, что есть более важные задачи, но вирусы - это реальная угроза человечеству. Мы живем в условиях постоянной биологической войны, только не рукотворной, а природной, которая длится миллиарды лет. Мы никогда не сможем полностью исключить вирусную угрозу, но должны быть максимально готовы ее предотвратить. Биологическая наука развивается семимильными шагами. Например, всего за несколько дней после идентификации вируса COVID-19 его геном был секвенирован и депонирован в общедоступные базы данных, что позволило оперативно начать разработку тест-систем и вакцин. В 2009 году, во время пандемии гриппа, вызванного вирусом А/H1N1, этот процесс занял гораздо больше времени. Нам нужно более подробно изучать вирусы человека и животных. Не надо забывать, что основной путь появления новых инфекций - зоонозный, поэтому крайне важно знать, что происходит с вирусами в естественных животных резервуарах. Нужно развивать новые технологии создания вакцин и препаратов. В этом смысле многообещающе выглядят РНК-вакцины, неслучайно им сейчас уделяют столько внимания. Именно это направление мы выбрали в СПбГПУ как основное.
Не знаю, насколько уместно будет такое сравнение, но инвестиции в вирусологию - это как страховой полис на автомобиль. Пока с автомобилем все в порядке, кажется: зачем я заплатил за полис, лучше бы потратил на что-то более насущное. Но если с автомобилем что-то случилось, начинаешь понимать, что без страхового полиса ты остался бы ни с чем. Думаю, что даже небольшой части суммы экономических потерь от нынешней пандемии хватило бы на поддержание и оснащение вирусологических лабораторий по всему миру на многие годы.
Читайте также:


