Роль вируса эпштейна барр в онкогематологических заболеваниях человека
- 4685
- 3,9
- 0
- 2
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Исследования в области происхождения злокачественных опухолей, ежегодно уносящих миллионы человеческих жизней, ведутся с XIX века. Работая в области молекулярной вирусологии, Вармус совместно с Дж. М. Бишопом в исследованиях 1970-х гг. сделали открытие, которое по-новому осветило долго остававшуюся дискуссионной проблему этиологии опухолей у человека и животных. Согласно полученным результатам, неконтролируемый рост клеток, образующих опухоль, вызывается не только проникающим в клетку извне онковирусом, но и внутренними процессами в самой клетке. Вармус доказал, что нормальные гены роста клетки вследствие случайных спонтанных мутаций под воздействием химических канцерогенов или, порой, процесса старения могут изменять свою молекулярную структуру и таким образом превращаться в протовирусы онкогенной природы. За открытие клеточного происхождения онкогенных протовирусов Вармус совместно с Дж. М. Бишопом в 1989 г. были удостоены Нобелевской премии по физиологии и медицине [1].
Один из самых распространённых вирусов в человеческой популяции — вирус Эпштейна-Барр (рис. 1) — был открыт и описан в 1964 году двумя английскими вирусологами: Майклом Эпштейном и Ивонной Барр. Вирус Эпштейна-Барр (ВЭБ) — член семейства герпесвирусов [6, 7]. В инфицированных клетках вирусная ДНК, как правило, не встроена в клеточный геном, а находится в ядре в виде замкнутого кольца (эписомы). Биологическое значение интеграции ВЭБ в геном клетки остается неясным. Высказываются предположения, что эписомная ДНК необходима для реализации полноценной репликации ВЭБ, завершающейся формированием вирусных частиц [8].

Рисунок 1. Структура вириона вируса Эпштейна-Барр. Вирион ВЭБ построен таким образом, что вирусная нуклеиновая кислота окружена белковой оболочкой (капсидом), образуя вместе с ней структуру, получившую название нуклеокапсид. Капсид имеет 25 граней и состоит из 162 субъединиц (так называемых капсомеров). Средние размеры вириона — около 150 нанометров. Снаружи вирусная частица покрыта двухслойной мембраноподобной оболочкой, именуемой суперкапсидом, или пеплосом. При этом между внешней мембраноподобной структурой и нуклеокапсидом располагается так называемая волокнистая оболочка, имеющая белковую природу и получившая название тегумент [8]. Рисунок с сайта viralzone.expasy.org.
В отличие от многих других герпесвирусов, вирус Эпштейна-Барр поражает в первую очередь эпителиальные клетки ротовой полости, глотки, миндалин. Здесь он размножается наиболее активно, и поэтому главным путём заражения вирусом являются поцелуи (вот и приехали). Наибольшее количество вирусных частиц находится в клетках эпителия около слюнных желез, и со слюной выделяется большое количество их. Не удивительно, что инфекционный мононуклеоз — самое распространённое заболевание, вызываемое вирусом Эпштейна-Барр, — называют ещё болезнью поцелуев [9].
Входными воротами инфекции являются клетки ротовой полости и носоглотки [10]. ВЭБ проникает в В-лимфоидную ткань ротоглотки, а затем происходит его распространение по всей лимфатической системе организма. ДНК вируса попадает в ядро клеток, при этом белки ВЭБ предоставляют инфицированным В-лимфоцитам способность непрерывно размножаться в культуре. Вирус может делать клетки бессмертными [11].
После первой встречи человека с ВЭБ вирус в незначительном количестве сохраняется в организме хозяина в течение всей жизни. Однако если любой элемент иммунного ответа нарушен, даже незначительное количество ВЭБ-инфицированных клеток может преумножиться колоссально [12].
Инфицированные В-клетки могут значительное время находиться в миндалинах, что позволяет вирусу выделяться во внешнюю среду со слюной. С зараженными клетками ВЭБ распространяется по другим органам. В пораженных вирусом клетках возможно два вида развития: литический, приводящий к разрушению клетки-хозяина, и латентный (клетка заражена, но ничего не выдает нахождения вируса), когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах, эпителии носоглотки и слюнных железах. Кроме того, он способен проникать и в другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов (рис. 2а, 2б) [13].

Злокачественные лимфомы (например, увеличение лимфоузлов), согласно данным Международного агентства по изучению рака, составляют 3–4% среди всех регистрируемых в мире злокачественных новообразований [14]. Лимфомы делят на две основные группы: лимфома Ходжкина (20–30 % всех лимфом) и неходжкинские лимфомы (около 70%) [14, 15].
Неходжикинские лимфомы — это совокупность новообразований, в возникновении которых принимают участие различные агенты [18]. Первая группа — это вирусы, трансформирующие лимфоциты и другие клетки (ВЭБ, HHV-8). Вторая группа представлена факторами различной природы, вызывающими иммунодефицитные состояния. К таким факторам в первую очередь относится ВИЧ (вирус иммунодефицита человека), вызывающий у инфицированного лица подавление иммунитета в результате истощения пула Т-лимфоцитов CD4+ и возникновение СПИДа. В третью группу входят некоторые инфекции, (например, H. pylori), которые увеличивают риск возникновения лимфом на фоне вызываемой ими хронической стимуляции иммунной системы и постоянной активации лимфоцитов [17].
Исследования последних лет свидетельствуют о том, что в патогенезе ВЭБ-ассоциированных патологий чрезвычайно важную роль играет вредный LMP1 — латентный мембранный белок 1, кодируемый одноименным геном (LMP1). Он обладает свойствами онкобелка и функционирует как постоянно активный псевдорецептор. Он способен изменять В-лимфоциты человека [19].
Есть предположение, что аминокислотные замены, накапливающиеся в LMP1, по-видимому, также вносят свой вклад в возникновение опухолей. Механизм этого процесса окончательно не установлен, но предполагается, что усиленный трансформирующий эффект мутированных LMP1 может представлять важную составляющую этого процесса. При этом показано, что различия в последовательности гена LMP1 могут определять агрессивный географически локализованный генотип ВЭБ [21].
Из известных механизмов действия LMP-2 (второй из братьев семейства LMP), расположенного на противоположном конце линейного генома, упоминается лишь способность этих белков совместно повышать сигнальную трансдукцию в ВЭБ (+) клетках [19].
По данным Харальда цур Хаузена, связь между вирусом и раковым заболеванием считается установленной при определении следующих критериев:
- эпидемиологические доказательства того, что вирусная инфекция является фактором риска для развития специфической опухоли;
- присутствие и сохранение генома вируса в клетках опухоли;
- стимуляция пролиферации клеток после введения генома (или его части) вируса в ткани культуры клеток;
- демонстрация того, что геном возбудителя индуцирует пролиферацию и злокачественный фенотип опухоли [19].
Однако канцерогенность ВЭБ далеко не однозначна. Несмотря на то, что кодируемые вирусом продукты способны вызывать пролиферацию инфицированных клеток, ведущую к возникновению лимфом у больных с иммунодефицитом, эти клинически агрессивные опухоли довольно часто поликлональны и подвергаются регрессии при восстановлении иммунного ответа на ВЭБ. Такие опухоли как лимфома Беркитта (ЛБ) и лимфома Ходжкина (ЛХ) встречаются не только в ВЭБ-ассоциированных, но и в ВЭБ-неассоциированных вариантах, что говорит о том, что патогенез этих новообразований связан не только с ВЭБ. Кроме того, злокачественные клетки больных ЛБ и ЛХ отличаются фенотипически от клеток ЛКЛ, полученных под воздействием ВЭБ in vitro, и не экспрессируют ряд белков, необходимых для трансформирующего роста. Эти находки позволяют предположить, что опухолевые клетки могут возникать и под воздействием факторов невирусного происхождения, а также зависеть от различных усиливающих рост клеток стимулов [17].
Лабораторная диагностика ВЭБ-инфекции базируется на цитологическом исследовании крови или костного мозга, серологических исследованиях и ПЦР. С помощью метода ПЦР можно определить ДНК вируса в плазме до клинических проявлений болезни, а репликация вируса в организме является показанием к противовирусной терапии и критерием эффективности проведенного лечения. Материалом для исследования служат слюна или рото- и носоглоточная слизь, соскоб эпителиальных клеток урогенитального тракта, кровь, спинномозговая жидкость, ткани опухоли и костный мозг. Как у больных ВЭБ, так и у носителей может быть получен положительный результат в ПЦР. Поэтому для их дифференцировки проводится количественный ПЦР-анализ для определения количества копий вирусного генома. У маленьких детей (до 1–3-х лет) по причине недостаточно сформированного иммунитета диагностика по антителам затруднительна, поэтому в данной группе пациентов в помощь приходит именно ПЦР. Однако в силу того, что ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов (до 30%), связанный именно с отсутствием репликации в момент исследования. При этом важно сопоставление результатов клинических, серологических и молекулярных обследований в определении ВЭБ-инфекции, как причины имеющегося заболевания [1].
Специфическая профилактика (вакцинация) против ВЭБ не разработана, но проводятся клинические испытания. Основной проблемой при разработке вакцины является большое отличие в белковом составе вируса на разных фазах его существования. Впрочем, в настоящее время разрабатывается вакцина, которая содержит рекомбинантный поверхностный антиген gp350. После вакцинации первичная инфекция протекает субклинически, но собственно инфицирование человека не предупреждается. Кроме того, вырабатывающиеся нейтрализующие антитела не влияют на течение различных форм латентной инфекции, в том числе опухолей. Профилактические меры сводятся к укреплению иммунитета, закаливанию детей, мерам предосторожности при появлении больного в окружении, соблюдение правил личной гигиены.
Заключение
Широкое распространение ВЭБ с выраженным трансформирующим потенциалом среди населения планеты и редкого возникновения в инфицированной популяции связанных с этим вирусом опухолей с преимущественной их локализацией в определенных географических регионах позволяет сделать важный вывод. Подобно большинству опухолей иной вирусной природы, в патогенезе ВЭБ-ассоциированных новообразований важную роль играют дополнительные факторы, и одного ВЭБ недостаточно для возникновения опухоли. ВЭБ лишь инициирует пролиферацию инфицированных им клеток, а последующие события влияют на гистопатологический спектр возникающих неоплазий. Одним из важнейших факторов, в значительной степени определяющих возникновение ВЭБ-ассоциированных опухолей, служит выраженная иммуносупрессия (врожденная, ятрогенная или индуцированная любой вирусной инфекцией, и в первую очередь ВИЧ), приводящая к утрате функции иммунного распознавания клеток, инфицированных ВЭБ.
Таким образом, несмотря на многолетнее изучение связи ВЭБ с опухолями человека, вопрос о роли вируса в их возникновении до конца не изучен. Раскрытие механизма злокачественной трансформации вирусом, персистирующим в латентном состоянии более чем у 90% населения планеты, — задача чрезвычайно сложная. Однако технические достижения последних лет, существенно повысившие специфичность исследований, позволяют надеяться, что детали ВЭБ-ассоциированного канцерогенеза будут выяснены.
Дудукина Елена Александровна
студент 5 курса медико-профилактического факультета, Первый МГМУ им. И.М. Сеченова, г. Москва
Львов Николай Дмитриевич
Вирус Эпштейна-Барр (ВЭБ), будучи одним из древнейших, как полагает современная наука, коэволюционаровал одновременно со своими хозяевами на протяжении миллионов лет [1, p. 929]. Благодаря способности поддерживать латентную инфекцию в организме в течение всей его жизни и периодически реактивироваться, не вызывая выраженных клинических проявлений у большинства инфицированных лиц, Эпштейн-Барр вирусная инфекция стала практически повсеместно распространена в популяции. Инфицированность мирового населения составляет >90 % [1, p. 986].
Дети в развивающихся странах приобретают Эпштейн-Барр вирусную инфекцию на первом году жизни, средний возраст сероконверсии в мире — 3—4 года. В развитых странах инфицирование происходит в подростковом возрасте [1, p. 929]. В некоторых развитых странах наблюдается бимодальный подъем заболеваемости с первым пиком у детей до 5 лет и вторым — среди детей 10-ти лет. Клинические проявления различны в зависимости от возраста первичного контакта с инфекционным агентом. При заражении в раннем детстве клиника стертая либо отсутствует, в то время как при инфицировании Эпштейн-Барр вирусом в школьном и подростковом возрасте развивается классическая клиническая картина инфекционного мононуклеоза: фебрильная лихорадка, ангина, увеличение заднешейных лифатических узлов, гепатоспленомегалия, в крови обнаруживаются атипичные мононуклеары. При использовании серологического метода диагностики с момента развития клинических признаков болезни на протяжении следующих 4—6 недель обнаруживаются IgM к VCA (viral capsid antigen) — вирусному капсидному антигену, с первой недели болезни до нескольких лет после выздоровления — Anti-EBV-EA-D Ig G (early antigen — D EBV) — антитела к раннему антигену D Эпштейн-Барр вируса, через несколько недель после появления клинических признаков определяются EBNA-IgG (иммуноглобулины класса G к нуклеиновым кислотам Эпштейн-Барр вируса), сохраняющиеся на протяжении всей жизни человека.
Титры антивирусных антител у серопозитивных лиц варьируются в зависимости от возраста, следуя U-образной кривой. Максимальные титры наблюдаются у детей и в возрастной группе старше 50 лет. Высокий уровень антивирусных антител среди детей объясняется наличием первичной инфекции, тогда как у пожилых людей повышение титра антител в основном связано с возраст-зависимой реактивацией инфекции вследствие ослабленного клеточного иммунного ответа [1, p. 929].
Эпштейн-Барр вирусная инфекция была обнаружена среди всех народов мира. В популяции циркулируют два основных типа вирусов, отличающихся по набору генов, которые кодируют ядерные белки в период латентного течения инфекции [1, p. 475]. Встречаемость штамма EBV1(Эпштейн-Барр вируса 1-го типа) несколько десятилетий назад была выше среди Западных популяций, тогда как штамм EBV2 (Эпштейн-Барр вирус 2-го типа) был распространен среди населения Африки, Папуа-Новой Гвинеи, а также среди коренного населения Аляски [1, p. 475]. Микст-инфекция двумя штаммами Эпштейн-Барр вируса отмечалась у ВИЧ/СПИД-положительных лиц. Однако информация, представленная в современных исследованиях, говорит о том, что большая часть населения всех континентов в настоящий момент подвержена инфицированию обоими типами Эпштейн-Барр вируса одновременно.
Распространенность полиморфизма специфических ДНК последовательностей Эпштейн-Барр вируса также имеет географические особенности. Наиболее изучен в этой области Эпштейн-Барр вирус-кодируемый онкоген LMP1 (latent membrane protein 1) — латентный мембранный белок 1 типа, различные варианты нуклеотидных последовательностей которого обнаруживаются у отдельных изолятов (штаммов) вируса, некоторые из них связаны с повышенным риском возникновения назофарингеальной карциномы [1, p. 929].
Недавние исследования показали, что вариации нуклеотидных последовательностей, кодирующих LMP1, полученные из клеток назофарингеальной карциномы в странах с высокой заболеваемостью этим новообразованием (в основном Юго-Восточная Азия), имеют четкие отличия от LMP1 белка клеток назофарингеальной карциномы, встречающейся в странах с низкой инцидентностью. Это дало основания предполагать существование определенной положительной селекции нуклеотидных последовательностей, кодирующих LMP1, в сторону сохранения изолятов с более выраженным онкогенным потенциалом в странах, эндемичных по назофарингеальной карциноме [1, p. 932].
Ранняя первичная Эпштейн-Барр вирусная инфекция связана, прежде всего, с плохими социально-экономическими условиям. Так в развитых странах подъем заболеваемости инфекционным мононуклеозом начинается гораздо позже, чем в развивающихся. Среди детей в возрасте от 5 до 10 лет, проживающих в неблагоприятных гигиенических условиях, серопревалентность по антивирусным антителам составляет 60 % по сравнению с менее чем 20 %-ой серопревалентностью среди детей, проживающих в более благоприятных санитарно-гигиенических условиях [1, p. 930].
Высокая распространенность Эпштейн-Барр вирусной инфекции наблюдается по всему миру, что служит индикатором весьма ограниченного влияния хозяин-специфических факторов на ее течение. Тем не менее, среди Инуитов (Эскимосов), проживающих в Антарктике, а также среди народов Юго-Восточной Азии существуют определенные генетические особенности иммунного ответа против Эпштейн-Барр вируса, что подтверждается необычно высоким титром антивирусных антител класса G к VCA (viral capsid antigen) — вирусному капсидному антигену, который остается постоянно высоким на протяжении всей жизни Инуитов [1, p. 931].
Эпштейн-Барр вирусная инфекция передается аэрозольным, фекально-оральным, контактным и трансмиссивным механизмами, реализуясь различными путями. Наиболее распространенным фактором передачи является слюна. Среди подростков и взрослого населения главным путем инфицирования является прямая передача вируса со слюной во время поцелуя, тогда как главным путем передачи инфекции среди маленьких детей является контактный, опосредованный через игрушки, на которых присутствует слюна носителя инфекции. В развивающихся странах были описаны случаи, когда матери перед тем, как давать пищу детям, пережевывали ее, что являлось главным фактором в распространении Эпштейн-Барр вирусной инфекции среди маленьких детей в семьях. Тем не менее, несмотря на 40-летнюю историю изучения Эпштейн-Барр вирусной инфекции, не все особенности передачи вируса до конца выяснены. После заражения инфицированное лицо может выделять Эпштейн-Барр вирус в окружающую среду различными путями. Так наличие Эпштейн-Барр вируса в секрете слюнных желез серопозитивных лиц варьируется от 22 % до 90 %. Наличие вирионов Эпштейн-Барр вируса в секрете слюнных желез, взятом в любой момент времени у конкретного пациента также может варьироваться в широких пределах от 32 % до 73 %. В ходе исследований не удалось обнаружить связь между наличием Эпштейн-Барр вируса в слюнном секрете и уровнем атипичных мононуклеаров (peripheral blood mononuclear cells, PBMCs). Т. о. полагают, что факторы ответственные за активацию репликации вируса и увеличение вирусной нагрузки в клетках слюнных желез слизистой оболочки ротоглотки и лимфоцитах крови могут различаться. Эпштейн-Барр вирус обнаруживается в цервикальном секрете 8—28 % девушек-подростков и женщин детородного возраста, а также в образцах спермы. Трансплацентарная передача Эпштейн-Барр вируса и передача с грудным молоком были описаны некоторыми исследователями, тем не менее, считается, что они не играют существенной эпидемиологической роли. Важными способами передачи Эпштейн-Барр вируса являются трансфузионный и трасплантационный. К примеру, эритроцитарная масса в среднем содержит два вириона Эпштейн-Барр вируса, в то время как в цельной крови среднее число вирионов колеблется от 600 до 700 ед. Эпштейн-Барр вирусная инфекция у людей после трансплантации органов в высшей степени коррелирует с возникновением так называемой посттрансплантационной лимфопролиферативной болезни (PTLD, posttransplant lymphoproliferative disease, or disorder), относящейся к опухолям [1, p. 931].
За последнее десятилетие методы, позволяющие обнаружить и количественно оценить внутри- и внеклеточную вирусную нагрузку, значительно усовершенствовались, что позволяет прослеживать в динамике вирусную нагрузку у пациентов, страдающих Эпштейн-Барр вирус-ассоциированными заболеваниями. Нагрузка более чем 10 2,5 копий Эпштейн-Барр вирусного генома /мкг ДНК при использовании метода ПЦР в режиме реального времени является клинически значимой [1, p. 932].
В крови клинически здоровых лиц с латентно протекающей Эпштейн-Барр вирусной инфекцией наблюдается приблизительно постоянное число инфицированных B-лимфоцитов, которое составляет 1—50 зараженных клеток на 1,000,000 B-лимфоцитов, вирусная нагрузка у таких лиц — менее 100 копий ДНК на 10 5 клеток. Однако даже у клинически здоровых лиц уровень вирусной нагрузки в периферической крови подвержен постоянным колебаниям. Как предполагают исследователи, это связано с эпизодической реактивацией вирус-зависимой клеточной пролиферации пораженных клеток: B-, Т-лимфоцитов, NK-клеток, макрофагов, нейтрофилов. В период острой первичной инфекции виремия достигает 10 3,7 копий генома ВЭБ /мкг ДНК, у пациентов с хронической активной формой Эпштейн-Барр вирусной инфекции, при назофарингеальной карциноме, посттрансплантационных лимфопролиферативных заболеваниях и других состояниях, связанных с персистенцией и последующей губительной реактивацией Эпштейн-Барр вируса, виремия — 10 4,1 копий /мкг ДНК [2]. Золотым стандартом в диагностике ВЭБ — ассоциированных заболеваний в настоящее время является обнаружение ДНК Эпштейн-Барр вируса в крови пациента с использованием ПЦР методики, дополнительное применение серологической диагностики проводят в случае необходимости [1, p. 932—934].
Многие из состояний, ассоциированных с Эпштейн-Барр вирусной инфекцией, развиваются у иммунокомпрометированных лиц, лиц пожилого возраста и в условиях, провоцирующих снижение иммунорезистентности организма. Для эпидемиологии многих Эпштейн-Барр вирус-положительных злокачественных новообразований характерна связь с географическим фактором — эндемичными районами, а также с генетическими детерминантами и влиянием окружающей среды. За последние десять лет были проведены исследования, в результате которых открылись новые подробности течения латентных состояний, закономерности опухолевой трансформации и механизмы иммортализации клеток. Латентное течение Эпштейн-Барр вирусной инфекции может иметь несколько форм, отличных по набору экспрессируемых генов, белковому профилю пораженных клеток, наличию или отсутствию характерных рецепторных белков на их поверхности, а также по морфологической картине пораженной ткани, что приводит к развитию различных ассоциированных состояний.
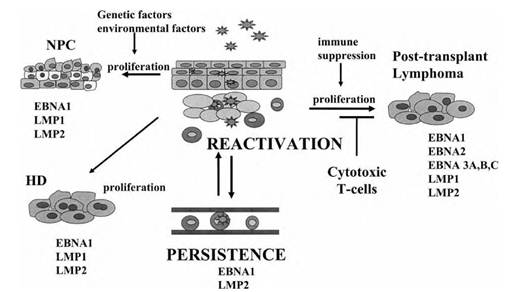
Рисунок 1. Патогенез ВЭБ инфекции
Классический путь заражения ВЭБ реализуется через слюну, при попадании на слизистую оболочку ротоглотки ВЭБ инвазирует эпителиоциты и лимфоциты, где размножается и реализует литический цикл. Вследствие виремии происходит диссеминация ВЭБ в красный костный мозг, органы РЭС. Также распространение ВЭБ инфекции происходит при миграции B-лимфоцитов. Реактивация вирусной инфекции возможна во всех инфицированных клетках, однако наибольшую роль во вторичном распространении ВЭБ играет механизм персистенции в B- лимфоцитах. На рисунке изображены паттерны экспрессии генов ВЭБ при различных формах течения латентной инфекции [1, p. 985].
Персистенция Эпштейн-Барр вируса в B-клетках памяти обычно протекает достаточно вяло с экспрессией лишь ядерного антигена 1 (nuclear antigen 1) — EBNA1 и/или латентного мембранного протеина 2 (latent membrane protein) — LMP2. Пролиферация пораженных B-лимфоцитов подконтрольна цитотоксическим лимфоцитам, распознающим EBNA белки как антигены. Именно это обстоятельство является объяснением высокой частоты развития B-лимфом у пациентов в состоянии иммунодепрессии, когда функция цитотоксических лимфоцитов подавлена и контроль за пролиферацией B-лимфоцитов утрачен. Реактивация литического цикла Эпштейн-Барр вируса в эпителиоцитах слизистой оболочки ротоглотки приводит к распространению инфекции в популяции, а латентное течение инфекции в эпителиоцитах ротоглотки с экспрессией генов EBNA1, LMP1 и LMP2 обуславливает синтез белков, трансформирующих и иммортализирующих клетки, приводя к возникновению различных типов назофарингеальной карциномы [1, p. 987].
В течение латентного периода Эпштейн-Барр вирусной инфекции происходит экспрессия многих генов ВЭБ. In vivo принято выделять три формы течения латентной инфекции в зависимости от набора экспрессируемых вирусных генов в пораженных клетках. В клетках лимфобластоидных культур in vitro (lymphoblastoid cell lines, LCL) и в клетках посттрансплантационных лимфом in vivo экспрессируются гены шести основных белков латентной инфекции: EBNA 1, 2, 3A, 3B, 3C, и ген лидирующего протеина — EBNA-LP (Leader Protein). Перечисленные белки регулируют экспрессию собственных генов, а также генов, кодирующих LMP1 и LMP2. Кроме того в клетках посттрансплантационных лимфом обнаруживаются неполиаденилированные РНК — EBER1 и EBER2. Они представляют собой молекулы некодирующей РНК длиной около 170 нуклеотидов. Транскрипция этих РНК молекул осуществляется РНК-полимеразой III клетки-хозяина. Биологическим действием EBERs является увеличение продукции ИЛ-10 Th2-лимфоцитами и угнетение функции цитотоксических T-лимфоцитов. Также в клетках LCL и посттрансплантационных лимфом обнаруживаются продукты правосторонней транскрипции BamHI A региона генома Эпштейн-Барр вируса — BARTs молекулы, которые представляют собой группу из 20 различных видов молекул микроРНК, получившихся в результате сплайсинга первичной молекулы РНК. BARTs активно участвуют в регуляции экспрессии различных вирусных (например, LMP1) и клеточных генов. Латентная инфекция, сопровождающаяся экспрессией всех перечисленных вирусных генов, считается латентной инфекцией 3 типа. Первые два типа течения латентной инфекции не отличаются подобным разнообразием экспрессируемых генов Эпштейн-Барр вируса в пораженных клетках. 1 тип течения латентной инфекции является наименее активным в отношении экспрессии вирусных генов, однако это не означает, что данный тип персистенции имеет наиболее благоприятное течение. Характерным признаком персистенции 1 типа является экспрессия генов EBNA1 и присутствие EBERs вследствие транскрипции BamHI A региона генома ВЭБ. Данный тип персистенции Эпштейн-Барр вируса встречается в клетках лимфомы Беркитта. 2 тип течения латентной Эпштейн-Барр вирусной инфекции был найден в малигнизированных клетках назофарингеальной карциномы и Ходжкинской лимфомы, при этом набор экспрессируемых генов ограничивается следующими: EBNA1, LMP1, LMP2, EBERs, BARTs [1, p. 987—983].
Таблица 1.
Тип течения латентной инфекции в зависимости от паттерна экспрессии генов Эпштейн-Барр вируса
ВЭБ-инфекция — одна из самых распространённых вирусных инфекций в мире. Антитела к вирусу имеет 90% взрослого населения и около 50% детского. Я очень часто сталкиваюсь с необоснованным назначением анализов на ВЭБ-инфекцию, к тому же совершенно неправильных. Нередко эта инициатива исходит от самих пациентов — непонятно, с какой целью. И уж тем более непонятно назначение лечения при обнаружении антител к вирусу или его самого в мазке из зева. Давайте разберёмся, нужны ли анализы на ВЭБ большинству пациентов.
ВЭБ-инфекция — это инфекция, вызванная вирусом Эпштейна-Барр, вирусом герпеса 4 типа. Инфицирование человека происходит в детском или подростковом возрасте. Передается инфекция воздушно-капельным, а чаще контактным (при поцелуях) путем. Поэтому ее еще называют "поцелуйной болезнью".
Заразность вируса невысокая. Чтобы произошло инфицирование, необходим тесный и длительный контакт больного и здорового человека. Тем не менее, инфекция широко распространена по всему миру.
Симптомы вируса Эпштейна-Барр
Первичное знакомство организма с ВЭБ обычно проходит бессимптомно. У подростков и молодых людей возможно развитие инфекционного мононуклеоза — это самая яркая клиническая форма ВЭБ-инфекции. Взрослые и пожилые люди инфекционным мононуклеозом болеют крайне редко.
Заболевание развивается примерно через две недели после контакта с больным человеком.
Начало обычно острое
- температура свыше 38 градусов;
Характерные симптомы инфекционного мононуклеоза
1. Увеличение лимфатических узлов. Поражаются околоушные, шейные, подчелюстные узлы. Реже процесс переходит на подмышечные и паховые.
2. Второй типичный признак — ангина. Она бывает разнообразной: катаральной, фолликулярной, лакунарной. Чаще всего наблюдается не только покраснение и отек миндалин, но и налёт на них. Ангина сопровождается болями в горле, особенно при глотании.
3. У большинства пациентов увеличиваются печень и селезёнка. Они хорошо прощупываются, но не болезненны, желтуха возникает редко.
4. У 25% пациентов на коже появляется сыпь. Она может быть пятнистой или в виде мелких бугорков.
Ангина при инфекционном мононуклеозе — один из главных признаков
Заболевание продолжается 10-14 дней, затем наступает полное выздоровление. Незначительное увеличение лимфоузлов и печени сохраняется до месяца.
Повторно инфекционным мононуклеозом, вызванным ВЭБ, не болеют. Однако возможны мононуклеозоподобные состояния, вызванные цитомегаловирусом, ВИЧ, вирусом герпеса 6 и 7 типов.
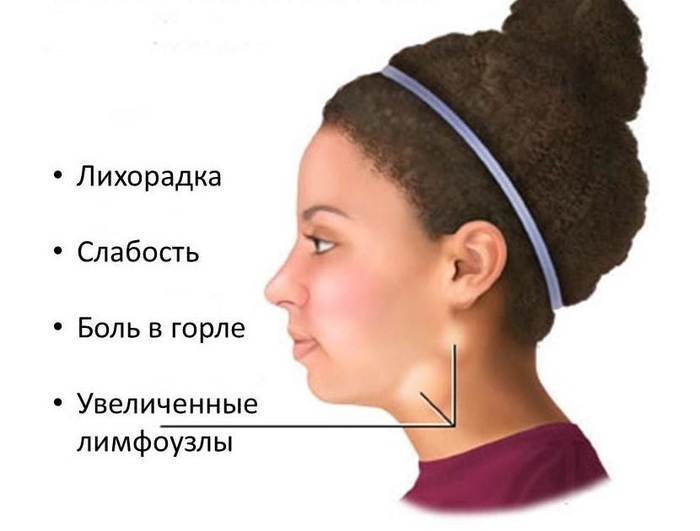
Основные симптомы хронической ВЭБ-инфекции
После завершения первичной инфекции вирус остается в организме человека пожизненно. Он содержится у абсолютно здоровых людей в слюне, моче и даже крови, именно поэтому сдавать мазки на ВЭБ-инфекцию нецелесообразно. В большинстве случаев вирус находится в неактивной форме и такое состояние называют бессимптомным носительством.
Хроническая активная ВЭБ-инфекция выявляется только у людей с нарушениями иммунитета.
Проявляется она следующими симптомами
- длительное увеличение нескольких групп лимфоузлов;
- беспричинное повышение температуры в пределах 37,5 градусов;
- мышечные и суставные боли.
Установлена роль вируса в развитии злокачественных опухолей носоглотки, лимфомы Беркитта.
Диагностика вируса Эпштейна-Барр
Это основная проблема ВЭБ-инфекции. Вирус обвиняют во всевозможных состояниях и заболеваниях — аллергии, хронические тонзиллиты, гаймориты, фурункулезы, гепатиты. На самом деле ничего этого ВЭБ не вызывает. Ангина и гепатит — это проявления только первичного инфицирования, то есть инфекционного мононуклеоза. А если у человека с хроническим тонзиллитом в мазке из зева выявлен ВЭБ — это не причина заболевания. Вирус точно так же содержится в слизистой зева здорового человека.
Как же нужно диагностировать ВЭБ-инфекцию?
1. При остром инфекционном мононуклеозе можно взять мазок из зева на ДНК вируса — и это единственный случай, когда анализ будет целесообразным.
2. В общем анализе крови можно увидеть завышенные лейкоциты, лимфоциты, моноциты. Главный лабораторный признак инфекционного мононуклеоза — атипичные мононуклеары. Это незрелые моноциты, количество которых может достигать 70%. У здоровых людей этих клеток нет.
3. В биохимическом анализе крови видны завышенные печёночные ферменты — АЛТ и АСТ.
4. Серодиагностика — обнаружение антител класса М к капсидному антигену вируса. Эти антитела появляются только при первичном заражении и в дальнейшем больше не образуются. Антитела класса G к капсидному антигену сохраняются на протяжении всей жизни.
5. При остром мононуклеозе также можно взять анализ крови на ДНК вируса методом ПЦР.
6. Острый мононуклеоз — показание для обследования человека на ВИЧ.
Для диагностики хронической активной ВЭБ-инфекции используется только выявление антител к разным антигенам вируса. Только так можно установить степень активности инфекции. Исследуют антитела к раннему и капсидному антигенам вируса. При реактивации инфекции обнаруживают антитела класса М к раннему антигену и высокие титры антител класса G к ядерному антигену. Все остальные антитела — лишь следствие перенесённой когда-то острой инфекции, они не дают информации об активности вируса в настоящем.
Как лечить вирус Эпштейна-Барр?
При инфекционном мононуклеозе лечение симптоматическое. Специфических противовирусных препаратов против ВЭБ нет. Допускается назначение группы ацикловира для уменьшения проявлений ангины. Симптоматическая терапия заключается в назначении жаропонижающих средств, гепатопротекторов, витаминов. Лечение амбулаторное, госпитализация рекомендована при тяжелом течении.
Еще раз повторюсь — не надо лечить антитела в крови и вирус в мазке из зева, если нет никаких нарушений здоровья. Это абсолютно нормальное состояние для человека без иммунодефицита. К тому же противовирусных препаратов, действующих на ВЭБ, нет.
ВЭБ-инфекция клинически проявляется в виде инфекционного мононуклеоза при первичном инфицировании. В дальнейшем вирус сохраняется в организме пожизненно в неактивной форме. Хроническая активная ВЭБ-инфекция возникает лишь у людей с иммунодефицитом.
Человеку, перенесшему инфекционный мононуклеоз, нужно обратиться к участковому инфекционисту для постановки на диспансерное наблюдение. Оно проводится от 6 до 24 месяцев в зависимости от тяжести болезни. В течение полугода следует избегать переохлаждений, перегреваний, физической нагрузки. Обязательно нужно двукратно обследоваться на ВИЧ.
![]()
Герпес-вирусная инфекция. Мнение
Выкладываю с разрешения жены, врача оториноларинголога.
Статья носит ознакомительный характер, не претендует на научную точность и является личным мнением автора по итогу десятилетних наблюдений за амбулаторными (посетители поликлиник) больными, в большинстве своем детьми, маленького уездного города N.
По итогу 10 лет работы в направлении ЛОР болезней мною было отмечено, что у детей особенно часто встречается герпес-вирусная инфекция. К разновидностям герпес-вирусной инфекции относится: Вирус Эпштейн – Барр (ВЭБ), цитомегаловирус, герпес 6, 7 типа. В сети полно информацию об этих инфекциях. Но в большинстве своем большими буквами будет написано, что лечить их не нужно, они есть у всех. Нет определенных стандартов в лечении этих инфекций, затруднительна так же диагностика.
Если брать клинические рекомендации 2016 года, то при подозрении на вирусную инфекцию необходимо сдать ПЦР крови на герпесвирусы, но отрицательный результат на практике не гарантирует того, что вирус не активный. Так же предлагается сдать ИФА крови, но если по ВЭБ инфекции расшифровка понятна : присутствие иммуноглобулинов М является острым процессом и обязательно подлежит лечению, а также отсутствие иммуноглобулинов М при увеличении G (капсидные антитела больше чем ядерные, повышенные антитела к ранним белкам). Что касается цитомегаловирусной инфекции : наличие М-антител говорит об остром процессе, но их отсутствие при увеличенных G c низкоавидными антителами подлежит лечению. Так же лаборатории предлагают сдать слюну методом ПЦР, положительным результатом считаются цифры больше 500 клеток, но это можно расценить как носительство, поэтому наиболее информативно сдавать и кровь и слюну и оценивать результат.
Теперь по поводу противовирусного лечения. Существует множество противовирусных препаратов. Наиболее известные: интерфероны (виферон, кипферон, генферон, реаферон), индукторы интерферонов (изопринозин, арбидол, циклоферон), стимуляторы Т звена: тимоген, т-активин, иммунофан, вироцидные, ацикловир, валацикловир, фамвир, антибактериальная терапия, иммуноглобулины человека. Но интернет опять вам скажет, что большинство из них с недоказанной эффективностью. Чем лечить? Не лечить? Обильное питье, прогулки на свежем воздухе, проветривания, витаминотерапия-все это важно! НО этого чаще всего бывает недостаточно и организму нужно помочь медикаментозно!
ПОЧЕМУ ВИРУС НЕ СПИТ? Ведь он есть у всех и если человек заболел, то организм сам с ним должен справиться, скажет вам интернет! Согласна, но почему то у многих он не самоизлечивается. Предполагаются следующие причины: аллергия, глистные инвазии, рефлюс –эзофагит, стресс, носительство бактериальных инфекций, недостаток витамина D, врожденные иммунодефициты, железодефицитная анемия, патология тимуса.
Что касается лечения то при всех вирусных инфекциях страдает интерфероновый статус, поэтому считаю оправданным назначение интерферонов коротким курсом. Для того чтобы остановить цикл размножения герпесов нужны производные ацикловира курсом 5-7 дней. Индукторы интерферона нужны, чтобы поддержать интерфероновый статус после отмены препаратов с готовым интерфероном. Стимуляторы Т звена необходимы при нарушении его работы (только после сдачи иммунограммы). Препараты иммуноглобулина человека назначаются и имеют доказанную эффективность только при внутривенном введении (что затруднительно в амбулаторных условиях). И очень ВАЖНО выяснить и лечить причины которые мешают организму самоисцелиться (см. выше) это поможет предотвратить новый рецидив.
Герпесвирусную инфекцию должны диагностировать и лечить врачи педиатры, терапевты. Но на практике эти пациенты оказываются на приеме у Лор-врача с осложнениями, из-за трудности диагностики герпесвирусной инфекции.
Когда можно заподозрить герпесвирусную инфекцию?
1. Частые тонзиллофарингиты.
2. Длительный кашел.
3. Субфебрилитет (периодическое повышение температуры до +37/38 градусов)
4. Длительный насморк.
5. Синдром хронической усталости.
6. Частые отиты, аденоидиты.
При подозрении на герпесвирусную инфекцию необходимо сдать:
1. ПЦР крови, ИФА крови, ПЦР слюны на вирусы
2. Общий анализ крови с формулой- поможет заподозрить причины почему нет самоизлечения.
3.Мазки на флору из зева и носа с чувствительностью к антибиотикам (при присоединении бактериальных осложнений)
4.Пройти консультацию смежных специалистов инфекциониста, аллерголога -иммунолога по показаниям.
Если заинтересовало, то продолжение следует.
Читайте также:


