Синтез вирусных нуклеиновых кислот
Для вирусов характерен дизъюнктивный (от disjuncus — разобщенный) способ репродукции-размножения. Потомство вируса возникает в результате сборки нуклеиновых кислот и белковых субъединиц, которые синтезируются раздельно клеткой хозяина.
Проникновение вируса в клетку и воспроизведение себе подобных проходит в несколько фаз:
1.проникновение в клетку хозяина,
2.синтез ферментов, необходимых для репликации вирусных нуклеиновых кислот,
3.синтез вирусных частей,
4.сборка и композиция зрелых вирионов,
5.выход зрелых вирионов из клетки.
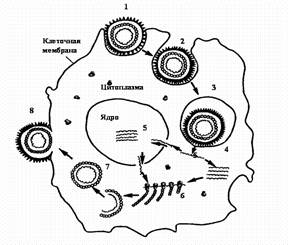
Стадии репродукции вирусов.
1 - адсорбция вириона на клетке; 2 - проникновение вириона в клетку путем виропексиса;
3 - вирус внутри вакуоли клетки; 4 - `раздевание вириона вируса; 5 - репликация вирусной нуклеиновой кислоты; 6 - синтез вирусных белков на рибосомах клетки; 7 - формирование вириона; 8 - выход вириона из клетки путем почкования.
Фаза I — адсорбция вириона на поверхности клетки.
Протекает в две стадии: первая — неспецифическая, когда вирус удерживается на поверхности клетки при помощи электростатических сил, т. е. благодаря возникновению противоположных зарядов между отдельными участками мембраны клеток и вируса. Эта фаза взаимодействия вируса с клеткой обратима, на нее оказывают влияние такие факторы, как рН и солевой состав среды.
Вторая стадия — специфическая, когда взаимодействуют специфические рецепторы вируса и рецепторы клетки, комплементарные друг другу. По химической природе рецепторы клетки могут быть мукопротеидами (или мукополисахаридами) и липопротеидами. Разные вирусы фиксируются на разных рецепторах: вирусы гриппа, парагриппа, аденовирусы — на мукопротеидах, а вирусы клещевого энцефалита, полиомиелита — на липопротеидах.
Фаза II — проникновение вируса в клетку. Электроноскопические наблюдения за процессом проникновения вирусов в чувствительные к ним клетки показали, что оно осуществляется посредством механизма, напоминающего пиноцитоз, или, как чаще называют, виропексис. В месте адсорбции вируса клеточная стенка втягивается внутрь клетки, образуется вакуоль, в которой оказывается вирион. Параллельно клеточные ферменты (липазы и протеазы) вызывают депротеинизацию вириона — растворение белковой оболочки и освобождение нуклеиновой кислоты.
Фаза III — скрытый период (период эклипса — исчезновения). В этот период в клетке невозможно определить наличие инфекционного вируса ни химическими, ни электронно-микроскопическими, ни серологическими методами. О сущности этого явления и его механизмов пока известно мало. Предполагается, что в скрытой фазе нуклеиновая кислота вируса проникает в хромосомы клетки и вступает с ними в сложные генетические взаимоотношения.
Фаза IV — синтез компонентов вириона. В этой фазе вирус и клетка представляют единое целое, вирусная нуклеиновая кислота выполняет генетическую функцию, индуцирует образование ранних белков и изменяет функцию рибосом. Ранние белки подразделяются на:
а) белки-ингибиторы (репрессоры), подавляющие метаболизм клеток
б) белки-ферменты (полимеразы), обеспечивающие синтез вирусных нуклеиновых кислот.
Синтез нуклеиновых кислот и белков протекает неодновременно и в разных структурных частях клетки. У вирусов, содержащих ДНК или РНК, эти процессы имеют некоторые различия и особенности.
Процесс формирования вирионов начинается спустя определенное время после того, как начал осуществляться синтез составляющих их компонентов. Продолжительность этого периода довольно вариабельна и предопределяется природой вируса — для РНК-содержащих обычно короче, чем для ДНК-вирусов. Например, продукция полных вирусных частиц осповакцины начинается приблизительно спустя 5—6 ч после инфицирования клеток и продолжается в течение последующих 7—8 ч, т. е. после того как синтез вирусной ДНК уже завершен.
Между нуклеиновой кислотой и соответствующим белковыми субъединицами образуются очень прочные связи, о чем свидетельствуют трудности отделения белка от вирусной нуклеиновой кислоты. Большую прочность вирусной частице придают входящие в ее состав углеводы и особенно липиды.
Формирование вирионов, так же как и синтез компонентов вируса, происходит в разных местах клетки, при участии различных клеточных структур. После завершения процесса формирования образуется зрелая дочерняя вирусная частица, обладающая всеми свойствами родительского вириона. Но иногда наблюдается образование так называемых неполных вирусов, которые состоят или только из нуклеиновой кислоты, или из белка, или из вирусных частиц, формирование которых остановилось в какой-то промежуточной стадии.
Фаза VI — выход зрелых вирионов из клетки. Существуют два основных механизма выхода зрелых вирионов из клетки:
1) выход вириона с помощью почкования. В этом случае наружная оболочка вириона происходит из клеточной мембраны, она содержит как материал клетки хозяина, так и вирусный материал;
2) выход зрелых вирионов из клетки через бреши в мембране. Эти вирусы не имеют наружной оболочки. При таком механизме выхода вирусов клетка, как правило, погибает и в среде появляется большое количество вирусных частиц.
Причиной гибели зараженной клетки могут быть три механизма:
2.защитная реакция клетки, запускающая генетическую программу ее гибели (апоптоз);
3. иммунная система организма, уничтожающая зараженную клетку.
Кроме продуктивного типа взаимодействия вируса и клетки возможно интегративное сосуществование или вирогения. Вирогения характеризуется интеграцией (встраиванием) нуклеиновой кислоты вируса в геном клетки, а также репликацией и функционированием вирусного генома как составной части генома клетки. Для интеграции с клеточным геномом необходимо возникновение кольцевой формы двунитевой ДНК вируса. Встроенная в состав хромосомы клетки вирусная ДНК называется провирусом. Провирус реплицируется в составе хромосомы и переходит в геном дочерних клеток, т.е. состояние вирогении наследуется. Под влиянием некоторых физических или химических факторов провирус может переходить в автономное состояние с развитием продуктивного типа взаимодействия с клеткой. Дополнительная генетическая информация провируса при вирогении сообщает клетке новые свойства, что может быть причиной развития опухолей, аутоиммунных и хронических заболеваний. На способности вирусов к интеграции с геномом клетки основаны персистенция (от лат. persisto - постоянно пребывать, оставаться) вирусов в организме и развитие персистентных вирусных инфекций. Например, вирус гепатита В способен вызывать персистирующие поражения с развитием хронического гепатита и часто опухолей печени.
Нуклеиновые кислоты – носители наследственности, определяют инфекционные свойства вируса, занимают в вирусных частицах центральное место, обычно защищены белковой оболочкой.
Состоят из трех основных компонентов:
1. Пуриновые и пиримидиновые основания;
2. Углевод (рибоза или дезоксирибоза);
3. Остаток фосфорной кислоты.
Физическая структура (архитектура) вирусов.
Не имеют клеточной структуры, представляют собой геометрически правильные образования. Капсомеры располагаются симметрично и вирусы делятся на три группы:
- Спирального типа симметрии;
- Кубического типа симметрии (многогранник – тераэдр, октаэдр, икосаэдр и др.);
- Комбинированного типа симметрии.
Вирусные элементарные тельца и внутриклеточные включения.
Элементарные тельца - синоним вирионов - зрелые вирусные частицы, способные при попадании в новые клетки вызывать репродукцию подобных себе частиц.
Внутриклеточные включения - скопления вирусных частиц в ядре или цитоплазме инфицированной клетки.
Три группы: цитоплазматические, ядерные, встречающиеся одновременно в ядре и цитоплазме -
имеет диагностическое значение.
Основы современной классификации вирусов.
В основу современной классификации вирусов положены основные их свойства.
Вирусы выделены в самостоятельное царство vira. Таксономические уровни:
Вид– вирусы одного вида объединяют генетические и антигенные свойства, патогенность и др.);
Род – объединяет группу видов вирусов, имеющих общую морфологию, физико-химические и др. свойства;
Семейство – объединяет групп родов вирусов, имеющих общие постоянные признаки (тип нуклеиновой кислоты и ее структуру, стратегию вирусного генома и др.).
Семейства имеют окончание - viridae , род - virus, названия вирусов состоят из двух слов – названия рода и вида: Семейство – Picorviridae (Picornaviridae?)
Вид – Rinovirus aphtae (возбудитель ящура).
Механизм репродукции вирусов
Вирусы - облигатные паразиты. Репродукция вирусов происходит только внутри клетки хозяина. Основной принцип:
- копирование молекулы нуклеиновой кислоты и
- синтез вирусных белков согласно генетической информации.
Особенности репродукции разных вирусов различны, но общими являются следующие факты:
- Источником строительного материала для синтеза нуклеиновых кислот вируса служат нуклеотиды клетки;
- Источником строительного материала для синтеза вирусных белков служат аминокислоты клетки;
- Синтез белков происходит на клеточных рибосомах;
- Источник энергии – АТФ, вырабатываемый митохондриями клетки;
- Синтез вирусных компонентов происходит дизъюнктивно (разобщенно во времени и пространстве);
- Репликацию нуклеиновой кислоты производят ферменты;
- Точность копирования молекул нуклеиновых кислот обеспечивается матричным механизмом и принципом комплиментарности.
Первая фаза репродукции вирусов.
1 фаза – состоит из проникновения вирусов в клетку и освобождения его нуклеиновой кислоты от наружных оболочек, что и приводит к инфекции.
1- адсорбция вируса на поверхности чувствительной клетки,
2 - проникновение вируса в нее и
3 - депротеинизация (раздевание) вирусов в клетке.
Первая стадия: Два механизма адсорбции:
- неспецифический - разнозаряженные молекулы на пов-сти клетки и вирусы притягиваются друг к другу,
- специфический - прикрепительные белки оболочки вируса и особые рецепторы пов-сти клетки образуют
Вторая стадия: проникновение вируса в клетку происходит несколькими вариантами :
- путем рецепторного эндоцитоза (в специальных участках мембраны клетки образуются особые ямки,
затем внутриклеточные вакуоли, куда и попадает вирус);
- путем слияния вирусных и клеточных мембран;
- впыскиванием нуклеиновой кислоты вируса в клетку.
Дата добавления: 2018-05-02 ; просмотров: 595 ;
86. 1. Определение, химический состав вирусов, функции компонентов.
Функция нуклеиновой кислоты вируса: …
Функция белков вирусных частиц: …
Размножение вирусов, синтез их нуклеиновых кислот.
Где размножается вирус?
О видах вирусов
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
Как вирусная частица попадает в клетки.
Что происходит с вирусной частицей после её попадания в клетку.
86. 3. Онкогенные вирусы. См. п.87.
86. 4. ВИЧ. См. п.77 и 80.
86. 5. Прионы.
86. 1. Определение, химический состав вирусов, функции компонентов. –
Опеределение вируса.
Вирусами называют КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ С БЕЛКАМИ,
которые могут находиться во внешней среде вне клеток и
могут при попадании в организм проникать в клетки и размножаться внутри клеток.
Некоторые вирусы вдобавок к НК и белкам содержат липиды и углеводы.
Таким образом, вирусы не являются клетками, у вирусов нет органелл.
Отдельный комплекс нуклеиновых кислот с белками называется вирусной частицей или вирионом.
Функция нуклеиновой кислоты вируса:
нуклеиновые кислоты используются для синтеза белков вирусных частиц (кодируют первичную структуру белка).
Функция белков вирусных частиц:
1 – защищают НК от повреждений (НК сами по себе очень неустойчивы), образуя оболочку вокруг НК,
2 – участвуют в размножении вирусов в качестве ферментов и т.д. см. далее.
Углеводы вирусных частиц часто находятся на поверхности вирусных частиц и могут помогать вирусным частицам проникать в клетки.
Отдельная вирусная частица и вирусные частицы данного вида вирусов содержат только один вид НК – или ДНК, или РНК.
Вирусы, в вирионе которых находится ДНК, называются ДНК-овые вирусами,
а вирусы, в вирионе которых находится РНК, называются, РНК-овыми вирусами.
ДНК вируса может быть не только двухцепочечной, но и ОДНОЦЕПОЧЕЧНОЙ.
РНК вируса может быть как одноцепочечной (как в клетках), так и ДВУХЦЕПОЧЕЧНОЙ.
Размножение вирусов, синтез их нуклеиновых кислот.
Синтез нуклеиновых кислот вирусов происходит разными способами. –
1) Наряду с репликацией ДНК (см. п. 78),
2) у вирусов есть репликация РНК
3) и обратная транскрипция (см. п.80).
Какой бы ни была нуклеиновая кислота в самом вирионе,
при размножении вируса происходит синтез вирусных матричных РНК для синтеза вирусных белков (для трансляции).
Где размножается вирус?
Синтез вирусных нуклеиновых кислот и синтез вирусных белков может происходить только внутри клеток,
так как для синтезов нужны среда, рибосомы (осуществляются синтез белка), нуклеотиды и аминокислоты и т.д.
Поэтому размножаться вне клеток вирусы не могут. –
Пока вирус не проник в клетку, он не может размножаться, не может как-то влиять на обмен веществ в организме.
Поэтому наличие вируса (вирионов) в крови
не означает, что человек будет болеть болезнью, которая вызывается этим вирусом.
Он может заболеть, только если вирусные частицы проникнут в клетки,
а если они не проникнут в клетки, то человек не заболеет, хоть и будет носителем вируса.
О видах вирусов
Вирусы, содержащие разные нуклеиновые кислоты (то есть с разными последовательностями нуклеотидов) и разные белки, относят к разным видам вирусов.
Вирусные частицы с одинаковыми (или очень похожими) последовательностями нуклеотидов в НК, относятся к вирусу одного и того же вида.
Кроме того, последовательность нуклеотидов нуклеиной кислоты вируса данного вида
может меняться, то есть вирус может мутировать.
В итоге получается другой ШТАММ данного вида вируса, но сам вирус относится к тому же виду вирусов, что и до мутации.
Вирусы, которые поражают бактерии, называются БАКТЕРИОФАГАМИ.
Бактериофаги могут использоваться для внесения в клетку бактерии чужих для неё генов для синтеза клеткой белков, кодируемых этими генами,
То есть бактериофаги могут играть роль векторов – это используется генной инженерией.
В эукариотические клетки вирусы попадают не так, как в бактериальные (далее).
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
При попадании вирусной частицы в организм её должны заметить и уничтожить клетки иммунной системы
(с помощью АНТИТЕЛ – специальных белков, задача которых – распознавание антигенов)
для того чтобы вирус не успел проникнуть в клетку, размножиться в ней, убить её и заражать новые клетки.
Как вирусная частица попадает в клетки.
Проникновение вирусной частицы в клетку начинается с того, что
вирус связывается с определённым белком на поверхности клетки,
который таким образом выполняет функцию РЕЦЕПТОРА клетки для этого вируса.
Роль рецептора вируса обычно играют белки, предназначенные для других целей –
например, ВИЧ использует рецепторы хемокинов.
Если рецепторы вируса отличаются от обычных так, что вирус не может с их помощью проникнуть в клетку, то вирус не приведёт к заболеванию.
Причиной отличия рецептора может быть мутация гена, который кодирует этот рецептор.
Что происходит с вирусной частицей после её попадания в клетку.
После попадания вирусной частицы внутрь клетки
вирусная нуклеиновая кислота высвобождается, после чего
могут синтезироваться новые молекулы вирусной нуклеиновой кислоты (см. п.77)
и новые молекулы вирусных белков (п.82).
После этого из молекул вирусных нуклеиновых кислот и молекул вирусных белков
могут образовываться новые вирусные частицы –
так происходит РАЗМНОЖЕНИЕ ВИРУСОВ.
Новые вирусные частицы могут покидать клетку, в которой образовались,
и поступать в новые клетки, заражая всё новые и новые клетки.
Если заражённые вирусом клетки подвергнутся АПОПТОЗУ (см. п. 79),
то распространение вирусных частиц может затормозиться.
Поэтому замедленный апоптоз способствует распространению вирусной инфекции.
Накопление вирусных частиц в клетке может приводить к РАЗРУШЕНИЮ КЛЕТКИ;
кроме того, оно нарушает нормальную жизнедеятельность клетки и организма –
всё это приводит к появлению симптомов вирусной инфекции.
Нуклеиновые кислоты некоторых вирусов (см. ВИЧ далее) могут использоваться
в качестве матриц для образования двухцепочечных ДНК (вирусных ДНК),
которые способны встраиваться в ДНК человека –
это встраивание называется интегрированием в геном,
оно относится к ПЕРЕСТРОЙКАМ генома – см. п.79.
86. 3. Онкогенные вирусы. См. п.87.
Некоторые вирусы способствуют появлению онкологических заболеваний.
Такие вирусы называются онкогенными вирусами.
Примеры онкогенных вирусов:
вирус папилломы человека способен приводит к раку матки,
вирусы гепатитов В и С приводят к раку печени.
Онкогенные вирусы относят к группе биологических мутагенов – см. п.79.
Почему некоторые вирусы могут приводить к онкологическим заболеваниям (см. п.87 и п.92, 98):
потому что онкогенные вирусы приводят к таким МУТАЦИЯМ,
которые способствуют появлению онкологических заболеваний.
Например, считается, что онкогенными являются те вирусы,
которые приводят к встраиванию вирусных ДНК в ДНК (геном) человека (интегрируется).
Потому что это встраивание может изменить тот участок ДНК,
в который встраивается вирусная ДНК (то есть привести к мутации).
В норме, до мутации, протоонкоген кодирует белки, которые стимулируют деление клеток и относятся к онкобелкам.
В норме активность онкобелков регулируется,
поэтому они стимулируют деление клетки только тогда, когда нужно –
и поэтому деление клетки (и образованных при её делении клеток) не приводит к образование опухоли.
Но после мутации протоонкогена он может измениться так, что
кодируемые им онкобелки не смогут регулироваться
и станут стимулировать деление клетки постоянно, без остановки,
что может привести к появлению опухоли,
если мутантные клетки не подвергнутся апоптозу
или не уничтожатся клетками иммунной системы.
86. 4. ВИЧ. См. п.77 и 80.
ВИЧ – это вирус иммунодефицита человека.
Размножение ВИЧ в организме человека может привести к развитию СПИДа –
Синдрома Приобретённого Иммунодефицита Человека.
ВИЧ повреждает клетки иммунной системы (Т-хелперы, макрофаги),
что приводит к дефициту иммунных клеток и снижению иммунитета (иммунодефициту).
1. После попадания ВИЧ в организм человека
ВИЧ, как и все вирусы, сначала связывается с рецепторами на поверхности клеток:
ВИЧ связывается с рецепторами хемокинов
(хемокиновыми рецепторами;
хемокины – это гормоны, относятся к цитокинам)
и СД4 рецепторами на поверхности клеток иммунной системы.
Связыванию ВИЧ с рецепторами помогают гликопротеины, расположенные на поверхности вирусной частицы ВИЧ.
Есть люди, в организме которых есть ВИЧ, но у которых не развивается СПИД –
то есть они являются носителями вируса, они могут заразить ВИЧ,
но больными они не являются.
Предполагают, что это связано с тем, что ВИЧ не может размножаться в организме этих людей,
поскольку не проникает в их клетки из-за особенностей строения рецепторов ВИЧ у этих людей:
возможно, из-за мутаций генов, кодирующих эти рецепторы.
2. В качестве нуклеиновой кислоты в ВИЧ содержится одноцепочечная РНК.
В клетках РНК вируса становится матрицей для синтеза комплементарной ей цепи ДНК
(комплементарной ДНК, кДНК),
который катализируется ферментом обратная транскриптаза
(потому что синтез ДНК на матрице РНК называется обратной транскрипцией),
который содержался в вирусной частице ВИЧ.
Затем на матрице первой цепи ДНК синтезируется вторая цепь ДНК,
в результате чего образуется двухцепочечная ДНК.
Эта вирусная ДНК способна встраиваться в ДНК человека
с помощью фермента ИНТЕГРАЗЫ, который тоже содержится в вирусной частице ВИЧ.
3. В некоторый момент вирусная ДНК, находящаяся в составе ДНК человека,
может использоваться для синтеза вирусных РНК (то есть для транскрипции – п.80).
4. Вирусные РНК могут использоваться для синтеза вирусных белков (для трансляции) с помощью рибосом самой клетки.
5. Один из ферментов ВИЧ осуществляет расщепление полипептидной цепи, синтезированной на вирусной РНК;
этот фермент называется ПРОТЕАЗОЙ.
В итоге образуются вирусные белки, в том числе уже названные протеаза, интеграза и обратная транскриптаза.
6. Объединение вирусных белков с вирусной РНК приводит
к появлению новых вирусных частиц ВИЧ,
которые могут разрушать клетки, поступать в кровь и проникать в новые клетки.
Диагностика ВИЧ
осуществляется методом ПЦР и с помощью иммуноферментного анализа.
Метод ПЦР быстрее и надёжнее.
СПИД пока считается неизлечимым заболеванием.
Но замедлить развитие СПИДа и продлить жизнь человека, инфицированного ВИЧ, можно за счёт замедления размножения ВИЧ в организме заражённого.
Размножение ВИЧ замедляется за счёт применения лекарств,
снижающих активность ферментов ВИЧ, участвующих в размножении ВИЧ (см. выше),
то есть за счёт применения ИНГИБИТОРОВ ферментов ВИЧ.
Чем раньше начинают лечение инфицированного ВИЧ – тем дольше он проживёт. Поэтому важно вовремя делать анализ на ВИЧ при наличии оснований предполагать, что человек мог заразиться ВИЧ.
При наличии ВИЧ у беременной есть шанс родить здорового ребёнка,
если вовремя сделать анализ на ВИЧ и провести лечение.
Прионами называют белки с особой структурой, которая приводит к так называемым прионовым болезням:
куру, болезни Крейцфельдта-Якобы, почесухе овец, коровьему бешенству.
У прионов есть способность
превращать молекулы нормальных белков в прионы
за счёт того, что под влиянием структуры уже имеющихся молекул прионов
структура молекул ряда других белов может измениться так,
что эти молекулы тоже становятся прионами –
нерастворимыми в воде молекулами,
под влиянием которых могут стать прионами другие молекулы белков –
то есть происходит как бы цепная реакция;
из-за этого число прионов в организме становится всё больше.
Из-за этого свойства прионы считаются инфекционными белками,
а прионовые болезни считаются заразными
(заражение происходит при попадании прионов в организм – обычно в качестве пищи).
В случае с прионами увеличение числа болезнетворных молекул
происходит не путём деления клеток
(в отличие от бактериальных и других инфекций, где бактерии размножаются делением)
и не путём синтеза нуклеиновых кислот (см. выше о размножении вирусов),
а под влиянием уже имеющихся молекул прионов.
Прионы могут оказаться в организме не только в результате заражения
(не только при съедении пищи, содержащей прионы),
но и в результате мутаций генов некоторых белков.
Из-за своей структуры прионы не уничтожаются и не теряют свои вредные свойства при сколь угодно долгой варке, поэтому варка не является способом сделать пищу безопасной и свободной от прионов. Единственный способ исключить возможность заражения прионами при эпидемиях коровьего бешенства – это не употреблять в пищу мясо, тушёнку, консервы, желатин и т.д.А единственный способ уничтожить прионы - только сжечь. Прионы устойчивы и к действию других факторов, которые разрушают структуру обычных белков, то есть прионы устойчивы к денатурации под действием излучений, ультразвука и т.д.
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Антибактериальные средства. Влияние на синтез НК и белков лежит в основе механизма действия таких антибиотиков как рифамицины, аминогликозиды, тетрациклины, макролиды и хлорамфеникол, а также производные хинолонкарбоновых кислот.
Рифамицин В — природный метаболит, выделенный из культуры Streptomyces mediterxanei. Он ингибирует ДНК-зависимую РНК-полимеразу, связываясь с ее b-субъединицей как у грамположительных, так и у грамотрицательных бактерий. Селективность действия рифамицинов у прокариот и эукариот обусловлена различиями в аминокислотной последовательности РНК-полимеразы.
Наибольшее распространение в медицине среди полусинтетических аналогов рифамицина В получил рифампицин. Он является одним из наиболее эффективных средств против микобактерий туберкулеза и стафилококковых инфекций.
Ингибиторами синтеза белка на рибосомах являются аминогликозиды (аминоциклитолы), тетрациклины, макролиды и хлорамфеникол. Антибактериальное действие аминогликозидов и хлорамфеникола обусловлено их способностью избирательно взаимодействовать с рибосомами прокариотических клеток. Селективность связывания обеспечена различиями в белковых компонентах этих органелл у эукариот и прокариот. Аминогликозиды взаимодействуют с малой субъединицей (30S), а хлорамфеникол — с большой (50S) субъединицей вблизи пептидилтрансферазного центра рибосомы, подавляя тем самым синтез белка у бактерий и не затрагивая биосинтез в клетках высших организмов.
Стрептомицин, выделенный из Streptomyces griseus в 1943 г., был вторым после пенициллина антибиотиком, эффективным в отношении широкого спектра бактерий, главным образом, грамотрицательных. В 50—60-е гг. он получил распространение как мощное противотуберкулезное средство. В настоящее время применяется редко из-за большого количества побочных эффектов, а также по причине выявления в данном ряду новых более эффективных и менее токсичных веществ. Однако стрептомицин остается в арсенале средств борьбы с такими опасными инфекциями как бубонная чума и туляремия.
Гентамицин и канамицины являются химически более стабильными структурами, чем стрептомицин. Они устойчивы в кислой и основной средах, а также к действию высокой температуры, что позволяет изготавливать на их основе широкий набор препаратов Канамицин А, Канамицин В, Торбамицин, Амикацин.
Причина развития резистентности к антибиотикам этого ряда кроется в способности некоторых микроорганизмов N-ацетилировать, О-фосфорилировать или О-аденилировать функциональные группы, обеспечивающие связывание аминогликозидов с рибосомами. Решить эту проблему в определенной степени удалось благодаря созданию полусинтетических производных — торбамицина и амикацина.
Хлорамфеникол (левомицетин) также является природным продуктом и первоначально (1947 г.) был выделен из культуры Streptomyces venezuela. Однако простое строение этого вещества позволило довольно быстро осуществить его синтез в промышленном масштабе. Хлорамфеникол нашел применение в лечении кишечных инфекций, менингита, бруцеллеза и др. Рацемат левомицетина используют наружно в виде синтомициновой эмульсии. Из-за неблагоприятных эффектов в отношении кроветворения хлорамфеникол относят к антибиотикам резерва и применяют в основном при неэффективности других препаратов.
Тетрациклины по химическому строению являются высоко функционализованными частично гидрированными нафтаценами. Они проявляют амфотерные свойства и образуют трудно растворимые соли с Fe2+, Al3+, Mg2+, Qa2+. Образование последних приводит к существенному снижению активности тетрациклинов и накоплению их в виде кальциевых солей в костной ткани при использовании в больших дозах в течение длительного времени. Первым в рассматриваемом ряду в 1948 г. был открыт хлортетрациклин. Получают тетрациклины ферментацией Streptomyces aureofaciens или Streptomyces rimosus и модифицируют синтетическим путем: тетрациклин, хлортетрациклин, миноциклин, санциклин, окситетрациклин, доксициклин, метациклин.
Они получили распространение в середине 60-гг. в терапии заболеваний, возбудителями которых являются грамотрицательные бактерии (кишечная, дизентерийная, брюшнотифозная палочки). Но в отношении грамположительных микроорганизмов (стафилококки, стрептококки, пневмококки) хинолонкарбоновые кислоты оказались неэффективными. В настоящее время их применяют, главным образом, в качестве дезинфектантов мочевыводящих путей. Благодаря изучению широкого круга аналогов удалось установить, что наибольшей активностью обладают соединения, содержащие атом фтора в бензольном кольце бициклической хинолиноновой системы. Первым фторхинолоном, получившим широкое медицинское применение в середине 80-х гг., стал норфлоксацин. Вслед за ним появились пефлоксацин, офлоксацин, ципрофлоксацин и ломефлоксацин.
По механизму действия препараты первого и второго поколения являются ингибиторами топоизомераз (ДНК-гиразы и топоизомеразы IV) — Ф, поддерживающих сверхспиральную структуру ДНК бактериальной клетки, без чего невозможно нормальное осуществление процессов репликации и транскрипции. В грамотрицательных микроорганизмах первичной мишенью является ДНК-гираза, вторичной — топоизомераза IV. Напротив, в грамположительных бактериях топоизомераза IV — первичная мишень. Фторхинолоны применяют при инфекциях мягких тканей и кожи, дыхательных путей, мочевыводящей системы, ПК, туберкулезе и многих др. заболеваниях.
Противоопухолевые средства. Согласно современной классификации противоопухолевые (антинеопластические, антибластомные) средства подразделяются на:
· алкилирующие вещества — бис-(3-хлорэтил) - амины, этиленамины, алкилсульфонаты, нитрозомочевины, триазены;
· антиметаболиты — аналоги фолиевой кислоты, аналоги пуринов и пиримидинов;
· вещества природного происхождения — алкалоиды, антибиотики;
· гормональные средства и их аналоги;
· препараты разных химических групп — производные метилгидразина, мочевины, антрацендионы, производные платины и др.
Среди вышеперечисленных средств непосредственное воздействие на НК оказывают алкилирующие агенты, антибиотики, производные платины, антрацендионы и акридины. Антиметаболиты — аналоги пуринов и пиримидинов — нарушают синтез ДНК и РНК, блокируя включение в их структуру соответствующих азотистых оснований.
Вещества алкилирующего типа взаимодействуют с нуклеофильными центрами азотистых оснований ДНК, тем самым, блокируя ее репликацию. Сшивка двух цепей ДНК происходит по остаткам гуанина. В результате нарушается способность клеток к делению. Особенно выраженный цитостатический эффект проявляется в отношении быстро пролиферирующих (размножающихся) клеток. К группе алкилирующих средств принадлежат производные бис-(Р-хлор-этил)амина: сарколизин, эмбихин, циклофосфан, допан, хлорбутин; этиленимины: тиофосфамид, бензотэф; алкилсульфонат — миелосан. Главной мишенью N-нитрозаминов — ломустина и кармустина — также является ДНК.
Свойства метилирующего агента проявляет дакарбазин. В результате его микросомального окисления и дезалкилирования образуется электрофильная частица CH3N2+, которая алкилирует азотистые основания НК.
Механизм цитостатического действия этих веществ обусловлен нарушением синтеза ДНК и РНК путем блокады включения в их структуру соответствующих пуриновых и пиримидиновых оснований. Они способны необратимо связывать тимидилатсинтетазу. Однако, кроме ингибирования названного Ф, эти соединения замещают истинные метаболиты в структуре НК, что приводит к замедлению деления опухолевых клеток. К сожалению, таким же образом эти препараты действуют и на здоровые клетки, в особенности на быстро делящиеся клетки костного мозга и кишечного эпителия.
Противоопухолевые антибиотики в большинстве случаев являются природными соединениями и продуцируются различными видами актиномицетов. Далеко не все такие вещества токсичны только для опухолевых клеток, однако в связи с тем, что они, как правило, действуют на механизм репликации, быстро делящиеся опухолевые клетки поражаются ими в большей степени, чем обычные. Антибластомным эффектом обладают митомицин С, блеомицин, доксорубицин, рубомицин, дактиномицин, антрамицин.
Митомицин С был выделен в середине 50-х гг. из культуры Streptomyces verticillatus, а в начале 70-х гг. получен синтетическим путем. Этот антибиотик проявляет свойства алкилирующего агента и одновременно является источником пероксидных радикалов, также нарушающих структуру ДНК. Видовая чувствительность опухолей к этому антибиотику объясняется, вероятно, различиями в способности клеток разных опухолей репарировать поврежденную ДНК или нейтрализовать алкилирующие агенты.
Блеомицины — группа антибиотиков, также продуцируемых Streptomyces verticillatus. По химическому строению это гликопептиды, содержащие в структуре два тиазольных, имидазольный и аминопиримидиновый циклы. Эти вещества ингибируют ДНК-лигазу, в результате чего в ДНК возникают разрывы. Антрациклины — важнейший класс антибластомных средств, обладающих политропным действием. Наиболее известными антрациклиновыми антибиотиками являются даунорубицин и доксорубицин.
Эти вещества встраиваются в ДНК за счет образования ионной связи между аминогруппой гексозного фрагмента и фосфатным остатком в НК, при этом плоская антрахиноновая система размещается между парами оснований в двойной спирали. В результате такого встраивания в двойную спираль — интеркаляции — снижается степень скрученности ДНК и прекращается ее репликация. Доксорубицин ингибирует также ДНК- и РНК-полимеразы. Кроме того, антрациклиновые антибиотики активируют супероксиддисмутазу и способствуют продукции свободных радикалов в клетках благодаря одно- и двухэлектронному восстановлению в семихинон и гидрохинон соответственно. При окислении 02 эти соединения образуют супероксид, перекись водорода и гидроксильный радикал, которые вносят свой вклад в реализацию противоопухолевого эффекта химиотерапевтических средств данного ряда.
Среди производных антрацена выраженным антибластомным действием обладают митоксантрон и бисантрен.
Способность к интеркаляции лежит в основе антинеопдастического действия дактиномицина (актиномицина D). Это вещество открыто в культуре Streptomyces parvulus в середине 40-х гг. и вскоре было получено синтетическим путем. Он способен встраиваться в структуру ДНК. В отличие от рассмотренных выше случаев интеркаляции, связывание дактиномицина обратимо. Однако образовавшийся комплекс диссоциирует очень медленно, в результате оказываются блокированными РНК-полимераза и биосинтез белка. Первоначально это вещество испытывали в качестве антимикробного средства, однако из-за высокой токсичности оно не получило клинического применения. В середине 50-х гг. его с успехом стали применять для лечения онкологических заболеваний. На сегодняшний день дактиномицин является одним из наиболее широко изученных антибластомных средств.
Антрамицин также является продуктом природного происхождения, однако имеет достаточно простую структуру пирролобенздиазепина, в составе которой есть высоко реакционноспособный карбиноламинный фрагмент. Антрамицин ковалентно связывается с гуанином и тем самым подавляет синтез НК.
Препараты платины - цисплатин, платан и карбоплатин — появились в середине 70-х гг.
Главной мишенью для комплексов платины являются пуриновые и пиримидиновые основания ДНК. При этом не затрагиваются ни фосфорные, ни дезоксирибозные остатки. Препараты этой группы не влияют на синтез РНК и белков и действуют одинаково эффективно как на стадии активного синтеза ДНК в клетке, так и на стадии митоза. Цитотоксическим эффектом обладают только цис-производные платины.
В заключении следует отметить, что все рассмотренные ЛВ являются высокотоксичными соединениями. Их общий недостаток - низкая избирательность действия. Антибластомные средства алкилирующего типа, антиметаболиты, интеркаляторы НК и др. повреждают мишени не только в клетках, пораженных опухолевым процессом, но и в нормально функционирующих, т.е. проявляют свойства канцерогенов. В связи с этим поиск новых низкотоксичных и высокоселективных средств чрезвычайно актуален. В настоящее время в связи с такими достижениями в области молекулярной генетики как расшифровка генома человека, открываются перспективы для выяснения тонких механизмов регуляции роста клеток. Так, установлено что одним из факторов, предотвращающим их неограниченный рост, является специфическая генетическая программа определяющая конечное число делений, которое может претерпеть данная клетка. По достижении этого числа делений клетки претерпевают сложную систему деградации, которая получила название апоптоз. Очевидно, нарушения в такой программе должны приводить к неограниченному росту клеток, что свидетельствует о возникновении опухолевого процесса. Понимание механизмов апоптоза способно многое изменить в поиске антибластомных средств.
Противовирусные средства. Вирусы - неклеточные структуры, содержащие НК в белковой оболочке - капсиде. Различают ДНК- и РНК-содержащие вирусы.
Транскрипция и репликация генетического материала вируса осуществляются обычно с участием Ф клетки-хозяина. Сначала вирусная ДНК копируется РНК-полимеразами клетки-хозяина, в результате чего образуется мРНК, которая затем транслируется. При этом транскрипция и репликация могут происходить как в ядре (например, у вируса герпеса), так и в цитоплазме (например, у поксвирусов). Трансляция вирусной мРНК на рибосомах клетки-хозяина приводит к образованию вирусных белков.
Сборка вируса и его компонентов обычно происходит спонтанно, но может зависеть от участия вспомогательных белков. Вирусная ДНК покрывается капсидом. Последний, в свою очередь, может включаться в мембранную структуру, получаемую вирионом от клетки-хозяина.
Проблема создания эффективных и безопасных противовирусных средств является одной из самых сложных в современной медицинской химии и фармакологии. Сложность эта заключается в выявлении веществ, способных избирательно подавлять репродукцию вирусов, не затрагивая процессов жизнедеятельности клеток организма-хозяина. Противовирусный препарат должен воздействовать на какой-либо из этапов жизненного цикла вирусной инфекции:
· блокировать связывание вириона с определенными рецепторами на поверхности клеток и последующее проникновение в клетку путем дезинтеграции его оболочек;
· препятствовать транскрипции вирусного генома;
· ингибировать синтез специфических вирусных белков;
· подавлять активность вирус-специфических полимераз НК.
Строгая направленность действия — один из основных критериев в отборе веществ с противовирусной активностью. При этом биологическими мишенями являются вирусный геном, вирус-специфичные ферменты (обратимые транскриптазы, протеазы, глюкозидазы). Вещества, тормозящие процесс дезинтеграции оболочки вируса и перенос его генетического материала в клетку хозяина, эффективны на начальных этапах развития инфекционного процесса. К ним относят производные адамантана (ремантадин и др.), которые применяют для профилактики и лечения начальной стадии гриппа.
Агентами, влияющими на репликацию вирусных НК, являются нуклеозиды и родственные им структуры. Так, галогенпроизводные тимидина эффективны в отношении ДНК-содержащих вирусов. Наиболее известным препаратом этого ряда является идоксуридин (R = I), который под действием вирусной тимидинкиназы превращается в трифосфат, ингибирующий клеточную ДНК-полимеразу. Кроме того, галогенпроизводные тимидина выступают его антиметаболитами. Встраиваясь в ДНК, они подавляют синтез мРНК и вирусных белков.
Видарабин получен из культуры Streptomyces antibiotycus. Он нарушает репликацию вирусной ДНК и эффективен в отношении вирусов герпеса различных типов. Основной недостаток видарабина — легкость дезаминирования в арабинозилгипоксантин под действием аденозиндезаминазы.
Читайте также:


