Способы передачи наследственного материала у бактерий и вирусов
В 1928 г. Ф. Гриффите получил интересные данные по заражению мышей возбудителем пневмонии. Он использовал два штамма пневмококка: вирулентный штамм S (клетки его имеют полисахаридную капсулу и дают гладкие колонии) и невирулентный штамм R (клетки не обладают капсулой и образуют шероховатые колонии). Заражение мышей вирулентным штаммом вызывало их гибель. При инъекции невирулентного штамма мыши не болели. Пневмония у них не развивалась и после введения вирулентного штамма, убитого нагреванием. Однако, если мышам вводился одновременно убитый штамм S и живой штамм R, через некоторое время они погибали от пневмонии, а при посеве крови были выделены живые пневмококки с капсулой. Таким образом, можно было предполагать, что свойства убитого вирулентного штамма как бы перешли к живому невирулентному. Это явление было названо трансформацией.
Природу этого явления в 1944 г. установил О. Эвери. Он провел аналогичный эксперимент с пневмококками in vitro. Спонтанно штамм S мог мутировать, т. е. приобретать свойства штамма R, но обратная мутация (R→S), как правило, не происходит. Однако добавление к R экстракта убитых пневмококков S увеличивает вероятность обратной мутации. Эвери выделил вещество из убитых бактерий вирулентного штамма S, очистил, изучил химические свойства и назвал его трансформирующим фактором. Трансформирующий фактор инактивировался лишь одним ферментом — дезоксирибонуклеазой, расщепляющим только ДНК. Это означало, что трансформирующим веществом является ДНК. Так было получено первое подлинное доказательство генетической роли нуклеиновых кислот. Однако это открытие не сразу привлекло всеобщее внимание, поскольку в то время было мало известно о химической природе генов, структуре белков и ДНК. Тем не менее открытие Эвери стимулировало более детальное изучение нуклеиновых кислот. В 1947 г. Э. Чаргафф установил, что количество нуклеотидов ДНК и их соотношение у разных организмов неодинаково. Это навело на мысль, что порядок расположения нуклеотидов в молекуле ДНК, очевидно, как-то связан с ее генетической специфичностью.
Трансформация сводится к включению вещества хромосомы одной бактерии (донора) в хромосому другой (реципиента) и служит одним из способов обмена генетической информацией у бактерий. Однако механизм ее еще недостаточно изучен.
Долгое время считалось, что генетическая трансформация свойственна только одноклеточным. В настоящее время установлено, что явления, напоминающие генетическую трансформацию, могут происходить и в клетках эукариотов. При взаимодействии некоторых вирусов с клетками животных возможна трансформация эукариотной клетки. Полученная ею новая генетическая информация устойчиво передается при последующих клеточных делениях. Получены неоспоримые доказательства существования генетической трансформации в клетках млекопитающих. Дж. Берг и В. Мак-Брайд при культивировании клеток мыши в среде с изолированными хромосомами клеток человека выделили потомство клеток с маркерами последнего. (Имеются основания считать, что в геном реципиента включается лишь небольшой участок хромосомы донора, около 2 %.) Пока мало известно о характере связи между геномом реципиента и фрагментом хромосомы донора, но, несомненно, связь эта довольно прочная — клетки мыши не теряли приобретенные свойства даже при выращивании в неселективных условиях.
В 1952 г. Н. Циндер и Дж. Ледерберг описали еще один способ передачи наследственной информации у бактерий. Исследования проводились на бактериях мышиного тифа Salmonella fyphimurium. В U-образную трубку с бактериальным фильтром посередине засевались на полную питательную среду 2 штамма: в одну часть пробирки штамм 22А (ауксотрофный по мутации, тормозящей синтез триптофана Т-; это требовало добавления данной аминокислоты в среду для культивирования), в другую — штамм 2А дикого типа (способен синтезировать триптофан Т+). Совместное выращивание двух штаммов бактерий мышиного тифа привело к тому, что через некоторое время при посеве на минимальную среду бактерии штамма 22А дали небольшое количество колоний. Следовательно, они каким-то образом приобрели способность синтезировать триптофан. Переход бактерий из одного колена пробирки в другое преграждался бактериальным фильтром, а возможность обратной мутации штамма 22А исключалась, так как он был стабильным в этом отношении. По мнению Циндера и Ледерберга, перенос информации осуществлялся фагом. Было установлено, что ДНК-содержащие вирусы (фаги) делятся на две группы: паразиты, приводящие к гибели бактериальные клетки, и умеренные (симбиотические), не вызывающие заболевания и разрушения клеток.Умеренные вирусы, или профаги, существуют в клетке в виде ДНК, интегрированной с ДНК бактерии, и реплицируются вместе с ее хромосомой. Явление такого сосуществования умеренного фага и бактерии носит название лизогении. Лизогенная клетка (иначе клетка с профагом) обычно ничем не отличается от других бактерий. Обнаружить профаг удается лишь при активизации его ионизирующим и ультрафиолетовым излучением или при воздействии каких-либо иных факторов, вследствие чего он превращается в зрелый фаг, убивает клетку и использует ДНК бактерии на построение своей ДНК. Таким образом, профаг при заражении новой клетки может сообщить ей часть наследственной информации от старой. Штамм 2А оказался лизогенным по фагу, который из умеренного в силу каких-то причин превратился в паразитический и при заражении новых бактерий перенес в них часть фрагмента ДНК с геном, контролирующим синтез триптофана. Бактериальный фильтр не послужил преградой для вирусов, так как размеры их очень малы и они могут фильтроваться.
Явление переноса наследственной информации бактериофагом от одних бактерий к другим называется трансдукцией.Механизм трансдукции еще недостаточно изучен. Предполагается, что фрагмент чужеродной ДНК вначале самостоятельно реплицируется, а затем путем рекомбинации включается в хромосому клетки-реципиента. Трансдукция в настоящее время детально изучается в связи с вопросами генной инженерии, поскольку может рассматриваться в качестве одного из путей переноса наследственной информации от клетки к клетке.
В 1946 г. Дж. Ледерберг и Е. Татум при совместном выращивании двух ауксотрофных комплементарных мутантов кишечной палочки Е. coli (В-М-Р+Т+ и В+М+Р-Т-) в течение ночи получили культуру В+М+Р+Т+, которая оказалась способной в отличие от исходных штаммов расти на минимальной питательной среде без добавления метионина, биотина, треонина и пролина. Трансформации и трансдукции здесь явно не было. При наличии бактериального фильтра в сосудах, где выращивались культуры, взаимного обмена информацией не наблюдалось. Очевидно, существует очень тесный контакт между бактериями. На основании этого впервые было высказано предположение о возможности у бактерий полового процесса. Половой процесс у бактерий, при котором осуществляется перенос генетической информации при тесном контакте клеток, был назван конъюгацией.Впоследствии удалось получить микрофотографии конъюгирующих бактерий кишечной палочки. Передача информации при конъюгации носит односторонний характер.В 1952 г. Б. Хейс показал, что при конъюгации одна из клеток (мужская F+) служит донором, другая (женская F - ) — реципиентом. Донорные клетки несут особый фактор F (фрагмент молекулы ДНК; автономно существует в цитоплазме и содержит около 10 пар нуклеотидов), являющийся нехромосомной структурой. Реципиенты этого фактора не имеют.
Процесс конъюгации и механизм переноса генетического материала был описан у бактерий Е. coli в 1955 г. В. Вольманом и Ф. Жакобом. Они показали, что при конъюгации фактор F может переходить из мужской клетки в женскую и превращать ее в F + . При этом другие свойства бактериальной клетки не изменяются. Передача полового фактора происходит как бы независимо от других генетических маркеров. Клетки штаммов F- внутри себя не рекомбинируют.
При обратной мутации половой фактор у бактерий может вновь приобрести автономное состояние. Освобожденный из хромосомы, подобно профагу, он иногда захватывает фрагмент бактериальной хромосомы, прилегающий к нему, и при конъюгации вместе с ним переходит в женскую клетку, сообщая ей свойства донорной клетки и некоторые другие свойства, контролируемые фрагментом хромосомы. Такой процесс переноса наследственной информации из одной бактериальной клетки в другую посредством полового фактора называется сексдукцией.
Таким образом, половой фактор является саморедуплицирующим генетическим элементом, способным существовать в двух состояниях: автономном и интегрированном в хромосому. Такие участки генетического материала получили название эписом.
Репликация ДНК
Уотсон и Крик уже во второй своей работе 1953 года предположили возможный механизм копирования наследственного материала. Легко представить, что цепи молекулы ДНК расходятся и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две дочерние двуспиральные молекулы ДНК, неотличимые от родительской молекулы.
Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм копирования называется полуконсервативным.В то же время обсуждались две другие модели, одна из них "консервативная" другая "дисперсионная" (Рисунок). Доказали существование полуконсервативной модели М. Мезелсон и Ф. Сталь в 1958 году. Авторы выращивали бактерии Е. coli несколько поколений на минимальной среде, в которой единственным источником азота был 15 NH4C1 (хлорид аммония). В этом соединении нормальный изотоп 14 N, был заменен на 15 N. В результате все клеточные компоненты бактерий, включая пурины и пиримидины в молекулах ДНК содержали более тяжелый азот 15 N. Затем клетки переносили на среду, содержащую изотоп 14 N. Через 1 или 2 поколения выделяли ДНК и центрифугировали в градиенте CsCl. Фракции, содержащие легкие или тяжелые цепи, а так же гибридные 15 N/ 14 N, легко отделялись одна от другой.
В 1957 году Артур Корнберг (в 1959 году Артуру Корнбергу (Arthur Kornberg) была присуждена Нобелевская премия за открытие механизма биосинтеза ДНК) обнаружил у бактерии Е. coli фермент, катализирующий процесс полимеризации ДНК из нуклеотидов – ДНК-полимеразу. Открытие Корнберга показало, что в основе удвоения молекул ДНК лежат обычные биохимические реакции. По современным представлениям в репликации ДНК у прокариот выделяют следующие этапы: 1. Релаксация суперспирализованной ДНК. Этот процесс катализируется ферментом топоизомеразой. 2. Денатурация двойной спирали ДНК.
Поскольку синтез ДНК происходит на одноцепочечной матрице, ему должно предшествовать обязательное разделение двух цепей ДНК. Участок начала расхождения цепей называется репликационной вилкой из-за характерной Y-образной формы. Именно в этой репликационной вилке ДНК-полимеразы синтезируют дочерние молекулы ДНК.
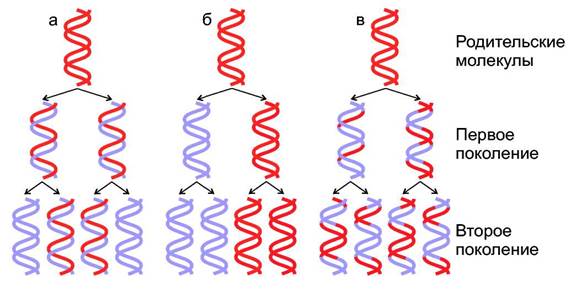
Модели репликации ДНК:
а - полуконсервативная, б - консервативная, в - дисперсионная.
Родительские цепи изображены в виде красных лент, вновь синтезированные
показаны синим цветом.
Участок ДНК, в котором репликация уже завершилась, выглядит как пузырек или "глазок" в нереплицированной ДНК. Репликационные глазки образуются в тех местах, где находятся специфические последовательности – точки начала репликации (origin of replication). Они состоят примерно из 300 нуклеотидов. С ориджина ими связываются инициаторные белки репликации.
Для того, чтобы цепи ДНК разъединились, функционирует особый фермент – ДНК-хеликаза, который связывается с инициаторными белками. Этот фермент движется по одиночной цепи ДНК и, встречая участок двойной спирали, он разрывает водородные связи между основаниями, разделяет цепи и продвигает репликационную вилку.
Субстратом для ДНК-полимеразы являются дезоксирибонуклеозид-трифосфаты (дНТФ), полимеризующиеся на одноцепочечной матрице. ДНК-полимеразы последовательно наращивают одну нить ДНК, шаг за шагом присоединяя к ней следующие звенья в направлении от 5' к 3' концу. В клетках присутствуют несколько разных типов ДНКполимераз, выполняющих различные функции и имеющих разное строение: они могут быть построены из различного количества белковых цепей (субъединиц), от одной до десятков. Однако, все они работают на любых последовательностях нуклеотидов матрицы; задача этих ферментов - сделать точную копию каждой матрицы.
Генетический материал живых организмов имеет огромные размеры и реплицируется с высокой точностью. В среднем, в процессе воспроизведения генома млекопитающего, состоящего из ДНК длиной 3 млрд. пар нуклеотидов, возникает не более трех ошибок. При этом ДНК синтезируется чрезвычайно быстро (скорость ее полимеризации колеблется в пределах от 500 нуклеотидов в секунду у бактерий до 50 нуклеотидов в секунду у млекопитающих).
Высокая точность репликации, наряду с ее высокой скоростью, обеспечивается наличием специальных механизмов, осуществляющих коррекцию, т.е. устраняющих ошибки.
Суть механизма коррекции заключается в том, что ДНК-полимеразы дважды проверяют соответствие каждого нуклеотида матрице: один раз перед включением его в состав растущей цепи, второй раз перед тем, как включить следующий нуклеотид. Очередная фосфодиэфирная связь синтезируется лишь в том случае, если последний нуклеотид растущей цепи ДНК образовал правильную уотсон-криковскую пару с соответствующим нуклеотидом матрицы.
БАКТЕРИИ. Химический состав клеток бактерий в основном такой же, как и у клеток высокоорганизованных организмов. Они окружены оболочкой, внутри которой находится цитоплазма, ядерный аппарат, рибосомы, ферменты и другие включения. В отличие от клеток эукариот в клетках бактерий отсутствуют митохондрии, аппарат Гольджи, эндоплазматическая сеть. Цитоплазма бактерий представляет собой коллоидную часть клетки с гранулярной (зернистой) структурой. Основную массу гранул составляют рибосомы с константой седиментации 70S, участвующие в синтезе белка. В центральной части цитоплазмы бактерий расположен ядерный аппарат - нуклеотид и плазмиды. Ядро прокариот называется нуклеотидом по той причине, что оно в отличии от эукариот не изолировано от цитоплазмы мембраной и представлено одной очень длинной молекулой ДНК (хромосомой). Хромосома бактерии E. coli включает около 5*10 6 пар оснований, имеет имеет молекулярную массу 3*10 9 Д.В хромосоме кишечной палочки ДНК замкнута в кольцо и состоит из дискретно расположенных генов. Длина молекулы ДНК в расправленном состоянии достигает 1 мм, что значительно превышает среднюю длину самой бактерии.
ДНК бактерий не отличается по строению от ДНК высших организмов. Она содержит те же четыре нуклеотида, в состав каждого из которых входят дезоксирибоза, остаток фосфорной кислоты и пуриновое (аденин или гуанин) или пиримидиновое (тимин или цитозин) основание. Соединение мононуклеотидных остатков осуществляется сложноэфирными мостиками.
ВИРУСЫ. Вирусная частица содержит в своём составе одну из нуклеиновых кислот, которая окружена белковой оболочкой (капсидом). Геном вирусов может быть представлен двухцепочной или одноцепочной ДНК, одноцепочной или двухцепочной РНК. Типичная частица состоит из головки и хвостового отростка. В головке плотно упакована ДНК. Головку и хвостовой отросток покрывает белковый чехол. На конце хвостового отростка имеются специальные волоконца, облегчающие прикрепление фага к оболочке бактерий.
7. Внехромосомные факторы наследования.
Наследование признаков через цитоплазму называется внехромосомной. Цитоплазма влияет на активность проявления гена. Некоторые её органоиды, имеющие свою систему белкового синтеза (митохондрии, пластиды), могут влиять на развитие определённых признаков. В процессе развития наблюдается сложное взаимодействие ядра и цитоплазмы. Но определяющую роль всё-таки играет ядро.
8. Роль плазмид в определении у бактерий свойств устойчивости к антибиотическим лекарственным веществам.
У некоторых непатогенных и патогенных видов бактерий обнаружены факторы резистентности к лекарственным веществам – R-факторы. Это довольно крупные плазмиды. Они, присутствуя в цитоплазме бактерий и передаваясь их поколения в поколение, обуславливают устойчивость бактерий к действию одного или нескольких лекарственных веществ.
9. Способы передачи наследственной информации у микроорганизмов: трансформация, трансдукция и конъюгация.
В процессе трансформации принимают участие две бактериальные клетки – донор и реципиент. Трансформирующий агент представляет собой часть молекулы ДНК донора, которая внедряется в геном реципиента, изменяя его фенотип. В процессе трансформации клетки донора и реципиента не соприкасаются друг с другом. Механизм переноса генетического материала заключается в том, что из клеток донора выделяются в окружающую среду молекулы или фрагменты молекул ДНК. Сначала ДНК адсорбируется на оболочке клетки реципиента. Затем через определённые рецепторные участки её стенки при помощи специальных клеточных белков ДНК втягивается внутрь клетки. Проникающая донорская ДНК должна быть двухцепочной. В реципиентной клетке она становиться одноцепочной.
Трансдукция – это перенос генов из одной бактериальной клетки в другую при помощи умеренных фагов. При переносе генетического материала происходит замена участка молекулы ДНК фага. Фаг при это теряет свой собственный фрагмент и становиться дефектным. Различают три вида трансдукции: общую, или неспецифическую, специфическую и абортивную.
Конъюгация – это передача генетического материала от одних бактерий другими при их скрещивании.
В состав нуклеотида бактерий входят ДНК, РНК и белки. Число нуклеотидов в бактериальной клетке может варьировать от одного (в культурах, находящихся в стационарной фазе роста) до двух (в стадии задержки размножения после переноса клеток в свежую среду) и четырех (в культурах с постоянной скоростью роста). Каждый нуклеоид содержит двухцепочечную замкнутую в кольцо молекулу ДНК. В молекуле ДНК нуклеотида закодирована вся генетическая информация, необходимая для жизнедеятельности клетки, поэтому нуклеотид рассматривают как бактериальную хромосому. Хромосомы имеют кольцевое строение. Гигантская молекула ДНК бактериальной хромосомы поддерживается связанными с ней молекулами РНК и белка в форме компактной структуры, свернутой в отдельные сверхспирализованные петли (домены), число которых колеблется от 12 до 80.
Помимо хромосомной ДНК в состав генома многих прокариот входят также сверхскрученные, ковалентно-замкнутые кольцевые молекулы внехромосомной, или плазмидной, ДНК.
Способы передачи наследственной информации у бактерий:
1.трансформация – перенос изолированных фрагментов мол-лы ДНК из одного орг-ма к другому.
2.трансдукция это способность переносить наследственную инф-ю от одного орг-ма к др. при помощи вирусов.
3.конъюгация – обмен наследственной информацией.
Генетический материал вируса представлен одной молекулой нуклеиновой кислоты, ДНК или РНК, не связанной с белком. В связи с этим вирусы подразделяются на ДНК- и РНК-содержащие. Вирусы бактерий чаще содержат ДНК, а почти все вирусы растений и подавляющее большинство вирусов человека — РНК.
Нуклеиновая кислота вируса бывает одно- или двухцепочечной и может иметь кольцевую или линейную форму. Кольцевая форма ДНК более стабильна и свойственна большинству вирусов. Кольцо ДНК (РНК) обычно бывает перекручено, поэтому она имеет суперспирализованный вид.
Генетическое вещество у вирусов заключено в белковую оболочку, которая вместе с нуклеиновой кислотой образует так называемый капсид или нуклеокапсид. Большинство вирусов растений и РНК-содержащих бактериальных фагов состоит только из нуклеиновой кислоты и белка.
Генная инженерия – это комплекс действий, направленных на реорганизацию (перестройку) наследственного материала. Целью ГИ явл-ся создание новых гибридных форм эукариот и прокариот не половым путем, а методом гибридизации мол-лы ДНК (перенос ген-ой инф-ции из 1 орг-ма в др.). Включает следующие этапы:
1.получение ген-го материала.
2.включение этого материала в автономно реплицирующуюся генетт-ю стр-ру и создание рекомбинантной ДНК.
3.введение рекомбинантной мол-лы ДНК в кл.-реципиент и вкл. ее в хромосомный аппарат.
4.отбор трансформированных кл. в геном кот. вкл. переносимый ген.
Способы получения генов для пересадки
1.синтезирование хим-м путем.
2.метод ферментативного синтеза.
3.с помощью фер-тов рестриктаз.
4.клонирование (размножение кл. с рекомб-ной ДНК).
Основные достижения ГИ.На основе генной инженерии можно наладить промышленное производство витаминов, аминокислот, ферментов, гормонов и т. д. В настоящее время уже освоено промышленное производство белка инсулина (гормона поджелудочной железы для лечения диабета) и интерферонов — белков, подавляющих размножение вирусов. Генная инженерия используется в медицинской практике получения вакцин и сывороток.
Генная инженерия позволяет конструировать и эукариотические клетки с новой генетической программой. В настоящее время получают гибриды соматических клеток разных видов и даже животных и растений. Созданы растения, способные усваивать атмосферный азот, что в будущем не только обогатит растительную пищу белками, но сделает ненужным применение азотсодержащих удобрений и благоприятно скажется на чистоте окружающей среды.
Успехи генной инженерии позволили решить ряд фундаментальных проблем биологии. Так, с ее помощью были обнаружены мозаичное, экзонинтронное, строение гена у эукариот, структурные особенности и механизмы активности генов имуноглобулинов, выделены гены, ответственные за развитие злокачественных опухолей, расшифрована их полная нуклеотидная последовательность, выяснены некоторые механизмы дифференциальной активности генов в онтогенезе.
СЕЛЕКЦИЯ КАК НАУКА И ТЕХНОЛОГИЯ. ИСХОДНЫЙ МАТЕРИАЛ В СЕЛЕКЦИИ. СИСТЕМЫ СКРЕЩИВАНИЯ И МЕТОДЫ ОТБОРА В СЕЛЕКЦИЮ, ИХ ХАРАКТЕРИСТИКА. ИСПОЛЬЗОВАНИЕ В СЕЛЕКЦИИ ДОСТИЖЕНИЙ ГЕНЕТИКИ.
Селекция –это наука и методах создания новых и улучшения существующих штампов микроорганизмов, сортов растений и пород животных.
Породой, сортом, штаммом называют популяцию организмов, искусственно созданную человеком и характеризующуюся определенными наследственными особенностями. Все особи внутри породы, сорта, штамма имеют сходные наследственно закрепленные св-ва: продуктивность, определенный комплекс физиологических и морфологических св-в, а также однотипичную реакцию на факторы внешней среды.
Наличие наследственной изменчивости позволяет путем различных систем скрещивания сочетать определенные наследственные признаки в одном организме, а также избавляться от нежелательных св-в.
Система скрещивания
Методы скрещивания 1. родственное (самоопыление)
(разведения): 2. Неродственное: - внутрипородное
Родственным скрещиванием (инбридинг) называют скрещивание особей, имеющих близкую степень родства:
Неродственное скрещивание-аутбридинг. Служит важным методом селекции. С его помощью комбинируют различные ценные признаки для создания новой породы или сорта.
Пример: чтобы повысить живой вес кур породы с маленьким весом, их можно скрестить с другой породой, характеризующейся большим живым весом. Гибридные куры первого поколения по весу будут занимать промежуточное положение. Но если их скрестить с такими же гибридными петухами, то во F2 произойдет расщепление на различные по весу особи. Породы еще не будет, но в этом поколении могут встретиться нужные сочетания признаков.
Отдаленная гибридизация – скрещивание форм, относящихся к разным видам и родам. В селекции получила наибольшее значение у растений, и прежде всего вегетативно-размножаемых. Ее широко использовали многие селекционеры для выведения сортов плодовых и ягодных растений, совмещающих в себе ряд таких ценных качеств, как морозостойкость, устойчивость к заболеваниям. Вегетативное размножение отдаленного гибрида снимает проблему стерильности. Так скрещивание диких иммунных к вирусным заболеваниям видов сахарного тростника с культурными формами позволило в 3 раза повысить продукцию сахара.
У животных: скрестили тонкорунных грубошерстных овец с диким бараном – Архаром была создана тонкорунная порода. Архаро – мерино, приспособленное к высокогорным пастбищным условиям.
В селекциях микроорганизмов гибрид двух дрожжей: Saccharomyces cerevisiae и S. Carlsbergensis сочетает ферменты, гидролизирующие сахара обоих видов. В силу этого он дает повышенный выход спирта и патоки. Этот гибридный штамм может неограниченно долго размножаться вегетативно не давая расщепления.
Основные задачи современной селекции:
- повышение урожайности сортов культурных растений
- повышение продуктивности пород домашних животных
- повышение продуктивности штаммов микроорганизмов
С целью изучения многообразия и географического распространения культурных растений Н.И Вавилов организовывал многочисленные экспедиции. В результате выделены центры происхождения культурных растений:
1)Южноазиатский – рис, сахарный тростник, цитрусовые.
Лекция 8. Передача наследственной информации у бактерий и вирусов. Основы фармакогенетики
Кишечная палочка (Escherichia coli) обладает гаплоидным набором хромосом, является быстрорастущим организмом, который можно культиворовать на синтетической среде. В бактериях происходит обмен генетической информацией, который приводит к возникновению новых рекомбинативных генотипов, однако процессы, которые приводят к такому обмену, существенно отличаются от оплодотворения и мейоза, характерных для высших организмов. Эти процессы называются парасексуальными и включают в себя такие формы, как сексдукция, трансформацияи трансдукция. Парасексуальные процессы – это обмен генетической информацией между клетками разных штаммов бактерий и вирусов.
Сексдукция – это перенесение генетического материала от одной бактерии к другой с помощью полового фактора (F+) при коньюгации. Впервые процесс коньюгации у бактерий обнаружили Дж.Ледеберг и Э.Татум в 1946 г. В 1952 г. Хейс установил неравноценную роль родительских штаммов при коньюгации. Выяснилось, что один штамм является донором (мужским), а другой – реципиентом (женским). F+ - это присутствующий половой фактор, что характерно для мужских клеток бактерий, F- - это отсутствующий половой фактор, что характерно для женских клеток бактерий.
Клетки-доноры обладают половым фактором F+, который является коньюгативной плазмидой и представляет собой циркулярно замкнутую молекулу ДНК. При коньюгации клетки доноры F+ соединяются с клетками-реципиентами F- при помощи коньюгационного мостика – особой протоплазматической трубки, образуемой клеткой F+. При коньюгации фактор F+ обычно не передается, так как располагается в конце хромосомы. С более высокой частотой передаются гены, расположенные около начальной точки хромосомы донора. Затем ДНК донора в гомологичных участках вступает в контакт с ДНК реципиента и в результате кроссинговера, некоторые участки одной цепи ДНК реципиента заменяются фрагментами ДНК донора. При коньюгации половой фактор вместе с фрагментами ДНК иногда переходит в женскую клетку, превращая ее в мужскую и передавая ей свойства, контролируемые фрагментом хромосомы донора. Мостик между коньюгирующими клетками хрупок, и перенос всей хромосомы донора, который при 370С занимает 90 минут редко доходит до конца. При данной температуре перенос происходит с постоянной скоростью. Большая скорость деления бактериальных клеток за короткий промежуток времени, обуславливает их показательное использование в генетических исследованиях.
Трансформация – это процесс передачи наследственной информации от одного штамма бактерий другому вследствие перенесения ДНК. Такое явление впервые обозначил Ф.Гриффитс в 1928 г. на пневмококках. В 1944 году Эвери, Мак-Леод и Мак-Карти осуществили химическую идентификацию трансформирующего начала. Они убивали клетки пневмококков нагреванием, экстрагировали с помощью лизиса в присутствии детергента и после осаждения абсолютным этанолом и депротеинизации хлороформом получали трансформирующее начало в высокоактивной форме. Конечный продукт давал отрицательную реакцию на белок и и РНК и резкоположительную реакцию на ДНК. Трансформирующая активность препарата была устойчива к протеолитическим ферментам и рибонуклеазе, но разрушалась под действием ферментов, расщепляющих ДНК. С помощью этих экспериментов было твердо установлено, что ДНК способна переносить генетическую информацию от одной бактерии к другой.
Трансдукция- Это перенос генов из одной бактериальной клетки в другую при участии определенных бактериофагов. Впервые явление трансдукции установили Н.Д.Циндер и Дж.Ледеберг в 1952 г. По строению бактериофаги – это вирусы, паразитирующие в бактериальных клетках. У бактериофагов ДНК заключена в головке фага. Если фаг вирулентный, то инфицирование этим фагом чувствительной клетки-хозяина приводит к ее лизису и высвобождению фагов-потомков. Фаговые частицы прикрепляются к специфическим участкам бактериальной клеточной стенки с помощью фибрилл отростка. Чехол отростка сокращается, и содержимое головки проникает внутрь бактерии, как бы впрыснутое шприцем. Фаговая ДНК проходит через отросток в бактериальную клетку, подавляя белоксинтезирующие механизмы клетки-хозяина, и заставляет их синтезировать компоненты фага, используя в качестве матрицы фотоспецифические мРНК. Есть и такие фаги, которые, инфицируя клетку, не обязательно вызывают ее лизис. Подобно коньюгации, трансдукция – однонаправленный перенос. Трансдуцированные гены донора включаются в тот участок бактериальной хромосомы, в котором расположены гомологичные гены реципиента. Иногда трансдуцированный фрагмент ДНК не интегрируется, а остается в цитоплазме бактерии; в этом случае он не может делиться, но способен транскрибироваться и транслироваться. Это абортивная трансдукция; она обусловливает гетерозиготность по генам, содержащимся в перенесенном фрагменте, и позволяет исследовать функцию генов и их взаимодействие.
Эксперимент Френкель-Конрата в 1955 г. отчетливо показал, что именно РНК определяет взаимодействие вируса и клетки-хозяина, а также генотип и фенотип вирусного потомства. В 1956 г. Гигер и Шрамм показали, что генетическим материалом ряда вирусов, а в частности вируса табачной мозаики (ВТМ) является одноцепочечная молекула РНК.
Фармакогенетика – наука о роли генетических факторов в индивидуальной, видовой, половой и возрастной восприимчивости организмов к лекарственным веществам, метаболизме этих веществ, толерантности, лекарственной зависимости, кумуляции, потенциировании и антагонизме. Фармакогенетика – это новый прикладной междисциплинарный раздел генетики и фармакологии (науки, изучающей действие лекарственных веществ на организм животных и людей).
- реакции организма на действие лекарственных веществ с учетом генетических особенностей отдельных индивидуумов в рамках возрастных, сезонных, половых, видовых особенностей;
- стремление достижения желаемого эффекта при их применении;
- механизм и степень наследования этих реакций в норме и патологии;
- генетику ферментов, которые превращают (метаболизируют) лекарственные вещества в норме и в случае патологических изменений в ферментной системе;
- разрабатывает способы профилактики патологических медикаментозных реакций и лечения органов с такими отклонениями.
Генетически обусловленные отличия в реакциях организма на лекарственные вещества зависят:
1. От замедленного метаболизма лекарственных веществ, вследствие чего возникает резкая реакция организма на фармакологические препараты (образование недостаточного количества соответствующих ферментов, или с недостаточной их активностью).
2. От ускоренного метаболизма лекарственных веществ, результатом которого является слабая фармакологическая реакция организма и пониженная лечебная эффективность препаратов.
3. От нарушения нормального взаимодействия между лекарственными веществами и метаболитами, что может приводить к образованию вредных химических соединений и негативной реакции организма.
Также могут возникать нетипичные реакции организма на лекарственные вещества, прямо не связанные с генотипом организма, а являются результатом аллергизации, ослабления защитных механизмов организма. Чаще всего это результат ферментных дефектов (энзимопатий).
Энзимопатии – наследственные нарушения структуры и функции ферментов, метаболизирующих лекарственные вещества. Они возникают в результате мутаций определенных генов и играют важную роль в возникновении негативного действия многих лекарственных веществ. В одном случае действие лекарственных веществ усиливается настолько, что обуславливает нежелательные последствия, а в другом – лекарственные вещества провоцируют обострение хронических заболеваний, которые протекали латентно.
Широкое применение антибиотиков и других лекарств привело к тому, что генетическая резистентность патогенных бактерий возросла до такой степени, при которой часто затруднено лечение инфекционных болезней. В Англии среди изученных штаммов сальмонелл 61% оказался резистентным к одному или более антибиотиков. В этой же стране в 1977 г. 62,6% штаммов E.coly, выделенных от крупного рогатого скота, были резистентными к стрептомицину и 47% - к тетрациклину, а у свиней – соответственно 5,5 и 47,1%.
У скота, павшего от респираторных болезней, выделено более 50% культур пастерелл, устойчивых к сульфаниламидам и стрептомицину, а 75% были нечувствительны к тетрациклину.
На некоторых фермах в Японии во время эпизоотии сальмонеллеза у телят выделяли до 77% устойчивых к хлорамфениколу штаммов сальмонелл, среди которых 85% были также устойчивы к тетрациклину, стрептомицину и сульфаниламидам. Резистентность полностью передавалась последующим поколениям сальмонелл.
Во многих странах повышение резистентности к различным лекарствам обнаружено у гельминтов и клещей. Установлено, что применение одного препарата ведет к возникновению устойчивости клещей к этому препарату в течение 5-10 лет.
Механизм резистентности микроорганизмов против лекарственных веществ.
Резистентность микроорганизмов зависит от образования в бактериальных клетках так называемых плазмид – эписом с R–фактором (способным обеспечить устойчивость бактерий против лекарственных веществ). Плазмиды по коньюгационному мостику могут проникать в другую бактерию, даже другого вида, обусловливая или невосприимчивость к определенным лекарственным веществам, или способность к синтезу колицинов. Колициногены включают гены, которые и обусловливают синтез бактерией особых белковых веществ – колицинов. Однако образовавшиеся метаболиты пагубно воздействуют на организм животного или человека, ухудшая состояние здоровья. Периодическое чередование разных лекарственных веществ (в пределах 2-3 суток), как правило, приводит к полной утрате способности бактериальной клетки к быстрому размножению R-факторов, размножению самой клетки и к ее гибели. Некоторые из плазмид способны встраиваться в хромосому бактерии, и тогда при переходе из одной бактерии в другую они, подобно половому фактору, перетягивают за собой часть, а иногда всю хромосому.
Эффективность введения лекарственных веществ зависит от:
- Пола. Мужской пол имеет меньше активных генов, чем женский, вследствие инертности Y-хромосомы. Например женский пол чувствителен к никотину, стрихнину, снотворному, но резистентен к алкоголю.
- Возраста. Новорожденные более чувствительны к лекарственным веществам, чем взрослые. При внутрибрюшном введении новорожденным крольчатам гексабарбитала 75мг/кг приводит к глубокому сну, а затем к гибели. У 10-дневных крольчат сон 1-2 часа, и гибнут 50%. У 16-дневных крольчат – сон 10-20 минут. Взрослые кроли не засыпают. Такие лекарственные вещества, как ацетилхолин, адреналин, никотин у старых животных вызывают реакцию в 3-10 раз выше, чем у молодых.
- Смены дня и ночи. Так морфин, амфетамин наиболее активны в ночное время, а никотинамид – днем. У мышей токсичность этилового спирта вечером и ночью выше, чем утром и днем. Ритмическая деятельность организма полностью зависит от генетического контроля и действия желез внутренней секреции.
- Факторов внешней среды. Температура, свет, радиационный режим, способ содержания (групповой, одиночно), режим кормления, атмосферное давление… Воздействие рентгеновскими лучами снижает действие лекарственных веществ. Одиночное содержание приводит к увеличению активности ферментов, вследствие чего продолжительность сна значительно уменьшается.
Читайте также:


