Вирулентные и умеренные вирусы
Вирулентные и умеренные фаги
Бактериофаги — вирусы бактерий, обладающие способностью специфически проникать в бактериальные клетки, репродуцироваться в них и вызывать их растворение (лизис).
Взаимодействие фага с бактериальной клеткой. По механизму взаимодействия различают вирулентные и умеренные фаги.
Вирулентные фаги , проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Процесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и весьма схож с процессом взаимодействия вирусов человека и животных с клеткой хозяина, вот они:
1) адсорбция — с помощью нитей хвостового отростка;
2) проникновение в клетку;
3) репродукция белка и нуклеиновой кислоты внутри клетки;
4) сборка и формирование зрелых фагов;
5) лизис клетки, выход фага из нее.
После биосинтеза фаговых компонентов и их самосборки в бактериальной клетке накапливается до 200 новых фаговых частиц. Под действием фагового лизоцима и внутриклеточного осмотического давления происходит разрушение клеточной стенки, выход фагового потомства в окружающую среду и лизис бактерии. Один литический цикл (от момента адсорбции фагов до их выхода из клетки) продолжается 30—40 мин. Процесс бактериофагии проходит несколько циклов, пока не будут лизированы все чувствительные к данному фагу бактерии.
Взаимодействие фагов с бактериальной клеткой характеризуется определенной степенью специфичности. По специфичности действия различают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий.
Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков.
Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая профаг, получила название лизогенной. Это название отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, т. е. вести себя как вирулентный фаг, лизирующий бактерии.
Доказано индуцирующее действие магнитных полей на лизогенные системы. При отщеплении профаг переходит в вегетативную (размножающуюся) форму и лизирует клетку. Выделившиеся фаговые частицы не способны к репродукции в лизогенных по тому же фагу бактериях, но могут вызывать лизис нелизогенных или лизогенных по другим фагам родственных клеток.
Изредка лизогенные бактерии утрачивают фаг без перехода его в вегетативную форму. Так, в результате лизогенизации у некоторых бактерий изменяются форма и цвет колоний, нетоксигенные штаммы коринебактерий дифтерии превращаются в токсигенные, а у сальмонелл появляются новые антигенные детерминанты. Изменчивость, формирующаяся под влиянием профага, получила название фаговой конверсии.
При индукции лизогенных бактерий в профаг нередко включаются гены бактерий, но чаще они замещают некоторую часть того его участка ДНК, которая остается в геноме бактериальной клетки.
Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств микроорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретает новые свойства. Таким образом, умеренные фаги являются мощным фактором изменчивости микроорганизмов.
Бактериофаги— вирусы бактерий. Бактериофагия — процесс взаимодействия фагов с бактериями, заканчивающийся очень часто их разрушением.
Различают фаги инфекционные, т. е. способные вызвать разные формы фаговой инфекции, и неинфекционные (вегетативные), или незрелые, фаги, находящиеся еще в стадии размножения. В свою очередь инфекционные фаги разделяют на покоящиеся (находящиеся вне клетки), вирулентные — способные вызвать продуктивную форму инфекции, и умеренные фаги — способные вызывать не только продуктивную, но и редуктивную фаговую инфекцию.
Механизм взаимодействия вирулентного фага с микробной клеткой.
1)Адсорбция фагов на клеточной поверхности бактерий при помощи специфических рецепторов (белков-лоцманов), которые располагаются на кончике нити, шипа или хвостика. В свою очередь, на клеточной стенке бактерии располагаются ее фагоспецифические рецепторы, распознаваемые фагом.
2)Проникновение фагового генома через клеточную стенку и цитоплазматиче- скую мембрану внутрь клетки и освобождение его от оболочки (раздевание фага).
3)Установление фагового генома с помощью белка-лоцмана для реализации содержащейся в геноме информации:
4)Репликация фаговой геномной ДНК или РНК.
5)Сборка вновь синтезированных вирионов — заключение геномной НК в белковую оболочку, морфогенез фагов.
6) Выход вновь синтезированных фагов из клетки:
а) путем отпочковывания;
б) путем лизиса клетки изнутри. Он осуществляется свободным лизоцимом и вызывает гибель клетки.
Особенности морфогенеза фагов.
Морфогенез мелких фагов протекает по типу самосборки. У крупных фагов этот процесс носит более сложный характер. Например, морфогенез фага Т4 требует активности более чем 40 генов и протекает при участии трех самостоятельных линий. На одной из них происходит сборка хвостика (участвует около 20 генов), на другой — головки фага (не менее 16 генов) и на третьей — сборка ворсинок (5 генов). Соединение хвостика с головкой не требует участия генов, однако оно не может произойти до тех пор, пока и хвостик, и головка не будут смонтированы полностью. Точно так же ворсинки могут присоединяться к хвостику только после того, как он соединится с полностью готовой головкой. Благодаря строгому генетическому контролю со стороны фага обеспечивается последовательность и согласованность всех процессов его внутриклеточного размножения.
Выход сформировавшихся фагов в большинстве случаев происходит благодаря лизису изнутри свободным лизоцимом. Он синтезируется на самом последнем этапе размножения фага. Иногда бывает лизис бактерий извне как следствие адсорбции многих фагов на одной клетке, но при этом размножения фагов не происходит.
Обычно же после внедрения фагового генома в клетку у нее возникает состояние иммунитета к суперинфекции данным фагом, т. е. проникновение других фаговых геномов становится невозможным. Иммунитет обеспечивается особым цитоплазматическим репрессором.
6. Методы культивирования вирусов. Заражение животных, куриных эмбрионов. Получение культур клеток. Среды, применяемые для культур клеток. Цитопатический эффект и его проявления. Реакция гемадсорбции.
Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах.
Культуры клеток. Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые.
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчения ткани, разъединения клеток путем трипсинизации, отмывания полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост, например в среде 199 с добавлением телячьей сыворотки крови.
Перевиваемые культуры в отличие от первичных адаптированы к условиям, обеспечивающим им постоянное существование in vitro, и сохраняются на протяжении нескольких десятков пассажей.
Перевиваемые однослойные культуры клеток приготовляют из злокачественных и нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьяны и др.
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток.
Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности.
Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорбировать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз.
Более точным количественным методом учета отдельных вирусных частиц является метод бляшек.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток.
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям.
Для получения чистых культур риккетсий, хламидий. и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его оболочках.
О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами.
К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов.
Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки).
Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
7. Особенности размножения вирусов, геном которых представлен однонитчатой ДНК. Репликативная и промежуточная репликативные формы. Особенности размножения вирусов, геном которых представлен однонитчатой РНК.
У вирусов, геном которых представлен однонитевой РНК, ее репликация происходит по следующей схеме: вначале на вирионной РНК (вРНК) синтезируются комплементарные ей РНК (кРНК). Этот процесс катализируется специфической РНК-репликазой I. Затем на кРНК синтезируется комплементарная ей, но идентичная исходной вирионная РНК (вРНК), этот процесс также катализируется специфической репликазой И. Таким образом, репликация идет по схеме:
вРНК > кРНК > вРНК.
Общие закономерности размножения вирусов.
Во-первых, все РНК-содержащие вирусы, кроме вирусов гриппа и ретровирусов, размножаются в цитоплазме. Для своего размножения вирусы гриппа А и В и ретровирусы проникают в ядро, что связано с особенностями поведения их генома. Во-вторых, размножение всех ДНК-содержащих вирусов, кроме вирусов оспы, протекает в ядре, где происходит транскрипция и репликация их геномных нуклеиновых кислот, и в цитоплазме, где происходит трансляция вирусных белков, их процессинг и морфогенез вирионов. Лишь размножение вирусов группы оспы происходит в цитоплазме клетки, поскольку они обладают собственными системами транскрипции.
Взаимодействие начинается с прикрепления вирусных частиц к клеточной поверхности. Процесс становится возможным при наличии соответствующих рецепторов на поверхности клетки и анти-рецепторов на поверхности вирусной частицы.
Вирусы используют рецепторы клетки, предназначенные для транспорта необходимых веществ: питательных частиц, гормонов, факторов роста и т.п.
Рецепторы: белки, углеводный компонент белков и липидов, липиды. Специфические рецепторы определяют дальнейшую судьбу вирусной частицы (транспорт, доставка в участки цитоплазмы или ядра). Вирус может прикрепляться и к неспецифическим рецепторам и даже проникать в клетку. Однако такой процесс не вызывает развития инфекции.
Вначале происходит образование единичной связи антирецептрора и рецептора. Такая связь непрочная и может разрываться. Для образования необратимой адсорбции необходимо мультивалентное прикрепление. Стабильное связывание происходит благодаря свободному перемещению молекул рецепторов в мембране. При взаимодействии вируса с клеткой наблюдается увеличение текучести липидов, и формирование рецепторных полей в области взаимодействия вируса и клетки. Рецепторы ряда вирусов могут быть представлены лишь в ограниченном наборе клеток-хозяев. Этим и определяется чувствительность организма к данному вирусу. Таким образом, вирусная ДНК и РНК обладает способностью инфицировать более широкий круг клеток-хозяев.
Антирецепторы могут находиться в составе уникальных вирусных органелл: структуры отростка у Т-бактериофагов, фибры у аденовирусов, шипы на поверхности вирусных мембран, корона у коронавирусов.
2 механизма – рецепторный эндоцитоз и слияние мембран. У фагов только НК. Механизм проникновения не известен.
Обычный механизм поступления в клетку питательных и регуляторных веществ. Происходит в специализированных участках - где имеются специальные ямки, покрытые клатрином, на дне ямки располагаются специфические рецепторы. Ямки обеспечивают быструю инвагинацию и образование покрытых клатрином вакуолей. (с момента адсорбции проходит не более 10 мин, за одну минуту может образоваться до 2000 вакуолей). Вакуоли сливаются с более крупными цитоплазматическими вакуолями, образуя рецепторосомы (уже не содержат клатрин), которые в свою очередь сливаются с лизосомами.
Слияние вирусной и клеточной мембран:
У оболочечных вирусов слияние обусловлено точечными взаимодействиями вирусного белка с липидами клеточной мембраны, в результате чего вирусная липопротеидная оболочка интегрирует с клеточной мембраной. У безоболочечных вирусов один из поверхностных белков также взаимодействует с липидами клеточных мембран и внутренний компонент проходит через мембрану (у парамиксовирусов – F-белок, у ортомиксовирусов – HA2 гемагглютинирующая субъединица). На конформацию поверхностных белков влияет рН.
При этом процессе исчезает инфекционная активность, часто появляется чувствительность к нуклеазам, возникает устойчивость к антителам. Конечный продукт раздевания – нуклеиновые кислоты, связанные с внутренним вирусным белком. Стадия раздевания является так же лимитирующей возможность инфекции (вирусы способны раздеваться не в каждой клетке). Раздевание происходит в специализированных участках клетки: лизосомы, аппарат Гольджи, околоядерном пространстве.
Раздевание проходит в результате ряда реакций. Например, у пикорнавирусов раздевание идёт с образованием промежуточных субвирусных частиц с размерами от 156 до 12S. У аденовирусов в цитоплазме и ядерных порах и имеет как минимум 3 стадии:
- образование субвирусных частиц с большей плотностью, чем вирионы;
- образование сердцевин, в которых отсутствует 3 вирусных белка;
- образование ДНК-белкового комплекса, в котором ДНК ковалетно соединена с терминальным белком.
Характеристика вирулентных и умеренных фагов.
При заражении бактерии фагом имеет место так называемая литическая инфекция т.е инфекция завершающаяся лизисом клетки хозяина, но это свойственно только так называемым вирулентным фагам, взаимодействие которых с клеткой приводит к гибели клетки и формированию фагового потомства.
В отличие от вирулентных, заражение умеренными фагам не приводит к лизису бактериальных клеток, а реализуется становление особого состояния сосуществования фага с бактериальной клеткой. Это сосуществование выражается в том, что некое начало фага присутствует в бактериальной клетке без всяких неблагоприятных условий для нее и сохраняется из поколения в поколение. На определенных этапах такого сосуществования фаг активируется в клетке и переходит в состояние литического цикла развития, вызывая лизис клетки и высвобождения фагового потомства. Такие фаги получили название лизогенезирующих или умеренных фагов, а состояние умеренного существования с фагом лизогенией, а бактерии, которые содержат в себе такой скрытый фаг - лизогенных бактерий. Термин лизогенные бактерии происходил из того, что когда-то были обнаружены культуры, у которых спонтанно появлялся фаг, и этот бактериафаг стал рассматриваться как загрязнение культуры, то есть в культуру попадает бактериальный вирус, и такие культуры получили название лизогенных, то есть они генерируют лизис.
- 450
- 0,4
- 0
- 1
Электронная микрофотография вирионов φKO2.
[1] и рисунок автора статьи

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Обобщенная схема вариантов развития событий в жизненных циклах бактериофагов представлена на рисунке 1. После заражения клеток вирулентные фаги вступают в продуктивный (литический) цикл с образованием фаговых частиц и последующим лизисом клеток. Умеренные же фаги в ходе лизогенного цикла встраивают свой геном в бактериальную хромосому и остаются в неактивном состоянии до воздействия каких-либо внешних факторов [5]. Схема, изображенная на рисунке, репрезентативна для большинства известных умеренных фагов (Inovirus, Epsilon15-, phiC31-, Stx-, P4-, P22-, SfV-, P2- и Mu-подобных) [6], в том числе и для одного из немногих модельных объектов молекулярной биологии — фага λ. Этот значимый для истории биологии бактериофаг был открыт Эстер Ледерберг в 1951 году при работе со штаммом Escherichia coli K-12 [7], [8]. Современное представление об интеграции генома фага λ в бактериальную хромосому подразумевает att-сайт-специфическую рекомбинацию кольцевой ДНК фага и бактериальной хромосомы с участием продукта гена int — интегразы. Этот процесс проиллюстрирован в разделе, посвященном трансдукции.

рисунок автора статьи
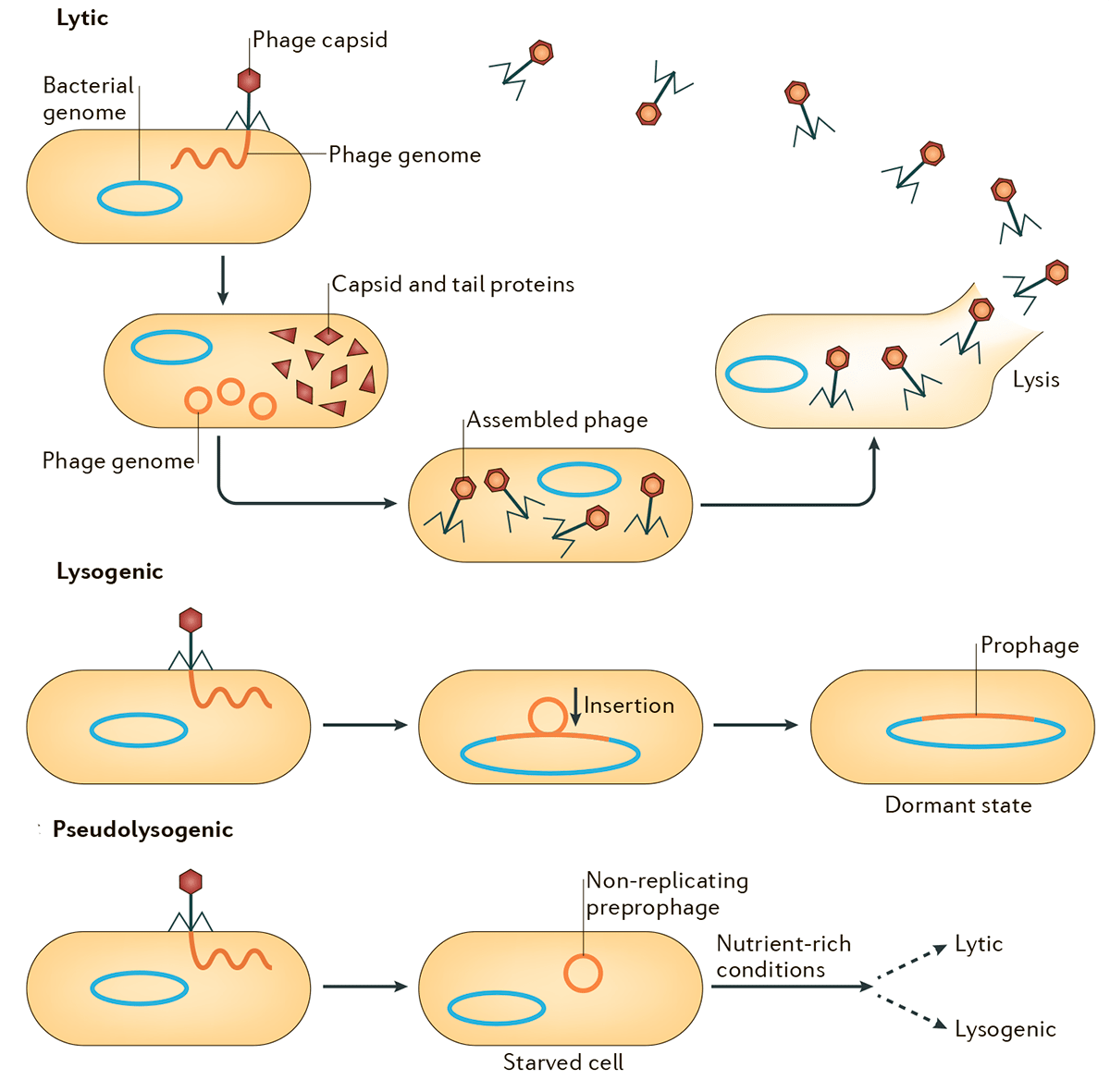
Рисунок 1. Схема литического, лизогенного и псевдолизогенного циклов. Лизогенный цикл может переключаться на литический, что будет сопровождаться продукцией частиц умеренного бактериофага и лизисом клеток. Псевдолизогения — нестабильное состояние фага, который не смог начать репликацию или стать профагом, — часто встречается при недостатке питательных веществ.
Однако, как и следует ожидать от Природы, такая форма пребывания умеренного фага в инфицированной клетке не может быть единственно возможной.
Бактерия Klebsiella oxytoca — оппортунистический патоген человека и животных, способный вызывать бронхопневмонию, воспаление мочевых путей, септицемию и колит [9], [10]. В 1980-е годы в Швеции из смазочно-охлаждающей жидкости для металлообработки выделили необычный штамм K. oxytoca, CCUG 15788, устойчивый к высокому содержанию Ni 2+ в среде [11], [12]. Тщательный электрофоретический и рестрикционный анализ геномной ДНК выявил в клетках CCUG 15788 две крупные плазмиды, правда, за устойчивость к никелю отвечали не они, а хромосома. Плазмида размером 160 т.п.н. оказалась стандартной, кольцевой, а вот меньшая, размером около 50 т.п.н., — линейной, что очень не типично для γ-протеобактерий [12]. Именно линейная плазмида, названная pKO2, через годы преподнесла исследователям сюрприз.

рисунок автора статьи
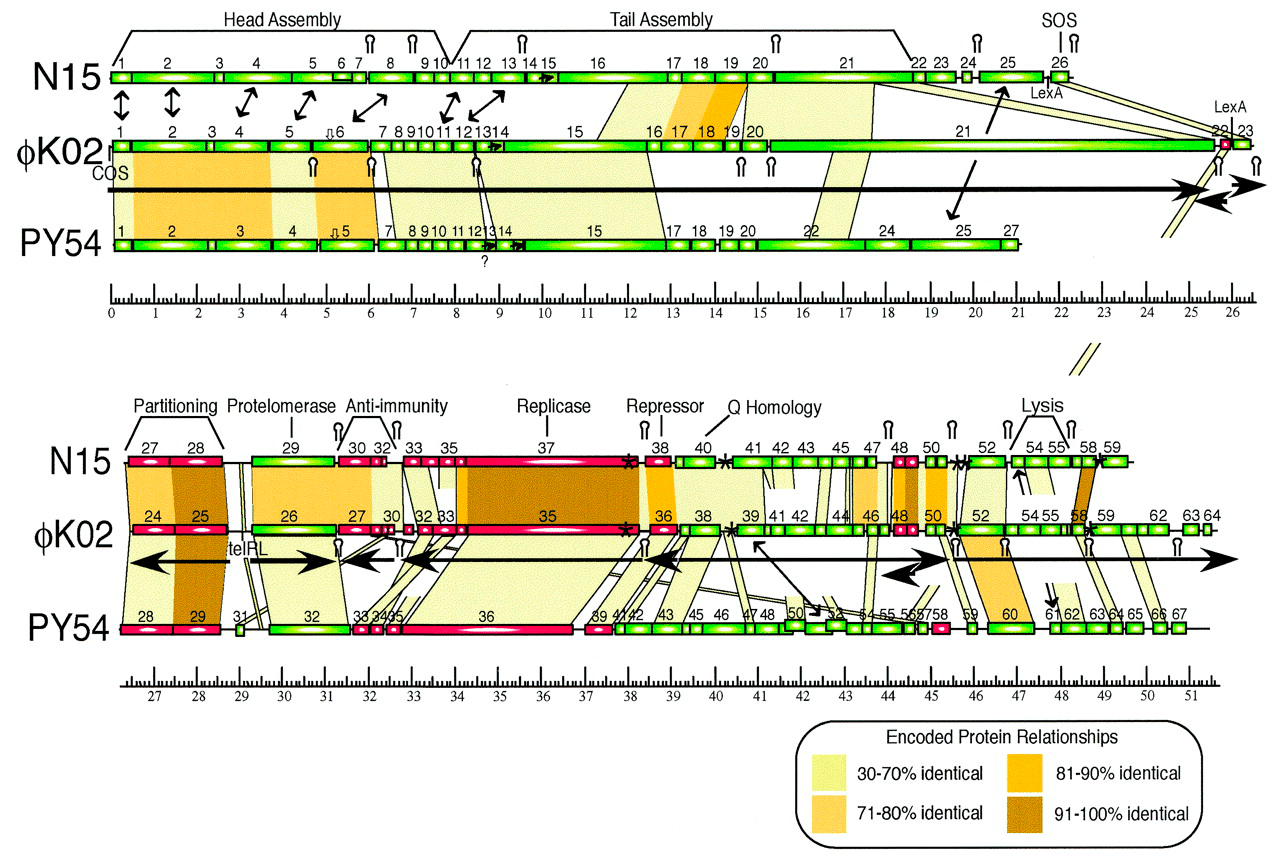
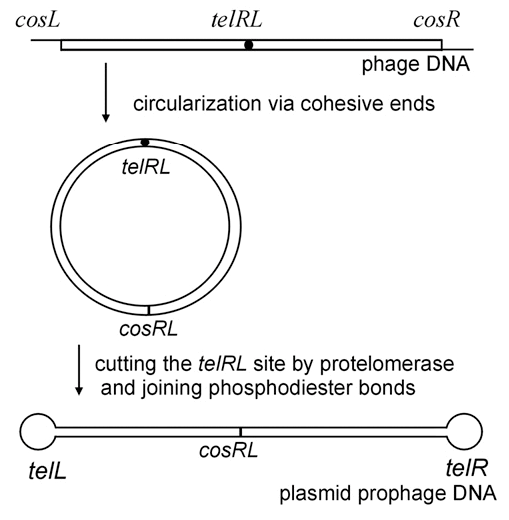
Охарактеризованный ранее фаг N15 представляет пока немногочисленную группу бактериофагов, профаги которых способны существовать в виде плазмид . N15 — первый исследованный пример линейной ДНК с ковалентно замкнутыми концами (теломерами) у прокариот [14]. Семья теломерных фагов-плазмид сейчас включает лямбдоидные N15, pY54 и φKO2 (Siphoviridae), а также фаги ΦHAP-1, VHML, VP882, Vp58.5 и vB_VpaM_MAR морских γ-протеобактерий (Myoviridae). У всех них очень схожи гены протеломераз и репликативного аппарата, а также модулей контроля лизогении [15].

рисунок автора статьи
Внедрение бактериофага, умеренного или вирулентного, в бактериальную клетку связано с риском для вируса и требует молекулярной продуманности и подготовки для успешного выполнения лизогенной или продуктивной программ. Для каждой стадии жизненного цикла вируса у бактерии есть специальные антифаговые барьеры и капканы (рис. 4а).
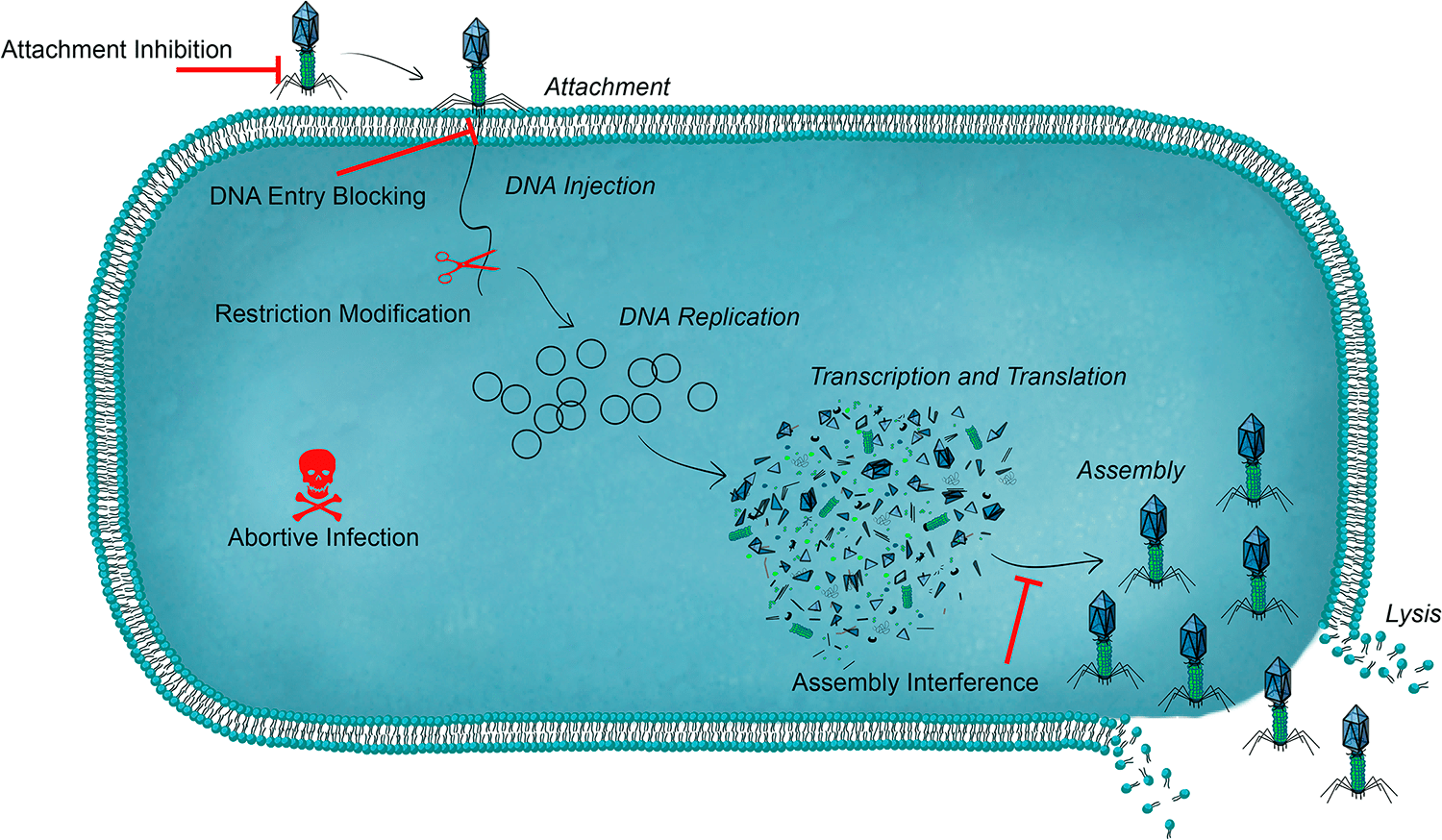
Рисунок 4а. Противофаговые системы бактерий. Этапы литического цикла выделены курсивом. Красным обозначены бактериальные системы противодействия вирусной инфекции. Клеточная оболочка изображена упрощенно, в виде цитоплазматической мембраны.
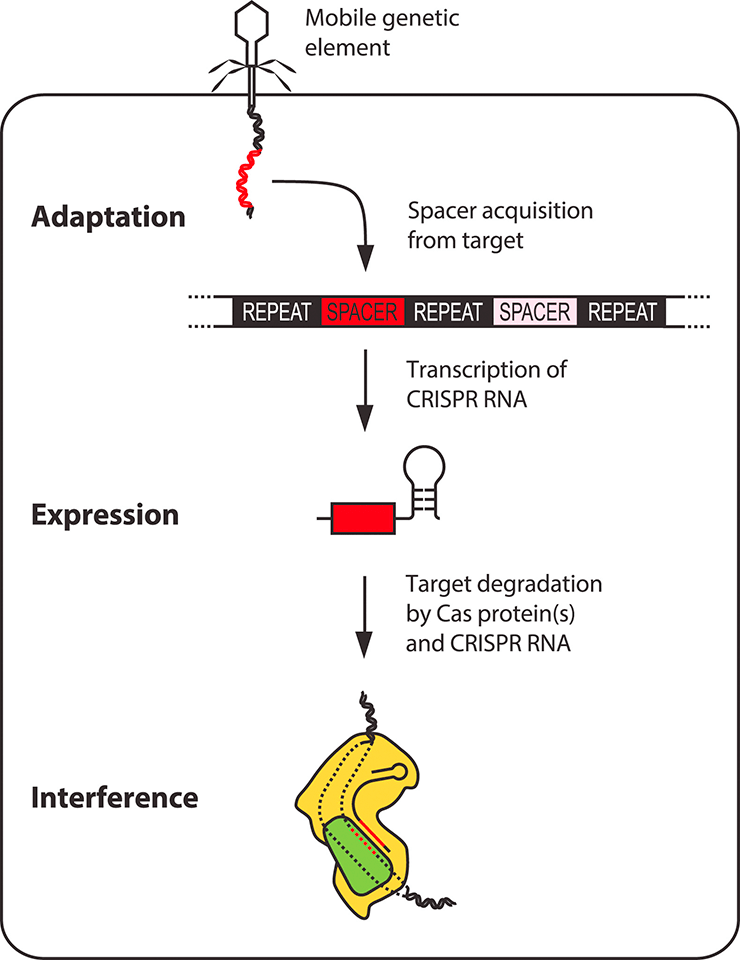
Рисунок 4б. Ключевые этапы работы иммунитета CRISPR-Cas. Адаптация — вставка новых спейсеров в локус CRISPR. Экспрессия — транскрипция локуса CRISPR и процессинг CRISPR-РНК. Интерференция — узнавание и деградация мобильных генетических элементов комплексом из CRISPR-РНК и Cas-белка.
Но преодолеть перечисленные барьеры — это еще не всё. Для успешной реализации лизогенного сценария умеренный бактериофаг должен обладать механизмом торможения литического цикла развития. Ключевую роль в переключении программы жизненного цикла бактериофага играют закодированные в геноме фага антагонистические репрессоры. Так, у φKO2 и N15 есть область иммунитета immB, содержащая гены репрессора профага CB, литического репрессора Cro и антитерминатора Q, подобные генам cI, cro и q модельного фага λ (рис. 5). Однако количество операторов, с которыми связываются репрессоры CB (CI) и Cro, у λ и теломерных φKO2/N15 неодинаково — шесть и пять соответственно [20], [21].
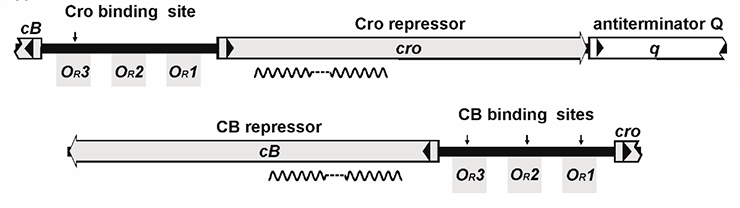
Рисунок 5. Репрессия транскрипции φKO2. Репрессор CB связывается с тремя операторами OR (между генами cB и cro) и двумя операторами OL (между cB и геном репликазы, repA). В этих зонах находится ряд промоторов, поэтому CB репрессирует транскрипцию cro, собственного гена, поздних генов, а также repA, что предполагает участие CB в контроле репликации плазмиды. Репрессор Cro связывается только с оператором OR3 и подавляет транскрипцию cB, но не своего собственного гена. Белки Q и Cro инициируют транскрипцию генов сборки фаговых частиц.
Роль умеренных, а иногда и вирулентных, фагов в микромире не ограничивается уничтожением с той или иной эффективностью своих хозяев. Бактериофаги — агенты горизонтального переноса генов и, соответственно, мощная движущая сила эволюции прокариот. А значит, в биографиях отдельных людей и человечества в целом они тоже оставляют заметные следы.
Находясь в клетках бактерий, умеренные фаги могут придавать своим хозяевам новые свойства — осуществлять лизогенную конверсию. Например, изменять морфологию колоний, ферментативную активность, бактериальные антигены, чувствительность к антибиотикам и другим веществам, а также к гомологичным фагам [3], [23–24]. Первой системой, на которой продемонстрировали лизогенную конверсию, была бактерия Corynebacterium diphtheriae. Ее штамм именно после инфицирования умеренным фагом β стал токсигенным [3]. В таблице приведены некоторые примеры фаговых генов, ответственных за патогенность бактерий.
| Бактерия | Фаги | Кодируемые фагом гены вирулентности и их продукты |
|---|---|---|
| C. diphtheriae | Beta | tox — дифтерийный токсин |
| E. coli | Stx | stx1, stx2 — шига-токсины; stk — тирозинкиназа, влияющая на передачу сигналов; cif, espI/nleA, espI, espK, espEU/tccP, nleI — эффекторные белки системы секреции III типа (T3SS), способствующие вторжению в клетки жертвы |
| λ | lom — белок внешней мембраны, обеспечивающий связывание с эпителиальными клетками; bor — белок внешней мембраны, помогающий уклоняться от иммунитета | |
| CP-933C | Факторы, регулирующие синтез T3SS | |
| S. enterica | φSopE | sopE — T3SS-эффектор |
| Gifsy-1 | gipA, gogB — факторы, способствующие колонизации пейеровых бляшек и выживанию в макрофагах | |
| Gifsy-2 | sodC1 — фермент-антиоксидант, способствующий выживанию в макрофагах; sseI — T3SS-эффектор | |
| Gifsy-3 | sspHI — T3SS-эффектор | |
| P. aeruginosa | D3 | Факторы, меняющие свойства внешней мембраны, а потому препятствующие фагоцитозу |
| S. mitis | SM1 | pblA, pblB — поверхностные белки, необходимые для прикрепления к тромбоцитам |
| C. jejuni | CJIE1 | Факторы, облегчающие адгезию и инвазию |
| V. cholerae | CTX | ctx — холерный токсин |

рисунок автора статьи
Помимо собственных генов фаги способны переносить в инфицируемые клетки и генетический материал предыдущего хозяина (фрагменты его хромосомы или мобильных генетических элементов). Этот процесс называется трансдукцией. Тех бактерий, чью ДНК фаг переносит, называют донорами, а тех, что этот материал принимают, — реципиентами. С помощью неспецифичной, или общей, трансдукции может передаваться любой признак: это происходит при случайном захвате в вирусную частицу фрагмента генома бактерии. При специфичной трансдукции фаговые частицы переносят из генома бактерии строго определенные маркеры. На это способны, как правило, только умеренные фаги — те, что встраиваются в бактериальный геном в строго определенных местах [2]. Классический пример специфичной трансдукции фагом λ бактериальных локусов gal и bio (или их частей) представлен на рисунке 6. В результате такой трансдукции возможно приобретение бактерией-реципиентом способности к утилизации галактозы и/или синтезу биотина, если, конечно, ранее она была лишена этих свойств [25].
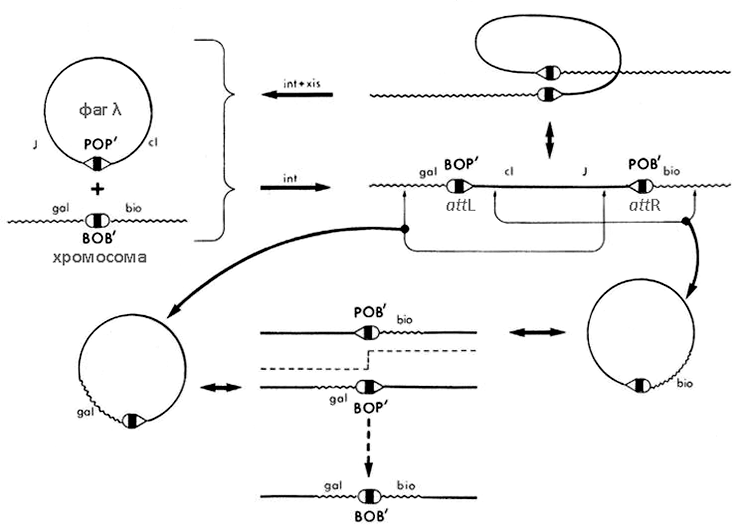
[25], рисунок с изменениями

рисунок автора статьи
Умеренные фаги образуют устойчивые ассоциации с бактериями-хозяевами. Для образования лизогенной бактерией фаговых частиц необходимо воздействие особых факторов, часто очень сильное. Известно, что в популяции лизогенных бактериальных штаммов всегда есть некоторое количество вирусных частиц. Это объясняется спонтанным высвобождением бактериофагов.
Фаговая индукция — переключение лизогенного цикла профага на литический, продуктивный — может быть обусловлена случайностями в экспрессии генов (генетический шум) или включением SOS-ответа, например, при повреждении ДНК УФ-облучением или активными формами кислорода (АФК). Объясняется это просто: во время SOS-ответа выводится из строя репрессор, поддерживающий профаг в неактивном состоянии, и запускается экспрессия литических генов.
Обобщенная схема активации продукции фаговых частиц представлена на рисунке 7а [26]. Повысить вероятность их выхода из клеток можно направленным воздействием физических, химических и биологических факторов.
- Из физических факторов индуцирующее действие показано для УФ-излучения, видимого света после предварительной сенсибилизации бактериальной культуры красителем, ионизирующего излучения, высокой температуры, высокого гидростатического давления, ультразвука и высушивания.
- Из химических — для глутатиона, серной, сероводородной и азотистой кислот, сульфатиазола, иприта, галогензамещенных аналогов урацила.
- Из биологических — для некоторых антибиотиков, ферментов, бактериоцинов и др. [3].
На рисунке 7б представлен еще один, необычный, вариант индукции профагов, связанный со снятием репрессии фаговых генов при попадании фага в цитоплазму новой, свободной от профага и, следовательно, репрессоров, клетки. Такая индукция называется зиготной и наблюдается при скрещивании лизогенной клетки-донора (Hfr) с нелизогенным реципиентом (F − ) [27].
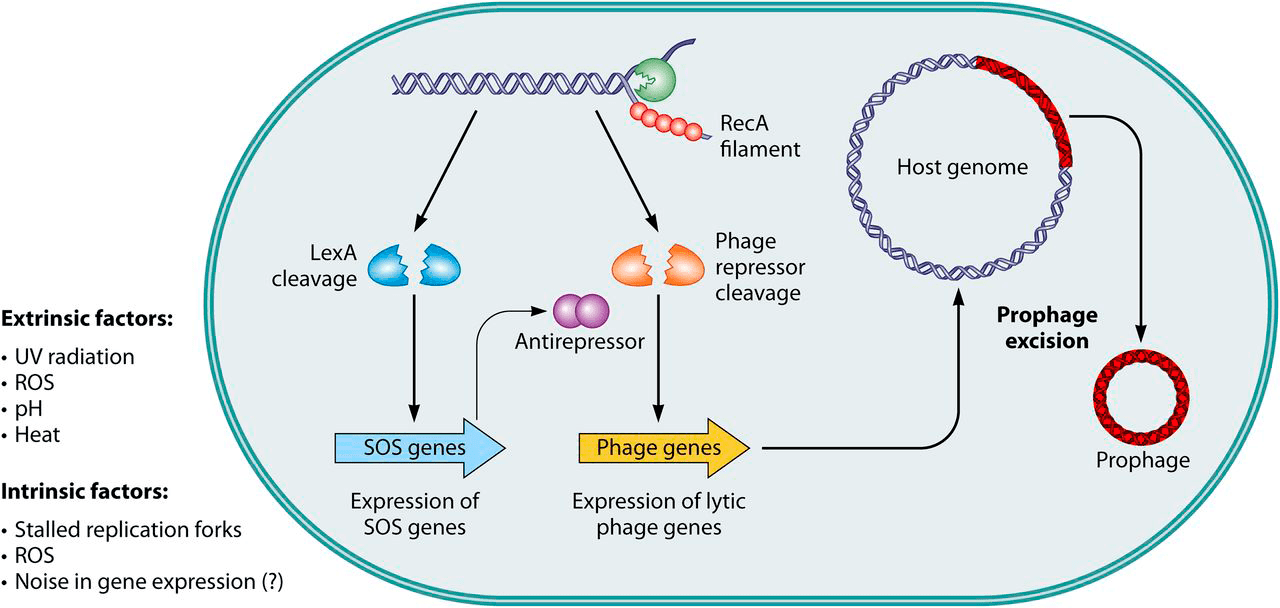
Рисунок 7а. SOS-зависимая фаговая индукция. Множество внешних и внутренних факторов оказывает влияние на геном бактерии и может привести к спонтанным повреждениям ДНК или остановке полимераз. На образовавшиеся одноцепочечные участки ДНК наслаиваются молекулы белка RecA. Это запускает автокаталитическое расщепление двух типов репрессоров — LexA (бактериальный белок) или CI-подобных (фаговые репрессоры). Из-за ослабления LexA-репрессии начинают экспрессироваться SOS-гены, тормозящие деление клеток и запускающие репарацию их ДНК. Для некоторых фагов, включая теломерных, показана SOS-зависимая инактивация фаговых репрессоров путем связывания с антирепрессорами. Это ведет к активации литических промоторов с последующим вырезанием профага из хозяйского генома и упаковкой в вирионы, которые высвобождаются из клетки при ее лизисе.
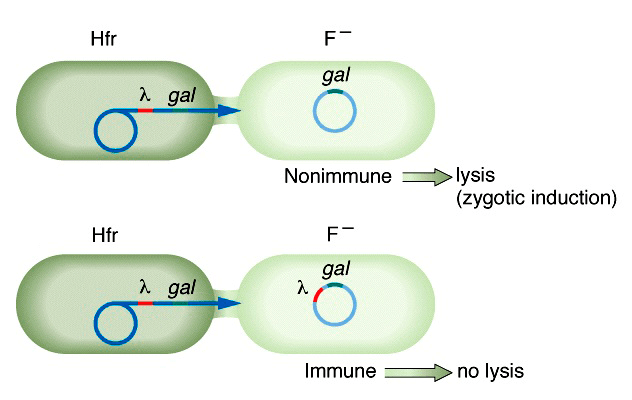
Рисунок 7б. Зиготная индукция

рисунок автора статьи
В качестве заключения
Мир простых на первый взгляд бактериальных вирусов по мере углубления его изучения оказывается всё более многоликим. Одних из них можно брать в союзники на антимикробные сражения, другие внезапно проявляют себя лизисом полезных для человека культур. И того хуже: заручившись поддержкой прокариотического хозяина, кто-то из них провоцирует вспышку опасной инфекции у эукариот. Ну а кто-то прекрасно справляется с переносом между бактериями метаболических генов или даже целых путей.
Умеренные бактериофаги сыграли важную роль в становлении понятий молекулярной биологии. Благодаря исследованиям фага λ получены представления о сайт-специфической и общей рекомбинации, положительной и отрицательной регуляции генов, репликации ДНК. И даже относительно недавно описанные теломерные бактериофаги уже нашли применение в биотехнологии: линейные плазмидные векторы в ряде случаев показали преимущество над суперскрученными кольцевыми плазмидами, способными к образованию крестообразных структур и реорганизации. К тому же на их основе можно создавать низкокопийные векторы, пригодные для экспрессии генов токсичных продуктов.
Несмотря на то, что умеренные фаги говорят лаконично на языке последовательности нуклеотидов и обладают сдержанными потребностями, в их коллективную историю несомненно еще будут вписаны интересные открытия и практические изобретения.
Читайте также:


