Вирус эхо 1 при лечении рака
Пресс-служба ФИЦ Институт цитологии и генетики СО РАН (Новосибирск) сообщила о новых результатах, полученных по проекту, направленному на создание эффективных средств лечения опухолей головного мозга на основе вирусов. В данном случае речь идет о глиобластоме, а в качестве потенциального терапевтического агента был использован печально известный вирус Зика
Неординарная и, прямо скажем, неочевидная идея лечить рак с помощью вирусов возникла практически сразу после открытия этих мельчайших созданий, и была основана на случайных наблюдениях за онкологическими больными, которые переболели вирусной инфекцией или перенесли вакцинацию. Оказалось, что в некоторых случаях состояние таких пациентов неожиданно значительно улучшалось, иногда отмечалась даже длительная ремиссия. Первые попытки подобного лечения были предприняты еще в первом десятилетии XX в. (для этого использовался ослабленный вакцинный препарат вируса бешенства), а в последующие годы ученые неоднократно возвращались к этой идее, используя для терапии рака непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, аденовирусов и др.
В России исследования онколитических свойств вирусов связаны с именем М. К. Ворошиловой из Института полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). В 1960–1970-х гг. в институте были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. В ряде случаев при вакцинации наблюдался положительный эффект в отношении злокачественных новообразований, вплоть до полного исчезновения первичной опухоли и метастазов. В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса.
Тем не менее недостаток знаний о молекулярных механизмах развития опухоли и функционировании самих вирусов, технологические сложности с высококачественной очисткой вирусных препаратов и плохая предсказуемость результатов лечения привели к тому, что в 1980-х гг. работы с онколитическими вирусами были свернуты как в мире, так и в России, и возобновились лишь в конце прошлого века. Этому способствовало открытие механизмов противораковой активности вирусов, связанных с отключением в опухолевых клетках механизма апоптоза (клеточного самоубийства), который включается, чтобы воспрепятствовать заражению инфицированными клетками здоровых окружающих тканей.


Сейчас новосибирские исследователи начали испытания вируса Зика, получившего несколько лет назад широкую известность благодаря вспышке заболевания в Южной Америке. Этот вирус, открытый еще в 1948 г., долгое время считался неопасным. Впервые о лихорадке Зика заговорили в 2007 г., когда на островах Яп в Тихом океане заболело около 5 тыс. человек, которые, впрочем, успешно поправились. В начале 2013 г. еще более масштабная эпидемия охватила Французскую Полинезию, а год спустя случаи заболевания новой болезнью были отмечены на территории Бразилии. В то же время там резко увеличилось число новорожденных с отчетливыми признаками микроцефалии – недоразвитости головного мозга. Оказалось, что виновником этой патологии был вирус Зика, который поражает головной мозг эмбриона во время болезни будущей матери. Из-за выраженного нейротропизма этот вирус и был выбран на роль потенциального оружия для борьбы с опухолью мозга.
Эксперимент проводился на лабораторных мышах из SPF-вивария ИЦиГ СО РАН – уникального объекта научной инфраструктуры Новосибирского научного центра, где в жестко контролируемых условиях согласно международным правилам содержатся животные, свободные от патогенов, что является необходимым условием для проведения современных медико-биологических исследований.
Под кожу мышей были имплантированы клетки человеческой глиобластомы, а затем особям был введен вирус Зика. Результаты оказались обнадеживающими: вирус настолько замедлил рост опухолей, что через два месяца от начала эксперимента их объем был в десять раз меньше, чем у контрольных животных. При этом существенного ущерба здоровым тканям он не принес.
Сами ученые уверены в перспективности такого подхода к лечению онкологических заболеваний, так как современная наука располагает всеми необходимыми инструментами, чтобы использовать онколитические свойства вирусов на благо нашему здоровью. И хотя сегодня применение вирусов в онкотерапии является скорее исключением, чем правилом, в сочетании с традиционными методами лечения они смогут служить дополнительным средством в системе комплексного воздействия на опухоль.
Соавтор исследования доктор Алан Фридман (Alan Friedman) проводит биопсию опухоли.
Фото Shawn Rocco/Duke Health.


Учёные из Института изучения рака Университета Дьюка (США) сообщили о первых впечатляющих результатах своей работы. Медики разработали новый метод борьбы с самым агрессивным типом рака головного мозга, глиобластомой. Первая фаза клинических испытаний показала значительные улучшения и повышение выживаемости больных.
Специалисты отмечают, что глиобластома является наиболее частой и наиболее агрессивной формой опухоли мозга. Стандартное лечение – операция, сопровождаемая химиотерапией. Однако в большинстве случаев в течение шести месяцев происходит рецидив. Статистика выживаемости печальна: даже при агрессивном лечении пациенты, как правило, могут прожить не более 20 месяцев, а в случае рецидива – не больше года.
"Глиобластома остаётся смертельной и разрушительной болезнью, несмотря на успехи в хирургической и лучевой терапии, а также новую химиотерапию и целевые агенты. Существует огромная потребность в принципиально разных подходах", — рассказывает ведущий автор исследования доктор Дарелл Бигнер (Darell Bigner).
Ранее учёные предложили убивать клетки таких опухолей при помощи реовирусов и даже вируса Зика. Правда, эти методики пока что опробованы лишь на мышах и в доклинических исследованиях.
Но есть ещё один вирус, способный справиться со страшной болезнью – это вирус полиомиелита, генетически модифицированный – скрещенный с риновирусом.
Новый вид терапии предполагает введение полиовирусной вакцины непосредственно в опухоль головного мозга с помощью хирургически имплантированного катетера. Достигая цели, полиовирус вызывает иммунный ответ: защитные клетки наконец "видят" конкретную мишень и начинают более активно атаковать её. При этом, благодаря модификации, вирус практически не способен атаковать нейроны мозга.
Команда из различных научных центров проводила доклинические исследования и разработку вакцины в течение 18 лет. На первом этапе клинических испытаний, который стартовал в 2012 году и продлился почти 28 месяцев, основной целью исследователей стал поиск подходящей дозировки.
При более высоких дозах у некоторых пациентов наблюдалось слишком много воспалений, которые могли привести к когнитивным нарушениям и другим нежелательным побочным эффектам, отмечают специалисты.
Всего в первой фазе исследований участвовал 61 пациент, из них 15 получали минимальные дозы полиовирусной вакцины. Участники были отобраны в соответствии со строгими рекомендациями: медики учитывали размеры опухолей и их местоположение, случаи рецидива болезни и другие факторы.
Результаты терапии оказались многообещающими: долгосрочная выживаемость пациентов с рецидивирующей глиобластомой заметно увеличилась. После лечения все пациенты прожили 12,5 месяцев, а 21% участников – до трёх лет. Для сравнения: в контрольной группе, которая проходила стандартное лечение, средняя продолжительность жизни после лечения составила 11,3 месяца, а показатель выживаемости в течение трёх лет составил лишь 4%.
По словам Бигнера, для пациента с глиобластомой выжить на раннем этапе лечения крайне важно. Полиовирусная терапия увеличивает шансы на успех: после этой стадии пациенты могут пройти дальнейшее лечение уже другими методами.
На фото ниже одна из участниц клинических испытаний, 61-летняя Дебра Паффер (Debra Puffer). Страшный диагноз она впервые услышала в 2014 году. Пациентка прошла через операцию и химиотерапию. Когда болезнь вернулась, она решила принять участие в новом исследовании, и после полиовирусной терапии болезнь не возвращалась 2,5 года.
В августе 2017 года случился новый рецидив, и Дебра прошла повторное лечение. Медики увеличили дозировку вакцины, и пациентка была госпитализирована с побочными эффектами, однако их удалось устранить.

Бигнер и его коллеги заключают, что впереди ещё много работы. Пока не совсем понятно, почему одни пациенты реагируют на методы иммунотерапии должным образом, в то время как у других иммунный ответ не активируется. Одно из направлений дальнейших исследований – поиск причины таких разных реакций.
Кроме того, специалистам предстоит подобрать наиболее эффективные методы лечения, которые должны следовать после полиовирусной терапии. Сегодня пациенты с рецидивирующей глиобластомой проходит химиотерапию на основе препарата под названием ломустин. Но, вполне возможно, медики смогут подобрать и более удачную комбинацию.
О результатах первой фазы клинических испытаний команда сообщила на 22-й Международной конференции по исследованию и терапии опухолей головного мозга (22nd International Conference on Brain Tumor Research and Therapy), которая прошла в Норвегии, а также опубликовала по итогам работы статью, с которой можно ознакомиться в издании New England Journal of Medicine.
Научная работа с более подробным описанием механизма действия полиовирусной терапии была опубликована в журнале Science Translational Medicine в 2017 году.
Исследователи ожидают старта второй фазы клинических исследований, в которых, по всей вероятности, примут участие уже не только взрослые, но и более юные пациенты. Более того, в скором времени присоединиться к испытаниям смогут также пациенты с раком молочной железы и меланомой. Согласно доклиническим тестам, полиовирусная терапия может показать обнадёживающие результаты и в этих случаях.
Кстати, ранее мы рассказывали о других методах борьбы с глиобластомой. Например, исследователи заставили клетки кожи охотиться и уничтожать клетки опухоли. А бороться с метастазами рака головного мозга могут стволовые клетки, производящие нужный токсин.
Ученые нашли причину появления рака. Можно ли от него защититься?
Известно, что основными причинами рака являются курение, нездоровое питание, а также воздействие инфекционных агентов, включая вирусы, бактерии и паразитов. Инфекции стоят на третьем месте среди лидирующих факторов развития опухолей и отвечают за 10 процентов смертей от этой болезни. В то же время на поверхности и внутри человеческого тела обитают миллионы микроорганизмов, чей состав уникален для каждого человека и составляет его микробиом. Микробиом влияет на здоровье человека, защищает его, но при нарушениях может спровоцировать развитие целого ряда заболеваний, включая онкологические. Микробы отвечают за уязвимость к раку, его прогрессирование и восприимчивость к лечению.
Важную роль в защите от бактерий играет слизистая оболочка, выстилающая внутреннюю поверхность пищеварительных, дыхательных и других органов. Она содержит гликопротеины — соединения, пронизывающие мембраны клеток эпителия. Эти молекулы формируют защитный слой. Степень гликозилирования (то есть уровень гликопротеинов) слизистой оболочки определяет уровень невосприимчивости к инфекциям. Однако во время заражения происходят изменения в гликопротеинах, затрагивающие как ту часть (домен), что находится внутри клетки, так и наружную. Это может либо способствовать ликвидации микроба, либо привести к инфекции и воспалению.
Когда наружная часть MUC1 связывается с бактерией, происходит отделение внутреннего домена. К нему присоединяются фосфорные остатки, что запускает целый ряд разных процессов: синтез провоспалительных факторов, адгезию (сцепление) эпителиальных клеток, их дифференциацию и программируемую клеточную смерть, называемую апоптозом.
Пока бактерии не рассматриваются как основная причина раковых заболеваний в отличие от тех же вирусов. Лишь для нескольких бактерий показано, что они могут спровоцировать развитие злокачественных опухолей через провоцирование воспалительных процессов, выделение токсинов и других повреждающих ДНК метаболитов или нарушение сигнальных путей клеток. Известны две широко распространенные бактериальные инфекции, которые могут вызывать рак. Это Helicobacter pylori, связанная с раком желудка и лимфомой, и Salmonella typhi, связанная с карциномой желчного пузыря у тех, кто страдает от хронического тифа. Но могут быть и другие инфекции, повышающие риск.
Campylobacter jejuni — одна из самых частых причин инфекционных отравлений, возбудитель кампилобактериоза. Бактерия проникает через слизистый слой в эпителиальную ткань пищеварительного тракта, провоцируя гастроэнтерит. Когда микроорганизм связывается с MUC1, гликопротеин высвобождается вместе с микробом в слой слизи. Пока неизвестно, предотвращает ли это развитие рака. Сама бактерия попадает в организм человека через загрязненную пищу и воду. В группу риска входят дети, пожилые люди, пациенты с ослабленным иммунитетом. Методом профилактики является правильное приготовление пищи.
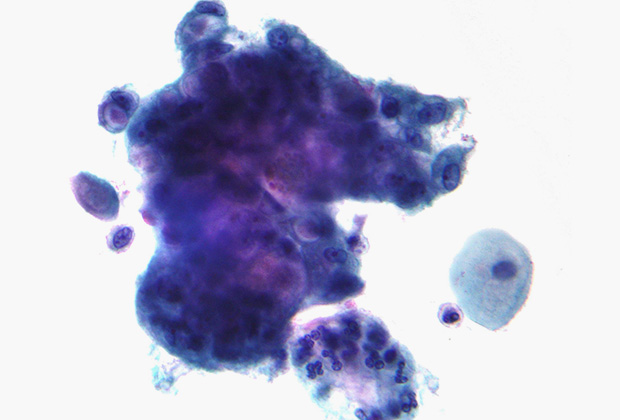
Хроническая инфекция Helicobacter pylori приводит к язвам и раку. Показано, что муцины являются важным препятствием для бактерии. Однако внутриклеточный домен MUC1 при связывании с бактерией способен взаимодействовать с NF-kB — транскрипционным фактором, который отвечает за регулирование апоптоза и клеточного цикла. Нарушение регуляции данного сигнального пути приводит к воспалениям, аутоиммунным заболеваниям и развитию опухолей. Для профилактики инфекции специалисты рекомендуют соблюдать гигиену рук. Заражение происходит через контакт с загрязненными предметами и людьми — носителями инфекции.
Haemophilus influenzae вызывает инфекции дыхательных путей, в том числе пневмонию. При хронической обструктивной болезни легких (ХОБЛ) дыхательные пути часто колонизируются этой бактерией. Кроме того, ХОБЛ является одним из факторов риска рака легких. Показано, что взаимодействие микроба с MUC1 вызывает изменения в регуляции специфических рецепторов, которые, в свою очередь, участвуют в прогрессировании легочных аденокарцином.
Еще одним потенциальным виновником опухолей является кишечная палочка Escherichia coli, возбудитель заболеваний кишечника. При взаимодействии микроба с MUC1 возникает воспалительный процесс. Показано, что инфекции связаны с колоректальным раком и раком мочевого пузыря, но пока не совсем понятно, могут ли они быть онкогенным фактором.
Среди онкогенных вирусов достаточно известны вирус Эпштейна-Барр (вирус герпеса) и вирус папилломы человека. Первый ассоциирован с крайне агрессивной назофарингеальной карциномой (рак носоглотки), лимфомой Ходжкина (рак лимфатической системы), лимфомой Беркитта, Т-клеточной лимфомой и раком желудка. Второй может вызвать рак шейки матки, а также опухоли на гениталиях, в заднем проходе, горле и голове. При отсутствии вируса рак шейки матки не развивается, то есть это заболевание четко связано с хронической инфекцией.
Опасность представляют и другие вирусы, в том числе возбудитель гриппа, однако при подобных инфекциях MUC1 эффективно защищает слизистую от патогена. Вирус гепатита часто становится причиной рака печени.
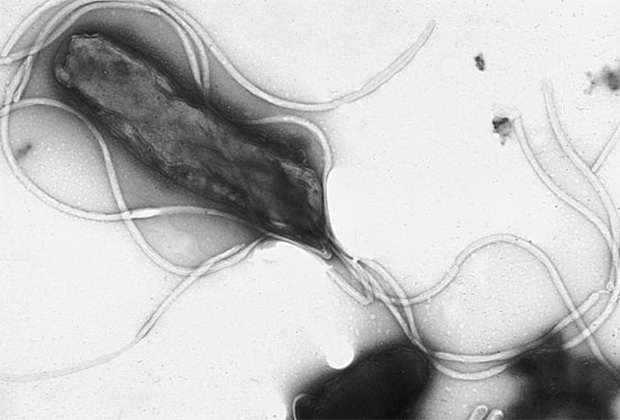
Что касается паразитов, то к онкологическим заболеваниям могут привести заражение кровяной шистосомой, которая проникает в организм человека через мочевыводящие пути. Червь провоцирует развитие плоскоклеточного рака мочевого пузыря, являясь второй ведущей причиной этого заболевания. Заражение обычно происходит в тропических регионах планеты при купании в естественных водоемах. Часто жертвами паразита становятся туристы и жители развивающихся стран с неблагополучной санитарной обстановкой. По подсчетам, во всем мире инфицировано более 207 миллионов человек.
Еще одним онкогенным паразитом является червь Opisthorchis viverrini, заражающий желчный пузырь и способствующий развитию холангиокарциномы. Этот тип опухолей редко встречается в западных странах, но распространен в Юго-Восточной Азии.
Некоторое время назад исследователи из Американского онкологического общества (ACS) пришли к выводу, что причиной половины случаев заболевания раком является нездоровый образ жизни. В целом внешние факторы среды отвечают за львиную долю онкологических заболеваний, неподконтрольными остаются лишь генетические факторы и просто случайные мутации в ДНК, на которые мы никак не можем повлиять.
Многие из воздействий можно исключить, другие — снизить до минимума. Среди этих мер обычно называют поддержание здорового веса, физические упражнения, отказ от курения и алкоголя, избегание длительного воздействия солнечных лучей и контакта с различными химическими загрязнителями. Однако теперь к этому можно добавить прививки (особенно, от ВИЧ и гепатита) и другие типы профилактики инфекционных и паразитарных заболеваний.
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ "Вектор", Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского "Шутка госпожи природы" именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого "фиксированного" (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.

У нас работы в данном направлении были начаты в 1970-х годах профессором М.К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
1. Хирургическое удаление опухоли.
2. Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
3. Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
4. Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
5. Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются "тормоза", не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
6. Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
7. Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии "Вектор" силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ "Вектор" А.Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н.Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П.М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ "Вектор" и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П.М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН имени В.А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: "Вирусы как троянские кони" и "Вирусы и рак". Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Сергей В. Нетесов, член-корреспондент РАН, Новосибирский государственный университет
Читайте также:


