Вирус от которого атрофируются мышцы
Причины и симптомы атрофии мышц, диагностика и лечение

Процесс атрофии мышц развивается постепенно и приводит к нарастающему уменьшению их в объёме и перерождению мышечных волокон, которые становятся более тонкими, в особо тяжелых случаях их число может сокращаться вплоть до полного исчезновения. Выделяют первичную (простую) и вторичную (неврогенную) мышечную атрофию.
В результате развития атрофии мышц в организме человека начинается уменьшение, деформация мышечной ткани, замена её на соединительную, неспособную выполнять двигательную функцию. Теряется мышечная сила, падает мышечный тонус, что приводит к ограничению двигательной активности или полной её потере.
Первичная мышечная атрофия вызвана поражением самой мышцы. Причиной заболевания в данном случае может быть неблагоприятная наследственность, которая выражается в нарушении обмена веществ в форме врожденного дефекта ферментов мышц или высокой проницаемости клеточных мембран. Существенное влияние оказывают также факторы внешней среды, провоцирующие начало патологического процесса. К ним относятся физическое перенапряжение, инфекционный процесс, травмы. Наиболее выражена первичная мышечная атрофия при миопатии.
Причиной атрофии мышц может стать травма нервных стволов, инфекционный процесс, протекающий с поражением двигательных клеток спинного мозга, такой как полиомиелит и полиомиелитоподобные заболевания.
Иногда патологический процесс носит наследственный характер. В этом случае поражаются дистальные отделы конечностей, а сам процесс протекает более медленно и носит доброкачественный характер.
В этиологии болезни выделяют следующие факторы: злокачественные опухоли, паралич спинного мозга или периферических нервов. Зачастую атрофия мышц развивается на фоне различных травм, голодания, интоксикации, в результате замедления обменных процессов по мере старения организма, длительной двигательной бездеятельности в силу каких-либо причин, как последствие хронических заболеваний.
Если поражается спинной мозг и крупные нервные стволы, то развивается нейропатическая атрофия мышц. При тромбозе крупных сосудов или нарушении кровотока в мышечной ткани в результате механических или патологических повреждений развивается ишемическая форма. Причиной функциональной формы является абсолютная, нередко частичная двигательная бездеятельность вследствие патологических процессов в организме – артритов, полиомиелитов и полимиелитоподобных заболеваний.
Различают две формы заболевания:
- Заболевание диагностируется первичным, если поражена непосредственно сама мышца. Большую роль в патогенезе играет наследственность, часто развивается в результате травмы или как последствие ушибов, интоксикаций, физического переутомления. Клинически выражается быстрым утомлением, заметным снижением мышечного тонуса. Могут наблюдаться характерные подергивания конечностей.
- Вторичная атрофия мышц развивается чаще, как посттравматическое осложнение или после перенесенных различных инфекций. В результате возникает поражение двигательных клеток, что приводит к ограничению двигательной функции стоп, голеней, кистей, предплечья, частичному или полному параличу. В основном, болезнь имеет вялотекущее течение, но бывают и периоды острых вспышек заболевания, сопровождающиеся сильными болями.
Вторичная атрофия мышц делится на:
Невральную миотрофию – при этой форме поражаются мышцы стоп и голени, происходит их деформация. У больного меняется походка. Чтобы свисающие стопы не задевали пол, он начинает высоко поднимать колени. Поверхностная чувствительность теряется, и угасают рефлексы. Спустя несколько лет после начала заболевания болезнь переходит на кисти и предплечья.
Самое тяжелое и сложное течение наблюдается при прогрессирующей атрофии мышц, чаще всего проявляющейся уже в раннем детстве, причем в семье у здоровых родителей. Для этой формы характерна полная потеря сухожильных рефлексов, резкое снижение артериального давления. Нередко наблюдаются фибриллярные подергивания конечностей.
Прогрессивная мышечная атрофия развивается у взрослых и называется атрофический синдром. При этом поражаются дистальные или отдаленные отделы верхних конечностей – пальцы, межкостные мышцы кисти. Кисть руки принимает специфический вид, становится похожа на обезьянью. Исчезают сухожильные рефлексы, но сохраняется чувствительность. При дальнейшем развитии заболевания в патологический процесс включаются мышцы шеи и туловища.
Общим признаком для всех видов мышечных атрофий является уменьшение объема поврежденной мышцы, что особенно заметно при сравнении со здоровой стороной. Степень выраженности симптомов зависит от тяжести и распространенности заболевания, во всех случаях приводит к понижению мышечного тонуса и болезненности при пальпации конечностей.
Диагностика атрофии мышц в настоящее время не представляет затруднения. Для выявления фоновой причины возникновения заболевания проводят развернутый клинический и биохимический анализы крови, функциональные исследования щитовидной железы, печени. Обязательна электромиография и исследование нервной проводимости, биопсия мышечной ткани, а также тщательный сбор анамнеза. При необходимости назначаются дополнительные методы обследования.
Существует несколько форм заболевания. Невральная амиотрофия, или амиотрофия Шарко-Мари, протекает с поражением мышц стопы и голени, наиболее подверженными патологическому процессу оказываются группа разгибателей и группа отводящих стопу мышц. Стопы при этом деформируются. У пациентов появляется характерная походка, во время которой больные высоко поднимают колени, так как стопа, во время подъема ноги, обвисает и мешает ходьбе. Врач отмечает угасание рефлексов, снижение поверхностной чувствительности в нижних отделах конечностей. Спустя годы после начала болезни в патологический процесс вовлекаются кисти и предплечья.
Прогрессирующая мышечная атрофия Верднига-Гоффмана характеризуется более тяжелым течением. Первые симптомы атрофии мышц появляются у ребенка в раннем возрасте, часто в семье у внешне здоровых родителей заболеванием страдают сразу несколько детей. Для болезни характерны потеря сухожильных рефлексов, резкое снижение артериального давления, фибриллярные подергивания.
При выборе метода лечения обязательно учитываются важные факторы: возраст пациента, тяжесть и форма заболевания. Основное значение придается лечению основного заболевания, которое привело к развитию мышечной атрофии. Проводится медикаментозное лечение и назначается дополнительное: физиотерапевтические процедуры, электролечение, лечебный массаж и гимнастика. Неукоснительное соблюдение всех рекомендаций и требований врача позволяет многим пациентам вернуть утраченные двигательные способности и затормозить процесс атрофии.

Эксперт-редактор: Мочалов Павел Александрович | д. м. н. терапевт
Образование: Московский медицинский институт им. И. М. Сеченова, специальность - "Лечебное дело" в 1991 году, в 1993 году "Профессиональные болезни", в 1996 году "Терапия".
Острые и подострые воспалительные миопатии могут иметь вирусное происхождение. Наиболее часто встречается острый вирусный миозит, вызванный вирусами гриппа и коксаки. Вирусы также могут провоцировать развитие подострого полиомиозита при синдроме Рейе. Воспалительные миопатии могут наблюдаться при синдроме приобретенного иммунодефицита человека (СПИДе) и при его лечении зидовудином. А. Течение заболевания, прогноз и лечение
1. Миозит, вызванный вирусами гриппа, встречается как у детей, так и у взрослых. Вирусное заболевание имеет продромальный период и затем течет с высокой лихорадкой, миалгиями, слабостью, болью в горле и ринореей. Иногда отмечается рвота и миоглобинурия. Мышечная сила не снижена, но проверка ее затруднительна из-за выраженных болей в мышцах. Сходная клиническая картина характерна и для заболеваний, вызванных вирусами парагриппа, респираторным синцитиальным вирусом, вирусом простого герпеса и микоплазмой пневмонии. Большинство лабораторных показателей в пределах нормы, но уровень креатинкиназы может быть повышен.
Прогноз обычно благоприятный. Больному показан постельный режим, обильное питье и жаропонижающие средства, за исключением аспирина. У взрослых заболевание протекает более тяжело. Могут развиться осложнения со стороны сердечно-сосудистой системы, миоглобинурия и почечная недостаточность. Больным с миоглобинурией показана внутривенная гидратация для профилактики развития острой почечной недостаточности.

2. Вирусы коксаки В вызывают плевродинию — эпидемическую миалгию Борнгольма, которая сопровождается воспалительной миопатией. Заболевание развивается в летне-осеннее время и передается фекально-оральным путем. Больные жалуются на внезапно начавшиеся острые боли в нижней части грудной клетки или в животе, усиливающиеся при глубоком вдохе и кашле. Острая фаза длится около недели, но слабость и боли в мышцах могут сохраняться еще длительное время. Могут наблюдаться рецидивы. Данные лабораторных анализов не показывают отклонений от нормы. Лечение симптоматическое,
3. Синдром Рейе — это синдром, представленный острой энцефалопатией и жировой дегенерацией печени, развивающийся после вирусных инфекций, вызванных вирусами опоясывающего лишая и гриппа. Это очень редкое заболевание, поражающее как детей, так и взрослых. Оно манифестирует неукротимой рвотой, затем развиваются изменения личности, спутанность сознания, летаргия и кома. Смертность очень высока. В данных лабораторных исследований выявляются отклонения, указывающие на острое нарушение функции печени. Уровень креатинкиназы ММ, специфичной для скелетных мышц, может быть повышен в 300 и более раз по сравнений) с нормой.
Прогноз заболевания коррелирует с уровнем креатинкиназы в крови. Провоцирующим фактором в развитии синдрома может быть назначение салицилатов. Лечение поддерживающее.
4. ВИЧ может вызвать развитие подострой или хронической миопатии как на ранних, так и на поздних стадиях СПИДа. ВИЧ-миопатия наблюдается только у взрослых. Отмечается симметричная слабость и в части случаев атрофия проксимальных групп мышц верхних и нижних конечностей. Может одновременно наблюдаться миелопатия или периферическая нейропатия. Уровень креатинкиназы повышен в 10-15 раз по сравнению с нормой. Синдром проявляется практически так же, как полиомиозит. Поэтому всем больным полиомиозитом рекомендовано проведение лабораторных исследований на ВИЧ. Данные электрофизиологических исследований и биопсии мышц также не отличаются от таковых при полиомиозите.
- В период развернутой клинической картины СПИДа наблюдается синдром ВИЧ-атрофии, который характеризуется диссоциацией между выраженной потерей мышечной массы и слабостью, последняя может быть незначительна или вообще отсутствовать. Уровень креатинкиназы нормален. При биопсии выявляется атрофия мышечных волокон типа II — это частая, неспецифическая находка, типичная для больных, страдающих кахексией, обездвиженных лиц и при нарушении питания.
- Пиомиозит — это мышечный абсцесс, вызванный Staphylococcus aureus. Такой диагноз можно предположить у больных СПИДом, жалующихся на локализованную боль и отек мышц. Иногда повышается температура тела и нарастает уровень креатинкиназы в крови. Для подтверждения диагноза проводят ультразвуковое исследование мышц, МРТ или КТ с контрастом, часто в режиме гидрограммы. В лечебных целях назначают антибиотики и дренаж абсцесса. Провоцирующими факторами к развитию пиомиозита могут служить травма и гематогенное распространение бактериальной инфекции, даже если посев крови отрицателен.
- Прогноз и лечение. В связи с эпидемией СПИДа и улучшением диагностических возможностей этой патологии, выявляется большее число больных ВИЧ-миопатией. Лечение эмпирическое. Если миопатия умеренная, то можно применять нестероидные противовоспалительные средства. Если миопатия прогрессирует, то можно начать антиретровирусную терапию (зидовудин).
- Зидовудиновая (АЗТ) миопатия развивается при длительном приеме этого препарата в результате токсического воздействия зидовудина на митохондрии скелетных мышц. Больные жалуются на миалгии в нижних конечностях и проксимальную слабость. После физической нагрузки отмечается повышение уровня креатинкиназы в крови. Заболевание обычно начинается через год после начала лечения и, выраженность симптомов зависит от дозы и длительности приема зидовудина. После прекращения терапии симптомы частично регрессируют. Очень трудно провести дифференциальную диагностику зидовудиновой миопатии и ВИЧ-миопатии только на основании клинической картины. При проведении биопсии мышц видны беспорядочно расположенные мышечные волокна —- признак митохондриальной болезни, что характерно для зидовудиновой миопатии.
Лечение заключается в прекращении терапии зидовудином. Можно назначить нестероидные противовоспалительные средства. Обычно регресс симптомов наблюдается через несколько недель после прекращения лечения АЗТ, хотя мышечная слабость может сохраняться в течение нескольких месяцев.
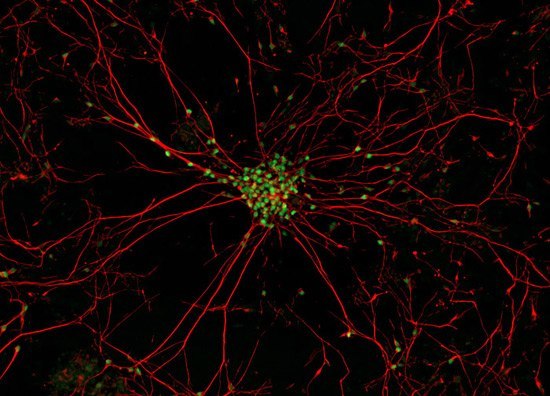
Настоящее фото мотонейрона (двигательного нейрона в передних рогах спинного мозга) - закупорка межсинаптических щелей (зелёные точки) - блокада передачи импульсов через медиаторы (вещества для передачи импульсов) в синапсы (места соединения) отростков нервных клеток.
В центре - тело мотонейрона.
Красные линии -длинные отростки мотонейрона - аксоны и короткие -дендриты.
Причина появления блокады передачи импульсов в межсинаптических щелях учёными мира не найдена. Предположительно - мутация гена,кодирующего фермент передачи этих импульсов через нейромедиаторы - супероксиддисмутазы. (СОД).
Предрасположенность к мутациям гена может иметь наследственный характер по аутосомно-рецессивному типу.
Эндемические (массовые вспышки) случаи этого заболевания зафиксированы у групп военных, живущих в островах на тихом океане. Чаще болеют мужчины от 40 до 60 лет.Следовательно не исключается инфекционная причина развития заболевания.
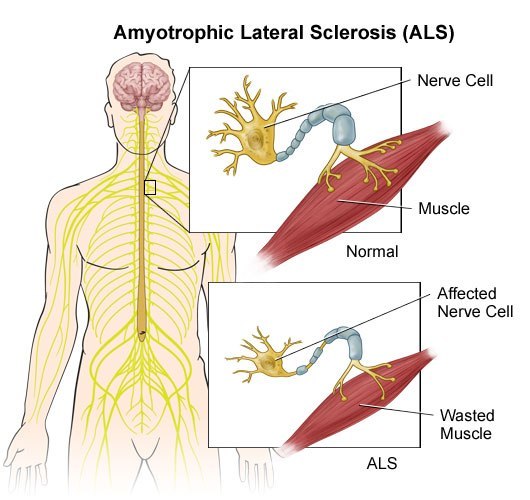
Боковой амиотрофический склероз. (БАС)..
Показано истончение нервных волокон в случае БАС и нарушение иннервации (передачи нервных импульсов) к мышцам. Как следствие - уменьшение работы мышцы и её последующая атрофия. (уменьшение размеров, обратное развитие.)
Блокада передачи нервных импульсов к мышцам (как к поперечно-полосатым которыми мы управляем сами своей волей так и к к гладким, работающим, независимо от нашего сознания, усилий и воли) пищеварительной и дыхательной системы ведёт к смерти из-за невозможности совершать эти жизненно важные моменты работы мускулатуры.
Две статьи из медицинских источников:
1) Теория аксостаза бокового амиотрофического склероза. Аксональная теория бокового амиотрофического склероза
Теория аксостаза основана на анализе патологических процессов, происходящих в аксональном транспорте мотонейронов [Chou S., 1992]. Наибольшими нейронами организма являются двигательные мотонейроны передних рогов спинного мозга и пирамвды Беца. Они должны поддерживать интеграцию дендритов, часто протяженностью более 1 см, и аксон, достигающий 100 см. В аксоне имеются непрерывные потоки, через которые клеточное тело направляет структурные и функциональные белки на периферию и получает обратные сигналы. Ортоградный транспорт бывает 2 видов: а) быстрый — 400 мм в день, идущий в обоих направлениях и транспортирующий связанные с мембраной белки и гликопротеиды, б) медленный — несколько миллиметров в день, транспортирующий сети микрофиламентов, микротрубочек, нейрофиламентов, как компонент "а" (0,1—2 мм в день), а также большой комплекс растворимых белков, как компонент "б" (2—4 мм в день). Ретроградный аксональный транспорт несет эндогенные (аминокислоты, фактор роста нервов) и экзогенные (токсин столбняка, вирус полиомиелита, простого герпеса, бешенства, лектин пероксидазы хрена и др.) субстанции от терминальных аксонов к клеточному телу со скоростью свыше 75 мм в день. Морфологические исследования аксонального транспорта в биоптатах двигательных веточек периферических нервов больных боковым амиотрофическим склерозом выявили уменьшение скорости ретроградного аксонального транспорта и, следовательно, связи терминального аксона с перикарионом [Bieuer A. et al., 1987]. В межреберных нервах больных АБС еще до развития признаков нейрональной дегенерации появляются изменения белков микротрубочек [Binet S. et al., 1988].
Улыраструктурные исследования проксимального аксона и аксонального бугорка мотонейронов переднего рога спинного мозга больных, умерших от бокового амиотрофического склероза [Sasaki S. et al., 1996], показали нарушение быстрого аксонального транспорта. Гладкий эндо-плазматический ретикулум теряет структуру: происходит скопление митохондрий, лизосом, Леви-подобных телец, эозино-фильных и гиалиновых включений, липофусциновых гранул, особенно в аксональном бугорке. Присутствие этих необычных структур является отражением дисфункции аксонального транспорта. Применительно к возможной этиологии АБС еще ранее выдвинута концепция "аксостаза" [Chou S., 1992]. Ней-ротоксические факторы путем ретроградного транспорта избирательно поражают нейрон, создавая феномен "суицидцального транспорта". Ухудшение медленного транспорта в аксоне сопровождается скоплением нейрофиламентов, набуханием проксимального аксона и последующей дистальнои аксональной атрофией, а также вторичной демиелинизацией, характерной для центральной дистальнои аксонопатии или "ретроградного умирания" — "dying back". Определенную значимость в развитии ранних морфологических изменений мотонейронов при АБС имеет теория аутоиммунитета [Smith R. et al., 1996], основанная на появлении антител к зарядам входа кальциевых каналов. Пассивный перенос фракций, содержащих иммуноглобулин, мышам вызывает изменения нервно-мышечных соединений, сходные с таковыми при спорадическом АБС. У животных эти изменения отражают расстройства внутриклеточного Са2+ гомеостаза, и раннее повреждение пластинчатого комплекса в мотонейронах в форме набухания и фрагментации. Иммуноглобулины от больных спорадическим боковым амиотрофическим склерозом вызывают зависимый от Са2+ апоптоз клеток вследствие оксидативных повреждений. Апоптоз, обусловленный иммуноглобулином от указанных больных, регулируется присутствием связанных белков, которые могут модулировать избирательную ранимость нейронов при спорадическом АБС.
2) Боковой амиотрофический склероз
Несмотря на более чем 100-летнее изучение, боковой амиотрофический склероз (БАС) остается фатальным заболеванием центральной нервной системы. Заболевание характеризуется неуклонно прогрессирующим течением с избирательным поражением верхнего и нижнего мотонейронов, что приводит к развитию амиотрофий, параличей и спастичности. До настоящего времени вопросы этиологии и патогенеза остаются невыясненными, в связи с чем не разработаны специфические методы диагностики и лечения этого заболевания. Рядом авторов отмечено повышение частоты встречаемости заболевания среди лиц молодого возраста (до 40 лет).
МКБ-10 G12.2 Болезнь двигательного неврона
Боковой амиотрофический склероз дебютирует в возрасте 40 – 60 лет. Средний возраст начала заболевания 56 лет. БАС - болезнь взрослых, и не наблюдается у лиц моложе 16 лет. Несколько чаще заболевают мужчины (отношение мужчины-женщины 1,6-3.0: 1).
БАС является спорадическим заболеванием и встречается с частотой 1,5 – 5 случая на 100 000 населения.
В 90% случаев БАС носит спорадический, а в 10% - семейный или наследственный характер как с аутосомно-доминантным (преимущественно), так и с аутосомно-рецессивным типами наследования. Клинические и патоморфологические характеристики семейного и спорадического БАС практически идентичны.
В настоящее время возраст является основным фактором риска при БАС, что подтверждается нарастанием заболеваемости после 55 лет, и в этой возрастной группе уже не наблюдается различий между мужчинами и женщинами. Несмотря на достоверную связь БАС с возрастом, старение является только одним из предрасполагающих факторов развития патологического процесса. Вариабельность заболевания как в различных возрастных группах, так и среди лиц одного возраста предполагает существование определённых факторов риска: дефицит, или наоборот, наличие определённых нейропротективных факторов, к которым в настоящее время относят: нейростероиды или половые гормоны; нейротрофические факторы; антиоксиданты.
Некоторые исследователи отмечают особо благоприятное течение заболевания у молодых женщин, что подтверждает несомненную роль половых гормонов, в особенности эстрадиола и прогестина, в патогенезе бокового амиотрофического склероза. Подтверждением этому являются: большая частота встречаемости БАС у мужчин до 55 лет (при этом у них отмечается более раннее начало и быстрое прогрессирование заболевания по сравнению с женщинами); с наступлением менопаузы женщины болеют также часто, как и мужчины; единичные случаи заболевания боковым амиотрофическим склерозом во время беременности. К настоящему времени существуют единичные работы по изучению гормонального статуса больных с боковым амиотрофическим склерозом, и ни одной, посвящённой определению концентраций гормонов у молодых пациентов.
Этиология заболевания не ясна. Обсуждается роль вирусов, иммунологических и метаболических нарушений.
В развитии семейной формы БАС показана роль мутации в гене супероксиддисмутазы-1 (Cu/Zn-супероксиддисмутазу, SOD1), 21q22-1 хромосома, выявлен также БАС, связанный с 2q33-q35 хромосомой.
Синдромы, клинически не отличимые от классического БАС, могут возникать в результате:
•опухоли большого затылочного отверстия
•спондилез шейного отдела позвоночника
•артериовенозная аномалия спинного мозга
•бактериальные - столбняк, болезнь Лайма
•вирусные - полиомиелит, опоясывающий лишай
Интоксикации, физические агенты:
•токсины - свинец, алюминий, другие металлы.
Мышечная атрофия — это потеря мышечной массы, которая может вызвать серьезные проблемы со здоровьем, в том числе затруднение передвижения и даже правильное дыхание. Часто атрофия мышц происходит из-за крайне малоподвижного образа жизни и других проблем со здоровьем, которые могут привести к потере мышечной массы.
В дополнение к тому, что такое мышечная атрофия, давайте рассмотрим основные симптомы этого состояния и обсудим, какие методы лечения доступны в настоящее время.
Что такое атрофия мышц?
Мышцы — это большой запас белка в нашем организме. Мышечная масса предназначена не только для того, чтобы тело было в форме. Основная физиологическая функция мышц состоит в том, чтобы запасаться источниками энергии для использования её телом при необходимости. То есть, если человек лишен питательных веществ или подвержен серьезному и изнурительному заболеванию (например, рак, серьезные ожоги, аутоиммунные заболевания и сердечная недостаточность), организм ищет другие доступные источники энергии, такие как белок, хранящийся в мышцах.
Он очень полезен в чрезвычайных ситуациях, но не в качестве постоянного источника энергии.
Таким образом, наличие запаса белка в организме полезно для стимулирования здорового старения, предотвращения возникновения метаболических нарушений и обеспечения энергией в условиях стресса жизненно важных органов, таких, например, как сердце, мозг и печень.
Таким образом, мышечная атрофия характеризуется чрезмерной деградацией белков в организме, что ухудшает функцию мышц, а также может нарушать другие функции обмена веществ. Чрезмерная потеря мышечной массы может ухудшить снабжение организма человека энергией в среднесрочной и долгосрочной перспективе и привести к смерти.
Типы мышечной атрофии
Существует 2 основных типа мышечной атрофии, которые различаются по своим причинам. Кроме того, атрофия может затронуть как одну, так и несколько мышц, в зависимости от тяжести и причины.
1. Атрофия из-за недостатка движения.
Это тип мышечной атрофии, при которой потеря мышечной массы происходит из-за недостатка мышечной массы.
Это может произойти из-за чрезвычайно сидячего образа жизни или из-за некоторых медицинских или медицинских состояний, которые мешают кому-либо заниматься физическими упражнениями и даже выполнять простые движения.
Например, люди с ревматоидным артритом или остеоартритом имеют больший риск развития мышечной атрофии, особенно если они никогда не упражняются. Другие медицинские состояния, такие как сломанная кость или сильный ожог (чьё выздоровление происходит медленно) и люди с параличом тела могут стать жертвами мышечной атрофии первого типа.
2. Нейрогенная атрофия.
Нейрогенная атрофия — это тип атрофии вызван проблемами нервной системы. Основными причинами являются нервно-мышечные заболевания, такие как спинальная мышечная атрофия, рассеянный склероз, боковой амиотрофический склероз и синдром Гийена-Барре. Другая проблема со здоровьем, которая может вызвать атрофию, — диабетическая нейропатия.
В таких случаях происходит прерывание нервных сигналов мышцы, нарушая ее нормальное функционирование.
Причины атрофии мышц
Помимо отсутствия физической активности, которое приводит к истощению мышц и упомянутых выше заболеваний, существуют и другие причины, которые могут ухудшить здоровье мышц.
Некоторые другие заболевания и травмы, которые мешают или ограничивают движения, могут вызвать атрофию. Есть даже случаи, когда мышечная атрофия является симптомом серьезного недоедания или мышечного заболевания, связанного со злоупотреблением алкоголем. Даже у астронавтов, которые проводят много времени в космическом путешествии, может также начать развиваться мышечная атрофия из-за недостатка гравитации.
Возможные причины мышечной атрофии из-за недостатка движения:
- госпитализация или длительный отдых из-за болезни или операции;
- временные травмы, такие как перелом руки или ноги;
- недоедание, при котором мышцам не хватает питательных веществ, что приводит к постепенному ослаблению и невозможности использовать мышцы должным образом;
- дерматомиозит, при котором возникает мышечное воспаление, проявляющееся сыпью;
- мышечная дистрофия, наследственное заболевание, которое вызывает прогрессирующую потерю мышечной ткани и порождает мышечную слабость;
- остеоартроз, тип артрита, который вызывает боль и затруднение передвижения;
- ревматоидный артрит, хроническое аутоиммунное заболевание, при котором возникает воспаление в суставах;
- полимиозит, генерализованное воспаление, вызывающее слабость мышц;
- отсутствие физической активности;
- сильные ожоги.
Возможные причины нейрогенной мышечной атрофии:
- миопатия, связанная со злоупотреблением алкоголем;
- рассеянный склероз, поражающий нервную систему, головной и спинной мозг, вызывающий нарушение равновесия, нарушение координации, слабость и другие симптомы;
- боковой амиотрофический склероз или болезнь Лу Герига, тяжелое нервно-мышечное состояние, которое приводит к мышечной слабости и затруднению контроля произвольного движения мышц;
- диабетическая нейропатия, осложнение диабета, связанное с высоким уровнем сахара в крови;
- повреждение шеи, периферических нервов или спинного мозга;
- атрофия спинного мозга, генетическое заболевание, вызывающее снижение мышечной функции;
- воздействие токсинов или соединений, вредных для организма в виде ядов;
- синдром Гийена-Барре, аутоиммунное нервное расстройство, которое вызывает воспаление нерва и мышечную слабость;
- спинальная мышечная атрофия или болезни Верднига-Гоффмана, генетическое заболевание, которое ослабляет и атрофирует мышцы, и ухудшает движения.
- естественный процесс старения;
- длительное использование кортикостероидов;
- сосудистое поражение головного мозга;
- проблемы с глотанием;
- нейропатия, болезнь, которая вызывает повреждение одного или нескольких нервов;
- полиомиелит, вирусное заболевание, влияющая на мышечную ткань и вызвающая паралич.
Симптомы
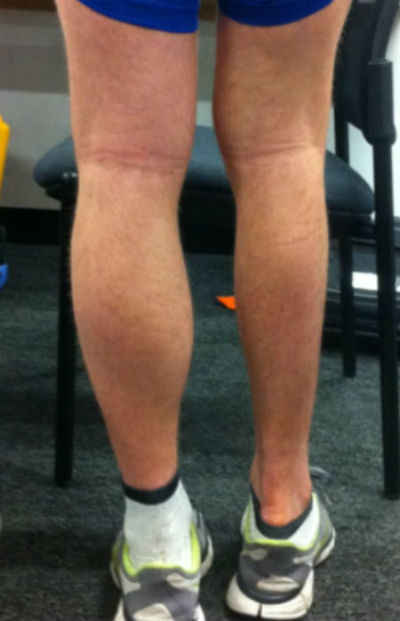
Симптомы мышечной атрофии могут варьироваться в зависимости от причины. Тем не менее, наиболее часто наблюдаемые симптомы:
- боль;
- ощущение, что одна конечность меньше другой, например, одна рука выглядит тоньше другой;
- нечувствительность;
- отек;
- мышечная слабость в любой конечности тела;
- трудность выполнения простых движений, таких как сидение или ходьба;
- проблемы с глотанием и речью;
- дыхательная недостаточность;
- мышечные спазмы или тремор;
- проблемы с костями и суставами, такие как сколиоз;
- проблемы координации движений;
- усталость;
- жесткость мышц.
Некоторые симптомы могут указывать на другие более серьезные проблемы со здоровьем. Поэтому, если вы заметили любой из следующих симптомов, обратитесь за медицинской помощью как можно скорее:
- изменение уровня сознания, например, обморок;
- искаженная и затянутая речь;
- неспособность говорить;
- изменения зрения, такие как потеря зрения или боль в глазах;
- внезапная слабость или онемение только на одной стороне тела;
- невозможность двигать частью тела.
Эти более серьезные симптомы могут указывать, например, на возникновение рассеянного склероза или инсульта. При рассмотрении любого из этих отклонений необходимо обратиться за помощью.
Осложнения состояния
Мышечная атрофия может быть признаком более серьезного заболевания. Таким образом, отсутствие надлежащего лечения может привести к серьезным осложнениям и необратимому повреждению организма.
Некоторые из осложнений атрофии — это снижение подвижности, снижение физической работоспособности, постоянные проблемы с осанкой, потеря силы и паралич.
Таким образом, пациент должен знать, что как только у него на руках будет диагноз, он должен сразу же начать лечение, чтобы остановить болезнь.
Диагностика
Диагноз состоит из оценки симптомов, истории болезни и запроса на дополнительные обследования. Также важно упомянуть любой тип старой или недавней травмы и рассказать врачу о лекарствах или пищевых добавках, которые вы принимаете.
Врач может запросить некоторые исследования, такие как анализ крови, рентген, МРТ, компьютерная томография, электромиография, биопсия мышц и нервов, а также исследование нервной проводимости, чтобы исключить возможные причины и завершить диагностику.
Лечение
В некоторых случаях, например, у тех, у кого мышечная атрофия возникла вследствие малой подвижности, состояние можно изменить путем лечения, которое включает сбалансированную диету в сочетании с физическими упражнениями и/или физической терапией.
Люди с нейрогенной атрофией мышц не могут быть полностью вылечены, но могут следовать специально разработанному лечению, чтобы снизить симптомы и улучшить качество жизни.
Лечение мышечной атрофии из-за малой подвижности.
Лечение доступно как часть полного курса или как отдельные методы терапии:
Физические упражнения и физиотерапия.
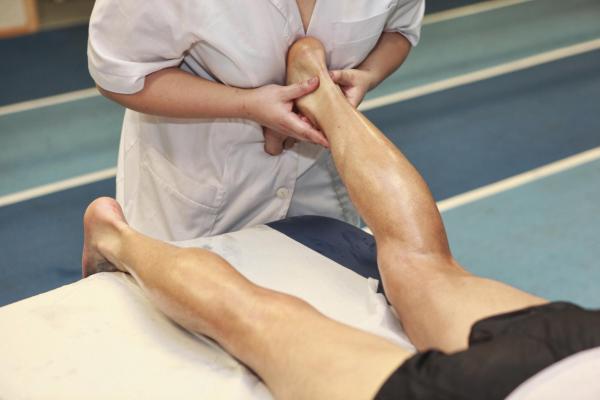
Вам рекомендуется как можно больше двигаться. В дополнение к простым упражнениям, таким как ходьба, рекомендуется заниматься бодибилдингом, если это возможно, и водными упражнениями, такими как аквааэробика, которые оказывают меньшее воздействие на суставы.
Если вам очень трудно заниматься физическими упражнениями, обратитесь за помощью к физиотерапевту, который поможет определить свои физические ограничения и научит правильному выполнению физических упражнений, делая физическую активность более легкой и приятной.
В тех случаях, когда человек не может двигаться в одиночку, необходима физиотерапия, чтобы не дать мышцам атрофироваться еще больше и даже восстановить некоторые повреждения.
Изменения в диете.
Чтобы избежать и лечить атрофию, вызванную малой подвижностью, необходимо правильно питаться. В дополнение к использованию здоровой пищи, важно обеспечить хорошее количество белка, чтобы организм мог восстановить атрофированные мышцы. В некоторых случаях могут быть назначены добавки, но обычно изменения в еде уже поможет восполнить всё необходимое организму.
Другие возможности методы лечения:
- Ультразвуковая терапия. Это неинвазивная терапия, при которой используются звуковые волны для лечения травм, вызывающих атрофию мышц.
- Альтернативные методы лечения. Альтернативные методы лечения, такие как остеопатия и хиропрактика могут помочь уменьшить симптомы.
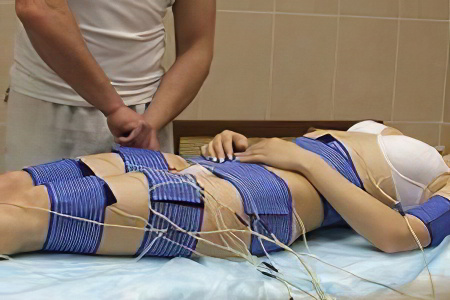
- Электрические стимулы. При длительных госпитализациях, когда человек не может встать с постели, необходимо, чтобы мышцы работали искусственно с помощью электрических стимулов и/или с помощью медсестер, профессионального терапевта или физиотерапевта, чтобы сохранить мышечную массу. В подобных случаях устройство генерирует электрический ток, который при воздействии на кожу вызывает непроизвольное сокращение мышц.
- Хирургия: В тех случаях, когда хирургическое вмешательство может помочь, назначается операция, после рассмотрения плюсов и минусов вмешательства.
Лечение нейрогенной мышечной атрофии.
В случаях нейрогенной мышечной атрофии, состояние также должно лечиться с использованием лекарств. Это потому, что при этом типе атрофии повреждение нерва не может быть обращено вспять. Часто эти люди не могут выполнять физические нагрузки или испытывают большие трудности с контролем именно движений.
Таким образом, лечение с физиотерапевтами имеет важное значение, чтобы помочь в выполнении упражнений. Кроме того, можно стимулировать мышцы и генерировать непроизвольные сокращения с использованием таких методов, как нервно-мышечная электростимуляция, которая с помощью электрических импульсов, воздействующих на нервы и мышцы, вызывает непроизвольные сокращения мышц, которые помогают движению мышц и лечению атрофии мышц в определенной области.
Поскольку существует несколько типов нейрогенной атрофии, важно выявить правильный диагноз и лечить состояние в соответствии с медицинскими рекомендациями. Как правило, в дополнение к физиотерапии, врачи указывают на использование противовоспалительных кортикостероидов, чтобы уменьшить воспаление и боль и уменьшить компрессию пораженных нервов.
Как предотвратить атрофию
Поскольку мышечная атрофия может возникать и в пожилом возрасте, важно знать способы предотвращения истощения мышц.
Лучший совет — вести активную жизнь. Недостаток физической активности является одним из основных факторов, способствующих атрофии мышц. Поэтому больше занимайтесь спортом, занимайтесь силовыми тренировками не менее 2 раз в неделю, плавайте, танцуйте, бегайте, гуляйте с домашним животным в парке. Важно почаще двигаться!
Другой важный совет — правильно питайтесь. Ешьте натуральные продукты. Это поможет не только сохранить мышцы здоровыми, но и остальную часть тела.
Заключительные советы
За исключением тех случаев, когда вы действительно не можете, правило таково — встань и двигайся. Это могут быть простые движения, но важно не поддаваться трудностям, связанным с атрофией мышц.
Даже если ваша атрофия не может быть обращена вспять, важно следить за ходом лечения и стараться оставаться активным до тех пор, пока это возможно. Это поможет повысить самооценку и качество жизни. Лечение очень важно, и с увеличением количества доступных в медицине ресурсов, можно хорошо жить, имея мышечную атрофию.
Читайте также:


