Вирус размножается в лимфоцитах
в случае с Ковид-19.
Я думаю, что САРС2 (вызывающий Ковид-19), равно как и САРС (вызывающий атипичную пневмонию), или МЕРС, показывающие очень похожие картины поражения нижних дыхательных путей, действуют схожим образом на иммунитет человека и пользуются примерно одинаковыми путями, чтобы заражать клетки и избегать "наказания".
Из известных механизмов заражения, по САРС, это 2 пути -
1) поражение клеток нижних дыхательных путей и тонкого кишечника (преимущественно), несущих на себе рецепторы к АСЕ2 (курильщики нервно курят в сторонке, тк курение (как и гипотензивные средства) не уменшает их количество, а скорее наоборот) приводящее к разрушению клеток (и тканей), с которыми эти коронавирусы "легко контачат", и
2) проникновение в иммунные клетки (в которых вирус тоже размножается, нарушает их функции, и либо убивает, либо может "озлокачествить") с использованем рецептора для связывания антител. Клетки, несущие на себе этот рецептор- это клетки имумнной системы (и их предшественники в костном мозге, селезенке, кишечнике, этс) . Второй путь, считается, ответственнен бОльшей частью за "тяжелое" течение болезни, тк это вариант антитело-зависимого усиления (АЗУ), или ADE.
Оба пути для вируса САРС- "рабочие".
Когда человек сталкивается с инфекцией впервые, вирус (САРС, 229E, или ему подобные), преимущественно, использует заражение через АСЕ2. Вообще, другие коронавирусы тоже якорятся на этот рецептор, потому они поражают дыхательные пути или ткани системы пищеварения ( поначалу и в основном). Есть варианты отличий для разных вирусов- разых животных.
Далее. После того, как вирус проник в организм, размножился в достаточном количестве, чтобы получились симптомы болезни, организм борется "подручными средствами", потратив некоторое время "на раскачку", используя специфический и неспецифический иммунные ответы, задействуя клеточный иммунитет, а затем и гуморальный.
В результате, при большинстве заболеваний, и в случае с САРС ( и Ковид-19) тоже, вырабатываются антитела, которые, обычно, успешно борются с инфекцией, ну или хотя бы "держат ее под контролем" (случаи хроники).
Чтоб суметь быстрее среагировать на врага, появись он вновь, в организме остаются В-лимфоциты памяти, которые, в случае новой угрозы, активируются и нарабатывается "пул" антител. Антитела вырабатываются В-лимфоцитами, но в имумнном ответе активно участвуют и Т-лимфоциты (регуляторные и убйицы), лейкоциты, а так же макрофаги\дендритные клетки (пожиратели заразы и активаторы -направители иммунитета).
В случае разных возбудителей болезней (т. е. их антигенов), мы имеем разное время "жизни" иммунитета против них. Иногда бывает, что иммунитет долго (на всю жизнь) не сохраняется, иногда остается на несколько лет, иногда на десятки лет. Это в случае, когда антиген один и тот же, а не когда возбудитель маскируется или перетасовывает свои антигенные белки.
Что же происходит в случае АЗУ при заражении коронавирусом.
Вирус САРС и аналогичные ( лихрадки Денге, кошачьего инфекционного перитонита, итп), и, с большой вероятностью, САРС2, может использовать циркулирующие в системе антитела (например, к коронавирусу 229E, который некоторым образом похож на него, и у людей вызывает бронхит, пневмонию, но, обычно не является причиной тяжелого заболевания) для того, чтобы поражать не только клетки "первичной атаки", но и иммунные клетки (т.е макрофаги и лимфоциты)- тоже.
После перенесенного заболевания, в организме переболевшего вырабатываются антитела, много и разные. Целый коктейль. Их называют поликлональными. Они вырабатываются на многие, разные, антигенные эпитопы одного и того же возбудителя, но, закрепляются и остаются в иммунной памяти, те их них, которые "наиболее эффективные" (тк там работает система "подкрепления"), и помогают качественно и быстро уничтожать врага. В случае с коронавирусами- это антитела к различным антигенным участкам "шипиков" оболочки вируса, или Spike protein. Это белки, которые формируют "короны" и помогают вирусу внедряться в клетки- мишени (через АСЕ2).
Иммунитет реагирует совершенно адекватно, тк эти шипики и антигенны, и удобны для "ухватывания", и если вирусы будут с антителами, висящими на шипиках, они не могут использоваться ими для внедрения в клетку.
Потому, в случае коронавирусов вообще, большинство антител, которые вырабытвает организм, так или иначе связано именно с этим поверхностным антигеном вируса. Так что в "коктейле" из антител, полученных естественным путем (болезнью), доминируют именно они.
Но, надо отметить, что белки, вполне похожие на шипики САРС ( и САРС2) имеют на своей поверхности и другие коронавирусы, вызывающие инфекции человека:
The coronaviruses HCoV-229E, -NL63, -OC43, and -HKU1 continually circulate in the human population and cause respiratory infections in adults and children world-wide.
У людей, которые переболели этими инфекциями (впрочем,как и САРС и САРС2), есть вероятность "закрепленного" иммунитета именно на антигены шипиков вирусов. Которые в некоторых участках- схожи у некоторых разных видов коронавиурсов. А значит, уже имеющиеся в системе В-клетки отреагируют на сигналы о возбудителе, выработают антитела, и эти антитела будут худо-бедно (а может и отлично, тут все индивидуально), но связываться с похожими вирусами (что как бы и неплохо, тк такая "перекрестная" реакция в идеале помогает защититься лучше, легче переболеть похожей инфекцией- например, этим поясняется "слабый" имумнитет к гриппу, когда вторичное заболевание слегка мутировашим вирусом не приводит к тяжелому течению, тк помогают "менее специфические" антитела, на самых ранних этапах).
Однако вирусы МЕРС, САРС, и, скорее всего САРС2- "подстраховались" на этот случай. Если есть антитела в крови или лимфе, которые могут связаться с белками их шипиков- прекрасно, пусть связываются. И пусть таким образом вирус будет "доставлен" в альтеранивный "док" (рецептор для связыания с антителами) на лимфоците и (или) макрофаге. И пусть его "примут" внутрь иммунной клетки, считая дезактивированным. Как бы не так. Попав внутрь, через "антительный" рецептор, вирус высвобождает свою РНК и заражает хозяина. Вырабатывая свои копии в больших количествах ( преимущественно в лимфоцитах), и стимулируя "хозяина" посылать сигналы, увеличивающие выработку таких же антител ( сигнальные молекулы на поверхности клеток, а так же цитокины и хемокины). И более сигналов, чтобы привлекать к месту заражения все больше "носителей" (Т-лимфоцитов, других моноцитов, включая и макрофагов) -чтоб было на ком размножаться, ведь одному вирусу достаточно 1 лимфоцита или макрофага, а вирусов- много. А если основной путь (через АСЕ2) блокируется, значит надо, чтоб было много доступа к альтернативному хозяину (иммунным клеткам).
Результат- толпы вирусов, зараженные макрофаги, не могущие выполнять свои функции, которые к тому же потом разрушаются и отравляют все вокруг своими "секретами", разрушенные, дезориентированные, и "сошедшие с ума" Т лимфоциты в огромных количествах, масса сигнальныхмолекул для привлечения других иммунных клеток, возбужденные моноциты, и вся эта "лимфа" буквально наводняет легкие, продолжающие тем временем разрушаться. Ну, или кишечник и брюшную полость, если говорить о кошачьем перитоните. А в крови тем временем наблюдается лимфопения (тк большинство лимфоцитов- отправились на войну в легкие, где, и погибают) и нарастание С-реактивного белка (чтоб мобилизовать еще больший имумнный ответ против опасного врага и бороться с увеличивающимся разрушениями собственных клеток)- типичнеы индикаторы тяжело протеающей инфекции САРС или Ковид-19.
При этом, разумеется, когда есть антитела, заражаемость клеток легких, самих по себе, несколько снижается,- зато заражаемость моноцитов растет. Хрен редьки не слаще.
Есть данные, которые показали, что в случае с САРС, существует сильная корреляция между наличием в крови антител к вирусу на ранних этапах ( 2 недели) и тяжестью и смертельностью течения заболевания. Модели на клеточных линиях и животных показали, что в присутствии специфических антител к большинству участков белков шипиков коронавирусов, при заражении возникает АЗУ. Что означает тяжелое течение заболевания и бОльшую вероятность смерти.
Так что у тех, кто переболел и имеет антитела, или " адаптивный гуморальный иммунитет", повторное заражение (от которого никто не застрахован, тк иммунитет, если он только не "поверхностный", препятствует не заражению, а развитию болезни), вполне вероятно, может привести к более тяжелому заболеванию.
Ученые считают, что у тяжело переболевших САРС (или умерших) и имевших антитела к вирусу на раннем этапе, скорее всего, это были антитела к коронавирусу 229E.
И стариков в выборке "тяжелых" много не только потому, что они "слабые", а еще и потому, что за более длинную жизнь они имели больше шансов столкнуться с каким-то из "уже человеческих" коронавирусов, которые циркулируют там или сям во время сезонных "простуд", по всему миру.
Потому есть шанс, что "молодежь", переболев Ковид-19 легко при первой волне, может тяжелее перенести вторую волну (итд).
"Переболеть" может не помочь не заболеть при следующей встрече с вирусом. И иногда наоборот, из-за способностей САРС (и САРС2) использовать АЗУ, поспособствовать заболеть тяжело.
Да, когда иммунитет слабый и антител мало, вирус прекрасно разрушает ткани леких (и др), так что "исключить" антитела подавлением В-клеток - тож не сахарный вариант.Так что в случае с коронавирусами, грань тонка, когда и как и чем подтолкунть иммунитет, а когда и наоборот, придавить.
Конечно, иммунитет у всех разный, много факторов участвует в его формировании. Но люди не могут отконтролировать, что за антитела будут вырабатываться. Так что, кому повезет, а кому и нет.
Естественный отбор по САРС.
Но могут попытаться создать вакцину, которая будет использовать как антиген те части вируса, которые не могут быть задействованы в АЗУ. Правда, зачастую бывает, что к таким антигенам иммунитет вырабатывается "неохотно" и оказывается слабым, потому тут есть сложности. Так что даже при оптимальном выборе антигенных белков для "искусственно синтезированного белкового антигена" , с учетом данных исследований по САРС, потребуется время, чтобы убедиться, что все работает хорошо и все безопасно ( тк лучше обойтись без АЗУ после вакцинации, как показал пример вакцины к лихорадке Денге, хотя там и менее специфичное связывание).
Статьи и работы для улучшения понмиания ситуации:
Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates.
- 4694
- 3,9
- 0
- 2
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Исследования в области происхождения злокачественных опухолей, ежегодно уносящих миллионы человеческих жизней, ведутся с XIX века. Работая в области молекулярной вирусологии, Вармус совместно с Дж. М. Бишопом в исследованиях 1970-х гг. сделали открытие, которое по-новому осветило долго остававшуюся дискуссионной проблему этиологии опухолей у человека и животных. Согласно полученным результатам, неконтролируемый рост клеток, образующих опухоль, вызывается не только проникающим в клетку извне онковирусом, но и внутренними процессами в самой клетке. Вармус доказал, что нормальные гены роста клетки вследствие случайных спонтанных мутаций под воздействием химических канцерогенов или, порой, процесса старения могут изменять свою молекулярную структуру и таким образом превращаться в протовирусы онкогенной природы. За открытие клеточного происхождения онкогенных протовирусов Вармус совместно с Дж. М. Бишопом в 1989 г. были удостоены Нобелевской премии по физиологии и медицине [1].
Один из самых распространённых вирусов в человеческой популяции — вирус Эпштейна-Барр (рис. 1) — был открыт и описан в 1964 году двумя английскими вирусологами: Майклом Эпштейном и Ивонной Барр. Вирус Эпштейна-Барр (ВЭБ) — член семейства герпесвирусов [6, 7]. В инфицированных клетках вирусная ДНК, как правило, не встроена в клеточный геном, а находится в ядре в виде замкнутого кольца (эписомы). Биологическое значение интеграции ВЭБ в геном клетки остается неясным. Высказываются предположения, что эписомная ДНК необходима для реализации полноценной репликации ВЭБ, завершающейся формированием вирусных частиц [8].

Рисунок 1. Структура вириона вируса Эпштейна-Барр. Вирион ВЭБ построен таким образом, что вирусная нуклеиновая кислота окружена белковой оболочкой (капсидом), образуя вместе с ней структуру, получившую название нуклеокапсид. Капсид имеет 25 граней и состоит из 162 субъединиц (так называемых капсомеров). Средние размеры вириона — около 150 нанометров. Снаружи вирусная частица покрыта двухслойной мембраноподобной оболочкой, именуемой суперкапсидом, или пеплосом. При этом между внешней мембраноподобной структурой и нуклеокапсидом располагается так называемая волокнистая оболочка, имеющая белковую природу и получившая название тегумент [8]. Рисунок с сайта viralzone.expasy.org.
В отличие от многих других герпесвирусов, вирус Эпштейна-Барр поражает в первую очередь эпителиальные клетки ротовой полости, глотки, миндалин. Здесь он размножается наиболее активно, и поэтому главным путём заражения вирусом являются поцелуи (вот и приехали). Наибольшее количество вирусных частиц находится в клетках эпителия около слюнных желез, и со слюной выделяется большое количество их. Не удивительно, что инфекционный мононуклеоз — самое распространённое заболевание, вызываемое вирусом Эпштейна-Барр, — называют ещё болезнью поцелуев [9].
Входными воротами инфекции являются клетки ротовой полости и носоглотки [10]. ВЭБ проникает в В-лимфоидную ткань ротоглотки, а затем происходит его распространение по всей лимфатической системе организма. ДНК вируса попадает в ядро клеток, при этом белки ВЭБ предоставляют инфицированным В-лимфоцитам способность непрерывно размножаться в культуре. Вирус может делать клетки бессмертными [11].
После первой встречи человека с ВЭБ вирус в незначительном количестве сохраняется в организме хозяина в течение всей жизни. Однако если любой элемент иммунного ответа нарушен, даже незначительное количество ВЭБ-инфицированных клеток может преумножиться колоссально [12].
Инфицированные В-клетки могут значительное время находиться в миндалинах, что позволяет вирусу выделяться во внешнюю среду со слюной. С зараженными клетками ВЭБ распространяется по другим органам. В пораженных вирусом клетках возможно два вида развития: литический, приводящий к разрушению клетки-хозяина, и латентный (клетка заражена, но ничего не выдает нахождения вируса), когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах, эпителии носоглотки и слюнных железах. Кроме того, он способен проникать и в другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов (рис. 2а, 2б) [13].

Злокачественные лимфомы (например, увеличение лимфоузлов), согласно данным Международного агентства по изучению рака, составляют 3–4% среди всех регистрируемых в мире злокачественных новообразований [14]. Лимфомы делят на две основные группы: лимфома Ходжкина (20–30 % всех лимфом) и неходжкинские лимфомы (около 70%) [14, 15].
Неходжикинские лимфомы — это совокупность новообразований, в возникновении которых принимают участие различные агенты [18]. Первая группа — это вирусы, трансформирующие лимфоциты и другие клетки (ВЭБ, HHV-8). Вторая группа представлена факторами различной природы, вызывающими иммунодефицитные состояния. К таким факторам в первую очередь относится ВИЧ (вирус иммунодефицита человека), вызывающий у инфицированного лица подавление иммунитета в результате истощения пула Т-лимфоцитов CD4+ и возникновение СПИДа. В третью группу входят некоторые инфекции, (например, H. pylori), которые увеличивают риск возникновения лимфом на фоне вызываемой ими хронической стимуляции иммунной системы и постоянной активации лимфоцитов [17].
Исследования последних лет свидетельствуют о том, что в патогенезе ВЭБ-ассоциированных патологий чрезвычайно важную роль играет вредный LMP1 — латентный мембранный белок 1, кодируемый одноименным геном (LMP1). Он обладает свойствами онкобелка и функционирует как постоянно активный псевдорецептор. Он способен изменять В-лимфоциты человека [19].
Есть предположение, что аминокислотные замены, накапливающиеся в LMP1, по-видимому, также вносят свой вклад в возникновение опухолей. Механизм этого процесса окончательно не установлен, но предполагается, что усиленный трансформирующий эффект мутированных LMP1 может представлять важную составляющую этого процесса. При этом показано, что различия в последовательности гена LMP1 могут определять агрессивный географически локализованный генотип ВЭБ [21].
Из известных механизмов действия LMP-2 (второй из братьев семейства LMP), расположенного на противоположном конце линейного генома, упоминается лишь способность этих белков совместно повышать сигнальную трансдукцию в ВЭБ (+) клетках [19].
По данным Харальда цур Хаузена, связь между вирусом и раковым заболеванием считается установленной при определении следующих критериев:
- эпидемиологические доказательства того, что вирусная инфекция является фактором риска для развития специфической опухоли;
- присутствие и сохранение генома вируса в клетках опухоли;
- стимуляция пролиферации клеток после введения генома (или его части) вируса в ткани культуры клеток;
- демонстрация того, что геном возбудителя индуцирует пролиферацию и злокачественный фенотип опухоли [19].
Однако канцерогенность ВЭБ далеко не однозначна. Несмотря на то, что кодируемые вирусом продукты способны вызывать пролиферацию инфицированных клеток, ведущую к возникновению лимфом у больных с иммунодефицитом, эти клинически агрессивные опухоли довольно часто поликлональны и подвергаются регрессии при восстановлении иммунного ответа на ВЭБ. Такие опухоли как лимфома Беркитта (ЛБ) и лимфома Ходжкина (ЛХ) встречаются не только в ВЭБ-ассоциированных, но и в ВЭБ-неассоциированных вариантах, что говорит о том, что патогенез этих новообразований связан не только с ВЭБ. Кроме того, злокачественные клетки больных ЛБ и ЛХ отличаются фенотипически от клеток ЛКЛ, полученных под воздействием ВЭБ in vitro, и не экспрессируют ряд белков, необходимых для трансформирующего роста. Эти находки позволяют предположить, что опухолевые клетки могут возникать и под воздействием факторов невирусного происхождения, а также зависеть от различных усиливающих рост клеток стимулов [17].
Лабораторная диагностика ВЭБ-инфекции базируется на цитологическом исследовании крови или костного мозга, серологических исследованиях и ПЦР. С помощью метода ПЦР можно определить ДНК вируса в плазме до клинических проявлений болезни, а репликация вируса в организме является показанием к противовирусной терапии и критерием эффективности проведенного лечения. Материалом для исследования служат слюна или рото- и носоглоточная слизь, соскоб эпителиальных клеток урогенитального тракта, кровь, спинномозговая жидкость, ткани опухоли и костный мозг. Как у больных ВЭБ, так и у носителей может быть получен положительный результат в ПЦР. Поэтому для их дифференцировки проводится количественный ПЦР-анализ для определения количества копий вирусного генома. У маленьких детей (до 1–3-х лет) по причине недостаточно сформированного иммунитета диагностика по антителам затруднительна, поэтому в данной группе пациентов в помощь приходит именно ПЦР. Однако в силу того, что ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов (до 30%), связанный именно с отсутствием репликации в момент исследования. При этом важно сопоставление результатов клинических, серологических и молекулярных обследований в определении ВЭБ-инфекции, как причины имеющегося заболевания [1].
Специфическая профилактика (вакцинация) против ВЭБ не разработана, но проводятся клинические испытания. Основной проблемой при разработке вакцины является большое отличие в белковом составе вируса на разных фазах его существования. Впрочем, в настоящее время разрабатывается вакцина, которая содержит рекомбинантный поверхностный антиген gp350. После вакцинации первичная инфекция протекает субклинически, но собственно инфицирование человека не предупреждается. Кроме того, вырабатывающиеся нейтрализующие антитела не влияют на течение различных форм латентной инфекции, в том числе опухолей. Профилактические меры сводятся к укреплению иммунитета, закаливанию детей, мерам предосторожности при появлении больного в окружении, соблюдение правил личной гигиены.
Заключение
Широкое распространение ВЭБ с выраженным трансформирующим потенциалом среди населения планеты и редкого возникновения в инфицированной популяции связанных с этим вирусом опухолей с преимущественной их локализацией в определенных географических регионах позволяет сделать важный вывод. Подобно большинству опухолей иной вирусной природы, в патогенезе ВЭБ-ассоциированных новообразований важную роль играют дополнительные факторы, и одного ВЭБ недостаточно для возникновения опухоли. ВЭБ лишь инициирует пролиферацию инфицированных им клеток, а последующие события влияют на гистопатологический спектр возникающих неоплазий. Одним из важнейших факторов, в значительной степени определяющих возникновение ВЭБ-ассоциированных опухолей, служит выраженная иммуносупрессия (врожденная, ятрогенная или индуцированная любой вирусной инфекцией, и в первую очередь ВИЧ), приводящая к утрате функции иммунного распознавания клеток, инфицированных ВЭБ.
Таким образом, несмотря на многолетнее изучение связи ВЭБ с опухолями человека, вопрос о роли вируса в их возникновении до конца не изучен. Раскрытие механизма злокачественной трансформации вирусом, персистирующим в латентном состоянии более чем у 90% населения планеты, — задача чрезвычайно сложная. Однако технические достижения последних лет, существенно повысившие специфичность исследований, позволяют надеяться, что детали ВЭБ-ассоциированного канцерогенеза будут выяснены.

Вирусы очень интересные существа. Они не имеют клеток, с точки зрения науки не считаются живыми… да и наука до сих пор точно не может сказать что это такое.
Всё что касается вирусов — очень сложно! Поэтому мы и наблюдаем такой ажиотаж!
Чтобы по минимуму в этом разбираться, нужно хотя бы знать следующие термины:
1) Дезоксирибонуклеиновая кислота;
2) Рибонуклеи́новая кислота;
3) капсид;
4) рецепторы и корецепторы;
5) мембрана;
6) связь ключ-замок;
7) интеграза;
8) протеаза;
9) обратная транскриптаза;
10) домен;
11) транскрипция;
12) мессенджер;
13) цитоплазма;
14) репликация;
Вирусы размножаются в клетке. Но каждый вирус специализируется на определенных клетках!
Так ВИЧ заражает Т-лимфоциты, Грипп поражает эпителий гортани и легких, коронавирус поражает эпителий верхних дыхательных путей, легких и желудочно-кишечного тракта, Герпесы поражают нервы и вызывают нейроинфекции, гепатиты поражают клетки печени и т.д.
Как вирус проникает в клетку:
Т.е. 1 вирус попав в клетку организма, превращает её в фабрику по производству новых вирусов.
Как реагирует иммунитет? Обычно если вирусов немного, то зараженные клетки успевают уничтожить лимфоциты и натуральные киллеры.
Но если доза вирусов досталась большая или иммунитет ослаблен стрессом от слива депозита во время кризиса на рынках, то фабрика эта вирусная успешно запускается!
Но не всё так плохо! В организме есть сигнализация! Если вирус попадает в клетку, то клетка начинает индуцировать и выбрасывать вокруг себя особые белки интерфероны. Эти белки дают сигнал соседний клеткам и клетки блокируют свои мембраны, не давая вирусам попасть внутрь себя. Также подается сигнал иммунным клеткам, что тут что-то не так и надо начинать работу.
Что касается интерферонов, то тут вообще всё очень сложно:
Кроме того, особыми клетками иммунитета В-лимфоцитами начинают продуцироваться особые белки иммуноглобулины (в народе — антитела), которые блокируют белки вируса, превращая их в беспомощные цели для макрофагов.
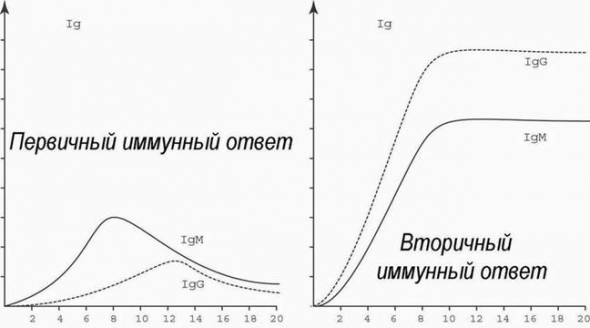
Иммуноглобулины классов A, M, G (IgA, IgM, IgG) или антитела — белки, которые вырабатываются иммунной системой организма в ответ на внедрение бактерий, вирусов, грибов и других чужеродных агентов (антигенов).
Антитела специфичны и вырабатываются к каждому конкретному антигену. Выработкой иммуноглобулинов сопровождается и аллергическая реакция. При аутоиммунных заболеваниях антитела продуцируются к собственным тканям.
Существуют пять классов антител, среди которых наибольшее диагностическое значение имеют IgA, IgG и IgM.
IgA-антитела синтезируются в дыхательных путях, желудочно-кишечном тракте, влагалище и других органах. Эти антитела защищают организм от вторжения чужеродных агентов извне. На долю иммуноглобулинов класса А приходится 10-15% всех антител. У небольшого числа людей IgA-антитела не вырабатываются — селективный дефецит иммуноглобулина A.
IgM-антитела находятся в крови и лимфатической жидкости. При попадании антигена именно иммуноглобулины М вырабатываются в первую очередь. Уровень IgM антител составляет 5-10%.
IgG-антитела обнаруживаются во всех жидкостях организма. Они являются самыми маленькими, но наиболее распространенными антителами (около 75-80% от всех иммуноглобулинов в организме). Только IgG-антитела могут проникать через плаценту беременной женщины, а, значит, и защищать плод — приблизительно до 6-месячного возраста.
Низкий уровень иммуноглобулинов может свидетельствовать о недостаточности иммунной системы. Повышенное количество иммуноглобулинов может вырабатываться при множественной миеломе (IgG, IgA), макроглобулинемии (IgM), первичном системном амилоидозе и других состояниях.
Как работают антитела:
Обычно это всё выглядит вот так: 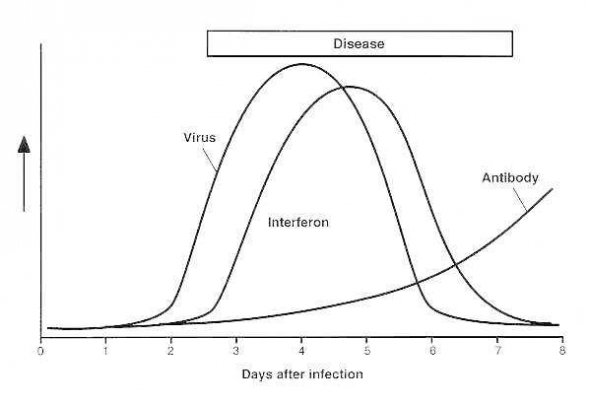
После выработки достаточно антител класса IgG — у вас теперь есть долгосрочный иммунитет от вируса!
Обычно на это у организма уходит 10-14 дней! Если вы не умерли в первые 5-8 дней, значит у вас хорошие шансы на выздоровление!
(исключение — люди болеющие СПИДом, наркоманы, алкоголики, голодающие, а также лица проживающие в неблагоприятных экологических условиях)
Теперь я надеюсь всем понятно, почему у нас столько много людей выздоровевших после коронавируса и почему всех сажают на карантин именно на 2 недели?
Многие вирусы не способны инфицировать лимфоидную ткань, т. е. селезенку, лимфатические узлы, тимус, лимфоидные клетки крови; обнаружение вируса в лимфатическом узле может быть просто результатом проникновения вируса по лимфатическим путям из периферического места размножения. Другие вирусы размножаются в лимфоцитах, ретикулярных клетках, макрофагах лимфоидной ткани, на что указывают данные окрашивания флуоресцирующими антителами и электронной микроскопии. До разработки надежных методов диагностики проводили подробное и тщательное исследование реакции лейкоцитов на вирусную инфекцию. Для некоторых вирусных болезней характерна лимфопения, для других — нейтропения; часто наблюдают лимфоцитоз при выздоровлении.
Состояние картины крови отражает ход воспалительных и иммунологических процессов в тканях, иногда — прямое действие вируса на лейкоциты и реакцию костного мозга. Сам костный мозг тоже может быть заражен, но инфекция костного мозга мало исследована. Сейчас уделяют меньше внимания изменениям поведения лейкоцитов крови; вместе с тем сами лейкоциты могут быть заражены, могут переносить вирус, вырабатывать интерферон, быть иммунологически активными и, вероятно, играют важную роль в патогенезе (Грессер и Ланг, 1966).
Лимфоидная ткань, имеющая множество разнообразных функций, может по-разному реагировать на разные вирусы: а) вирусы могут размножаться без цитопатического эффекта, как у мышей при врожденном заражении вирусами ЛХМ и лейкозов, когда развивается персистентная инфекция с иммунологической толерантностью; б) размножение вируса в лимфоидной ткани может происходить с цитопатическими эффектами, такими, как образование включений или гигантских клеток, например при цитомегаловирусной, герпесвирусной, коревой инфекции. Зараженные лейкоциты в конечном итоге гибнут, но успевают принять участие в распространении вирусов по организму. Вирус чумы рогатого скота вызывает более серьезные цитопатические поражения в лимфатических узлах (Тадзима и Усидзима, 1971).

Это сопровождается гиперпластической иммунной реакцией клеток, которая вносит свой вклад в изменение лимфоидной ткани; иммунные реакции могут играть роль в развитии патологических изменений; в) в типичном случае лимфатический узел дренирует пораженную зону и накапливает вирионы и вирусные антигены, являясь местом развития иммунного ответа. Взаимодействие иммунных клеток или антител с вирусным антигеном в лимфатическом узле может вести к отеку, а иногда и к некрозу даже в тех случаях, когда сам вирус не вызывает цитопатического эффекта, как вирус ЛХМ у взрослых мышей (Миме и Тозолини, 1969; Тозолини и Миме, 1971), или не вызывает существенного заражения лимфоидной ткани, как вирус коровьей оспы у мышей (Валнерова и Миме, 1971); г) поражения лимфоидной ткани могут быть результатом прямого деструктивного действия вируса.
При оспе мышей, сопровождающейся тяжелыми деструктивными поражениями, обусловленная этим слабость иммунного (клеточного) ответа приводит к бурному размножению вируса в печени и в конечном счете к гибели животного; у выздоравливающих животных неинфицированные клетки лимфоидного ряда обеспечивают сильный иммунный ответ (Миме, 1964). Вирус венесуэльского энцефалита (Виктор и др., 1956) и вирус некроза тимуса мышей (Роу и Кэпс, 1961) тоже, видимо, размножаются в лимфоидной ткани и разрушают ее. У мышей, зараженных вирусом гепатита мышей (коронавирусом), развивается некроз фолликулов селезенки с локальным размножением вируса (Биггарт и Рюбнер, 1970). Некроз можно предотвратить кортизоном, который либо стабилизирует мембраны, либо тормозит иммунологический механизм поражений; е) наконец, поражения лимфоедной ткани могут быть вызваны «ортикостероидными гормонами.
Тяжелая инфекция действует как стресс, а сравнимые по силе стрессы, вызванные иными факторами — холодом, голодом, травмой, — повышают секрецию кортикостероидных гормонов.
Эти гормоны оказывают глубокое воздействие на лимфоидную ткань, но их участие в патологических процессах редко отделяют от прямого вирусного и иммунологического воздействия на лимфоидную ткань (Валнерова и Миме, 1971). Многие вирусные инфекции обладают иммунодепрессивным действием, обычно связанным с размножением вируса в лимфоидной ткани; механизмы этого процесса еще неясны.
Читайте также:


