Вирусная теория канцерогенеза по
В 1908—1911 гг была установлена вирусная природа лейкоза и саркомы кур. В последующие десятилетия была доказана вирусная этиология ряда лимфоидных и эпителиальных опухолей у птиц и млекопитающих. В настоящее время известно, что в естественных условиях, например, лейкоз вызывается вирусами у цыплят, кошек, крупного рогатого скота, мышей, обезьян-гиббонов.
В последние годы открыт первый вирусный возбудитель, вызывающий развитие лейкоза у человека,— это ATLV (adult T-cell leukemia virus — вирус Т-клеточного лейкоза взрослых) Т-клеточный лейкоз взрослых — эндемичное заболевание, встречающееся в двух районах земного шара иа островах Клуши и Шихоку в Японском море и у негритянского населения стран Карибского бассейна. Больные с этой лимфомой встречаются спорадически н в других регионах, но у многих из них выявлена та или иная связь с эндемическими областями.
Заболевание это встречается обычно у людей старше 50 лет, протекает с кожными поражениями, гепатомегалией, спленомегалией, лимфаденопатией и имеет неблагоприятный прогноз Вирус ATLV или HTLV является экзогенным для человека, отличается от других известных ретровирусов животных, передается Т-клеткам горизонтально от матери к ребенку, от мужа к жене (но не наоборот), при лереливании крови, не обнаруживается ни при каких других формах лейкозов или лимфом человека. Таким образом, Т-клеточный лейкоз взрослых — это типичное инфекционное заболевание (вертикальная передача вируса через половые клетки исключена специальными исследованиями). В эндемичных очагах более 20% практически здоровых людей, главным образом родственники больных, являются носителями вируса.
В других частях земного шара антитела к вирусу обнаруживают редко. Считается, что заболевает 1 из 2000 инфицированных людей. Вирус, неотличимый от ATLV, обнаружен в Африке у обезьяи. Помимо лимфомы (лейкоза), указанный вирус может вызывать СПИД, при котором нарушен Т-клеточный иммунитет.
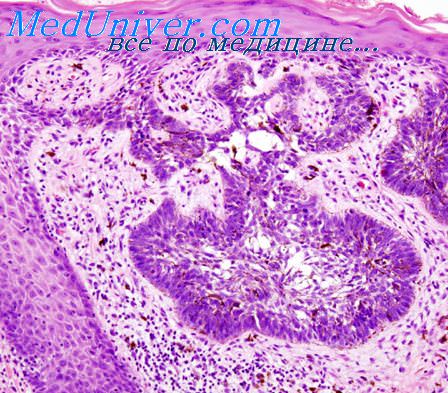
Вирусную этиологию подозревают и по отношению к некоторым другим опухолям человека Вирус Эпстайна — Барр (EBV), входящий в группу вирусов герпеса, является весьма вероятным этиологическим фактором лимфомы Беркитта. В клетках этой лимфомы в эндемических очагах в Африке постоянно обнаруживают ДНК EBV. Однако лимфома Беркитта встречается и за пределами Африки, но ДНК EBV обнаруживается лишь в меньшей части таких случаев. Общим для EBV-положительиых и EBV-отрицательных опухолей являются характерные перестройки хромосом (транслокация между хромосомами 8 и 14), что рассматривают как доказательство единой этиологии этих опухолей.
ДНК этого вируса находят в геноме клеток недифференцированной назофарингеальиой карциномы, но не в опухолях носоглотки другого гистогенеза. У больных с этими опухолями отмечают высокий титр антител к различным компонентам EBV, значительно превышающий эти показатели в популяции — EBV имеет широкое распространение, и антитела к нему обнаруживаются у 80—90% здоровых людей. Высокий титр антител обнаружен у больных лимфогранулематозом. Подавление иммунитета и активация EBV являются, по мнению ряда авторов, основной причиной развития лимфом и иммуиобластных сарком у больных с трансплантированными почками, подвергавшихся действию иммуноделрессивных средств; в пользу этого свидетельствует высокий титр антител к EBV и обнаружение ДНК EBV в геноме опухолевых клеток.
Существуют данные, позволяющие предполагать инфекционную (вирусную) этиологию рака шейки матки частота возникновения этого рака выше при раннем начале половой жизни с частой сменой партнеров, повышена она у вторых жен мужчин, первые жены которых также страдали тем же заболеванием. На основании сероэпидемиологических данных думают о роли вируса герпеса II типа как инициатора; подозревают также вирус кондилом.
В районах с высокой частотой возникновения вирусного гепатита В повышена также и заболеваемость гепатоцеллюлярным раком. С другой стороны, больные с этой опухолью чаще дают серопозитивную реакцию на вирус гепатита В, чем здоровые индивидуумы; но есть и серонегативные случаи рака. Получены линии опухолевых клеток, содержащие ДНК вируса и продуцирующие его антиген. В целом роль вируса гепатита В в индукции гепатоцеллюляриого рака остается невыясненной.
Из бородавок человека (verrucae vulgaris) выделено несколько типов вирусов папиллом, которые, как считают, вызывают лишь доброкачественные опухоли, не склонные к озлокачествлению. Лишь один из этих вирусов (5-го типа) выделен из папиллом, развивающихся при наследственной бородавчатой эпидермодисплазии и имеющих тенденцию к малигнизации.
Онкогены ныне идентифицированы, определена их химическая структура, локализация в хромосомах. Идентифицированы также белки — продукты деятельности этих генов, каждый из них синтезирует свой специфический белок.
Кафедра онкологии и лучевой терапии
Заведующий кафедрой: д.м.н, профессорВельшер Леонид Зиновьевич
Преподаватель: к.м.н, доцентГенс Гелена Петровна
Реферат на тему:
Канцерогенез.
Выполнила: студентка 5 курса,
лечебного факультета (дн.отд.),
Согласно теории Вирхова, патология клетки лежит в основе любой болезни. Канцерогенез - последовательный, многоступенчатый процесс накопления клеткой изменений ключевых функций и характеристик, приводящих к ее озлокачествлению. Клеточные изменения включают нарушения регуляции процессов пролиферации, дифференцировки, апоптоза и морфогенетических реакций. В результате клетка приобретает новые качества: иммортализацию ("бессмертие", т.е. способность к неограниченному делению), отсутствие контактного ингибирования и способность к инвазивному росту. Кроме того, опухолевые клетки получают способность избегать действия факторов специфического и неспецифического противоопухолевого иммунитета организма хозяина. В настоящее время ведущая роль в индукции и промоции канцерогенеза принадлежит генетическим нарушениям. Около 1% генов человека ассоциированы с канцерогенезом.
4 стадии канцерогенеза:
1. Стадия инициации (изменение клеточных онкогенов, выключение генов-супрессоров)
· Фаза метаболической активации( превращение проканцерогенов в канцерогены)
· Фаза взаимодействия с ДНК ( прямой и непрямой генотоксический эффект)
· Фаза фиксации индуцированных изменений (повреждения ДНК должны проявиться в потомстве клеток-мишеней, способных давать пролиферативный пул.)
2. Стадия промоции
I(ранняя) фаза- перестройка фенотипа, происходящая вследствие эпигенетических изменений (т.е. генной экспрессии), индуцированных опухолевым промотором.
Изменение генной экспрессии, что дает возможность клетке функционировать в условиях пониженного синтеза генных продуктов.
II (поздняя) фаза - представляет собой качественно-количественные изменения, охватывающие период функционирования клетки в условиях переключения генной активности, завершающийся образованием неопластически трансформированных клеток (неопластическая трансформация — проявление признаков, характеризующих возможность клеток к неограниченной пролиферации и дальнейшей профессии, т.е. накоплению злокачественного потенциала
3. Стадия прогрессии: разработана L.Foulds в 1969 г. Происходит постоянный стадийный прогрессирующий рост опухоли с прохождением ею ряда качественно отличных стадий в сторону повышения ее злокачественности. В ходе прогрессии опухоли может происходить ее клональная эволюция, появляются новые клоны опухолевых клеток, возникающие в результате вторичных мутаций. Опухоль постоянно изменяется: происходит прогрессия, как правило, в сторону повышения ее злокачественности, которая проявляеются инвазивным ростом и развитием метастазов.
Стадияинвазивной опухолихарактеризуется возникновением инфильтрирующего роста. В опухоли появляются развитая сосудистая сеть и строма, выраженная в различной степени. Границы с прилежащей неопухолевой тканью отсутствуют из-за прорастания в нее опухолевых клеток. Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками.
Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками, о чем свидетельствуют уменьшение количества межклеточных контактов, снижение концентрации некоторых адгезивных молекул из семейства CD44 и других и, наоборот, усиление экспрессии прочих, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом. На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса - ламинину, фибронектину, коллагенам.
Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым ей путь для инвазии. В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в ходе третьей фазыинвазии, а затем процесс повторяется снова.
4. Стадия метастазирования - заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим и кровеносным сосудам, периневрально, имплантационно, что стало основой выделения видов метастазирования. Процесс метастазирования объясняется теорией метастатического каскада, в соответствии с которой опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдаленные органы.
В процессе метастазирования опухолевая клетка должна обладать качествами:
· проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов);
· отделяться от опухолевого пласта в ток крови (лимфы) в виде отдельных клеток или небольших их групп;
· сохранять жизнеспособность после контакта в токе крови (лимфы) со специфическими и неспецифическими факторами иммунной защиты;
· мигрировать в венулы (лимфатические сосуды) и прикрепляться к их эндотелию в определенных органах;
· инвазировать микрососуды и расти на новом месте в новом окружении.
Метастатический каскад условно может быть разделен на четыре этапа:
1. формирование метастатического опухолевого субклона;
2. инвазия в просвет сосуда;
3. циркуляция опухолевого эмбола в кровотоке (лимфотоке);
4. оседание на новом месте с формированием вторичной опухоли.
В настоящее время существует несколько концепций онкогенеза , каждая из которых преимущественно влияет на 1 и(или) 2 этап канцерогенеза
Мутационная теория канцерогенеза
Нормальная клетка превращается в опухолевую в результатеструктурных изменений в генетическом материале, т.е. мутаций. Стало аксиомой представление о многоэтапности процесса канцерогенеза, решающей предпосылкой которого является нерегулируемая экспрессия трансформирующего гена – онкогена, предсуществующего в геноме.
Превращение протоонкогена в активно действующий онкоген обеспечивается следующими механизмами.
1. Присоединение к протоонокгену промотора– участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним . Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR)ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома – мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки
2. Вставка в геном клетки энхансера(enchancer – усилитель) – участка ДНК, способного активизировать работу структурного гена, находящегося не только в непосредственной близости от него, но и на расстоянии многих тысяч пар нуклеотидов или даже встроенного в хромосому после него. Свойствами усилителя обладают подвижные гены, LTR ДНК-копий.
3. Хромосомные абберации с явлениями транслокации,роль которых в механизмах опухолевой трансформации клетки можно проиллюстрировать следующим примером.
При лимфоме Беркитта конец q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный гентуc (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется . Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.
4.Точечные мутации протоонкогена,к примеру, C-H-raS, согласно имеющимся сведениям, отличается от нормального гена (C-H-raS) всего одной аминокислотой, но, тем не менее обусловливает снижение гуанозинтрифосфатазной активности в клетке, что может вызвать рак мочевого пузыря у человека.
· могут модифицировать рецепторы факторов роста
· действовать на ключевые внутриклеточные процессы
Тканевая теория канцерогенеза
Клетка становится автономной, т.к. нарушается тканевая система контроля пролиферации клоногенных клеток, обладающих активизированными онкогенами. Основным фактом, подтверждающим механизм, основанный на нарушении тканевого гомеостаза, является способность опухолевых клеток нормализоваться при дифференцировке.Изучение перевивной ороговевающей карциномы крысы методом автографического анализа показало (Pierce, Wallace, 1971), что раковые клетки при делении могут давать нормальное потомство, то есть злокачественность генетически не закреплена и не наследуется дочерними клетками, как это предполагалось мутационной гипотезой и молекулярно-генетической теорией. Хорошо известны эксперименты по пересадке ядер опухолевых клеток в предварительно энуклеированные зародышевые клетки: в этом случае развивается здоровый мозаичный организм. Таким образом, вопреки представлению о якобы сохранении трансформированных онкогенов в нормализованных опухолевых клетках при дифференцировке, есть основание поставить под сомнение связь генетических нарушений с механизмом трансформации в качестве непосредственной причины.
Вирусная теория канцерогенеза
Основателем вирусной онкологии следует считать Пэйтона Рауса, который в 1911 г. описал куриную саркому, перевиваемую от птицы к птице с помощью бесклеточных фильтратов. Вирус получил название вируса саркомы Рауса.
Чтобы стать злокачественной клетка должна приобрести по крайней мере 6 свойств как результат мутации генов, ответственных за деление клетки, апоптоз, репарацию ДНК, внутриклеточные контакты и т.д. В частности, на пути к приобретению злокачественности клетка, как правило:
1) самодостаточна в плане сигналов пролиферации (что может быть достигнуто активацией некоторых онкогенов, например, Н-Ras);
2) нечувствительна к сигналам, подавляющим ее рост (что происходит при инактивации гена опухолевого супрессора Rb);
3) способна ослабить или избежать апоптоза (что происходит в результате активации генов, кодирующих факторы роста);
4) формирование опухоли сопровождается усиленным ангиогенезом (что может быть обеспечено активацией гена VEGF, кодирующего ростовые факторы эндотелия сосудов;
5) генетически нестабильна;
6) не подвергается клеточной дифференцировке;
7) не подвергается старению;
8) характеризуется изменением морфологии и локомоции, что сопровождается приобретением свойств к инвазии и метастазированию.
Поскольку мутации генов являются событиями случайными и достаточно редкими, их накопление для инициации клеточной трансформации может длиться десятилетиями. Трансформация клетки может произойти гораздо быстрее в случае высокой мутагенной нагрузки и/или дефектности (слабости) механизмов защиты генома (генов p53, Rb, ДНК репарации и некоторых других). В случае же инфицирования клетки онкогенными вирусами, кодируемые вирусным геномом белки, обладающие трансформирующим потенциалом, нарушают номальные клеточные сигнальные связи, обеспечивая условия для активной клеточной пролиферации.
Хорошо известно, что возникновение примерно 15-20% новообразований человека имеют вирусное происхождение. Среди наиболее часто встречающихся таких вирусом индуцированных опухолей можно назвать рак печени, рак шейки матки, рак носоглотки, лимфому Беркитта, лимфому Ходжкина и многие другие. В настоящее время экспертами Международного Агентства по Изучению Рака (МАИР) следующие вирусы рассматриваются в качестве онкогенных для человека:
Вирусы гепатита В и С (Hepatitis B virus и Hepatitis C virus, HBV/ HCV), вызывающие рак печени; В результате генетических перестроек происходит делеция гена X и некоторой части генов PreS2, при этом клетки печени становятся HBsAg-негативными и окончательно уходят из-под иммунологического контроля. Далее происходит селекция клеток, в которых интегрирована ДНК HBV и которые содержат
3 основных транс-активатора, а именно: HBx, LHBs и/или MHBs(t). Транс-активаторы активируют клеточные гены, ответственные за пролиферацию клеток, синтез цитокинов (IL-6) и т.д. Цитокины, секретируемые клетками, содержащими транс-активаторы, создают микроокружение из прилегающих фибробластов, эндотелиальных клеток и др., в свою очередь, выделяющих другие ростовые факторы, стимулирупующие по паракринному типу пролиферацию гепатоцитов. Усиленная пролиферация гепатоцитов может привести к генетическим поломкам, которые будут способствовать селекции клеток с ускоренной пролиферацией и приобретению ими признаков злокачественной трансформации. В опухолевых клетках печени часто имеет место инактивация опухолевых супрессоров р53, Rb, BRCA2 и Е-кадхерина. Отмечена также активация теломеразы в печеночных клетках на стадии их превращения в злокачественные и нарушение функционирования ряда важных сигнальных систем.
Определенные типы (16 и 18) папаломавирусов человека (Human papillomavirus, HPV) — являющихся этиологическим агентом рака шейки матки и некоторых опухолей ано-генитальной сферы; Установлено, что трансформирующими генами являются в основном гены Е6 и Е7, в меньшей степени Е5. Механизм функционирования генов Е6 и Е7 сводится к взаимодействию продуктов этих генов с продуктами 2-х генов супрессоров р53 и Rb и последующей инактивации последних, что приводит к неконтролируемому росту инфицированных клеток.Проведенные исследования показали, что каждый из выше упомянутых 3-х генов латентной HPV инфекции, обладающий трансформирующими потенциями, вносит свой вклад внарушение сигнальных путей клетки, увеличение ее пролиферативной активности и накопление дополнительных генетических изменений. Стоит отметить что созданы терапевтические и профилактические вакцины против ВПЧ. Которые стимулюруют иммунную систему против Е6 и/или Е7 ранних вирусных белков (опухолевых антигенов), препятствующих входу инфицированных клеток в апоптоз и фазу старения, а также генерируют вирус-нейтрализующие антитела, специфические для капсида HPV.
Вирус Эпштейна-Барр (Epstein-Barr virus, EBV), принимающий участие в возникновении целого ряда злокачественных новообразований;Механизм канцерогенеза сложен и мало изучен. В частности, белок LMP1, локализуясь в мембране, имитирует функцию конститутивно активированного рецептора СD40 и частично замещает эту функцию. Привлекая адаптерные молекулы TRAF через домены активации CTAR1 и CTAR2 активирует транскрипционные факторы AP-1 и NFkB и таким образом индуцирует экспрессию генов, регулируемую этими факторами (рецептор эпидермального фактора роста, EGFR, CD40, поверхностные активационные маркеры, молекулы адгезии и т.д.). Кроме того, LMP1 взаимодействует с Jak3-киназой и таким образом активирует STAT-сигнальные пути, стимулирующие размножение и передвижение клеток. LMP2A активирует киназу Akt/PBK, вызывая ряд эффектов, наиболее ярким из которых является подавление апоптоза. EBNA2 имитирует транскрипционную функцию процессированной формы Notch (трансмембранный белок, преобразующий контакты с окружающими клетками в генетические программы, регулирующие судьбу клетки), конститутивная активность которого ведет к развитию лимфоидных и эпителиальных опухолей. Основная функция EBNA1 состоит в обеспечении репликации и поддержания эписомального состояния генома ВЭБ.
Герпесвирус человека 8-го типа (Human herpesvirus type 8, HHV-8), игращий важную роль в возникновении саркомы Капоши, первичной выпотной лимфомы, болезни Кастельмана и некоторых других патологических состояний;
Вирус Т-клеточного лейкоза человека (Human T-cell leukemia virus, HTLV-1), являющийся этиологическим агентом Т-клеточного лейкоза взрослых, а также тропического спастического парапареза и ряда других неонкологических заболеваний.Механизм транс-актививации транскрипции ряда вирусных и клеточных генов (цитокинов, их рецепторов, циклинов и др), ассоциированных с клеточной пролиферацией и способствующих росту инфицированных HTLV-1 клеток. Белок Тах может и транс-репрессировать транскрипции определенных генов, действуя через транскрипционный ко-активатор р300. Тах также инактивирует чекпоинты (сверочные точки) клеточного цикла и ДНК-полимеразу (DNApol), снижая активность всех 3-х систем репарации ДНК и вызывая тем самым генетическую нестабильность, что в конечном итоге приводит к возникновению опухолевой клетки.
Вирус иммунодефицита человека (Human immunodeficiency virus, HIV)— не обладающего трансформирующими генами, но создающего необходимые условия (иммунодефицит) для возникновения рака.
Несмотря на различную организацию онкогенных вирусов человека, неодинаковый спектр их клеток-мишеней, они обладают рядом общих биологических свойств, а именно:
1) вирусы лишь инициируют патологический процесс, усиливая пролиферацию и генетическую нестабильность инфицированных ими клеток;
2) у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
3) после инфицирования до возникновения опухоли имеет место продолжительный латентный период, длящийся годами, иногда десятилетиями;
4) у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой возможностью ее возникновения;
5) для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к селекции наиболее агрессивного опухолевого клона.
Аннотация научной статьи по клинической медицине, автор научной работы — Багдян А.К.
Причины и механизмы возникновения опухолей волнуют человечество не одно столетие. За это время было сформулировано множество теорий онкогенеза : теория раздражения, мутационная, иммунологическая, полиэтиологическая, вирусная, тканевая, теория четырёхстадийного канцерогенеза. Но не одна из них пока не может считаться единственной и общепринятой. Все теории отражают лишь различные стороны одного процесса повреждения генома клетки. В связи с этим много вопросов, касающихся опухолеобразования, всё ещё остаются нерешёнными.Целью работы является стремление привлечь внимание медиков к теории вирусного онкогенеза и подчеркнуть приоритет русских учённых в этом вопросе.Первые публичные высказывания о вирусной природе опухолей принадлежали И.И. Мечникову. В 1909-1910 гг. он утверждал, что раковые заболевания человека обязаны своим происхождением какому-нибудь вирусу, которого пока не обнаружили, но и лишь одного проникновения его в организм недостаточно, так как нужны соответствующие условия, например, хронические поражения тканей. Другой русский учёный Н.Ф. Гамалея в 1930 году впервые предсказал существование и значение эндогенных онковирусов. В 40-х годах ХХ века наш советский академик Л.А. Зильбер разработал вирусно-генетическую теорию опухолей; открыл специфические для опухолевых тканей антигены, исследовал роль онкогенных вирусов. Эти исследования положили начало новой области онкологии иммунологии рака. Они послужили основой для разработки современных диагностических иммунологических методов выявления опухолей и создания современных противоопухолевых вакцин.Так, в настоящее время в ряде стран успешно используется вакцина для профилактики рака шейки матки.
Похожие темы научных работ по клинической медицине , автор научной работы — Багдян А.К.
Bulletin of Medical Internet Conferences (ISSN 2224-6150)
2016. Volume 6. Issue 5
ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России, кафедра клинической иммунологии и аллергологии
Научный руководитель: д.м.н. Лебедева М.Н.
Причины и механизмы возникновения опухолей волнуют человечество не одно столетие. За это время было сформулировано множество теорий онкогенеза: теория раздражения, мутационная, иммунологическая, полиэтиологическая, вирусная, тканевая, теория четырёхстадийного канцерогенеза. Но не одна из них пока не может считаться единственной и общепринятой. Все теории отражают лишь различные стороны одного процесса - повреждения генома клетки. В связи с этим много вопросов, касающихся опухолеобразования, всё ещё остаются нерешёнными.
Целью работы является стремление привлечь внимание медиков к теории вирусного онкогенеза и подчеркнуть приоритет русских учённых в этом вопросе.
Первые публичные высказывания о вирусной природе опухолей принадлежали И.И. Мечникову. В 1909-1910 гг. он утверждал, что раковые заболевания человека обязаны своим происхождением какому-нибудь вирусу, которого пока не обнаружили, но и лишь одного проникновения его в организм недостаточно, так как нужны соответствующие условия, например, хронические поражения тканей. Другой русский учёный Н.Ф. Гамалея в 1930 году впервые предсказал существование и значение эндогенных онковирусов. В 40-х годах ХХ века наш советский академик Л.А. Зильбер разработал вирусно-генетическую теорию опухолей; открыл специфические для опухолевых тканей антигены, исследовал роль онкогенных вирусов. Эти исследования положили начало новой области онкологии - иммунологии рака. Они послужили основой для разработки современных диагностических иммунологических методов выявления опухолей и создания современных противоопухолевых вакцин.
Так, в настоящее время в ряде стран успешно используется вакцина для профилактики рака шейки матки.
1. Большая медицинская энциклопедия: (в 30-ти т. / Б 79 АМН СССР). Гл. ред. Б.В. Петровский. - 3-е издание. Т 17. 1981.
Ключевые слова: онкогенез
Злокачественные новообразования — не редкость в природе: опухолеподобные разрастания тканей (корончатые галлы) описаны у растений, животные — от беспозвоночных (членистоногие, моллюски) и рыб и кончая птицами и млекопитающими — поражаются лейкозами и различными опухолями.
Считается, что неоплазии чаще бывают у домашних и содержащихся в неволе животных, чем в дикой природе, но это оспаривается, так как может быть следствием более внимательного ветеринарного надзора за животными в неволе.
Имеются интересные видовые различия в распространенности злокачественных опухолей: у человека, утратившего такие защитные производные покровов тела, как шерсть, и перешедшего к питанию кулинарно обработанной пищей, чаще встречаются эпителиальные опухоли, в то время как у животных доминируют гемобластозы и саркомы.
Ни для одного новообразования человека не доказана прямая заразность, в то время как некоторые неоплазии животных (болезнь Марека у кур, инфекционная саркома наружных половых органов у собак, рак молочной железы у мышей) — контагиозны.
Изложение основ этиологии и патогенеза опухолевого роста является необходимым и важным разделом общей онкологии. В настоящее время, благодаря успехам молекулярной биологии, механизмы канцерогенеза, в основном, изучены. Знакомство с его основами составляет важную часть профессиональной эрудиции врача любой специальности.
Интересно отметить, что почти все изложенные ниже основы различных ранее предложенных теорий органически вписываются в рамки современной синтетической теории этиологии и патогенеза рака и, принципиально, не противоречат друг другу.
Теория эмбриональной дистопии
Теория эмбриональной дистопии [Конгейм, 1882] стала первой научной теорией опухолевого роста. По ее версии, злокачественная опухоль — результат своеобразной формы дизэмбриогенеза.
В организме сохраняются дистопированные дремлющие клетки эмбриональных зачатков, которые могут под воздействием различных экзогенных и эндогенных стимулов переходят в активное пролиферирующее состояние, ведущее к развитию опухоли.
Данная теория имеет множество очевидных подтверждений. Это и эмбриоподобный вид многих неопластических клеток с выраженной степенью их анаплазии, и эмбриоподобный тип биохимических аномалий (энергетический обмен), и частая локализация рака (например, базальнокпеточного) у мест контакта производных различных эмбриональных зачатков и листков.
С позиций данной теории признается большое значение не только пренатальных, но и постнатапьных дистопий зародышевых клеток, то есть решающей роли высвобождения группы клеток зачатка из-под физиологических ростоингибирующих влияний, что иллюстрируется, например, возникновением невусов и меланом.
Важным в теории является положение, что существует необходимость экспрессии (активации) протоонкогенов, как в эмбриогенезе, так и при развитии рака, что хорошо встраивается в современную теорию опухолевого роста.
Теория хронического неспецифического раздражения
Теория хронического неспецифического раздражения [Вирхов, 1885] постулирует: там, где клетки повторно повреждаются и регенерируют — возникает повышенный риск рака. По данной теории повреждающими факторами могут быть механическое раздражение (Вирхов) и признанные в настоящее время химические и иные немеханические агенты (канцерогены).
Принципиально важно, что теория Вирхова вводит представление о полиэтиологичности рака. Как и предсказывал Вирхов, роль хронических пролиферативных воспалительных процессов, как фактора риска рака, достаточно велика. В ходе воспаления при повреждении ядра и клетки стимулируется экспрессия протоонкогенов.
Повреждение может иметь разные последствия (рак или гиперплазия и регенерация), в зависимости от генетического состояния клеток-мишеней и/или индуцированных в них генетических изменений.
Многочисленные доказательства теории Вирхова включают данные по эпидемиологии профессиональных форм рака (рак кожи мошонки у трубочистов, кожи рук у рентгенологов и др.). Теория раздражения легла в основу представлений, ставящих на первое место в этиологии неоплазии действие тех или иных конкретных канцерогенных факторов.
В настоящее время, по оценке ВОЗ, в основе 90% случаев рака лежит тот или иной внешний повреждающий фактор. Уже сам этот факт свидетельствует о ценности прародительницы современных концепций — теории неспецифического раздражения.
Теория трансплацентарного канцерогенеза
Теория трансплацентарного канцерогенеза, т.е. индукции опухолей у потомков в результате действия канцерогенных веществ на их матерей в период беременности, является общепризнанным фактом.
Действительно, через плаценту проходят почти все лекарственные препараты, применяемые в акушерской практике. Известно более 60 соединений, вызывающих трансплацентарный канцерогенный эффект в опытах на животных.
Есть работы, основанные на большом статистическом материале, указывающие на трансппацентарное воздействие табака, алкоголя на потомство. Так, у курящих женщин дети заболевали в два раза чаще, чем у некурящих.
Трансплацентарно действуют некоторые применяемые в сельском хозяйстве пестициды. Имеются данные о трансплацентарной индукции опухолей у цетей под влиянием противоэпилептического препарата дифенина.
Трагический эксперимент был поставлен жизнью. В США в 70-е годы было зарегистрировано более 500 случаев рака влагалища у девочек и девушек (15-20 лет), матери которых во время беременности принимали синтетические эстрогены (стильбестроп, диэтилс-тильбестроп). В связи с этим, очевидна необходимость тщательной проверки всех веществ и препаратов, с которыми контактирует беременная женщина.
Полевая теория опухолевого роста
Полевая теория опухолевого роста [Уиллис, 1951] развилась на основных идеях теории Вирхова и формально противостоит теории моноклонального возникновения опухолей, которая в настоящее время стала доминирующей.
В основе полевой теории лежит положение, что хронические пропиферативные воспалительные процессы, как факторы риска, формируют поле (зону) в органе, где и происходит развитие опухоли. При этом на опухолевом поле могут сосуществовать опухолевые зачатки, находящиеся одномоментно на разных стадиях онкогенеза и дающие начало мупьтицентрическому развитию рака.
Сейчас предлагается объяснение, основанное на том, что в ткани, испытывающей канцерогенные влияния, «возможно параллельное (и не всегда одновременное) возникновение нескольких трансформированных клеток — источников возникновения нескольких опухолевых клонов.
Теория химического канцерогенеза
Теория химического канцерогенеза также сформировалась, по мере развития индустриального общества, в русле вирховской концепции.
Теория начала развиваться с 1775 года, когда английский врач P. Pott описал опухоли мошонки у трубочистов. Развитие профессиональной гигиены и индустрии дало много новых тревожных свидетельств в пользу теории химического канцерогенеза. Но решающую роль в признании вклада данной теории в онкологию имело создание химической экспериментальной модели злокачественной опухоли.
В 1918 году японские исследователи Ямагива и Ишикава получили рак кожи у мышей и кроликов, которым в течение нескольких месяцев наносили на кожу угольный деготь. С этого момента начинаются систематические исследования в области химического канцерогенеза.
Теория физического канцерогенеза
Основу ее формируют положения, отводящие этиологическую роль в развитии рака различным физическим воздействиям на ткани. Исторически наиболее ранними являются наблюдения о роли механических повреждений в канцерогенезе (например, рак кожи большого пальца у закройщиков и др.).
Постепенно накапливались эпидемиологические и экспериментальные свидетельства о возможности развития рака при различных видах ионизирующих излучений, инсоляции, длительном тепловом воздействии.
Инфекционно-паразитарная теория канцерогенеза
Впервые идею об инфекционной этиологии опухолей выдвинули исследователи бильгарциоза — паразитарного заболевания, вызываемого печеночной двуусткой. В местах локализации в организме человека яиц двуустки с высокой частотой отмечаются рак и саркомы.
В экспериментах установлена связь между цистицеркозом и саркомой печени крыс, спироптерой и плоскоклеточным раком желудка или языка. Предполагается, что с паразитами в организм попадают опухолеродные вирусы или другие канцерогены, которые на фоне вызываемой паразитами иммуносупрессии, способствует развитию рака.
Вирусная теория канцерогенеза
Приоритет формулировки предположения о вирусном онкогенезе принадлежит французским авторам Борелю и Боску (1903), дальнейшая разработка проблемы — Раусу (1910), Люке (1934), Биттнеру (1936) и др., рассматривающими связь между вирусами и раком как чисто инфекционную.
Огромное значение в развитии вирусной теории онкогене за имели работы выдающегося российского вирусолога Г.Ш. Зильбера, превратившие ее инфекционный вариант в вирусо-генетический, делающий упор на интегративном взаимодействии опухолеродногo вируса с определенными участками генома клеток-мишеней.
Современная теория канцерогенеза может быть названа синтетической, поскольку на роль этиологических факторов, вызывающих генетические повреждения (мутации), как единой основы канцерогенеза, могут претендовать все факторы, выдвигавшиеся различными ранними теориями как исключительная причина рака.
Таким образом, и химическая, и лучевая, и вирусная, и другие теории этиологии рака имеют право на существование, как частные случаи современной концепции, т.е. злокачественные новообразования рассматриваются сейчас как истинно полиэтиологические заболевания.
При всем широком разнообразии макро- и микроскопических признаков, ультраструктурных, биохимических, иммунологических и генетических параметров, характеризующих новообразования, последние развиваются по определенным общим законам возникновения и роста.
Прежде чем обратиться к анализу причин и механизма развития злокачественных новообразований, представляется целесообразным изложить главные концептуальные принципы современной онкогенно-антиокогенной теории канцерогенеза.
Концептуальные принципы современной онкогенно-антиокогенной теории канцерогенеза
1. В основе современной модели канцерогенеза лежит концепция онкогенов (протоонкогенов) и антионкогенов (генов-супрессоров), что стало переломным этапом в понимании механизмов развития рака.
Установлено, что ведущую роль в формировании опухоли играют два класса нормальных регупяторных генов: протоонкогены — активаторы пролиферации и дифференцировки клеток и супрессорные гены (антионкогены) — ингибиторы этих процессов. В последнее время выделяют третий класс онкоассоциированных генов, к которым относят мутаторные гены.
2. Пусковым и обязательным событием в канцерогенезе являются нелетальные повреждения протоонкогенов и генов-супрессоров в виде их структурных изменений. Последствиями таких генетических повреждений (мутаций) является активация онкогенов и инактивация генов-супрессоров и мутаторных генов.
В результате мутаций возникают нарушения баланса между ними, происходит утрата контроля за нормальным клеточным ростом, дифференцировкой и пролиферацией, которые, в конечном счете, приводят к злокачественной трансформации клетки и развитию новообразования.
3. Малигнизированный клон, как таковой, не возникает путем однократного мутационного собьпия. Активации одного онкогена или, наоборот, потери функции одного антионкогена, недостаточно для превращения нормальной клетки в опухолевую.
На основании математического моделирования предполагается, что для превращения нормальной клетки в опухолевую требуется от 5 до 7 независимых случайных мутаций как минимум в 4-5 генах (протоонкогенах. генах-супрессорах) тогда как доброкачественные onyxоли могут развиваться в результате мутации 1-2 генов.
Условие состоит в том, чтобы оба события совпали в одной и той же клетке. Только при этом нормальная клетка становится раковой. На деле, при возникновении конкретного опухолевого клона для реализации конечного результата необходимо гораздо большее количество мутационных шагов. Каждая опухоль, таким образом, имеет свой генетический портрет, который и определяет ее свойства.
4. Происхождение мутантных генов, участвующих в канцерогенезе может быть различным. Повреждения онкогенов и генов-супрессоров в соматических клетках организма могут быть следствием воздействия на человека различных экзогенных и эндогенных факторов.
В этом случае они не наследуются, но определяют трансформацию именно той клетки, которая их приобретает. Большинство известных раков относится к данному типу. Повреждения, затрагивающие потенциальные онкогены (антионкогены), могут быть в половых клетках.
В этом случае они наследуются через половинный набор хромосом одного из родителей, создавая предпосылки для реализации наследуемых семейных форм рака (наследственной предрасположенности к раку).
5. Раковая клетка передает свою аномальность по наследству своим дочерним клеткам через механизмы генетического классического наследования. Поэтому, с позиций молекулярной генетики, рак является генетическим заболеванием (заболеванием генома клетки!), вызванным изменениями в протоонкогенах (или генах-супрессорах).
В связи с этим, часто обсуждаемый вопрос канцерогенеза — эпидемиологический. Очевидно, поскольку опухоль — генетическая болезнь — она незаразна.
6. Пролиферация является необходимым компонентом процесса канцерогенеза. Она может быть результатом генетических изменений в клетке, или связана с другими физиологическими или патологическими процессами и предшествовать изменению в геноме.
Репликация ДНК в пролиферирующих клетках делает их более чувствительными к мутациям. В активно делящихся клетках увеличивается также вероятность спонтанных мутаций, поэтому пролиферация может быть охарактеризована как ранняя стадия канцерогенеза. Не делящаяся, дифференцированная клетка не озлокачествляется.
7. Генетическая концепция канцерогенеза подразумевает, что популяция опухолевых клеток — это результат размножения, начавшийся от одной клетки — родоначальницы клона, претерпевшей опухолевую трансформацию. В этом состоит смысл представления о моноклональном развитии злокачественных опухолей.
8. В настоящее вреин канцерогенез понимается как стадийный, ступенчатый процесс, в основе которого лежит концепция инициации, промоции и прогрессии. Согласно этой концепции, в результате инициации клетка претерпевает необратимые изменения генотипа, которых, однако, недостаточно для ее превращения в опухолевую.
На стадии промоции в клетке происходят процессы, приводящие к формированию опухолевого фенотипа, т.е. превращению инициированной клетки в злокачественную. В основе прогрессии опухоли (теория Foulds) лежит процесс наращивания злокачественных свойств опухолевых клеток путем отбора соответствующих клонов.
Переход от одной стадии канцерогенеза к другой (последующей или предыдущей) происходит в результате воздействия экзогенных и эндогенных факторов, которые могут, как способствовать, так и противодействовать этому процессу.
9. Важную роль в реализации мутаций и канцерогенеза играют также факторы риска и антириска. Имеется в виду роль возраста, попа, питания, вредных привычек, наследственности, социально-географических и природно-этнических факторов.
Доказано, что факторы образа жизни и окружающей среды являются основной причиной развития 90-95% злокачественных опухолей человека. Около 80 веществ и сложных смесей являются канцерогенными для человека. Не вызывает сомнений роль онкогенных вирусов, некоторых бактерий и паразитов, ультрафиолетовой и ионизирующей радиации в этиологии рака.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Читайте также:


