Вирусные инфекции в онкогематологии
Большинство людей называет лейкоз раком крови, а лимфому раком лимфоузлов, но эти злокачественные процессы совсем не рак и не имеют отношения к онкологии, ими занимаются онкогематологи.
Что такое онкогематология?
Онкогематологические заболевания
Все онкогематологические заболевания происходят из разных клеток крови и костного мозга, по-разному протекают и лечатся, обещая неодинаковый исход. Большое число разнородных болезней объединяет злокачественная природа и четкая клональность — поражение только определенной популяции клеток.
Лимфомы или лимфосаркомы представлены множеством видов новообразований лимфоидной ткани и начинают свой рост в лимфоузлах, постепенно захватывая новые зоны и соседние ткани, циркулируя в кровеносном и лимфатическом русле. Лимфома Ходжкина наиболее благоприятна по течению и может излечиваться, неходжкинские лимфомы многообразны проявлениями и степенью агрессивности.
Миелома по биологической сути — хронический лейкоз, возникший из синтезирующих специфический белок плазматических клеток костного мозга. Она имеет типичные проявления с преимущественной локализацией опухолевых узлов в костях скелета.
Причины возникновения онкогематологических заболеваний
Предрасполагают к мутациям: облучение и использование цитостатиков, длительный профессиональный контакт с химическими реагентами, в частности, с бензолом, а каждый пятый случай острого миелолейкоза связывают с курением.
Симптомы
Злокачественная трансформация проявляется:
- замещением лимфатических узлов опухолью и неконтролируемым их ростом с внедрением в окружающие ткани;
- инфильтрацией лимфатических сосудов в коже и органах лейкозными клетками;
- образованием опухолевых клеточных конгломераций в костном мозге, что вызывает боли и деформацию костей с переломами;
- пропитыванием злокачественными клетками тканей головного мозга — нейролейкемией.
Замещение нормальных клеток крови и костного мозга злокачественными проявляется иммунодефицитом и ассоциированными с ним симптомами цитопении:
- склонностью к местным и генерализованным инфекциям с постоянной лихорадкой;
- слабостью и утомляемостью вследствие анемии, а также недостаточностью функциональных возможностей органов из-за кислородного голодания;
- повышенной кровоточивостью при снижении численности тромбоцитов.
При каждом заболевании отмечается свой набор симптомов, прогрессирующих без активного лечения и в конечном итоге приводящих к смерти.
Способы диагностики
Кроме большого числа анализов крови при трепанобиопсии для исследования берется костный мозг, причём изучение состояния костномозгового кроветворения проводится при первичной диагностике, в процессе лечения и после завершения терапии. Проводится иммунологическое типирование и генетическое тестирование клеток мозга. Из костномозговых клеток выделяют генетический материал в виде ДНК и РНК и сохраняют его для последующих молекулярных исследований.
Для будущей трансплантации стволовых клеток после высокодозной химиотерапии проводят HLA-типирование больного и его ближайших родственников на возможное донорство костного мозга.
Для выявления злокачественного поражения центральной нервной системы проводится люмбальная пункция и исследуется состав спинномозговой жидкости.
Инструментальная диагностика включает рентгеновское, КТ и МРТ обследование, определение функциональных возможностей органов перед проведением агрессивной химиотерапии.
Лечение онкогематологических заболеваний
Химиотерапия проходит по стандарту: индукция (подготовка) ремиссии несколькими курсами, консолидация — закрепление эффекта и многолетняя поддерживающая монотерапия. При вероятности поражения головного мозга проводится профилактика нейролейкемии — введение цитостатика в спинномозговую жидкость.
Проводимая после индукции высокодозная химиотерапия в несколько раз повышает эффективность лечения. Завершается лечение пересадкой стволовых клеток, которые набираются у пациента до начала ХТ или предоставляются донором.
При лимфомах и миеломе по опухолевым зонам проводится лучевая терапия. Хирургическое лечение не актуально при большинстве процессов.
Прогноз при онкогематологических заболеваниях
Перспектива на жизнь определяется заболеванием, его чувствительностью к лекарствам и адекватностью терапии. Сегодня многие процессы, если не окончательно вылечиваются, то переходят в хроническую форму, позволяя активно жить и работать.
Химиотерапия онкогематологического заболевания много агрессивнее, чем используется в онкологии, часто проходит за гранью возможностей человеческого организма, а выхаживание после пересадки требует исключительного профессионализма, но специалисты нашей клиники неоднократно делом доказывали своё мастерство.

Оногематология – это раздел медицины, изучающей опухоли кроветворной системы или гемобластозы. В круг интересов онкогематологии также входят предраковые миелодисплазии. Данная область науки занимается изучением этиологии, патогенеза, клиники злокачественных опухолей крови, а также разрабатывает новые методы их лечения.
Содержание:
Гематобластозы
К гемоблатозам относят такие распространенные виды опухолей кроветворной системы как лейкозы, лимфомы, эритромиелоз. В основе всех гемобластозов лежит малигнизация стволовых клеток. Эти клетки, находящиеся в костном мозге, дают начало всем клеточным элементам крови. При воздействии патологического фактора на одну единственную клетку-предшественницу в последствии образуется целое поколение мутантных эритроцитов, лейкоцитов. Такие клетки не способны к дифференцировке, то есть не могут качественно выполнять свои функции. Также для мутантных клонов клеток характерна увеличенная продолжительность жизни и время деления. Однако некоторые же клетки, напротив, обладают сниженной продолжительностью цикла деления и за очень короткое время воспроизводят огромное число себе подобных. При этом происходит угнетение нормальных ростковых клеток и неизмененные клетки-предшественницы просто не имеют возможности размножаться.
В развитии гемобластозов можно выделить две стадии. В первую из них, моноклоновую, существует один клон клеток опухоли. Патологический процесс является доброкачественным. На второй стадии развития заболевания появляется множество клонов патологических клеток. При этом происходит такой отбор клеточных популяций, что наибольшему размножению подвергаются те клетки, которые наиболее автономны. Такие клоны не подвергаются влиянию регуляторный механизмов человеческого организма, например, гормональным воздействиям.
Постепенно зрелые клетки крови замещаются на созревающие, бластные. В таком случае лейкоз называется бластным и развивается гематосаркома. Клетки опухоли постепенно утрачивают присущий нормальным клеткам набор ферментов. Изменяется и их форма. Лейкоциты эритроциты, бласты приобретают размытые очертания, увеличивается площадь их поверхности.
Факторы риска развития гемобластозов
Точная причина появление опухолей кроветворной системы до конца не установлена, однако можно назвать факторы, играющие большую роль в патогенезе данных заболеваний:
- Наследственная предрасположенность – выявляется зависимость между возникновением гемобластозов и рядом наследственных заболеваний, связанных мутациями хромосом. К таких болезням относятся, например, синдром Висскотта-Олдриджа, болезнь Братона, синдром Луи-Бера;
- Мутагенные факторы эндогенного (из внутренней среды организма) и экзогенного (из внешней среды) происхождения;
- Вирусная инфекция – способна предрасполагать к развитию гемобластозов. К таким вирусам специалисты относят вирус Эпштейн-Барра, Т-лимфоцитарный вирус лейкоза;
- Интоксикации химическими веществами с канцерогенным эффектом – это могут быть соединения органических растворителей, бензолов и других токсических веществ. Также гемобластозы могут возникать под влиянием некоторых лекарственных препаратов. В частности к таким лекарственным средствам относят цитостатики, обладающие угнетающим действием на пролиферацию как клеток опухолей, так и клеток здоровых тканей;
- Мутагенным действие обладает и ионизирующая радиация. Патогенное воздействие на организм человека может оказывать рентгеновское облучение, ультрафиолетовая радиация солнца. Получить предпосылки к развитию злокачественного заболевания крови человек может во время прохождения курса лучевой терапии по поводу злокачественного заболевания другой локализации.
Лечение гемобластозов в Израиле
Диагностика гемобластозов включает тщательное изучение анализа кроив, пунктата костного мозга. Далее определяется план лечение, основная задача которого – подавить патологический опухолевый клон клеток. С этой целью во всем мире применяются цитостатические препараты. Как уже говорилось, подбор препарата для каждого конкретного пациента представляет собой нелегкую задачу, с которой великолепно справляются израильские врачи. Эффективная терапия позволяет вызвать наступление ремиссии заболевания. В дополнение к цитостатикам нередко применяется кортикостероидная терапия, переливание компонентов крови (тромбоцитарная, лейкоцитарная масса). При выраженных положительных изменениях в миелограмме доза препаратов снижается до поддерживающей. Чаще применяется полихимиотерапия, использующая сочетание нескольких цитостатических препаратов для полной эрадикации патологического клона клеток.
Эффективным методом лечения гемобластозов является пересадка костного мозга. При этой процедуре очень важен подбор донора, совместимого с пациентов по HLA-системе антигенов. Самым лучшим вариантом является пересадка костного мозга от братьев или сестер. В предоперационном периоде и после пересадки проводится химиотерапия, лучевая терапия, направленные на предотвращение реакции отторжения трансплантанта. Пересадка костного мозга позволяет достичь выраженной ремиссии заболевания у большинства пациентов.
Большое значение у больных гемобластозами имеет противоинфекционная терапия, направленная на лечение и профилактику бактериальных, вирусных, грибковых заболеваний. С этими целями назначаются антибактериальные, противовирусные, антимикотические препараты. Такое лечение помогает поддержать ослабленный организм пациентов.
Онкогематология – это важнейший раздел медицины, занимающийся лечением онкологических заболеваний крови.
Онкогенные вирусы представляют собой группу неродственных вирусов (табл. 22.1), способных вызывать персистирующую инфекцию в клетках организма человека, приводящую к их трансформации (иммортализации). Трансформированные клетки приобретают новые свойства — высокую скорость размножения, способность к бесконтрольному неограниченному делению, утрачивают чувствительность к сигналам, ингибирующим размножение, включая контактное ингибирование. Происходит изменение их морфологии и метаболизма. Появление трансформиро-
 |
| 22.1. Онкогенные вирусы и вирус иммунодефицита человека |
| СЕМЕЙСТВО Herpesviridae ПОДСЕМЕЙСТВО Gammaherpesvirinae РОД Lymphocryptovirus вирус Эпштейна—Барр (EBV) |
| РОД Rhadinovirus герпесвирус человека 8-го типа Саркома Капоши (HHV-S) СЕМЕЙСТВО Hepadnaviridae вирус гепатита В (HBV) СЕМЕЙСТВО Retroviridae РОД Deltaretrovirus Т-лимфотропные вирусы человека типов 1, 2, 5 (HTLV-1, HTLV-2, HTLV-5) |
| ванных клеток в организме может в конечном итоге привести к возникновению злокачественного новообразования. Папилломавирусы человека (HPV) — просто устроенные ДНК-содержащие вирусы с изометрическим типом симметрии капсида. К настоящему моменту известно более 70 типов HPV, которые дифференцируют на основании первичной последовательности ДНК. HPV поражают эпителиоциты кожи и сли- |
Таблица (ВИЧ)
HPV-16, HPV-18 и др.
вирусы иммунодефицита человека (ВИЧ) 1-го, 2-го типа (HIV-l, HIV-2)
Доброкачественные папилломы различных локализаций, опухоли кожи и слизистых оболочек верхних дыхательных путей, гениталий (рак шейки матки)
Поражения почек (см. также главу 21)
Мультифокальная прогрессирующая лейкоэнцефалопатия (см. также главу 19)
Т-клеточные лейкозы/лимфо-мы, эндемическая лимфома Беркитта, карцинома носоглотки
Острый Т-клеточный лимфо-цитарный лейкоз/лимфома, тропический спастический паралич (см. также главу 19)
ВИЧ-инфекция/Синдром приобретенного иммунодефицита (ВИЧ/СПИД)
зистых оболочек, преимущественно респираторного и гени-тального Тракта. ЯРКявляются возбудителями доброкачественных разрастаний — папиллом (бородавок) ладоней и ступней (чаще HPV типов 1, 2, 3, 4), ротовой полости и гортани (чаще HPV6 и 11-го типов), наружных половых органов — condyloma acuminatum (HPV 6, 11, 42—44-го типов). С ЯРК-инфекцией также связывают развитие ряда злокачественных новообразований: шюскоклеточного рака кожи, кератокарциномы, мела-номы — в клетках этих опухолей в некоторых случаях удается обнаружить HPV типов 37, 38, 41 и 48, интраэпителиальные неоплазии генитального тракта (шейки матки, вульвы, полового члена) ассоциированы преимущественно с ЯРКтипов 6, 11, 16 и 18. Наиболее высоко онкогенными являются HPVтипов 16 и 18. Эти вирусы в 90—100 % случаев обнаруживаются в опухолевых клетках при карциноме шейки матки и выявляются при раке прямой кишки и карциноме носоглотки и гортани.
Полиомавирусы вызывают опухоли у лабораторных животных. У человека представители этого рода — вирусы ВК (BKV) и JC (JCV) — вызывают пожизненную бессимптомную латентную персистирующую инфекцию. Заболевания развиваются только на фоне иммунодефицита. BKV является возбудителем геморрагического цистита (см. главу 21). JCV вызывает развитие медленной инфекции — мультифокальной лейкоэнцефало-патии (см. главу 19).
Вирус Эпштейна—Барр является возбудителем инфекционного мононуклеоза (см. главу 21) и вызывает пожизненную бессимптомную латентную инфекцию, персистируя в незрелых В-лимфоцитах. Латентная инфекция сопровождается трансформацией В-лимфоцитов. При недостаточном защитном клеточном иммунитете бесконтрольная пролиферация трансформированных В-лимфоцитов может привести к развитию злокачественной опухоли — лимфомы. Специальная лабораторная диагностика не проводится.
Герпесвирус человека 8-го типа (ЯЯК-8) вызывает пожизненную бессимптомную латентную инфекцию. С его реактивацией на фоне иммунодефицита (СПИД, возраст старше 60 лет) связывают развитие сосудистой опухоли — ангиосар-комы Капоши. Специальная лабораторная диагностика не проводится.
Вирус гепатита В является возбудителем вирусного гепатита В (см. главу 20). В случае хронической активной формы заболевания через 10—35 лет может развиться первичный рак печени. Более чем в 80 % случаев в опухолевых клетках обнаруживают дефектные провирусы. Специальная лабораторная диагностика не проводится.
Среди онкогенных ретровирусов связь с опухолями человека установлена только для Т-лимфотропного вируса человека 1-го типа — HTLV-1. Вирус вызывает пожизненную бессимптомную

латентную инфекцию, персистируя в Т-лимфоцитах; хелперах (CD4 + ). Заболевания — острый Т-клеточный лимфо;цитарный лейкоз/лимфома или тропический спастический йаралич — развивается менее чем в 5 % случаев и имеет длительный инкубационный период.
Вирусы иммунодефицита человека 1-го и 2-го типа (ВИЧ-1 и ВИЧ-2) являются возбудителями медленной инфекции с длительным инкубационным (латентным) периодом от 3 до 10 лет и более. Первичная инфекция может протекать бессимптомно или с неспецифическими гриппоподобными проявлениями. После длительного латентного периода у ВИЧ-инфицированных лиц развивается синдром приобретенного иммунодефицита (СПИД), который характеризуется снижением содержания в крови CD4 + Т-лимфоцитов (менее 500/мм 3 ) и разнообразными клиническими проявлениями, включая СПИД-ассоциированные оппортунистические инфекции и опухоли. Для предотвращения распространения и своевременного начала лечения первостепенное значение имеет ранняя диагностика ВИЧ-инфекции. В общей стратегии лабораторного обследования с целью выявления ВИЧ/СПИД существуют следующие направления: обследование больных с клинической картиной СПИД или СПИД-ассоциированных заболеваний (оппортунистических инфекций и опухолей); обследование здоровых лиц, контактировавших с больными (половые контакты, мать—ребенок и др.); обследование беременных, рожениц и лиц при плановой госпитализации; анонимное обследование всех желающих. Строго обязательным является обследование доноров крови, спермы, костного мозга и других с целью выявления потенциальных источников инфекции и предотвращения ят-рогенного заражения.
Тема 22.1. МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ИНФЕКЦИЙ, ВЫЗВАННЫХ ОНКОГЕННЫМИ ВИРУСАМИ ЧЕЛОВЕКА И ВИРУСАМИ ИММУНОДЕФИЦИТА ЧЕЛОВЕКА
1. Биологические свойства онкогенных вирусов. Вирусные и клеточные онкогены и антионкогены. Роль онкогенных вирусов в патогенезе злокачественных новообразований человека.
2. Биологические свойства ВИЧ. Экология ВИЧ и эпидемиология ВИЧ-инфекции, группы риска. Патогенез, диагностика, принципы профилактики и лечения ВИЧ/СПИД. СПИД-ассоциированные оппортунистические инфекции.
1. Ознакомиться с бланками направлений на исследование в вирусологическую лабораторию.
2. Указать материал для диагностики ВИЧ-инфекции.
3. Ознакомиться с тест-системами для серодиагностики ВИЧ-инфекции.
4. Оценить результаты серодиагностики ВИЧ-инфекции методом ИФА и наметить план дальнейшего обследования.
• Микробиологическая диагностика инфекций, вызванных
HPV
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: мазок-соскоб или биоптат из пораженного участка кожи или слизистой оболочки.
Цитологический метод — обнаружение измененных клеток с признаками ЦПД (коилоциты).
Вирусоскопический метод — обнаружение зрелых вирусных частиц в зараженных клетках. Этот метод позволяет обнаружить вирусы только в случае их репродукции. В опухолевых клетках присутствуют дефектные вирусы, не способные к репродукции.
Вирусологический метод — не применяют в связи со сложностью культивирования вируса.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические методы. Иммунохимические исследования. Обнаружение вирусных антигенов в зараженных клетках методом ИФ.
Молекулярно-биологические исследования. Обнаружение вирусных ДНК в зараженных клетках — метод ДНК-зондов (ДНК-гибридизация in situ), ПЦР. Эти методы позволяют диагностировать латентную инфекцию и присутствие дефектных вирусов.
Серодиагностика. С целью диагностики ЯРК-инфекции выявляют антитела к белкам капсида и вирусным онкогенам.
• Микробиологическая диагностика инфекций, вызванных BKV
и JCV (см. главу 21 и главу 19 соответственно)
• Диагностика инфекций, вызванных HTLV
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
Серодиагностика — обнаружение антител к вирусным белкам — применяют для выявления вирусоносительства и лабораторной диагностики тропического спастического паралича (см. также главу 19).
 |
 |
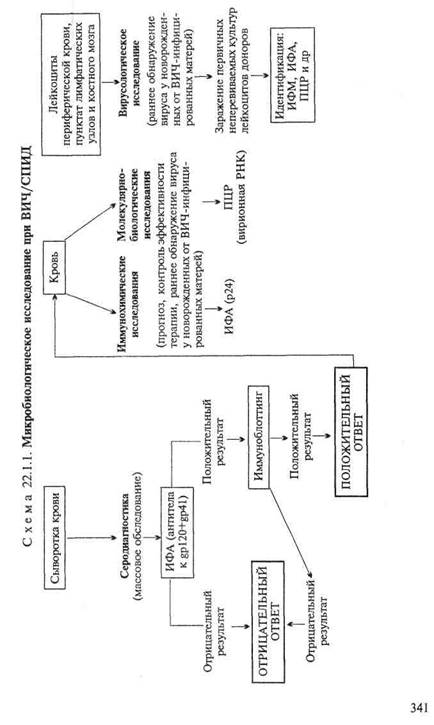 |
• Микробиологическая диагностика ВИЧ-инфекции
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, лейкрциты периферической крови, пунктат лимфатических узлов и костного мозга. Вирус также может быть обнаружен в отделяемом слизистых оболочек генитального тракта, сперме, слюне, слезной жидкости, грудном молоке, спинномозговой жидкости, в трупном материале.
Вирусологический метод(схема 22.1.1). Выделение вируса из крови и лейкоцитов в связи со сложностью культивирования в клинической практике используется редко. Основным показанием к применению является раннее обнаружение вируса у новорожденных от ВИЧ-инфицированных матерей. Вирус выделяют путем совместного культивирования мононуклеарных лейкоцитов периферической крови пациента с лейкоцитами здоровых доноров в присутствии IL-2 для стимуляции роста Т-лимфоцитов. ЦПД проявляется образованием синцития и лизисом зараженных клеток. Метод позволяет выявить латентную инфекцию. О присутствии вируса судят по результатам определения специфических антигенов ВИЧ (р24, обратной транскриптазы) в культуральной среде и зараженных клетках. Культивирование ВИЧ требует соблюдения специальных условий безопасности при работе.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические методы.Иммунохимические исследования. Обнаружение вирусных антигенов (р24) в крови и лимфоцитах с помощью ИФА. Следует учитывать, что р24 в достаточном для выявления количестве присутствует в крови только при первичной инфекции и на поздних стадиях заболевания.
Молекулярно-биологические исследования. Обнаружение РНК вирусов в крови методом RT-ПЦР. Метод основан на преобразовании вирусной РНК в комплементарную ДНК (кДНК) с использованием фермента обратной транскриптазы (RT) и амплификации полученной кДНК методом ПЦР — применяется для определения уровня вирусемии. Чувствительность метода позволяет обнаруживать вирус в малых концентрациях.
Серодиагностика.Обнаружение антител к вирусным антигенам (поверхностным белкам gpl20) — методы ИФА — применяют для массового обследования. В случае положительного результата с целью верификации осуществляют поиск антител к индивидуальным вирусным белкам методом иммуноблоттин-га, непрямой ИФ и другими методами.
Метод иммуноблоттинга ("вестерн-блот") — тестирование сыворотки на наличие антител против отдельных вирусных



антигенов сердцевины и поверхностной оболочки ВИЧ.Вирусные белки с помощью электрофореза в вертикальном блоке полиакриламидного геля разделяют по молекулярной массе и переносят на нитроцеллюлозную мембрану, где антитела сыворотки реагируют с индивидуальными вирусными белками. Образующиеся иммунные комплексы выявляются авторадио-графически или с помощью ИФА.
Для косвенного подтверждения диагноза СПИД могут быть использованы методы оценки иммунного статуса: определение общего количества лимфоцитов, Т-лимфоцитов, соотношения CD4 + /CD8 + Т-лимфоцитов, количества натуральных киллеров, уровней сывороточных иммуноглобулинов. Для СПИД характерно развитие Т-клеточного дефицита: снижение количества Т-лимфоцитов, преимущественно Т-хелперов CD4 + (менее 500/мм 3 ), снижение уровня показателя CD4 + /CD8 + ниже 1,0; уменьшение количества натуральных киллеров; умеренная поликлональная гипергаммаглобулинемия с увеличением содержания IgG.
• Диагностические, профилактические и лечебные препараты
Тест-системыдля диагностики ВИЧ/СПИД методом ПЦР.
Тест-системыдля серодиагностики ВИЧ/СПИД методом ИФА.
Тест-системыдля диагностики папилломавирусной инфекции методом ПЦР.
Ингибиторы обратной транскриптазы:азидотимидин (AZT), ди-дезоксиинозин (DDI), дидезоксицитидин (DDC), невирапин и др.
Ингибиторы протеазы:саквинавир, ритонавир, индинавир, нелфинавир и др.
Препараты для иммунотерапии:интерферон человеческий лейкоцитарный; интерферон рекомбинантный.












Место ПЦР в лабораторной диагностике вирусных инфекций в рутинной практике
Лабораторная диагностика актуальна для пациентов с иммунодефицитом. У пациентов с гемобластозами он возникает на фоне основного заболевания и из-за химиотерапии. Последняя может также влиять на патогенез вирусной инфекции.
Цель исследования. Обоснование целесообразности применения метода ПЦР в рутинной диагностике парентеральных вирусных гепатитов и герпесвирусов.
Материал и методы. Определяли лабораторные маркеры герпесвирусов, вирусов гепатитов В (ВГВ) и С (ВГС) в образцах клинического материала 997 пациентов на разных стадиях гемобластозов, протекающих с пневмонией и/или дыхательной недостаточностью и дисфункцией печени (до гепатита).
Результаты. ВГВ-инфекция ассоциирована с низкой (до 10 3МЕ/мл) виремией, ВГС-инфекция – с высокой (более 105 МЕ/мл). Применение ПЦР позволило выявить скрытые формы вирусных гепатитов, ранние стадии инфицирования и предположить вирусассоциированное поражение печени при криптогенном гепатите. ДНК герпесвирусов достоверно чаще выявляются в бронхоальвеолярной лаважной жидкости а не в крови. Поражение органов дыхания часто ассоциировано с герпесвирусами.
Заключение. ПЦР является удобным методом выявления скрытых форм вирусных инфекций у больных гемобластозами. При криптогенном гепатите исследование биоптатов печени позволило предположить вирусассоциированное поражение. Лабораторная диагностика вирусных инфекций должна носить комплексный характер.
Развитие фармацевтической промышленности в последние несколько лет позволило сильно расширить возможности терапии и профилактики вирусных заболеваний [1, 2]. Это связано, в том числе, с разработкой и внедрением новых противовирусных препаратов прямого действия, иммуномодуляторов и вакцин [2]. Однако краеугольным камнем остается своевременная, точная и быстрая лабораторная диагностика. Устойчивое развитие экспериментальной науки способствует расширению спектра используемых методов определения различных микроорганизмов и позволяет перевести некоторые из методик в область рутинной практики диагностических лабораторий [3, 4]. Лабораторная диагностика вирусных инфекций успешно применяет множество методов, которые с учетом детектируемой мишени можно условно разделить на 2 группы [5, 6]. Прямые методы основаны на выявлении компонентов вируса (антигенов, неструктурных белков или нуклеиновой кислоты), опосредованные – на определении реакции организма на присутствие вируса (антитела различных классов). Существует ряд ограничений при использовании тех или иных методов диагностики, связанных как с особенностями патогена, так и с состоянием организма пациента. Наиболее часто используемым и доступным материалом для исследования является кровь. Однако прямые диагностические методы могут быть малоэффективными в случаях, если имеет место локальная репликация вируса, когда зрелые вирионы не попадают в кровоток [7, 8]; элиминация вируса; изменения в структуре компонентов вирионов в результате мутаций [9]; изменение сценария, по которому развивается патогенетический процесс (скрытая форма гепатита В) [10–15]; цитопения или уменьшение числа клеток-мишеней для репликации лимфотропных вирусов [16–22].
Опосредованные методы также имеют ряд ограничений. Например, наличие гипогаммаглобулинемии у пациента может приводить к неэффективной серологической диагностике из-за нарушения синтеза иммуноглобулинов разных классов [18]. С другой стороны, применение внутривенных препаратов иммуноглобулинов, напротив, теоретически может приводить к гипердиагностике. Таким образом, очевидно, что подход к лабораторной диагностике вирусных инфекций должен быть комплексным.
Своевременное выявление вирусной инфекции особенно актуально для пациентов, находящихся в состоянии первичного или вторичного иммунодефицита. К таким пациентам относятся, в первую очередь, ВИЧ-инфицированные, больные онкологического и онкогематологического профиля, реципиенты костного мозга, органов и тканей, и беременные женщины [4, 7, 16–25]. Пациенты с гемобластозами находятся в состоянии иммунодефицита как на фоне течения основного заболевания (угнетения нормального кроветворения), так и за счет проводимой химиотерапии [7, 24]. У них страдают как клеточное, так и гуморальное звено иммунитета, что может приводить к низкому уровню или практически полному отсутствию иммуноглобулинов [24]. Еще одной проблемой лабораторной диагностики является изменение патогенетического процесса вирусной инфекции на фоне массивной цитостатической терапии [8, 10–13, 15].
Практика гематологического стационара в последние десятилетие показала необходимость увеличения числа используемых лабораторных методов [7, 8, 17, 25]. При подозрении на ВГВ-инфекцию необходимо тестировать кровь пациентов с угнетенным иммунитетом и реципиентов множественных трансфузий не только на HBsA.
1. Rider T.H., Zook C.E., Boettcher T.L., Wick S.T., Pancoast J.S., Zusman B.D. Broad-spectrum antiviral therapeutics. PLoS One 2011; 6(7): e22572.
2. Pawlotsky J.M. New antiviral agents for hepatitis C. F1000 biology reports 2012; 4(5): 557. DOI:10.3410/B4-5
3. Туполева Т.А., Тихомиров Д.С., Грумбкова Л.О., Игнатова Е.Н., Романова Т.Ю., Филатов Ф.П., Гаранжа Т.А. Контаминация при ПЦР-исследованиях: проблемы и решения. Клин. лаб. диагностика 2015; 60(1): 26–42.
4. Гаранжа Т.А., Тихомиров Д.С., Чернова Н.Г., Троицкая В.В., Моисеева Т.Н., Кузьмина Л.А., Филатов Ф.П., Паровичникова Е.Н. Вирусные поражения слизистых оболочек ЖКТ и дыхательных путей у онкогематологических больных. Вестник гематологии 2014; X(4): 17.
5. Storch G.A., Wang D. Diagnostic Virology. In: Knipe D.M., Howley P.M., Griffin D.E., Lamb R.A., Martin M.A., Roizman B., eds. Fields virology. Philadelphia: Lippincott Williams Wilkins, 2013. Vol. 1: 414–52.
6. Носик Н.Н., Стаханова В.М. Лабораторная диагностика вирусных инфекций. Клиническая микробиология и антимикробная химиотерапия 2000; 2(2): 70–8.
7. Чернова Н.Г., Тихомиров Д.С., Гаранжа Т.А., Клясова Г.А., Рощина Л.С., Грачева А.Н, Костина И.Э., Аль-Ради Л.С., Моисеева Т.Н., Кравченко С.К. Вирусные поражения слизистых оболочек органов желудочно-кишечного тракта у больных лимфомами. Тер. архив 2014; 86(7): 93–6.
9. Pellett P.E., Roizman B. Herpes viridae. In: Knipe D.M., Howley P.M., Griffin D.E., Lamb R.A., Martin M.A., Roizman B., eds. Fields virology. Philadelphia: Lippincott Williams Wilkins, 2013. Vol. 2: 1802–2080.
11. Selim H.S., Abou-Donia H.A., Taha H.A., El Azab G.I., Bakry A.F. Role of occult hepatitis B virus in chronic hepatitis C patients with flare of liver enzymes. European Journal of Internal Medicine 2011; 22(2): 187–90. DOI:10.1016/j.ejim.2010.12.001
12. Allain J.P., Mihaljevic I., Gonzalez‐Fraile M.I., Gubbe K., Holm‐Harritshøj L., Garcia J.M. Infectivity of blood products from donors with occult hepatitis B virus infection. Transfusion 2013; 53(7): 1405–15. DOI:10.1111/trf.12096.
13. Tseng T.C., Liu C.J., Yang H.C., Su T.H., Wang C.C., Chen C.L., Fang‐Tzu Kuo S., Liu C.H., Chen P.J., Chen D.S., Kao J.H. Determinants of spontaneous surface antigen loss in hepatitis B e antigen–negative patients with a low viral load. Hepatology 2012; 55(1): 68–76. DOI: 10.1002/hep.24615.
14. Allison R.D., Conry-Cantilena C., Koziol D., Schechterly C., Ness P., Gibble J., Kleiner D.E., Ghany M.G., Alter H.J. A 25-year study of the clinical and histologic outcomes of hepatitis C virus infection and its modes of transmission in a cohort of initially asymptomatic blood donors. Journal of Infectious Diseases 2012; 206(5): 654–61. DOI: 10.1093/infdis/jis410.
15. Carreño V., Bartolomé J., Castillo I., Quiroga J.A. New perspectives in occult hepatitis C virus infection. WJG 2012; 18(23): 2887. DOI: 10.3748/wjg.v18.i23.2887
16. Tikhomirov D., Garanzha T., Troitskaya V.V., Tupoleva T., Romanova T., Galstyan G., Parovichnikova E., Filatov F. Does neutropenia affects herpes virus reactivation in critically ill patients with hematological malignancies and pneumonia? Haematologica 2015; 100(1): 474.
17. Тихомиров Д.С., Гаранжа Т.А., Троицкая В.В., Галстян Г.М., Паровичникова Е.Н., Филатов Ф.П. Лабораторные маркеры герпесвирусных инфекций при нозокомиальных пневмониях у онкогематологических больных при лейкопении. Вестник гематологии 2014; X(4): 67–8.
18. Булиева Н.Б. Эпидемиология оппортунистических инфекций при гемобластозах. Медицинский альманах 2011; 5(18): 132–7.
19. Hsu J. W., Hiemenz J. W., Wingard J. R., Leather H. Viral Infections in Patients with Hematological Malignancies. Neoplastic Diseases of the Blood 2013; 1193-1–239. DOI: 10.1007/978-1-4614-3764-2_53.
22. Ogata M., Satou T., Kadota J. I., Saito N., Yoshida T., Okumura H., Tsudo M. Human herpesvirus-6 reactivation and HHV-6 encephalitis after allogeneic hematopoietic cell transplantation: a multicenter, prospective study. Clin. Infect. Dis. 2013; 57(5): 671–8. DOI: 10.1093/cid/cit358
23. DiMaio D., Fan H. Viruses, Cell Transformation, and Cancer In: Knipe D.M., Howley P.M., Griffin D.E., Lamb R.A., Martin M.A., Roizman B., eds. Fields virology. Philadelphia: Lippincott Williams Wilkins, 2013. Vol. 1: 153–88.
24. Волкова М.А., ред. Клиническая онкогематология. Руководство для врачей. М.: Медицина, 2008.
25. Туполева Т.А., Игнатова Е.Н., Тихомиров Д.С., Гаранжа Т.А., Ярославцева Н.Г., Гуляева А.А., Грумбкова Л.О., Филатов Ф.П., Молекулярные методы диагностики – удобный инструмент для выявления скрытых вирусных инфекций у доноров крови. Сборник трудов VIII Всероссийской научно-практической конференции с международным участием. М., 2014; 1: 441.
Читайте также:


