Вирусологический метод при гриппе
Известно более 200 разновидностей вирусов, избирательно поражающих респираторный тракт человека (возбудителей ОРВИ).
У большинства возбудителей ОРВИ первичное размножение вирусов происходит в слизистой оболочке дыхательной системы, поэтому клиническая картина сходная, заболевание протекает в виде ринита, ринофарингита, как правило, в легкой форме. У детей раннего возраста вирусы могут поражать нижние отделы респираторного тракта, и болезнь протекает в более тяжелой форме в виде бронхитов, бронхиолитов, пневмоний. Наиболее тяжело протекающей острой вирусной респираторной инфекцией является грипп, который часто принимает эпидемическое распространение, характеризуется явлениями общей интоксикации, лихорадкой, поражением дыхательного тракта, нервной и сердечно-сосудистой систем. Максимальное число тяжелых форм течения инфекции наблюдается в период пандемий, обусловленных новым вариантом вируса гриппа.
Лаборатория оуществляет диагностику с помощью экспресс-методов, вирусологических и серологических методов исследования. Быстрая (экспресс) диагностика гриппа и ОРВИ:
1)метод флюоресцирующих антител (МФА) - основан на выявлении вирусных антигенов в клетках эпителия носовых ходов, конъюнктивы (при явлениях конъюнктивита). Исследуемый материал: мазки из носа, конъюнктивы, взятые в первые 3 дня и не позднее 5 дня болезни. Определяемые возбудители: - вирусы сезонного гриппа типа А (H1N1) - вирусы сезонного гриппа типа А (H3N2) - вирусы гриппа типа В - вирусы парагриппа 1, 2, 3 типов - аденовирусы - респираторно-синцитиальный вирус;
2) метод полимеразной цепной реакции (ПЦР)- основан на обнаружении в клинических пробах генетического материала вирусов (РНК или ДНК)- является наиболее современным, высокочувствительным методом.
Исследуемый материал: мазки из носа и зева, взятые в первые 3 дня и не позднее 5 дня болезни, секционный материал. Определяемые возбудители:
- вирусы пандемического высокопатогенного гриппа типа А (H1N1)
- вирусы гриппа типа А
- вирусы гриппа типа В - вирусы парагриппа 1, 2, 3,4 типов
- аденовирусы - респираторно-синцитиальный вирус;
Вирусологическая диагностика - выделение вируса на чувствительной клеточной культуре с последующей идентификацией в реакции нейтрализации или ПЦР.
Этот метод отличается трудоемкостью и длительностью и используется, главным образом, для эпидемиологических и научных целей (изучается изменчивость вирусов, что помогает прогнозировать эпидемические подъемы гриппа, отбираются актуальные штаммы, пригодные для изготовления вакцин) Исследуемый материал: мазки из носа и зева (в первые 3 дня и не позднее 5 дня болезни).
- вирусы гриппа типа А (разные серотипы)
- вирусы гриппа типа В Серологическая диагностика является ретроспективной. Она выявляет прирост титров антител к возбудителям заболевания в парных сыворотках крови, что позволяет установить точную этиологию даже при отрицательных результатах других методов лабораторной диагностики, а также при бессимптомном или атипичном течении гриппа, широко применяется и для эпидемиологических целей. Исследуемый материал: сыворотки крови, взятые в начале заболевания и через 10- 14 дней.
Возбудители к которым определяется прирост титров антител:
- вирусы сезонного гриппа типа А (H1N1)
- вирусы сезонного гриппа типа А (H3N2) - вирусы гриппа типа В
- вирусы парагриппа 1, 2, 3 типов
В период подьема заболевамости гриппом и ОРВИ (в октябре- декабре 2009г.) вирусологической лабораторией обследовано методом флюоресцирующих антител (МФА) 432 человека. У 27% заболевших был выявлен аденовирус, у 8,3% - вирус парагриппа 3 типа, у 8% - респираторно-синцитиальный вирус, у 2% - вирусы парагриппа 1, 2 типов, у 0,2% - вирус сезонного гриппа типа А (H1N1).
При обследовании методом ПЦР 565 больных с подозрением на высокопатогенный грипп типа А (H1N1) РНК вируса обнаружена у 213 человек (в 38% проб). По даннным серологического обследования 67 больных ( в октябре и ноябре) заболевания гриппозной этиологии составили 4,3 % (грипп А(H1N1) сезонный - 2 человека), парагрипп 3 типа — 4,5% ( 3 человека), парагрипп 2 типа — 1,5% ( 1человек).


ОРВИ и грипп имеют респираторные симптомы и общие. Их можно распознать по катаральным признакам со стороны дыхательных путей и общей симптоматике, характерной для большинства заболеваний.
Современные методы диагностики данной группы заболеваний
Различают несколько видов диагностики, которые различаются по особенностям проведения и методу выявления возбудителя. Это:
- экспресс-методы;
- серологическая диагностика;
- вирусологическая диагностика.
Первая группа - экспресс-методики. Это быстрый способ подтвердить или исключить наличие болезни. Используется метод флюоресценции и ПЦР. Рассмотрим их подробнее.
Изучение флюоресцирующих антител - МФА. Способ основан на определении антигенов к вирусу в эпителиальных клетках носовой слизистой, на конъюнктиве (если есть глазные поражения). Антитела при действии антигена реагируют специфическим свечением, которое легко заметить при микроскопическом исследовании. Этот параметр считается маркером диагностики и является основой для подтверждения результата. Способ имеет диагностическую ценность начиная с 3 и заканчивая 5 днем заболевания. Чувствителен к таким антигенам: вирус гриппа типа А, В, вирус парагриппа, аденовирусы и возбудитель РС-инфекции. Это удобный и быстрый метод, не требующий особых ресурсов, который часто применяется в ходе диагностики.

Метод полимеразно-цепной реакции базируется на основе обнаружения участков нуклеиновых кислот генетического материала вируса и определении их групповой принадлежности по этому критерию. Методика имеет высокую диагностическую ценность, является современным и качественным способом подтверждения заболевания. Считается “золотым стандартом” диагностики, так как не дает ложных результатов и является специфическим для определения конкретных патогенов, широко применяется в стационарных и амбулаторных условиях.
Вирусологические методики основаны на чистом выделении вирусных микроорганизмов и их конкретных штаммов, за чем следует их прикрепление к клеточным культурам в лабораторных условиях. Далее следует определение вида вируса с помощью ПЦР или других реакций. Метод требует значительных ресурсов, довольно длительный и трудоемкий. Его ценность заключается в получении эпидемиологических данных и основе для научных работ. То есть, детальное изучение вируса, частоты его распространения позволяет прогнозировать эпидемическую картину, создавать вакцины. Для исследования берется мазок из носа и носоглотки. Материал пригоден в течении 3-5 дня заболевания. С помощью вирусологических методов можно определить такие возбудители:
Серологические методы диагностики - это ретроспективное исследование, которое дает точные данные относительно стадии процесса, степени активности и типа возбудителя. Используется для эпидемиологических целей.
Для анализа используется сыворотка крови, в которой необходимо определить количество и виды антител. Используется известный антиген вируса. При возникновении реакции с материалом пациента формируются иммунные комплексы антиген-антитело, что подтверждает диагноз. Для диагностики также важен прирост титра антител, для чего используются парные сыворотки.
Результат имеет высокую точность и может определиться даже если все другие методы не дали результата, так как имеет высокую чувствительность. особенно важно использование метода для стертых форм с минимальными клиническими проявлениями. Сыворотки для анализа берутся в начале болезни, а также через 10-14 дней после её завершения. Используется метод для подтверждения наличия в организме таких возбудителей: вирусы гриппа А, В, возбудители парагриппа, аденовирусы и РС-вирусы.

Наличие вируса гриппа можно подтвердить с помощью РТГА - реакции торможения геммааглютинации. Метод основан на свойстве снижения гемагглютинирующих способностях вируса, если в крови есть антитела к нему. Для этого используется кровь с эритроцитами, антиген. Препараты крови берутся парными, в начале болезни, и в период выздоровления. Метод имеет высокую диагностическую ценность, точный и чувствительный.
Виды исследуемого материала и особенности сдачи
Для диагностики используются смывы из носа, мазки из носовых ходов, носоглотки, а также препараты крови.
Забор мазка и смыва проводит медицинский персонал. Он следит за тем, чтобы препараты строго соответствовали должной локализации. Забор проходит в чистых условиях, стерильными инструментами и в стерильную тару. До того, как взять мазки пациента просят высморкаться, чтобы очистить носовые ходы от слизи. Зонд вводится легко, на глубину 2-3 см. Проводится стандартное движение по нижней части носового хода и под раковиной носа. Необходимо, чтобы забор происходит в современной клинике, где есть возможность правильно хранить и транспортировать собранный материал в короткий срок до лаборатории.
Мазок из глотки берется по похожей методике, чтобы затронуть те участки слизистой, на которой скапливается возбудитель. Перед забором необходимо легко прополоскать рот, чтобы взятый материал был чистым. Желательно забирать материал на 3-й день после начал болезни.
Нормы и отклонения от них, расшифровка результатов
Экспресс-тест дает результаты сразу после диагностики, его расшифровка не вызывает трудностей, так как определяет наличие вируса или его отсутствие в организме.
Серологические реакции более сложные и могут расшифровываться по разному: наличие антител класса М говорит об острой стадии процесса, антитела G формируются при хроническом течении.
Сроки готовности результатов
Результаты исследования готовы на 1-2 день после сдачи. Экспресс-тест дает результат сразу. Серологические методы требуют больше затрат времени для сравнения титров антител. Более быстрые методы важны для диагностического процесса, а те, что более затратны - для эпидемиологического и научного исследования.

Скорость диагностики зависит от правильности сдачи препаратов, условий лаборатории, качества реактивов.
Вовремя сданный анализ позволяет точно и быстро определить диагноз. Это - залог правильного и эффективного лечения. Если болезнь запустить, она грозит осложнениями, которые особенно опасны, если у человека грипп. Это актуально для детей, пожилых людей, беременных женщин и лиц с дефицитом иммунной системы, ведь осложнения чаще всего проявляются у них.
Лаборатория АО "СЗЦДМ" предлагает услуги, обеспечивающие комплексное и преемственное лабораторное обследование пациента
Диагностика В медицинских центрах АО "СЗЦДМ" проводят качественные диагностические исследования всего организма
Лечение Наши медицинские центры ориентированы на обслуживание пациентов в амбулаторном режиме и объединены единым подходом к обследованию и лечению пациентов.
Реабилитация Реабилитация - это действия, направленные на всестороннюю помощь больному человеку или инвалиду для достижения им максимально возможной полноценности, в том числе и социальной или экономической.
Выезд на дом Внимание! Действует акция "Выезд на дом - 0 рублей"
Профосмотры АО "СЗЦДМ" проводит профилактические осмотры работников, которые включают в себя - комплексы лечебных и профилактических мероприятий, проводимых для выявления отклонений в состоянии здоровья, профилактики развития и распространения заболеваний.

Учебник предназначен для студентов, аспирантов и преподавателей высших медицинских учебных заведений, университетов, микробиологов всех специальностей и практических врачей.
5-е издание, исправленное и дополненное
Книга: Медицинская микробиология, иммунология и вирусология
Вирус гриппа А
Вирион имеет сферическую форму и диаметр 80 – 120 нм, его молекулярная масса 250 МД. Геном вируса представлен однонитевой фрагментированной (8 фрагментов) негативной РНК с общей м. м. 5 МД. Тип симметрии нуклеокапсида спиральный. Вирион имеет суперкапсид (мембрану), содержащий два гликопротеида – гемагглютинин и нейраминидазу, которые выступают над мембраной в виде различных шипов (рис. 85). Гемагглютинин имеет структуру тримера с м. м. 225 кД; м. м. каждого мономера 75 кД. Мономер состоит из меньшей субъединицы с м. м. 25 кД (НА2) и большей – с м. м. 50 кД (НА1).
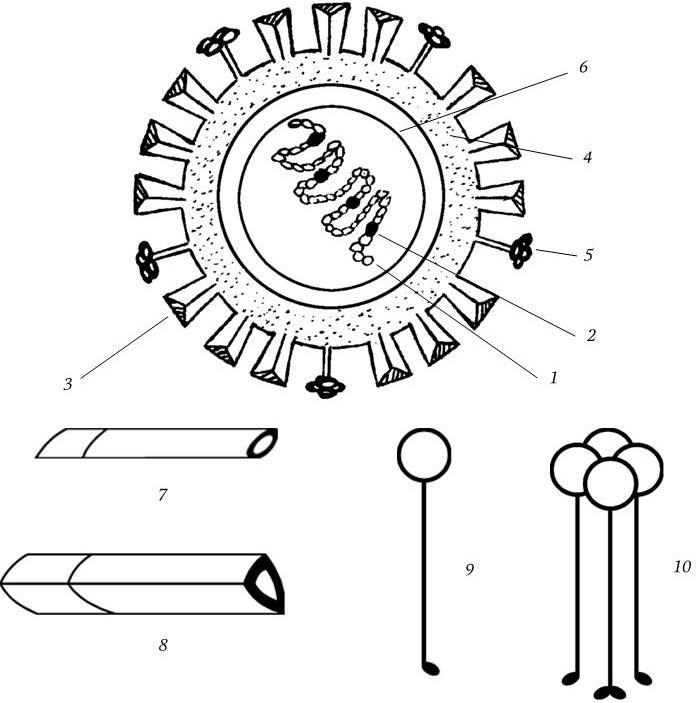
Рис. 85. Схема строения вириона вируса гриппа А:
1 – спираль РНП; 2 – белки РВ1, РВ2, РА; 3 – гемагглютинин; 4 – липидный бислой; 5 – нейраминидаза; 6 – матриксный белок; 7, 8 – мономер и тример гемагглютинина; 9, 10 – мономер и тетрамер нейраминидазы
Основные функции гемагглютинина:
1) распознает клеточный рецептор – мукопептид, имеющий N-ацетилнейраминовую (сиаловую) кислоту;
2) обеспечивает слияние мембраны вириона с мембраной клетки и мембранами ее лизосом, т. е. отвечает за проникновение вириона в клетку;
3) определяет пандемичность вируса (смена гемагглютинина – причина пандемий, его изменчивость – эпидемий гриппа);
4) обладает наибольшими протективными свойствами, отвечая за формирование иммунитета.
У вирусов гриппа А человека, млекопитающих и птиц обнаружено 13 различающихся по антигену типов гемагглютинина, которым присвоена сквозная нумерация (от Н1 до Н13).
Нейраминидаза (N) является тетрамером с м. м. 200 – 250 кД, каждый мономер имеет м. м. 50 – 60 кД. Ее функции: 1) обеспечение диссеминации вирионов путем отщепления нейраминовой кислоты от вновь синтезированных вирионов и мембраны клетки; 2) совместно с гемагглютинином определение пандемических и эпидемических свойств вируса. У вируса гриппа А обнаружено 10 различных вариантов нейраминидазы (N1 – N10).
Нуклеокапсид вириона состоит из 8 фрагментов вРНК и капсидных белков, образующих спиралевидный тяж. На 3'-концах всех 8 фрагментов вРНК имеются одинаковые последовательности из 12 нуклеотидов. 5'-концы каждого фрагмента также имеют одинаковые последовательности из 13 нуклеотидов. 5'– и 3'-концы частично комплементарны друг другу. Это обстоятельство, очевидно, позволяет осуществлять регуляцию транскрипции и репликации фрагментов. Каждый из фрагментов транскрибируется и реплицируется самостоятельно. С каждым из них прочно связаны четыре капсидных белка: нуклеопротеид (NP), он выполняет структурную и регуляторную роль; белок РВ1 – транскриптаза; РВ2 – эндонуклеаза и РА – репликаза. Белки РВ1 и РВ2 обладают основными (щелочными) свойствами, а РА – кислотными. Белки РВ1, РВ2 и РА образуют полимер. Нуклеокапсид окружен матриксным белком (М1-белком), который играет ведущую роль в морфогенезе вириона и защищает вирионную РНК. Белки М2 (кодирует одна из рамок считывания 7-го фрагмента), NS1 и NS2 (кодируются восьмым фрагментом вРНК, который имеет, как и седьмой фрагмент вРНК, две рамки считывания) синтезируются в ходе репродукции вируса, но в его структуру не входят.
Особенность транскрипции. В ядре на вРНК синтезируются три типа вирусспецифических РНК: 1) позитивные комплементарные РНК (мРНК), используемые в качестве матриц для синтеза вирусных белков; они содержат на 5'-конце шапочку, отщепленную от 5'-конца клеточной мРНК, а на 3'-конце – поли-А-последовательность; 2) полноразмерная комплементарная РНК (кРНК), которая служит матрицей для синтеза вирионных РНК (вРНК); на 5'-конце кРНК шапочки нет, на 3'-конце отсутствует поли-А-последовательность; 3) негативная вирионная РНК (вРНК), являющаяся геномом для вновь синтезированных вирионов.
Немедленно, еще до завершения синтеза, вРНК и кРНК вступают в ассоциацию с капсидными белками, которые поступают в ядро из цитозоля. Однако в состав вирионов включаются только рибонуклеопротеиды, связанные с вРНК. Рибонуклеопротеиды, содержащие кРНК, не только не попадают в состав вирионов, но даже не покидают ядро клетки. Вирусные мРНК поступают в цитозоль, где и транслируются. Вновь синтезированные молекулы вРНК после ассоциации с капсидными белками мигрируют из ядра в цитозоль.
Особенности трансляции вирусных белков. Белки NP, PB1, PB2, PA и M синтезируются на свободных полирибосомах. Белки NP, PB1, PB2 и PA после синтеза из цитозоля возвращаются в ядро, где и связываются с вновь синтезированной вРНК, а затем в виде нуклеокапсида возвращаются в цитозоль. Белок матриксный после синтеза движется к внутренней поверхности клеточной мембраны, вытесняя из нее в этом участке клеточные белки. Белки H и N синтезируются на рибосомах, связанных с мембранами эндоплазматического ретикулума, транспортируются по ним, подвергаясь гликозилированию, и устанавливаются на внешней поверхности клеточной мембраны, образуя шипы как раз напротив белка М, расположенного на ее внутренней поверхности. Белок Н подвергается в ходе процессинга разрезанию на НА1 и НА2.
Заключительный этап морфогенеза вириона контролируется М-белком. С ним взаимодействует нуклеокапсид; он, проходя через мембрану клетки, покрывается вначале М-белком, а затем клеточным липидным слоем и суперкапсидными гликопротеидами Н и N. Жизненный цикл вируса занимает 6 – 8 ч и завершается отпочковыванием вновь синтезированных вирионов, которые способны атаковать другие клетки ткани.
Устойчивость вируса во внешней среде невелика. Он легко разрушается при нагревании (при 56 °C в течение 5 – 10 мин), под действием солнечного и УФ-света и легко обезвреживается дезинфицирующими веществами.
Эпидемиология. Источник инфекции – человек, больной или носитель, редко животные (домашние и дикие птицы, свиньи). Заражение от людей происходит воздушно-капельным путем, инкубационный период очень короткий (1 – 2 сут.), поэтому эпидемия распространяется очень быстро и может при отсутствии коллективного иммунитета перерасти в пандемию. Иммунитет – основной регулятор эпидемий гриппа. По мере нарастания коллективного иммунитета эпидемия идет на убыль. Вместе с тем вследствие формирования иммунитета происходит отбор штаммов вируса с измененной антигенной структурой, прежде всего гемагглютинина и нейраминидазы; эти вирусы продолжают вызывать вспышки до тех пор, пока и к ним не появятся антитела. Такой антигенный дрейф и поддерживает непрерываемость эпидемии. Однако у вируса гриппа А обнаружена еще одна форма изменчивости, получившая название шифта, или сдвига. Она связана с полной сменой одного типа гемагглютинина (реже – и нейраминидазы) на другой.
Все пандемии гриппа были вызваны вирусами гриппа А, претерпевшими шифт. Пандемия 1918 г. была вызвана вирусом с фенотипом H1N1 (погибло около 20 млн человек), пандемия 1957 г. – вирусом H2N2 (переболело более половины населения мира), 1968 г. – вирусом H3N2.
Для объяснения причин резкой смены типов вирусов гриппа А предложены две основные гипотезы. Согласно гипотезе А. А. Смородинцева, вирус, исчерпавший свои эпидемические возможности, не исчезает, а продолжает циркулировать в коллективе без заметных вспышек или длительно персистировать в организме человека. Через 10 – 20 лет, когда появится новое поколение людей, не имеющих иммунитета к этому вирусу, он становится причиной новых эпидемий. В пользу этой гипотезы говорит тот факт, что вирус гриппа А с фенотипом H1N1, исчезнувший в 1957 г., когда его вытеснил вирус H2N2, вновь появился после 20-летнего отсутствия в 1977 г.
По другой гипотезе, развиваемой и поддерживаемой многими авторами, новые типы вируса гриппа А возникают вследствие реассоциации геномов между вирусами гриппа человека и птиц, между вирусами гриппа птиц, между вирусами гриппа птиц и млекопитающих (свиньи), чему способствует сегментарная структура вирусного генома (8 фрагментов).
Таким образом, у вируса гриппа А есть два пути изменения генома.
1. Точечные мутации, обусловливающие антигенный дрейф. Им подвержены, прежде всего, гены гемагглютинина и нейраминидазы, особенно у вируса H3N2. Благодаря этому вирус H3N2 за период с 1982 по 1998 г. вызвал 8 эпидемий и сохраняет эпидемическое значение до сих пор.
2. Реассоциация генов между вирусами гриппа человека и вирусами гриппа птиц и свиней. Считается, что именно реассоциация геномов вирусов гриппа А с геномами вируса гриппа птиц и свиней – главная причина возникновения пандемических вариантов этого вируса. Антигенный дрейф позволяет вирусу преодолевать существующий у людей иммунитет. Антигенный шифт создает новую эпидемическую ситуацию: к новому вирусу у большинства людей иммунитета нет, и возникает пандемия гриппа. Возможность такой реассоциации геномов вирусов гриппа А доказана экспериментально.
Установлено, что эпидемии гриппа у людей вызывают вирусы типа А только 3 или 4 фенотипов: H1N1 (H0N1); H2N2; H3N2.
Однако существенную угрозу для человека предсталяет и куриный (птичий) вирус. Вспышки куриного гриппа наблюдались неоднократно, в частности куриный вирус H5N1 вызвал миллионную эпизоотию среди домашних и диких птиц с 80 – 90 %-ной летальностью. От кур заражались и люди; так в 1997 г. от кур заразилось 18 человек, треть из них погибла. Особенно крупная вспышка наблюдалась в январе – марте 2004 г. Она охватила почти все страны Юго-Восточной Азии и один из штатов США и нанесла огромный экономический ущерб. От кур заразилось и погибло 22 человека. Для ликвидации этой вспышки были предприняты самые жесткие и решительные меры: строгий карантин, ликвидация всего поголовья птиц во всех очагах, госпитализация и изоляция больных и всех людей с повышенной температурой, а также лиц, находившихся в контакте с больными, запрет импорта куриного мяса из указанных выше стран, строгий медицинский и ветеринарный надзор за всеми пассажирами и транспортными средствами, прибывающими из этих стран. Широкого распространения гриппа среди людей не произошло потому, что не было реассоциации генома вируса куриного гриппа с геномом вируса гриппа человека. Однако опасность такой реассоциации остается реальной. Всего в течение 2003–2007 гг. в мире переболело 322 человека, из них 195 умерли.
В названии выявляемых штаммов вирусов гриппа указывают серотип вируса (A, B, C), вид хозяина (если им не является человек), место выделения, номер штамма, год его выделения (последние 2 цифры) и фенотип (в круглых скобках).
Особенности патогенеза и клиники. Инкубационный период при гриппе короткий – 1 – 2 сут. Вирус размножается в эпителиальных клетках слизистой оболочки дыхательных путей с преимущественной локализацией в области трахеи, что клинически проявляется в виде сухого мучительного кашля с болями по ходу трахеи. Продукты распада пораженных клеток попадают в кровь, вызывают сильную интоксикацию и повышение температуры тела до 38 – 39 °C. Повышение проницаемости сосудов, обусловленное повреждением клеток эндотелия, может стать причиной патологических изменений в различных органах: точечных кровоизлияний в трахее, бронхах, а иногда и отека мозга с летальным исходом. Вирус гриппа оказывает угнетающее действие на кроветворение и иммунную систему. Все это может приводить к вторичным вирусным и бактериальным инфекциям, которые осложняют течение болезни.
Постинфекционный иммунитет. Прежние представления о том, что после перенесенного гриппа остается слабый и кратковременный иммунитет, опровергнуты после возвращения вируса H1N1 в 1977 г. Этот вирус вызывал заболевание главным образом у людей не старше 20 лет, т. е. у тех, кто не болел им раньше, до 1957 г. Следовательно, постинфекционный иммунитет достаточно напряженный и продолжительный, но имеет выраженный типоспецифический характер.
Главная роль в формировании приобретенного иммунитета принадлежит вируснейтрализующим антителам, блокирующим гемагглютинин и нейраминидазу, а также секреторным иммуноглобулинам IgAs.
Лабораторная диагностика. Материалом для исследования служит отделяемое носоглотки, которое получают либо путем смыва, либо с помощью ватно-марлевых тампонов, и кровь. Методы диагностики применяют следующие:
1. Вирусологический – заражение куриных эмбрионов, культур клеток почек зеленых мартышек (Vero) и собак (МДСК). Культуры клеток особенно эффективны для выделения вирусов А (H3N2) и В.
2. Серологический – выявление специфических антител и возрастания их титра (в парных сыворотках) с помощью РТГА, РСК, иммуноферментного метода.
3. В качестве ускоренной диагностики используют иммунофлуоресцентный метод, позволяющий быстро обнаружить вирусный антиген в мазках-отпечатках со слизистой оболочки носа или в смывах из носоглотки больных.
4. Для обнаружения и идентификации вируса (вирусных антигенов) предложены методы РНК-зонда и ПЦР.
Лечение. Для лечения, которое следует начинать как можно раньше, и профилактики гриппа и других вирусных ОРЗ применяют дибазол, интерферон и его индукторы амиксин и арбидол по специальным схемам, а для лечения и профилактики гриппа у детей старше 1 года – альгирем (ремантадин) по специальным схемам.
Специфическая профилактика. Ежегодно в мире гриппом болеют сотни миллионов людей, что наносит колоссальный ущерб здоровью населения и экономике каждой страны. Единственным надежным средством борьбы с ним является создание коллективного иммунитета. Для этой цели предложены и используются следующие типы вакцин: 1) живая из аттенуированного вируса; 2) убитая цельновирионная; 3) субвирионная вакцина (из расщепленных вирионов); 4) субъединичная – вакцина, содержащая только гемагглютинин и нейраминидазу.
Детей от 6 мес. до 12 лет, по рекомендации ВОЗ, следует прививать только субъединичной вакциной как наименее реактогенной и токсичной.
Главная проблема в повышении эффективности противогриппозных вакцин – обеспечение их специфичности против актуального вируса, т. е. того варианта вируса, который вызвал данную эпидемию. Иначе говоря, вакцина должна содержать специфические антигены актуального вируса. Основной путь повышения качества вакцины – использование наиболее консервативных и общих для всех антигенных вариантов вируса А эпитопов, которые обладают максимальной иммуногенностью.
(1).jpg)
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.

Программа разработана совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.
Методические указания МУК 4.2.2136-06 “Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 9 ноября 2006 г.)
В справке нет пункта 3!
Дата введения: с момента утверждения
ВГПА - вирус гриппа птиц типа А
Биобезопасность - биологическая безопасность
ЛПУ - лечебно-профилактические учреждения
МФА - метод иммунофлуоресцирующих антител
ОТ-ПЦР - метод обратной транскрипции - полимеразной цепной реакции
1.1 В настоящих методических указаниях определены порядок сбора, упаковки, хранения, транспортирования и выполнения лабораторных исследований биологического материала от больных (и умерших) пациентов при лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА).
1.2 Методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, лечебно-профилактических и других организаций, независимо от организационно-правовой формы.
3.1 При эпизоотическом неблагополучии в России и за рубежом по ВГПА и при отсутствии лабораторно подтвержденных случаев заболевания людей на данной территории:
3.1.1 Забор материала от пациентов (или умерших) с подозрением на инфекцию ВГПА проводят в лечебно-профилактических учреждениях (ЛПУ).
Применяемые на этом этапе тест-системы должны обеспечивать первичную идентификацию возбудителя как вируса гриппа типа А и дифференциацию штаммов этого вируса по типу гемагглютинина (например Н5).
3.1.4 При получении положительных результатов подтверждающего тестирования референс-лаборатория проводит изоляцию вируса, изучение его свойств и депонирование.
Максимальное внимание должно уделяться случаям ВГПА с предположительной передачей от человека человеку. Регистрация подобных случаев требует незамедлительного проведения комплекса противоэпидемических мероприятий и изучения генетических особенностей изолята ВГПА.
3.2 При наличии лабораторно подтвержденных случаев заболевания людей ВГПА на данной территории:
3.2.1 Забор материала проводят в ЛПУ при подозрении на заболевание ВГПА.
3.2.3 Обязательное подтверждающее тестирование в референс-лаборатории не проводится. Направление материала в референс-лабораторию осуществляется в случаях возникновения противоречивых результатов при первичном тестировании.
4.3 Для исследования забирают следующие виды клинического материала:
- смывы из полости носа и ротоглотки (для ОТ-ПЦР-анализа);
- мазки из полости носа (для МФА и ОТ-ПЦР-анализа) и ротоглотки (для ОТ-ПЦР-анализа);
- носоглоточное отделяемое (для выделения вируса, ОТ-ПЦР-анализа).
- фекалии (для ОТ-ПЦР-анализа).
Перечисленные выше процедуры по забору клинического материала врачи осуществляют в противочумных костюмах IV типа (или длинном хирургическом халате, с завязками на спине, шапочках), дополненных ватно-марлевыми повязками или респираторами типа ШБ-1 (или РБ) “Лепесток-200”. На руки надевают резиновые перчатки.
Целесообразно также включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж и биоптаты легких при возможности их забора. Данные процедуры осуществляет врачебный персонал, одетый в противочумный костюм I типа (или длинный хирургический халат, с завязками на спине, дополненный фартуком, бахилами, косынкой, очками, ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200” и перчатками).
Выбор времени забора клинического материала очень важен, так как наиболее высокое содержание вируса в дыхательных органах человека регистрируется в течение первых четырех дней после появления признаков заболевания. Образцы должны быть собраны в течение 3 сут. после появления клинических признаков, указанных в п. 6.1.
Для постмортальной диагностики используют аутоптаты легких, трахеи и селезенки.
От одного больного должно забираться не менее трех видов клинического материала. Обязательно следует забирать мазки из полости носа и роторлотки и носоглоточное отделяемое. Каждый образец материала помещают в отдельную транспортную емкость.
4.4 Сбор материала производят в пробирки со стабилизирующей средой, приготовленной согласно приложению 4, и/или в пробирки с транспортной средой, предоставляемой (или рекомендуемой) фирмой-производителем тест-систем.
4.5 Отправку материала в лабораторию осуществляют в транспортной таре со стабилизирующей средой (приложение 4).
1) в транспортную емкость (плотно закрывающиеся пластмассовые пробирки или флаконы с завинчивающимися крышками); плотно закрытый верхний конец транспортной емкости вместе с крышкой герметизируют различными пластификаторами (парафин, парафильм и др.); емкость маркируют;
2) в полиэтиленовый пакет подходящего размера с ватой (или другим гигроскопичным материалом) в количестве достаточном для адсорбции всего образца в случае его утечки; полиэтиленовый пакет следует герметично заклеить или запаять;
5.1.1 Образцы от одного пациента могут быть упакованы в один полиэтиленовый пакет. Не допускается упаковывать образцы материалов от разных людей в один и тот же пакет.
5.1.2 В полиэтиленовый пакет вкладывают бланк направления с указанием: наименование направляющего учреждения, ФИО больного, возраст, место жительства, предварительный диагноз, эпидемиологический анамнез, вид материала, дата и время взятия материала.
5.2 Герметично закрытые полиэтиленовые пакеты помещают в термоизолирующий плотнозакрывающийся контейнер (термос), приспособленный для транспортирования биологических материалов.
5.2.1 В термоконтейнеры и термосы помещают охлаждающие элементы или пакеты со льдом. К наружной стенке термоконтейнера или термоса прикрепляют этикетку с указанием вида материала, условий транспортирования, названия пункта назначения. Сроки и условия транспортирования упакованных проб клинического материала указаны в приложении 2.
5.3 Транспортирование проб клинического материала в референс-лабораторию, вирусологические лаборатории и лаборатории учреждений противочумной системы Роспотребнадзора осуществляется нарочным(и), информированным о правилах доставки материала в соответствии с п. 3.4. СП 1.2.036-95.
6.1 При отсутствии лабораторно подтвержденных случаев заболевания людей на данной территории лабораторные исследования с целью диагностики ВГПА следует проводить у пациентов с респираторными заболеваниями тяжелого течения и неясной этиологии при наличии как минимум двух из перечисленных (следующего комплекса - убрать) симптомов:
- фебрильная лихорадка с температурой тела выше 380C;
- затрудненное дыхание или дыхательная недостаточность;
- водянистая диарея при отсутствии слизи и крови в фекалиях;
в комбинации хотя бы с одним из следующих эпидемиологических признаков в период 1-7 дней перед появлением симптомов :
- посещение мест регистрации заболевания ВГПА у птиц или людей;
- тесный контакт (в радиусе 1 метра) с лицом, являющимся подозрительным, вероятным или подтвержденным случаем ВГПА;
- контакт с погибшими или больными птицами, уход, убой, ощипывание, разделка тушек, подготовка к употреблению домашней или дикой птицы или контакт с их останкам или объектами окружающей среды, контаминированными их фекалиями на территории, где в течение последнего месяца были заподозрены или подтверждены случаи инфекции ВГПА у животных или людей;
- манипуляции с образцами клинического материала (от животных или людей), подозрительным на зараженность ВГПА в лаборатории или в иной обстановке;
- употребление сырых или недостаточно приготовленных продуктов из домашней птицы на территории, где в течение последнего месяца были заподозрены или подтверждены случаи инфекции ВГПА у животных или людей.
- Тесный контакт с подтвержденно инфицированным ВГПА животным, но не домашними или дикими птицами (например, кошка или свинья).
Данный случай расценивается как подозрительный случай ВГПА.
Вероятный случай ВГПА - лицо, умершее от необъясненного острого респираторного заболевания, которое расценивается как эпидемиологически связанное по времени, месту и экспозиции с вероятным или подтвержденным случаем ВГПА, а также лицо, отвечающее критериям для подозрительного случая, и одному из дополнительных критериев:
a. инфильтраты или признаки острой пневмонии на рентгенограмме грудной клетки плюс признаки дыхательной недостаточности (гипоксемия, выраженное тахипноэ) или
b. положительный результат лабораторного подтверждения инфекции, вызванной вирусом гриппа А, но недостаточное лабораторное подтверждение инфекции.
6.2 При наличии лабораторно подтвержденных случаев заболевания людей ВГПА на данной территории показанием к обследованию являются клинические симптомы, приведенные в п. 6.1. Дополнительные эпидемиологические признаки являются необязательными.
6.3 Исследование секционного материала от умерших на наличие вируса ВГПА проводят при:
- сходстве клинической картины заболевания, приведшего к летальному исходу, с описанной в п. 6.1 или невозможности исключения такой клинической картины в анамнезе и при наличии в анамнезе хотя бы одного из перечисленных в п.п. 6.1 дополнительных эпидемиологических признаков.
6.4 Исследования проводят с использованием диагностических тест-систем, разрешенных к применению в установленном порядке. Для выявления ВГПА методом ОТ-ПЦР предпочтение должно отдаваться диагностическим тест-системам, которые обеспечивают максимальную контаминационную безопасность исследований.
6.5 При проведении первичного тестирования на наличие вируса ВГПА должны исследоваться не менее 2 видов клинического материала (например: мазки из полости носа и из ротоглотки) с использованием как минимум двух методов - ОТ-ПЦР и МФА.
6.6 При получении отрицательных результатов исследования всех образцов выдается окончательный отрицательный ответ.
При отсутствии регистрации заболевания людей, вызванных ВГПА, на данной территории при получении хотя бы одного положительного результата при МФА исследовании или использовании ОТ-ПЦР выдается предварительный положительный ответ и образцы направляют для подтверждающего тестирования в референс-лабораторию.
В период регистрации заболевания людей, вызванных ВГПА на данной территории, обязательное подтверждающее тестирование не проводят, и при получении хотя бы одного положительного результата при вирусологическом исследовании или использовании ОТ-ПЦР выдается окончательный положительный ответ.
6.7 При подтверждении в референс-лаборатории положительного результата первичного тестирования, при исследовании хотя бы одного вида клинического материала выдается окончательный положительный ответ.
При получении в референс-лаборатории отрицательных результатов исследования двух видов клинического материала проводится повторное тестирование. При получении аналогичного результата выдается окончательный отрицательный ответ.
7.1 Первичное исследование материала от больного, подозрительного на зараженность вирусом ВПГА, проводят в лабораториях, имеющих разрешение на работу с ПБА III-IV групп патогенности.
Подтверждающее тестирование осуществляется в референс-лаборатории.
7.2 Проведение работ, не связанных с накоплением вируса, образованием аэрозолей инфицированного материала (окраска и просмотр мазков, постановка серологических реакций с необеззараженным, диагностическим материалом, серологические исследования с необеззараженным материалом) осуществляют в противочумном костюме IV типа, дополненном ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200 и резиновыми перчатками. Работы проводят в боксе биологической безопасности II класса.
7.3 Проведение работ по заражению культур клеток или куриных эмбрионов, а также связанных с возможностью образования аэрозоля осуществляют в боксах безопасности III класса. Работы проводят в противочумном костюме IV типа, дополненном ватно-марлевой повязкой или респиратором типа ШБ-1 (или РБ) “Лепесток-200 и резиновыми перчатками.
7.4 Аптечка экстренной профилактики лабораторий, проводящих диагностику заболеваний, вызванных ВГПА, должна быть укомплектована в соответствии с СП 1.3.1285-03 и дополнена двумя из следующих противовирусных препаратов: Циклоферона и Амиксина, Ремантадина, Альгирема, Арбидола и Озельтамивира (Тамифлю).
7.5 Режимы обеззараживания различных объектов при лабораторной диагностике ВГПА (в соответствии с СП 1.3.1285-03).
7.5.1 Обеззараживание поверхностей помещения (пол, стены, двери), оборудования, рабочих столов и др. - двукратным протиранием с интервалом 15 мин 6% раствором перекиси водорода или 3% раствором хлорамина (экспозиция 120 мин), либо любым дезинфицирующим средством, обладающим вирулицидной активностью, с последующей обработкой УФ в течение 60 мин.
Запрещено одновременное использование 6% раствора перекиси водорода и 3% раствора хлорамина в пределах одной лаборатории в связи с опасностью взрывоподобного характера протекания химической реакции при смешении этих растворов.
7.5.2 Обеззараживание защитной одежды осуществляют:
а) кипячением в 2% растворе соды в течение 30 мин с момента закипания;
б) замачиванием на 30 мин при 50. С в 3% растворе перекиси водорода с 0,5% моющего средства.
7.5.3 Обеззараживание перчаток - замачиванием на 60 мин в 6% растворе перекиси водорода с 0,5% моющего средства или в 3% растворе хлорамина.
7.5.4 Обеззараживание лабораторной посуды, автоклавируемых дозаторов, наконечников, вируссодержащих жидкостей, агарозного геля, инструментария из металла проводится методом автоклавирования - давление 2,0 кГс/см2 (0,2 Мпа), температура 132+-2. С, время 45 мин.
7.5.5 Обеззараживание дозаторов - двукратным протиранием поверхностей дозатора с интервалом 15 мин 6% раствором перекиси водорода, с последующей обработкой в парах формалина в течение 60 мин.
| Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации | Г.Г. Онищенко |
Рекомендуется использование следующей стабилизирующей среды для хранения и транспортировки материала от людей для дальнейших вирусологических исследований.
Среда готовится в стерильных условиях, автоклавирование не допускается, можно стерилизовать фильтрованием через нитроцеллюлозный стерильный фильтр в стерильную же посуду.
- среда для культур клеток N199, содержащая 0,5% BSA;
- пенициллин 2 х 10(6) ед./л, стрептомицин 200 мг/л, полимиксин В 2 х 10(6) ед./л, гентамицин 250 мг/л, нистатин 0,5 х 10(6) ед./л.
Методические указания МУК 4.2.2136-06 “Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 9 ноября 2006 г.)
Текст методические указания официально опубликован не был
2. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 9 ноября 2006 г.
Читайте также:


