Вирусы и бактерии в пище
Рассмотрены основные пути передачи вирусов, которые способны проникать в организм человека через инфицированные пищевые продукты. Показано, что вирусы устойчивы к неблагоприятным условиям окружающей среды и могут в течение нескольких месяцев храниться в пищевых продуктах и окружающей среде.
Описаны распространенные источники, где могут накапливаться энтеровирусы, вирус Коксаки В5, вирус холеры свиней (HCV), вирус африканской свиной лихорадки (ASFV), вирус ящура, полиовирус, ротавирус и .
Ключевые слова: вирусы, пищевые продукты, биобезопасность, энтеровирусы
The main routes of transmission of viruses that can enter the body through infected food were considered. It has been shown that viruses are resistant to adverse environmental conditions and may be stored for several months in food and environment.
Common sources, which can accumulate enteroviruses, Coxsackie B5 virus, hog cholera virus (HCV), African Swine Fever virus (ASFV), FMD virus, poliovirus, rotavirus and echovirus are described.
Keywords: viruses, food, biosafety
Болезни пищевого происхождения часто называют пищевыми отравлениями. Пищевые отравления могут быть вызваны химическими веществами, бактериями или определенными пищевыми продуктами, например, ядовитыми грибами. Также любой продукт питания может содержать ряд инфекционных агентов вирусной природы [8, 10].
О случаях выявления в продуктах питания вирусов известно намного меньше, чем о выявлении других микроорганизмов. Это связано с тем, что вирусы, в отличие от бактерий, не способны размножаться на питательных средах и для их культивирования используют чувствительные клетки. Также вирусы не размножаются в продуктах питания и их количество намного меньше, чем бактерий, потому для их выделения нужны методы экстракции и концентрирования. Следует отметить, что лабораторные вирусологические методики нельзя применить во многих микробиологических лабораториях, которые исследуют пищевые продукты. Из литературы известно [2, 8], что среди энтеровирусов наиболее часто встречаются возбудители болезней пищевого происхождения — это норовирус Norwalk (NOV) и вирус гепатита, А (HAV). Через пищевые продукты могут передаваться и другие вирусы — такие, как ротавирус, вирус гепатита Е (HEV), астровирус, вирус Айчи, саповирус, энтеровирус, коронавирус, парвовирус, аденовирус и другие [2, 3, 4].
Основные пути передачи вирусов в организм человека
В зависимости от симптомов заболевания, вирусы, передающиеся через пищевые продукты, можно распределить по следующим группам: возбудители гастроэнтерита (NOV), возбудители кишечного вирусного гепатита (HAV с репликацией в печени) и третья группа вирусов — с репликацией в кишечнике человека, которые становятся возбудителями заболеваний лишь после миграции в другие органы, такие, как центральная нервная система (энтеровирус) [2, 3, 8].
Основными вирусами пищевого происхождения являются те, которые проникают через тракт и выделяются с фекальными и рвотными массами, также те, которые инфицируют человека при пероральном проникновении. Широко распространено бессимптомное инфицирование и выделение вирусов, на которое необходимо обращать внимание при производстве продуктов питания [3].
Для размножения (репликации) вирусам необходимо проникнуть в живые клетки. В отличие от бактерий они не могут развиваться в пище. Следовательно, вирусы не вызывают ухудшения состояния продукта, и органолептические свойства еды не изменяются от вирусного заражения.
Энтеровирусы человека, такие как NOV и HAV, имеют высокую инфекционную активность, и наиболее распространенным путем инфицирования является их передача от одного человека к другому. Вторичное распространение этих вирусов после их первичного проникновения, например, с зараженной инфицированной едой, является обычной практикой, и приводит к активным и длительным вспышкам заболевания [2, 3, 5].
Простые вирусы, такие, как NOV и HAV, имеют только одну белковую оболочку — капсид. Сложные вирусы, например, вирус гриппа, кроме внутренней оболочки, имеют еще и внешнюю оболочку (биомембрану), которая является дериватом чувствительной клетки. Наличие у вирусов как капсидной, так и мембранной структуры повышает их устойчивость к среде обитания и сопротивляемость к очистке и дезинфекции. При этом простые вирусы проявляют повышенную сопротивляемость к действию растворителей (например, хлороформу) и обезвоживанию.
Вирусы, могут в течение нескольких месяцев храниться в пищевых продуктах или в окружающей среде (например, в почве, воде, осаждениях, двустворчатых моллюсках или на разных поверхностях). Большинство вирусов пищевого происхождения более стойкие, чем бактерии, к охлаждению, замораживанию, изменению pH, высушиванию, ультрафиолетовому облучению, нагреванию, изменению давления, дезинфекции и так далее [3, 9].
Температуры замораживания и охлаждения не приводит к инактивации вирусов, и считаются важными факторами, которые повышают стойкость вирусов пищевого происхождения к условиям окружающей среды. Нагревание и высушивание могут применяться для инактивирования вирусов, однако, уровень стойкости к таким процедурам у разных вирусов неодинаковый.
Традиционная практика мытья рук может быть эффективнее в борьбе с вирусами по сравнению с обработкой рук дезинфицирующими средствами. Большинство химических дезинфицирующих средств, которые применяются на объектах пищевой промышленности, не обеспечивают эффективную инактивацию вирусов без оболочки, таких, как NOV или HAV.
Зоонозный путь передачи пищевых вирусов менее распространен, чем для патогенных микроорганизмов, таких, как Salmonella и Campylobacter, однако таким образом передается вирус HEV.
Выделение вирусов из пищевых продуктов
Совершенствование методов выделения вирусов, которые основываются на применении ревертазной полимеразной цепной реакции (ПЦР), позволило непосредственно обнаруживать ряд вирусов в пищевых продуктах [1]. Эффективность методики выявления вирусов с помощью ревертазной ПЦР в продуктах питания была доказана многочисленными исследованиями [3].
Естественным источником, способным накапливать энтеровирусы, могут быть моллюски, поскольку они являются биофильтрами водоемов. В искусственно инфицированных полиовирусом (104 бляшкообразующих единиц, БОЕ) устрицах инфекционные свойства вирусов наблюдались на протяжении 30–90 дней в условиях хранения устриц при пониженной температуре [9]. Хотя, маловероятно поглощение энтеровирусов устрицами и моллюсками, в случае, когда концентрация вирусов в открытом водоеме менее 0,01 БОЕ/мл [5].
При исследовании сырых устриц в каждом из 17 образцов был выявлен и полиовирус 1, при этом полиовирус 3 был найден в одном из 24 исследуемых образцов [9].
Обычно индекс БГКП является достоверным показателем наличия кишечной палочки в воде, но он не распространяется на энтеровирусы, которые являются более стойкими к неблагоприятным экологическим условиям, чем патогенные бактерии [10]. При исследовании больше 150 образцов рекреационных вод из Техасского залива энтеровирусы были выявлены в 43% образцов, при этом 44% образцов имели допустимые показатели индекса БГКП. Следует отметить, что энтеровирусы были выявлены в 35% образцов воды, которые удовлетворяли стандартам чистоты по показателям индекса БГКП для промышленного получения моллюсков. Из этого следует, что показатель не коррелирует с наличием в водоемах вирусов [9].
При исследовании моллюсков в открытых и закрытых водоемах в 23% образцов из открытых водоемов были выделены энтеровирусы, при этом в исследуемых образцах отсутствовали бактерии рода Salmonella, Shigella, Yersinia, которые вызывают кишечные заболевания. В 40% образцов моллюсков из закрытых водоемов были выделены бактерии рода Salmonella, при этом в исследованных образцах не было обнаружено бактерий родов Shigella и Yersinia. Следует также отметить, что корреляции между титром энтеровирусов и общим числом колиформ в моллюсках не обнаружено [5, 9].
Способность вирусов сохраняться в пищевых продуктах
Энтеровирусы могут храниться в говядине до 8 дней при температуре 23–24 °С, при этом на их инфекционные свойства не влияет размножение бактерий, которые вызывают порчу продукта. Вирус Коксаки В5 сохраняет свои инфекционные свойства на овощах при температуре 4 °С на протяжении 5 дней [3].
При исследовании инфекционных свойств вируса холеры свиней (HCV) и вируса африканской свиной лихорадки (ASFV) в мясе больных животных, было показано, что даже после промышленной обработки вирусы сохраняют свою жизнеспособность. Из мяса инфицированных указанными вирусами животных была изготовлена пастеризованная ветчина, сухая колбаса и колбаса типа салями, при этом вирусы не были выявлены в пастеризованной ветчине, но были выделены из ветчины после посола. Вирус ASFV был выделен в двух колбасных продуктах после добавления ингредиентов посола и стартовых культур, но не выявлялся после 30 дней ферментации колбасы. Следует отметить, что вирус HCV также оставался активным после внесения ингредиентов для посола и посевных культур, но сохранял способность к заражению даже после 22 дней ферментации мяса [6].
Исследования инфекционных свойств вируса ящура в зависимости от температуры показали, что термическая обработка зараженной говядины при температуре 93,3 °С приводит к полному инактивированию вируса. Однако, в лимфоузлах крупного рогатого скота вирус выдерживал нагревание до 90 °С на протяжении 15 минут [1]. Кипячение крабов на протяжении 8 минут оказалось достаточным, чтобы инактивировать полиовирус 1, ротавирус и [7, 9]. При этом полиовирус способен выдерживать тушение, прожарку, запекание и пропаривание устриц [9]. Следует отметить, что в жареных гамбургерах энтеровирусы были выявлены в 8 из 24 не прожаренных пирожков (до температуры внутри пирожка 60 °С) при их быстром охлаждении до 23 °С. Вирусов не было выявлено при охлаждении пирожков на протяжении 3 минут при комнатной температуре [5].
Следует отметить, что проверка продуктов питания на наличие вирусов является сложной процедурой, которая требует матричного анализа проб и концентрирования вирусов, а также основана на выявлении вирусных нуклеиновых кислот. В настоящее время отсутствуют простые и доступные методы оценки уровня инактивации вирусов в пищевых продуктах. Таким образом, главной задачей вирусологических исследований пищевых продуктов является разработка простых методов выявления вирусов, а также способов их инактивирования.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
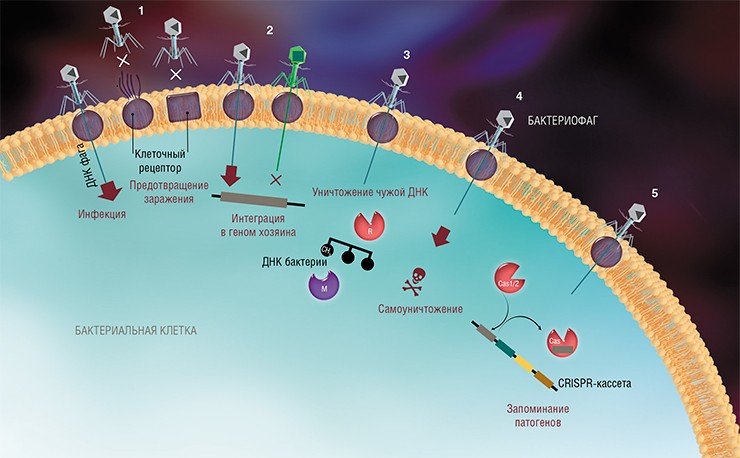
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
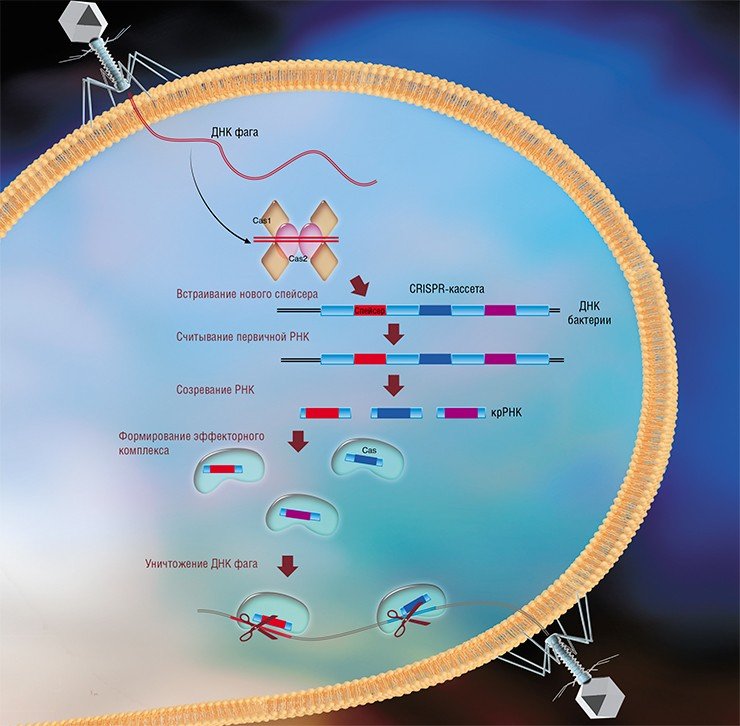
Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
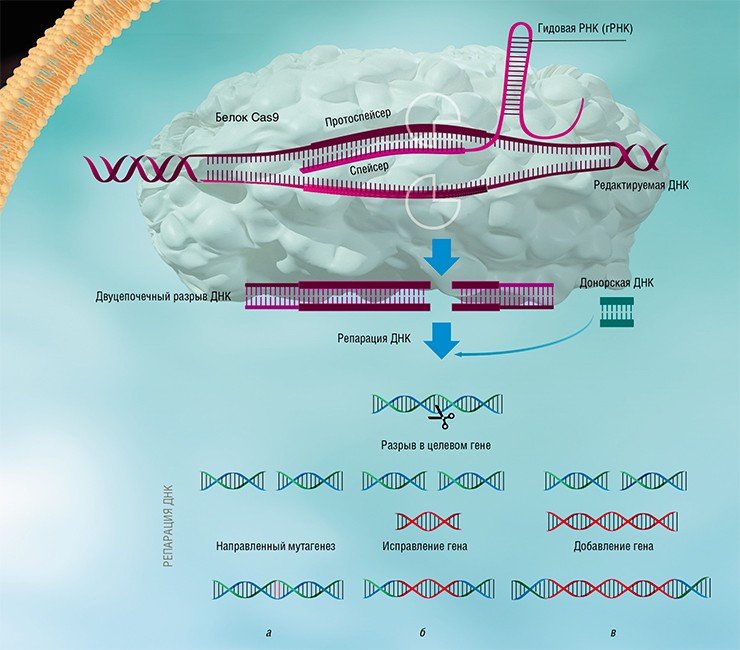
Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Мастерок.жж.рф
Бывает, заболев ОРВИ или гриппом, люди спешат в аптеку за антибиотиком, не отдавая себе отчета в том, что вирусное заболевание им вылечить невозможно. Ведь антибиотик — лекарство, направленное на подавление болезнетворных бактерий, но никак не вирусов. От последних могут помочь только противовирусные препараты.
Бактерии и вирусы — это микроскопические организмы, которые могут вызывать заболевания, как у людей, так и у животных или растений. Хотя бактерии и вирусы могут иметь некоторые общие характеристики, они также очень разные. Бактерии обычно намного больше, чем вирусы, и их можно рассмотреть при помощи обычного микроскопа. Вирусы примерно в 1000 раз меньше бактерий и видны только под электронным микроскопом. Бактерии являются одноклеточными организмами, которые размножаются независимо от других организмов. Вирусы нуждаются в помощи живой клетки для воспроизведения.
Примечательно, что вирус имеет гораздо меньшие размеры, чем бактерии. Потому они и способны проходить через антибактериальный фильтр. Размер вируса варьирует от нескольких десятков до трёхсот нанометров. Они недоступны для микроскопического исследования через световое оборудование. Именно это долгое время не позволяло их обнаружить даже при исследовании тканей заражённых организмов.
Проникая в клетки вирусы, начинают свою пагубную деятельность. Иммунная система человека вырабатывает антитела, которые отправляются на поиски злобного паразита. Только вот ни антитела, ни лейкоциты из-за своих огромных размеров не могут проникать сквозь мембрану оболочек человеческих клеток. Обычно соединительная ткань, где находятся микробы, хорошо омывается кровью, а присутствие в организме ее насыщенной антибиотиком помогает мгновенно справляться с ними.
Вирусы проникают в клетку живого организма или бактерию и заставляют органоиды (рибосомы) клетки синтезировать вирусные белки, из которых потом собираются множественные копии вируса. При выходе вирусов из клетки чаще всего происходит её гибель. Новые вирусы с большой скоростью захватывают другие клетки. Так вирус заставляет организм работать на себя. Так, собственно, и прогрессирует инфекция.
Вирус либо разрушает клетку хозяина, либо провоцируют ответ иммунной системы, который проявляется такими симптомами, как чувство усталости, повышение температуры и даже тяжелое повреждение тканей.
Если визуально представить себе огромный дом в 20-25 этажей, то маленькая, упавшая с подоконника коробка спичек это соотношение размеров микроба и вируса. Потому им легко паразитировать, функционировать, питаясь цитоплазмой, при этом, не повреждая внешние ее клетки. Некоторые даже используют в свою пищу микробов, подобные вирусы еще называют фагоцитами.
Иммунная система, как и многие другие физиологические системы, состоит из молекул, клеток, тканей и органов. Главный орган иммунной системы — это вилочковая железа, или тимус — орган, который находится за грудиной и производит особые клетки, самые главные клетки иммунной системы.
— По сути это клетки-регуляторы и клетки-солдаты, и эта армия стоит на защите нашего организма. Но к встрече с вирусом ее нужно готовить. На формирование иммунитета уходит от двух недель до трёх месяцев после прививки. Поэтому ее лучше делать не накануне, а до предположительного времени эпидемии.
Клетки вакцинированного человека подготовлены и научены бороться с вирусом в отличие от клеток невакцинированного. Они выделяют антитела, которые блокируют вирус. Профилированная клетка знает, какие частички нужно выработать, чтобы заблокировать конкретный вирус. Поэтому организм нужно готовить к возможной встрече с вирусом — иммунизировать вакциной, содержащей антигены.
Таким образом, строение вируса предполагает паразитический образ жизни, который необходим микроорганизмам для защиты от окружающей среды. Хотя вирусы достаточно свободно передвигаются в пространстве от одного хозяина к другому. Поэтому они создают высокий риск эпидемий тех заболеваний, где вирусы выступают возбудителем.
Вирус табачной мозаики поражает не только растения табака, но и плодовую мушку, которая им питается. Таким образом, продлевая жизнь мушки и её плодовитость (принося пользу), вирус вредит растениям;
Вирус, поражающий грибок, который размножается в траве возле геотермальных источников, позволяет растению выживать в условиях повышенной температуры. Это выгодно вирусному организму для сохранения хозяина в труднодоступных для истребления местах, где температура достигает 50 градусов по Цельсию;
Некоторые вирусы защищают организм хозяина от проникновения и размножения в организме других вирусных агентов. Вирус охраняет свою территорию и в некоторых случаях не приносит значительного вреда хозяину для сохранения места проживания.
Интересно, что с течением времени такие вирусы становятся не столько паразитами, сколько частью самого организма. Поэтому он начинает передаваться из поколения в поколение и определяется генетическим кодом, как полезное свойство, которое подлежит передаче. Таким образом, вирус сохраняет свое место и наделяет организм хозяина новыми свойствами для выживания.
Передаваться вирусы могут также от больных животных. Часто причиной становится употребление заражённого мяса или тесный контакт с заражёнными особями. Хотя существуют и вирусы, которые не способны передаваться между видами. Такие микроорганизмы для человека и других животных относительно безопасны. Чаще всего человек заражается, употребляя мясо крупного рогатого скота и домашней птицы. Но известны вирусы, которые разносятся дикими животными, например, голубями. Кроме того, при укусах заражённых млекопитающих передаётся вирус бешенства и другие.
Человек может передавать вирусную инфекцию разными путями. В зависимости от локализации возбудителя и особенностей заболевания выделяются следующие пути передачи от человека к человеку:
Воздушно-капельный. Такой вариант передачи присущ в основном вирусам, поражающим дыхательную систему. Вирус витает в воздухе и передаётся потенциальному хозяину в момент вдыхания заражённых воздушных масс;
Половой. Многие вирусы локализуются на слизистых оболочках, затем поражая весь организм. Нередко такие паразиты попадают в организм здорового человека при половом контакте. При этом даже использование презерватива не всегда может защитить от заражения. Влажные поцелуи также могут стать причиной заражения;
Гематогенный. Это происходит в процессе переливания заражённой крови. Чаще всего такое бывает при экстренном переливании, когда кровь не проходит должной проверки с обязательным периодом хранения;
Бытовой. В некоторых случаях вирус может передаваться через личные вещи или попадание на повреждённую кожу заражённых выделений организма больного. Таким путём может передаваться ряд вирусных гепатитов и СПИД, хотя и считается, что вероятность заражения в этом случае относительно низкая.
Некоторые вирусы требуют также хирургического вмешательства для устранения очага инфекции. В частности, представителей контагиозного моллюска или папилломатозные образования (ВПЧ) необходимо удалять хирургическим путём. После удаления проводят иммуномодулирующую терапию, которая направлена на восстановление защитных функций организма. Любой вирус опасен тем, что вызывает подавление иммунной системы, подвергая организм опасности заражения любыми заболеваниями. Особенно этим отличается ВИЧ. Поэтому с ним так сложно бороться и поддерживать жизнеспособность пациента.
Вирусы окружают нас и могут проникать в наш организм. Становясь паразитами, они начинают отбирать ресурсы человеческого организма и медленно убивать нас. Поэтому важно соблюдать меры предосторожности и своевременно проходить вакцинацию. Особенно это важно для тех, кто по профессии много контактирует с людьми, которые могут быть заражены какими-либо вирусами.
В связи с возможностью передачи вируса даже по воздуху или через слизистые оболочки следует укреплять свое здоровье и избегать сомнительных контактов. Беспорядочные половые связи и тесное взаимодействие с больным человеком может привести к заражению. При этом человек может даже не знать о том, что имеет заболевание, и вести самый обычный образ жизни. Поэтому лучше всегда быть осторожными в общении, а также заботиться о себе и своих близких.
Вирус быстро размножается, поедая цитоплазму клеток, вскоре ему становится мало полученного, и он пробивает оболочку клетки, сразу атаковывается антителами. Но если иммунитет упал, то медикаментозное воздействие может рекомендовать врач, например использование иммуноглобулина. Тогда кровью с активными веществами вирус убивать проще, тем более, когда ни уже остались незащищенными и вышли из человеческих клеток. С успехом используются в антивирусной терапии ацикловир, вирамун, эпивир, ремантадин и другие препараты. Именно по этой причини вирусы бесполезно лечить антибактериальной терапией.
Но вся сложность состоит в том, что более девяноста процентов вирусов в человеческом организме находится именно в клетках, а там их не убить и не достать. То есть, по сути, лекарствами их не убить, а пока синтезируются антитела и глобулины внутри организма, особенно если у человека слабый иммунитет пройдет много времени. А за этот период вирус может нанести достаточно вреда организму. Ученых тревожит незащищенность нашего тела от вирусной природы заболеваний.
Бактерии: бактерии являются прокариотическими клетками, которые показывают все характеристики живых организмов. Бактериальные клетки содержат органеллы и ДНК, которые погружены в цитоплазму и окружены клеточной стенкой. Эти органеллы выполняют жизненно важные функции, позволяющие бактериям получать энергию из окружающей среды и воспроизводится.
Вирусы: Вирусы не считаются клетками, а существуют как частицы нуклеиновой кислоты (ДНК или РНК), заключенные в оболочку белка. Также известные как вирионы, вирусные частицы существуют где-то между живыми и неживыми организмами. Хотя они содержат генетический материал, они не имеют клеточной стенки или органелл, необходимых для производства и воспроизводства энергии. Вирусы полагаются исключительно на клетку-хозяина для репликации.
В то время как большинство бактерий безвредны, а некоторые даже полезны для людей, другие бактерии способны вызывать заболевания. Патогенные бактерии, которые вызывают заболевание, продуцируют токсины, разрушающие клетки организма. Они могут вызывать пищевое отравление и другие серьезные заболевания, включая менингит, пневмонию и туберкулез.
Бактериальные инфекции можно лечить антибиотиками, которые очень эффективны при уничтожении бактерий. Однако из-за чрезмерного использования антибиотиков бактерии получили сопротивление к ним. Некоторые из них даже стали известны как супербактерии, поскольку получили устойчивость к множеству современных антибиотиков. Вакцины также полезны для предотвращения распространения бактериальных заболеваний. Лучший способ защитить себя от бактерий и других микробов — это правильно и часто мыть руки.
Вирусы являются патогенами, которые вызывают ряд заболеваний, включая ветрянку, грипп, бешенство, Эбола, болезнь Зика и ВИЧ/СПИД. Вирусы способны вызывать постоянные инфекции, в которых они находятся в состоянии покоя, и могут быть повторно активированы позднее. Некоторые вирусы вызывают изменения в клетках-хозяевах, которые приводят к развитию рака. Известно, что эти вирусы вызывают раковые заболевания, такие как рак печени, рак шейки матки и лимфома Беркитта. Антибиотики не работают против вирусов. Лечение вирусных инфекций обычно связано с лекарствами, которые лечат симптомы инфекции, а не сам вирус. Как правило, иммунная система самостоятельно борется с вирусами. Вакцины также могут использоваться для предотвращения некоторых вирусных инфекций.
Лекарств от вирусной инфекции не существует? На самом деле, они есть. Большинство противовирусных препаратов действуют по одному из трех механизмов.
Второй – нарушение структуры новых вирусных частиц. Подобного рода лекарственные препараты представляют собой измененные аналоги азотистых оснований, служащих материалом для синтеза нуклеиновых кислот. Из-за структурного сходства они встраиваются в ДНК или РНК размножающегося в клетках вируса, делая новые вирусные частицы дефектными, неспособными к поражению новых клеток. Пример такого препарата – ацикловир, применяющийся для лечения герпетических инфекций.
Третий механизм – не допустить попадание вируса в клетку. Лекарство препятствуют отсоединению вирусной ДНК или РНК от белковой оболочки, из-за чего генетический материал вируса теряет способность проникать сквозь клеточную мембрану. Так действует, например, ремантадин.
Все вышеперечисленные препараты действуют только на активно размножающиеся вирусы.
Читайте также:


