Вирусы у которых есть обратная транскриптаза
Обратная транскриптаза (ревертаза или РНК-зависимая ДНК-полимераза) представляет собой фермент, катализирующий синтез ДНК на матрице РНК в процессе, который получил название “обратная транскрипция”. Название процесса отражает противоположность процессу транскрипции, осуществляемой в другом направлении: с молекулы ДНК-матрицы синтезируется РНК-транскрипт.
Эти ферменты были выделены из РНК-содержащих вирусов (ретровирусов). Обратная транскриптаза используется опухолеродными вирусами для транскрипции м-РНК в комплементарную цепь ДНК. При изучении ретровирусов, геном которых представлен молекулами одноцепочечной РНК, было обнаружено, что в процессе внутриклеточного развития ретровирус проходит стадию интеграции своего генома в виде двухцепочечной ДНК в хромосомы клетки-хозяина. В 1964 г. Темин выдвинул гипотезу о существовании вирусспецифичного фермента, способного синтезировать на РНК-матрице комплементарную ДНК. Усилия, направленные на выделение такого фермента, увенчались успехом, и в 1970 г. Темин с Мизутани, а также независимо от них Балтимор открыли искомый фермент в препарате внеклеточных вирионов вируса саркомы Рауса. Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза, или ревертаза.
Наиболее детально изучена ревертаза ретровирусов птиц. Каждый вирион содержит около 50 молекул этого фермента. Обратная транскриптаза состоит из двух субъединиц — a (65 кДа) и b (95 кДа), присутствующих в эквимолярном количестве. Обратная транскриптаза обладает, по крайней мере, тремя ферментативными активностями:
1) ДНК-полимеразной, использующей в качестве матрицы как РНК, так и ДНК;
2) активностью РНКазы Н, гидролизующей РНК в составе гибрида РНК - ДНК;
3) ДНК-эндонуклеазной активностью.
Первые две активности необходимы для синтеза вирусной ДНК, а эндонуклеаза, по-видимому, важна для интеграции вирусной ДНК в геном клетки-хозяина. Очищенная обратная транскриптаза синтезирует ДНК как на РНК-, так и на ДНК-матрицах (рис. 11).

Рис. 11. Схема синтеза двухцепочечных ДНК-копий молекул РНК
Чтобы начать синтез, ревертазе, как и другим полимеразам, необходим короткий двухцепочечный участок (праймер). Праймером может служить одноцепочечный сегмент как РНК, так и ДНК, которые в процессе реакции оказываются ковалентно связанными с новосинтезированной цепью ДНК. В генетической инженерии используют как олиго-(дТ) праймеры, комплементарные 3'-полиА концам мРНК, так и набор “случайных” по составу и последовательности гексануклеотидов (random primers). Часто для молекул РНК с известной первичной последовательностью, не имеющих З'-поли (А) концов, используют химически синтезированные олигонуклеотиды, комплементарные З'-концу
Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера.
Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E. coli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи. Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми, и для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований.
Дата добавления: 2016-02-09 ; просмотров: 1636 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Обратная транскриптаза – персональная ретроспектива
Темин даже не пытался объяснить непрофессионалам свое изобретение. А я все же попробую. Я была свидетелем того, как все происходило. Он открыл обратную транскриптазу (ОТ) – фермент, необходимый для репликации ретровирусов, в частности ВИЧ. Этот фермент играет гораздо более важную роль, чем просто фермент для репликации вируса, и, как прогнозировал Темин, он играет важную роль в композиции нашего генома. Эти родственники ретровирусов амплифицируют наши гены, изменяют набор генов наших геномов, но никогда не покидают клетку. В настоящее время даже существует гипотеза, согласно которой РНК в процессе эволюции превратилась в ДНК именно благодаря обратной транскриптазе. Когда я начала исследования обратной транскриптазы, о ней еще ничего не знали, а сейчас, 45 лет спустя, ее рассматривают в качестве одного из наиболее распространенных и, вероятно, самых важных белков, известных в биологии.
Гюнтер Стент, знаменитый генетик, переехавший из Берлина, пригласил меня к себе в офис в Беркли – у него на столе стоял макет здания Общества Макса Планка в Тюбингене, и он предложил мне поехать туда поработать. Именно так я и поступила: за день рассмотрела три темы и решила выбрать ту, которая показалась мне наиболее интересной и которая, вероятнее всего, могла быстро дать результаты. Восхитительный вид на горную цепь Швабская Юра оказал на мое решение большое влияние ненаучного свойства. Я привнесла в вирусологический институт молекулярную биологию. Однако сначала мне пришлось преодолеть трудный барьер. Мне нужно было научиться изолировать вирус из живых цыплят, которых я заразила вирусом миелобластоза птиц (ВМП), индуцирующим одно из заболеваний крови. Эта процедура предусматривала забор образцов крови непосредственно из сердца цыпленка при помощи гиподермичной иглы – сегодня такой метод не разрешили бы. Предметом изучения моего проекта был механизм репликации этого вируса. Однако несколько месяцев движения вперед в проекте не наблюдалось.
Существует еще один аспект. Меня часто спрашивают: откуда ученые берут идеи и как делаются открытия? Приведу один пример: сходите с другими учеными, задавайте вопросы, слушайте и учитесь! Только не ходите в фастфуд!
Очень известному позднее вирусологу Питеру Дюсбергу, который был замечательным ученым и преподавателем в Беркли в годы моего пребывания там (а известен он был не только тем, что приклеивал на инкубатор для выращивания культур тканей довольно пикантные фотографии красоток), не удавалось обнаружить в мышиных вирусах фермент РНКаза Н, удаляющий РНКазу. А я изучала куриный вирус. Дюсберг утверждал, что этой РНКазы Н в мышиных вирусах нет. Поэтому, с его точки зрения, мои наблюдения представляли собой единичное исключение, характерное для птичьего вируса. К счастью для меня, он опубликовал свою точку зрения. Это было самое лучшее, что для меня, молодого ученого, могло произойти, поскольку это позволило мне доказать неправоту ученого с мировым именем. Мы с ним дружили всю жизнь. Он часто заходил ко мне, когда приезжал в Берлин к матери; мы даже устраивали крупномасштабные подиумные дискуссии об опасности самого важного ретровируса – ВИЧ и практически никогда не сходились во мнениях.
Будучи физиком по образованию и аспиранткой, я не умела выделять фермент ОТ. Я снимала комнату в St. Joseph’s Home в Цюрихе (там на прикроватной тумбочке лежала Библия). Мне разрешили наблюдать, как в Институте Чарльза Вайссмана при Цюрихском университете выделяют фермент. Я сидела в холодном помещении – при более высокой температуре фермент теряет активность – и, дрожа всем телом, наблюдала, как оператор проводил изоляцию. Вайссман изолировал Q-бета репликазу из бактерий (об этом пойдет речь в последней главе). После этого я вернулась домой, в Общество Макса Планка в Тюбинге, чтобы выделить из птичьего вируса фермент ОТ, реплицирующий вирус. Мне нужно было научиться у Вайссмана рассчитывать объем материала на входе и выходе, иметь представление о количественных показателях и проверять их баланс. И, какими бы исследованиями после этого мне ни приходилось заниматься, я никогда не забывала количественно определять свои действия. Вместе с Институтом Вайссмана мы разработали несколько моделей репликации вируса при помощи ОТ и РНКазы Н и сделали несколько совместных публикаций. Но процесс репликации ретровируса оказался гораздо сложнее, чем мы предполагали, то есть таким, каким его методом проб и ошибок создала природа. Через несколько лет ко мне обратилась Boehringer Company и заказала большой объем фермента ОТ для продажи: все лаборатории хотели использовать его для получения ДНК из РНК. Проблема, касавшаяся двух субъединиц, оказалась очень значимой, но ее удалось автоматически решить в процессе хранения фермента, как это произошло в моей морозильной камере. Я была рада, что мне удалось компенсировать институту в Берлине затраты на проведение исследования.
Позднее в своей исследовательской деятельности мне приходилось сталкиваться с тем, что люди боятся нашей работы. Так было в случае с гриппом, ТОРС и вирусом рака, поскольку заражались не только коллеги, но и их сослуживцы, и часто мужья и жены. Подозрительность была вполне оправданна, поскольку действительно было несколько инцидентов – в Китае, например, из лаборатории с высокой степенью биозащиты пропадал вирус ТОРС (три раза!); кроме того, однажды исчезло несколько лабораторных лягушек ( и это стало огромной проблемой в Калифорнии.
86. 1. Определение, химический состав вирусов, функции компонентов.
Функция нуклеиновой кислоты вируса: …
Функция белков вирусных частиц: …
Размножение вирусов, синтез их нуклеиновых кислот.
Где размножается вирус?
О видах вирусов
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
Как вирусная частица попадает в клетки.
Что происходит с вирусной частицей после её попадания в клетку.
86. 3. Онкогенные вирусы. См. п.87.
86. 4. ВИЧ. См. п.77 и 80.
86. 5. Прионы.
86. 1. Определение, химический состав вирусов, функции компонентов. –
Опеределение вируса.
Вирусами называют КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ С БЕЛКАМИ,
которые могут находиться во внешней среде вне клеток и
могут при попадании в организм проникать в клетки и размножаться внутри клеток.
Некоторые вирусы вдобавок к НК и белкам содержат липиды и углеводы.
Таким образом, вирусы не являются клетками, у вирусов нет органелл.
Отдельный комплекс нуклеиновых кислот с белками называется вирусной частицей или вирионом.
Функция нуклеиновой кислоты вируса:
нуклеиновые кислоты используются для синтеза белков вирусных частиц (кодируют первичную структуру белка).
Функция белков вирусных частиц:
1 – защищают НК от повреждений (НК сами по себе очень неустойчивы), образуя оболочку вокруг НК,
2 – участвуют в размножении вирусов в качестве ферментов и т.д. см. далее.
Углеводы вирусных частиц часто находятся на поверхности вирусных частиц и могут помогать вирусным частицам проникать в клетки.
Отдельная вирусная частица и вирусные частицы данного вида вирусов содержат только один вид НК – или ДНК, или РНК.
Вирусы, в вирионе которых находится ДНК, называются ДНК-овые вирусами,
а вирусы, в вирионе которых находится РНК, называются, РНК-овыми вирусами.
ДНК вируса может быть не только двухцепочечной, но и ОДНОЦЕПОЧЕЧНОЙ.
РНК вируса может быть как одноцепочечной (как в клетках), так и ДВУХЦЕПОЧЕЧНОЙ.
Размножение вирусов, синтез их нуклеиновых кислот.
Синтез нуклеиновых кислот вирусов происходит разными способами. –
1) Наряду с репликацией ДНК (см. п. 78),
2) у вирусов есть репликация РНК
3) и обратная транскрипция (см. п.80).
Какой бы ни была нуклеиновая кислота в самом вирионе,
при размножении вируса происходит синтез вирусных матричных РНК для синтеза вирусных белков (для трансляции).
Где размножается вирус?
Синтез вирусных нуклеиновых кислот и синтез вирусных белков может происходить только внутри клеток,
так как для синтезов нужны среда, рибосомы (осуществляются синтез белка), нуклеотиды и аминокислоты и т.д.
Поэтому размножаться вне клеток вирусы не могут. –
Пока вирус не проник в клетку, он не может размножаться, не может как-то влиять на обмен веществ в организме.
Поэтому наличие вируса (вирионов) в крови
не означает, что человек будет болеть болезнью, которая вызывается этим вирусом.
Он может заболеть, только если вирусные частицы проникнут в клетки,
а если они не проникнут в клетки, то человек не заболеет, хоть и будет носителем вируса.
О видах вирусов
Вирусы, содержащие разные нуклеиновые кислоты (то есть с разными последовательностями нуклеотидов) и разные белки, относят к разным видам вирусов.
Вирусные частицы с одинаковыми (или очень похожими) последовательностями нуклеотидов в НК, относятся к вирусу одного и того же вида.
Кроме того, последовательность нуклеотидов нуклеиной кислоты вируса данного вида
может меняться, то есть вирус может мутировать.
В итоге получается другой ШТАММ данного вида вируса, но сам вирус относится к тому же виду вирусов, что и до мутации.
Вирусы, которые поражают бактерии, называются БАКТЕРИОФАГАМИ.
Бактериофаги могут использоваться для внесения в клетку бактерии чужих для неё генов для синтеза клеткой белков, кодируемых этими генами,
То есть бактериофаги могут играть роль векторов – это используется генной инженерией.
В эукариотические клетки вирусы попадают не так, как в бактериальные (далее).
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
При попадании вирусной частицы в организм её должны заметить и уничтожить клетки иммунной системы
(с помощью АНТИТЕЛ – специальных белков, задача которых – распознавание антигенов)
для того чтобы вирус не успел проникнуть в клетку, размножиться в ней, убить её и заражать новые клетки.
Как вирусная частица попадает в клетки.
Проникновение вирусной частицы в клетку начинается с того, что
вирус связывается с определённым белком на поверхности клетки,
который таким образом выполняет функцию РЕЦЕПТОРА клетки для этого вируса.
Роль рецептора вируса обычно играют белки, предназначенные для других целей –
например, ВИЧ использует рецепторы хемокинов.
Если рецепторы вируса отличаются от обычных так, что вирус не может с их помощью проникнуть в клетку, то вирус не приведёт к заболеванию.
Причиной отличия рецептора может быть мутация гена, который кодирует этот рецептор.
Что происходит с вирусной частицей после её попадания в клетку.
После попадания вирусной частицы внутрь клетки
вирусная нуклеиновая кислота высвобождается, после чего
могут синтезироваться новые молекулы вирусной нуклеиновой кислоты (см. п.77)
и новые молекулы вирусных белков (п.82).
После этого из молекул вирусных нуклеиновых кислот и молекул вирусных белков
могут образовываться новые вирусные частицы –
так происходит РАЗМНОЖЕНИЕ ВИРУСОВ.
Новые вирусные частицы могут покидать клетку, в которой образовались,
и поступать в новые клетки, заражая всё новые и новые клетки.
Если заражённые вирусом клетки подвергнутся АПОПТОЗУ (см. п. 79),
то распространение вирусных частиц может затормозиться.
Поэтому замедленный апоптоз способствует распространению вирусной инфекции.
Накопление вирусных частиц в клетке может приводить к РАЗРУШЕНИЮ КЛЕТКИ;
кроме того, оно нарушает нормальную жизнедеятельность клетки и организма –
всё это приводит к появлению симптомов вирусной инфекции.
Нуклеиновые кислоты некоторых вирусов (см. ВИЧ далее) могут использоваться
в качестве матриц для образования двухцепочечных ДНК (вирусных ДНК),
которые способны встраиваться в ДНК человека –
это встраивание называется интегрированием в геном,
оно относится к ПЕРЕСТРОЙКАМ генома – см. п.79.
86. 3. Онкогенные вирусы. См. п.87.
Некоторые вирусы способствуют появлению онкологических заболеваний.
Такие вирусы называются онкогенными вирусами.
Примеры онкогенных вирусов:
вирус папилломы человека способен приводит к раку матки,
вирусы гепатитов В и С приводят к раку печени.
Онкогенные вирусы относят к группе биологических мутагенов – см. п.79.
Почему некоторые вирусы могут приводить к онкологическим заболеваниям (см. п.87 и п.92, 98):
потому что онкогенные вирусы приводят к таким МУТАЦИЯМ,
которые способствуют появлению онкологических заболеваний.
Например, считается, что онкогенными являются те вирусы,
которые приводят к встраиванию вирусных ДНК в ДНК (геном) человека (интегрируется).
Потому что это встраивание может изменить тот участок ДНК,
в который встраивается вирусная ДНК (то есть привести к мутации).
В норме, до мутации, протоонкоген кодирует белки, которые стимулируют деление клеток и относятся к онкобелкам.
В норме активность онкобелков регулируется,
поэтому они стимулируют деление клетки только тогда, когда нужно –
и поэтому деление клетки (и образованных при её делении клеток) не приводит к образование опухоли.
Но после мутации протоонкогена он может измениться так, что
кодируемые им онкобелки не смогут регулироваться
и станут стимулировать деление клетки постоянно, без остановки,
что может привести к появлению опухоли,
если мутантные клетки не подвергнутся апоптозу
или не уничтожатся клетками иммунной системы.
86. 4. ВИЧ. См. п.77 и 80.
ВИЧ – это вирус иммунодефицита человека.
Размножение ВИЧ в организме человека может привести к развитию СПИДа –
Синдрома Приобретённого Иммунодефицита Человека.
ВИЧ повреждает клетки иммунной системы (Т-хелперы, макрофаги),
что приводит к дефициту иммунных клеток и снижению иммунитета (иммунодефициту).
1. После попадания ВИЧ в организм человека
ВИЧ, как и все вирусы, сначала связывается с рецепторами на поверхности клеток:
ВИЧ связывается с рецепторами хемокинов
(хемокиновыми рецепторами;
хемокины – это гормоны, относятся к цитокинам)
и СД4 рецепторами на поверхности клеток иммунной системы.
Связыванию ВИЧ с рецепторами помогают гликопротеины, расположенные на поверхности вирусной частицы ВИЧ.
Есть люди, в организме которых есть ВИЧ, но у которых не развивается СПИД –
то есть они являются носителями вируса, они могут заразить ВИЧ,
но больными они не являются.
Предполагают, что это связано с тем, что ВИЧ не может размножаться в организме этих людей,
поскольку не проникает в их клетки из-за особенностей строения рецепторов ВИЧ у этих людей:
возможно, из-за мутаций генов, кодирующих эти рецепторы.
2. В качестве нуклеиновой кислоты в ВИЧ содержится одноцепочечная РНК.
В клетках РНК вируса становится матрицей для синтеза комплементарной ей цепи ДНК
(комплементарной ДНК, кДНК),
который катализируется ферментом обратная транскриптаза
(потому что синтез ДНК на матрице РНК называется обратной транскрипцией),
который содержался в вирусной частице ВИЧ.
Затем на матрице первой цепи ДНК синтезируется вторая цепь ДНК,
в результате чего образуется двухцепочечная ДНК.
Эта вирусная ДНК способна встраиваться в ДНК человека
с помощью фермента ИНТЕГРАЗЫ, который тоже содержится в вирусной частице ВИЧ.
3. В некоторый момент вирусная ДНК, находящаяся в составе ДНК человека,
может использоваться для синтеза вирусных РНК (то есть для транскрипции – п.80).
4. Вирусные РНК могут использоваться для синтеза вирусных белков (для трансляции) с помощью рибосом самой клетки.
5. Один из ферментов ВИЧ осуществляет расщепление полипептидной цепи, синтезированной на вирусной РНК;
этот фермент называется ПРОТЕАЗОЙ.
В итоге образуются вирусные белки, в том числе уже названные протеаза, интеграза и обратная транскриптаза.
6. Объединение вирусных белков с вирусной РНК приводит
к появлению новых вирусных частиц ВИЧ,
которые могут разрушать клетки, поступать в кровь и проникать в новые клетки.
Диагностика ВИЧ
осуществляется методом ПЦР и с помощью иммуноферментного анализа.
Метод ПЦР быстрее и надёжнее.
СПИД пока считается неизлечимым заболеванием.
Но замедлить развитие СПИДа и продлить жизнь человека, инфицированного ВИЧ, можно за счёт замедления размножения ВИЧ в организме заражённого.
Размножение ВИЧ замедляется за счёт применения лекарств,
снижающих активность ферментов ВИЧ, участвующих в размножении ВИЧ (см. выше),
то есть за счёт применения ИНГИБИТОРОВ ферментов ВИЧ.
Чем раньше начинают лечение инфицированного ВИЧ – тем дольше он проживёт. Поэтому важно вовремя делать анализ на ВИЧ при наличии оснований предполагать, что человек мог заразиться ВИЧ.
При наличии ВИЧ у беременной есть шанс родить здорового ребёнка,
если вовремя сделать анализ на ВИЧ и провести лечение.
Прионами называют белки с особой структурой, которая приводит к так называемым прионовым болезням:
куру, болезни Крейцфельдта-Якобы, почесухе овец, коровьему бешенству.
У прионов есть способность
превращать молекулы нормальных белков в прионы
за счёт того, что под влиянием структуры уже имеющихся молекул прионов
структура молекул ряда других белов может измениться так,
что эти молекулы тоже становятся прионами –
нерастворимыми в воде молекулами,
под влиянием которых могут стать прионами другие молекулы белков –
то есть происходит как бы цепная реакция;
из-за этого число прионов в организме становится всё больше.
Из-за этого свойства прионы считаются инфекционными белками,
а прионовые болезни считаются заразными
(заражение происходит при попадании прионов в организм – обычно в качестве пищи).
В случае с прионами увеличение числа болезнетворных молекул
происходит не путём деления клеток
(в отличие от бактериальных и других инфекций, где бактерии размножаются делением)
и не путём синтеза нуклеиновых кислот (см. выше о размножении вирусов),
а под влиянием уже имеющихся молекул прионов.
Прионы могут оказаться в организме не только в результате заражения
(не только при съедении пищи, содержащей прионы),
но и в результате мутаций генов некоторых белков.
Из-за своей структуры прионы не уничтожаются и не теряют свои вредные свойства при сколь угодно долгой варке, поэтому варка не является способом сделать пищу безопасной и свободной от прионов. Единственный способ исключить возможность заражения прионами при эпидемиях коровьего бешенства – это не употреблять в пищу мясо, тушёнку, консервы, желатин и т.д.А единственный способ уничтожить прионы - только сжечь. Прионы устойчивы и к действию других факторов, которые разрушают структуру обычных белков, то есть прионы устойчивы к денатурации под действием излучений, ультразвука и т.д.
Современная биология поражает уникальностью и масштабностью своих открытий. На сегодняшний день эта наука изучает большинство процессов, которые скрыты от нашего глаза. Этим примечательна молекулярная биология – одно из перспективных направлений, которое помогает разгадать сложнейшие тайны живой материи.
Что такое обратная транскрипция
Обратная транскрипция (сокращенно ОТ) – это специфический процесс, характерный для большинства РНК-содержащих вирусов. Главной его особенностью является синтез двухцепочечной молекулы ДНК на базе матричной РНК.
ОТ не характерна для бактерий или эукариотических организмов. Главный фермент – ревертаза – играет ключевую роль в синтезе двухцепочечной ДНК.
История открытия
Идея о том, что молекула рибонуклеиновой кислоты может стать матрицей для синтеза ДНК, считалась абсурдной вплоть до 1970 года. Тогда Балтимор и Темин, работавшие отдельно друг от друга, почти одновременно открыли новый фермент. Они назвали его РНК-зависимая-ДНК-полимераза, или обратная транскриптаза.
Открытие данного энзима безоговорочно подтвердило существование организмов, способных к обратной транскрипции. В 1975 году оба ученых получили Нобелевскую премию. Через некоторое время Энгельгардт предложил альтернативное название обратной транскриптазы – ревертаза.

Почему ОТ противоречит центральной догме молекулярной биологии
Центральная догма – это принципиальная схема последовательного синтеза белка в любой живой клетке. Такая схема строится из трех компонентов: ДНК, РНК и белок.
Согласно центральной догме, РНК может синтезироваться исключительно на матрице ДНК, а уж затем РНК участвует в построении первичной структуры белка.
Эта догма была официально принята в научном обществе раньше, чем произошло открытие обратной транскрипции. Неудивительно, что идея об обратном синтезе ДНК из РНК долго отвергалась учеными. Лишь в 1970 году вместе с открытием ревертазы была поставлена точка в этом вопросе, что отразилось и в принципиальной схеме синтеза белка.
Ревертаза ретровирусов птиц
Процесс обратной транскрипции не обходится без участия РНК-зависимой-ДНК-полимеразы. Максимально изучена на сегодняшний день ревертаза ретровируса птиц.
Всего около 40 молекул этого белка можно обнаружить в одном вирионе этого семейства вирусов. Протеин состоит из двух субъединиц, которые находятся в равном количестве и выполняют три важнейшие функции ревертазы:
1) Синтез молекулы ДНК как на матрице одноцепочечной/двухцепочечной РНК, так и на основе дезоксирибонуклеиновых кислот.
2) Активация РНКазы Н, главная роль которой заключается в расщеплении молекулы РНК в комплексе РНК-ДНК.
3) Разрушение участков молекул ДНК для встраивания в геном эукариот.
Механизм ОТ
Этапы обратной транскрипции могут варьироваться в зависимости от семейства вирусов, т.е. от вида их нуклеиновых кислот.
Рассмотрим сначала те вирусы, которые используют ревертазу. Здесь процесс ОТ делится на 3 этапа:
Такой способ размножения вирионов характерен для некоторых онкогенных вирусов и вируса иммунодефицита человека (ВИЧ).
Стоит отметить, что для синтеза любой нуклеиновой кислоты на матрице РНК нужна затравка, или праймер. Праймер представляет собой короткую последовательность нуклеотидов, комплементарную 3’-концу молекулы РНК (матрицы) и играющую важную роль в инициации синтеза.
Когда готовые двухцепочечные молекулы ДНК вирусного происхождения встраиваются в геном эукариот, запускается обычный механизм синтеза белков вириона. В итоге “захваченная” вирусом клетка становится фабрикой по производству вирионов, где в больших количествах образуются необходимые молекулы протеинов и РНК.
Повторение таких циклов приводит как к репликации генома вируса, так и к образованию мРНК, способных к синтезу белка в условиях зараженной эукариотической клетки.
Биологическое значение обратной транскрипции
Процесс ОТ имеет первостепенное значение в жизненном цикле многих вирусов (в первую очередь ретровирусов, таких как ВИЧ). РНК вириона, атаковавшего клетку эукариот, становится матрицей для синтеза первой цепочки ДНК, на которой не трудно достроить и вторую цепь.
Полученная двухцепочечная ДНК вируса встраивается в геном эукариот, что приводит к активации процессов синтеза белков вириона и появлению большого количество его копий внутри зараженной клетки. В этом и заключается основная миссия ревертазы и ОТ в целом для вируса.
У эукариот также может встречаться обратная транскрипция в контексте ретротранспозонов – мобильных генетических элементов, способных самостоятельно транспортироваться из одного участка генома в другой. Такие элементы, как считают ученые, стали причиной эволюции живых организмов.
Ретротранспозон представляет собой участок ДНК эукариот, который кодирует несколько белков. Один из них, ревертаза, принимает непосредственное участие в делокализации такого ретротраспорозона.
Использование ОТ в науке
С того момента, как удалось выделить ревертазу в чистом виде, процесс обратной транскрипции взяли на вооружение ученые-биологи. Изучение механизма ОТ и сейчас помогает прочитать последовательности важнейших белков человека.
Дело в том, что геном эукариот, в том числе и нас, содержит неинформативные участки под названием интроны. Когда с такой ДНК считывается последовательность нуклеотидов и формируется одноцепочечная РНК, последняя лишается интронов и кодирует исключительно белок. Если с помощью ревертазы на матрице РНК синтезировать ДНК, ее легко потом секвенировать и узнать порядок нуклеотидов.
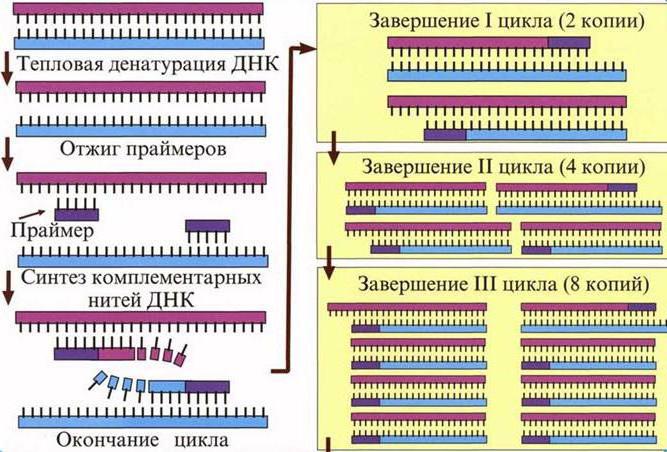
Нуклеиновая кислота, которая была образована с помощью обратной транскриптазы, называется кДНК. Она часто используется в полимеразной цепной реакции (ПЦР), чтобы искусственно увеличить число копий полученной копии кДНК. Данный метод используется не только в науке, но и в медицине: лаборанты определяют сходство такой ДНК с геномами различных бактерий или вирусов из общей библиотеки. Синтез векторов и внедрение их в бактерии – одно из перспективных направлений биологии. Если с помощью ОТ формировать ДНК человека и других организмов без интронов, такие молекулы легко внедряются в геном бактерий. Так последние становятся фабриками по производству необходимых человеку веществ (например, ферментов).
Читайте также:


