Живая гриппозная вакцина детская
Владелец регистрационного удостоверения:
Лекарственная форма
рег. №: ЛСР-002340/09 от 23.04.12 - БессрочноФорма выпуска, упаковка и состав препарата Ультрагривак ® Вакцина гриппозная живая
Лиофилизат для приготовления раствора для интраназального введения в виде аморфной массы белого цвета.
| 1 доза (0.5 мл) | |
| вирус гриппа птиц типа А | 10 7 ЭИД 50 |
Вспомогательные вещества: стабилизатор М-2 30.6 мг.
Растворитель: вода д/и - 1 мл.
ЭИД 50 - средняя эмбриональная инфицирующая доза (количественный показатель вирулентности возбудителя инфекционной болезни, выражаемый значением инфицирующей дозы, которая при данном пути заражения вызывает развитие болезни у 50% экспериментальных животных).
0.5 мл (1 доза) - ампулы стеклянные (1) в комплекте с растворителем 1 мл амп. 1 шт., шприцем с иглой в контурной безъячейковой упаковке и насадкой Actuators-183.016 - пачки картонные.
3 мл (6 доз) - ампулы стеклянные (1) в комплекте с растворителем 5 мл амп. 1 шт., шприцем с иглой в контурной безъячейковой упаковке и 6 насадками Actuators-183.016 - пачки картонные.
3 мл (6 доз) - ампулы стеклянные (1) в комплекте с растворителем 5 мл амп. 1 шт., шприцем с иглой и насадкой Actuators-183.016 - упаковки ячейковые контурные (1) - пачки картонные.
0.5 мл (1 доза) - ампулы стеклянные (2500) - коробки картонные.
Фармакологическое действие
Вакцина вызывает формирование специфического иммунитета у людей против гриппа птиц типа А. Защитный эффект вакцины, как правило, наступает через 21 день после второй вакцинации.
Показания препарата Ультрагривак ® Вакцина гриппозная живая
- специфическая профилактика гриппа птиц у людей.
Вакцинация рекомендована по эпидемическим показаниям лицам от 18 до 60 лет.
Открыть список кодов МКБ-10| Код МКБ-10 | Показание |
| Z25.1 | Необходимость иммунизации против гриппа |
Режим дозирования
Вакцину вводят интраназально 2-х кратно с интервалом в 10 дней посредством распылителя - дозатора (РД).
Непосредственно перед вакцинацией содержимое ампулы растворяют при комнатной температуре в 0,5 мл растворителя, входящего в комплект вакцины. Вакцина должна полностью растворяться в течение 3-х мин. Растворенный препарат -бесцветная, слегка опалесцирующая жидкость.
Непригоден к применению препарат в ампулах с нарушенной целостностью, маркировкой, а также при изменении его физических свойств (цвета, прозрачности), при неправильном хранении.
Вакцина вводится в носовые ходы из расчета 0,25 мл в каждое носовое отверстие. Для введения вакцины в виде мелкодисперсной смеси используются стерильный шприц, стерильная игла и одна съемная насадка Actuators-183.016 одноразового использования, входящие в комплект вакцины.
Наконечник-распылитель вводят на глубину 0,5 см в носовые ходы, предварительно очищенные от слизи. Прививаемый должен находиться в сидячем положении со слегка запрокинутой головой. После введения вакцины прививаемый должен оставаться в сидячем положении со слегка запрокинутой головой в течение 1 мин. Растворенная вакцина должна быть использована в течение 30 мин.
Способ применения при вакцинации:
1. Надеть иглу на шприц, наполнить его растворителем (вода для инъекций) комнатной температуры, входящим в комплект вакцины, в объеме 0,5 мл.
2. Для растворения наполнить вскрытую ампулу с вакциной растворителем из шприца.
3. После растворения заполнить шприц препаратом в объеме 0,5 мл (отметка 20 по шкале 80 единиц или отметка 50 по шкале 100 единиц).
4. Снять иглу и надеть плотно съемную насадку Acuators-183.016 (наконечник-распылитель).
5. Поднести вплотную к носовому ходу наконечник-распылитель и резкими нажатиями на поршень шприца впрыснуть вакцину в каждый носовой ход по 0,25 мл.
Побочное действие
После вакцинации в течение 4 сут у некоторых привитых могут появиться: повышение температуры до 37,5° С, легкое недомогание, головная боль, незначительные катаральные явления. Допускается наличие реакций с повышением температуры выше 37,5 °С не более, чем у 2 % привитых. Продолжительность температурной реакции не должна превышать 3 сут.
Противопоказания к применению
- острые инфекционные и неинфекционные заболевания;
- хронические заболевания в стадии обострения или декомпенсации;
- гиперчувствительность к куриному белку;
- реакция или поствакцинальное осложнение на предыдущее введение сезонных противогриппозных вакцин;
- иммунодефицитное состояние (первичное), иммуносупрессия, злокачественные новообразования;
- заболевания носоглотки в стадии обострения;
- беременность и период кормления грудью.
Применение при беременности и кормлении грудью
Противопоказан при беременности, в период лактации.
Применение у детей
Применение у пожилых пациентов
Особые указания
Все лица, подлежащие прививкам, должны быть обследованы врачом (фельдшером) с учетом анамнестических данных. В день прививки вакцинируемые должны быть осмотрены врачом (фельдшером) с обязательной термометрией. При температуре выше 37°С прививки не проводят. За правильность назначения прививки отвечает врач (фельдшер). Проведенную прививку регистрируют в установленных учетных формах с указанием даты, предприятия-производителя препарата, номера серии, реакции на прививку.
Острые инфекционные и неинфекционные заболевания являются временными противопоказаниями для проведения прививок. Прививку проводят через 2-4 недели после выздоровления. При нетяжелых ОРВИ, острых кишечных заболеваниях и др. прививку проводят после нормализации температуры.
Прививаемый должен находиться в сидячем положении со слегка запрокинутой головой. После введения вакцины прививаемый должен оставаться в сидячем положении со слегка запрокинутой головой в течение 1 мин. Растворенная вакцина должна быть использована в течение 30 мин.
Действующее вещество:
Инструкция по медицинскому применению
Вакцина гриппозная аллантоисная интраназальная живая сухая
Инструкция по медицинскому применению - РУ № Р N003224/01
Дата последнего изменения: 27.03.2013
Лиофилизат для приготовления раствора для интраназального введения.
Одна прививочная доза (0,5 мл) содержит:
- реассортантный вирус гриппа подтипов А/H1N1/ и A/H3N2/ – не менее 10 6,9 ЭИД50;
- реассортантный вирус гриппа типа В – не менее 10 6,4 ЭИД50.
- стабилизатор М-2: сахароза – 15 мг, лактозы моногидрат – 6 мг, глицин – 3 мг, натрия глутамата моногидрат – 3 мг, трометамол – 0,3 мг, натрия хлорид – 0,3 мг, желатин – 3 мг.
Аморфная масса белого цвета.
Вакцина представляет собой реассортантные вирусы гриппа подтипов A/H1N1/, A/H3N2/ и типа В, полученные из вируссодержащей аллантоисной жидкости куриных эмбрионов.
Активная профилактика гриппа у взрослых без ограничения возраста и у детей с 3-х летнего возраста.
Вакцинацию проводят однократно в осенне-зимний период ежегодно.
Вакцинация в первую очередь рекомендована лицам с высоким риском возникновения осложнений и лицам по роду профессии имеющим высокий риск заболевания гриппом или заражения других лиц: лица старше 60 лет, лица, страдающие хроническими соматическими заболеваниями, часто болеющие ОРЗ; дошкольники, школьники, медицинские работники, работники сферы обслуживания, транспорта, учебных заведений.
1. Острые инфекционные и неинфекционные заболевания являются временными противопоказаниями для проведения прививок. Прививку проводят через 2-4 недели после выздоровления. При нетяжелых ОРВИ, острых кишечных заболеваниях и др. прививку проводят после нормализации температуры.
2. Хронические заболевания в стадии обострения или декомпенсации.
3. Аллергические реакции на куриный белок и другие компоненты вакцины.
4. Побочная(-ые) реакция(-и) или поствакцинальное осложнение на предыдущее введение вакцин для профилактики гриппа.
5. Иммунодефицитные состояния, иммуносупрессия, злокачественные новообразования.
Все лица, подлежащие вакцинации, должны быть обследованы врачом (фельдшером) с учетом анамнестических данных. В день прививки вакцинируемые должны быть осмотрены врачом (фельдшером) с обязательной термометрией. При температуре выше 37°С прививки не проводят. За правильность назначения прививки отвечает врач (фельдшер). Проведенную прививку регистрируют в установленных учетных формах с указанием даты, предприятия-производителя препарата, номера серии, реакции на прививку.
Вакцину вводят интр аназально с помощью распылителя -дозатора одноразового использования (РД).
Непосредственно перед введением вакцины содержимое ампулы растворяют при комнатной температуре в 0,5 мл растворителя, идущего в комплекте с препаратом. Вакцина должна растворяться в течение 3-х мин.
Растворенный препарат – прозрачная или слегка опалесцирующая бесцветная жидкость. Растворенная вакцина должна быть использована в течение 30 мин.
Непригоден к применению препарат в ампулах с нарушенной целостностью, маркировкой, а также при изменении его физических свойств (цвета, прозрачности), при неправильном хранении.
Вакцину вводят в носовые ходы из расчета 0,25 мл в каждый носовой ход.
Распылитель-дозатор одноразового использования состоит из стерильного шприца со шкалой делений на 40 и 100 единиц*, стерильно й иглы и одной съемной насадки- распылителя для создания мелкодисперсной взвеси.
*В объемном соотношении шкалы идентичны .
Способ применения при вакцинации:
1. Надеть иглу на шприц, наполнить его растворителем комнатной температуры в объеме 0,5 мл.
2. Внести во вскрытую ампулу с вакциной растворитель из шприца.
3. После растворения заполнить шприц препаратом в объеме 0,25 мл (отметка 10 по шкале 40 единиц или отметка 25 по шкале 100 единиц).
4. Снять иглу и надеть плотно насадку-распылитель.
5. Поднести вплотную к носовому ходу насадку-распылитель и резким нажатием на поршень шприца впрыснуть вакцину в носовой ход.
6. Снять насадку-распылитель, надеть иглу и заполнить шприц оставшимся в ампуле препаратом (0,25 мл).
7. Снять иглу, снова плотно надеть насадку-распылитель и ввести препарат в другой носовой ход в соответствии с пунктом 5.
Насадку-распылитель вводят на глубину 0,5 см в носовые ходы, предварительно очищенные от слизи. Прививаемый находится в сидячем положении со слегка запрокинутой головой. После введения вакцины прививаемый должен оставаться в сидячем положении со слегка запрокинутой головой в течение 1 мин.
Последующие прививки могут быть проведены любой гриппозной вакциной в осенне-зимний период следующего года в соответствии с Инструкцией по применению препарата.
После вакцинации у некоторых привитых могут появиться: повышение температуры до 37,5°С, легкое недомогание, головная боль, незначительные катаральные явления. Допускается наличие реакций с повышением температуры выше 37,5°С не более, чем у 2% привитых. Продолжительность температурной реакции и катаральных явлений не должна превышать 3 суток.
Случаи передозировки не установлены.
Не рекомендуется после вакцинации применение в течение 2 суток любых лекарственных средств, вводимых интраназально.
Сведения о возможном влиянии лекарственного препарата на способность управлять транспо ртными средствами, механизмами.
Лиофилизат для приготовления раствора для интраназального введения по 1 дозе (0,5 мл) в ампулах.
Растворитель – вода для инъекций по 1 мл.
1 ампула с вакциной, 1 ампула с растворителем, 1 распылитель-дозатор одноразового использования, состоящий из шприца, иглы и съемной насадки-распылителя (насадка-распылитель для назального применения лекарственных средств вертикального типа), инструкция по применению в пачке из картона коробочного.
В соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8°С. Замораживание не допускается. Хранить в недоступном для детей месте.
В соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8°С. Допускается транспортирование при температуре от 9 до 25°С не более 10 суток.
1 год. По истечении срока годности препарат применению не подлежит.












Живая гриппозная вакцина для детей и взрослых: трансмиссивность вакцины в наблюдениях на детях 3–6 лет
Живые гриппозные реассортантные вакцины применяются в России для иммунизации всех групп населения, включая детей. Проведено изучение иммуногенности, приживляемости и трансмиссивности компонентов коммерческой трехвалентной живой гриппозной вакцины на привитых детях 3–6 лет. Вакцинные вирусы выделяли из носовых мазков в развивающихся куриных эмбрионах и культуре клеток MDCK. Наилучший эффект выделения вакцинных вирусов дает использование комбинации этих двух систем культивирования. Обследование детей группы плацебо, находящихся в постоянном контакте с привитыми лицами, показало отсутствие передачи вакцинных штаммов живой гриппозной вакцины от привитых непривитым детям. Приживляемость вакцинного вируса хорошо коррелировала с его иммуногенностью.
Современная живая гриппозная вакцина (ЖГВ) представляет собой трехвалентный препарат, состоящий из аттенуированных вирусов гриппа типа А (H1N1 и H3N2) и В, которые в результате репродукции в клетках верхнего респираторного тракта человека индуцируют образование противовирусного иммунитета, сходного с иммунитетом, приобретенным в ответ на перенесенное заболевание. Штаммы отечественной ЖГВ представляют собой 6:2 реассортанты. С шестью внутренними генами от доноров аттенуации А/Ленинград/134/17/57 (H2N2) и В/СССР/60/69 – холодоадаптированных, температурочувствительных, созданных в лаборатории штаммов – они наследуют аттенуированный фенотип, а антигенную актуальность приобретают вместе с двумя белками оболочки, наследуемыми от эпидемического родителя [1]. Генетическая стабильность неоднократно подтверждена как для российской ЖГВ, так и для используемой в США вакцины FluMist [2–4].
Для оценки эффективности ЖГВ изучают иммунный ответ у вакцинированных лиц и приживляемость вакцинных штаммов в клетках носоглотки. Приживляемость ЖГВ у привитых оценивается культивированием их назальных мазков в чувствительных к вирусам гриппа лабораторных системах. Важной характеристикой вакцинных штаммов вируса гриппа является также отсутствие трансмиссивности (способности к передаче аттенуированного вируса от вакцинированных контактным лицам). Вероятность трансмиссивности вакцинных вирусов гриппа, обладающих высокой способностью к реассортации, вызывает настороженность у специалистов, так как теоретически может привести к появлению нового эпидемического варианта в результате скрещивания с дикими циркулирующими вирусами. Хорошая приживляемость вакцинных вирусов не свидетельствует о возможности его высокой трансмиссивности.
Несмотря на то что реассортантные вакцинные штаммы успешно получают в лабораторных условиях в развивающихся куриных эмбрионах (РКЭ), некоторые современные вирусы гриппа удается выделить исключительно из клеток млекопитающих и они сложно поддаются переадаптации к РКЭ [5, 6], поэтому в настоящем исследовании для накопления вакцинных вирусов из носовых мазков привитых использовались две системы: РКЭ и перевиваемая культура клеток почки собаки MDCK.
В настоящем исследовании проведено изучение иммуногенности и приживляемости вакцинных штаммов у детей 3–6 лет, привитых живой гриппозной реассортантной тривакциной, а также предпринята попытка выделить вакцинные штаммы от непривитых детей, находящихся в тесном контакте с вакцинированными, т. е. оценить возможную трансмиссивность ЖГВ.
Материалы и методы
Вирусы. Коммерческая живая гриппозная реассортантная тривакцина. В состав вакцины входили реассортантные вирусы А/17/Новая Каледония/20/99 (H1N1), А/17/Вайоминг/03/8 (H3N2) и В/60/Джилин/03/1, подготовленные на основе штаммов, рекомендованных ВОЗ на эпидемический сезон 2004–2005 гг. (А/Новая Каледония/20/99 (H1N1), А/Вайоминг/3/03 (H3N2) и В/Джилин/20/03 – В/Пекин/184/93–like), и ХА доноров аттенуации А/Ленинград/134/17/57 (H2N2) и В/СССР/60/69.
Все выделенные вирусы типировались в РТГА со специфическими крысиными антисыворотками.
Результаты и обсуждение
Выделение вирусов гриппа из мазков в РКЭ и культуре клеток MDCK. 24 ребенка 3–6 лет были привиты однократно коммерческой ЖГВ. Мазки от привитых детей собирали на 2-е, 3-и и 4-е сутки после вакцинации. Результаты выделения вакцинных вирусов представлены в табл. 1.
Процент выделения вируса в РКЭ и культуре MDCK составил 87,5 и 98,5 соответственно, причем у 21 ребенка вирус был выделен одновременно и в РКЭ, и в культуре MDCK, а у 2 – только в культуре. У 1 из 24 детей вирус не был выделен ни в РКЭ, ни в культуре. В целом, в одной или в другой системе культивирования в 96% случаев был выделен хотя бы один из компонентов вакцины.
Представляет интерес тот факт, что в 5 (21%) образцах, положительных как в РКЭ, так и в культуре MDCK, в разных системах выделились разные вакцинные составляющие. В 4 из них РКЭ были чувствительны только к компоненту A(H1N1), тогда как культура клеток – к компоненту В. В одном образце с помощью РКЭ выделился вирус A(H3N2), а с помощью культуры – A(H1N1).
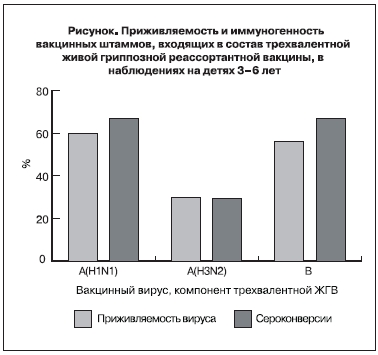
Таким образом, приживляемость штаммов трехвалентной ЖГВ у вакцинированных детей, выявленная с помощью обеих систем культивирования изолятов (РКЭ и МDСК), составила 66,7% (16 из 24) для компонентов А/17/Новая Каледония/99/145 (H1N1) и В/60/Джилин/03/1 и 29,2% (7 из 24) для компонента А/17/Вайоминг/03/8 (H3N2).
Параллельно с группой детей, привитых трехвалентной ЖГВ, анализировалась равнозначная по числу лиц группа детей (28 человек), получивших препарат плацебо (аллантоисная жидкость куриного эмбриона). Отбор детей в обе группы проводили так, чтобы в отдельных коллективах находилось примерно равное число представителей каждой группы. Ни у кого из 28 лиц группы плацебо после трех пассажей вирусы не выделились ни в РКЭ, ни в культуре MDCK (табл.2). Эти результаты свидетельствуют о том, что не происходит передачи вакцинных штаммов от привитых контактным лицам, т.е. ЖГВ не трансмиссивна.
Иммуногенность живой гриппозной вакцины. Для оценки иммуногенности ЖГВ для детей изучались парные сыворотки крови, взятые до вакцинации и через 21 день после вакцинации. Достоверным приростом титров сывороточных антител считали их 4-кратное и более увеличение во второй сыворотке по сравнению с первой. Процент сероконверсий рассчитывался как отношение количества лиц с 4-кратным и более приростом титра антител к общему числу привитых.
На рисунке представлены результаты изучения иммуногенности и приживляемости вакцинных штаммов, входящих в состав трехвалентной ЖГВ. Продемонстрировано, что приживляемость вакцинного вируса хорошо коррелирует с его иммуногенностью.
В настоящем исследовании проведен анализ приживляемости, трансмиссивности и иммуногенности ЖГВ, подготовленной на эпидемический сезон 2004–2005 гг. Проведена оценка чувствительности двух систем культивирования вирусов – РКЭ и культуры MDCK – для выделения вакцинных штаммов ЖГВ от привитых лиц. Ранее эти две системы сравнивались лишь по их сродству к циркулирующим эпидемическим вирусам [5, 7, 8]. Авторы отмечали сложности выделения современных вирусов гриппа в системе РКЭ. Большинство вирусов гриппа A(H3N2) и В в последние эпидемические сезоны вообще не удавалось выделить в РКЭ, часто они были неспособны даже искусственно адаптироваться к этой системе. При этом эпидемические вирусы A(H1N1) (А/Новая Каледония/20/99-подобные вирусы) способность к репродукции в куриных эмбрионах сохранили [5, 6]. Полученные нами данные подтверждают эту тенденцию. Так, наиболее успешно в куриных эмбрионах удавалось выделить вакцинный штамм на основе вируса А/Новая Каледония/20/99 (H1N1), тогда как вакцинный компонент В выделялся от привитых детей достоверно чаще в клетках MDCK, несмотря на то, что сам вакцинный вирус был хорошо адаптирован к репродукции в РКЭ в процессе его подготовки.
Сравнительно низкая (29,2%) частота выделения вакцинного штамма A(H3N2) может быть обусловлена тем, что в два предшествующих эпидемических сезона (2002–2003 и 2003–2004 гг.) вирусы именно этого сероподтипа являлись основными возбудителями гриппа на территории России [5, 6] и часть детей могла иметь иммунитет к антигеннородственному штамму. Этот вывод подтверждают также данные о невысокой иммуногенности вакцинного компонента A (H3N2) (30,2%).
Иммуногенность вакцинных штаммов ЖГВ хорошо коррелировала с частотой их изоляции от привитых. Следует отметить, что до 2004 г. реассортантные вакцинные штаммы ЖГВ для детей и для взрослых готовили на двух разных донорах аттенуации. Вакцинные штаммы ЖГВ для взрослых – на доноре аттенуации А/Ленинград/134/17/57 (H2N2), а штаммы ЖГВ для детей – на гиператтенуированном доноре А/Ленинград/134/47/57 (H2N2) [1]. В 2003 г. Комитет медицинских иммунобиологических препаратов счел целесообразным рекомендовать взрослый вариант вакцины для иммунизации детей в возрасте 3–6 лет с внесением соответствующих изменений в инструкцию по применению препарата [9]. Высокая иммуногенность компонентов A(H1N1) и В после однократной иммунизации детей 3–6 лет и отсутствие побочных эффектов в очередной раз подтверждают оправданность такого перехода.
Несмотря на то что приживляемость того или иного вакцинного компонента составила в нашем исследовании 96%, трансмиссивность вируса от привитых контактным детям не наблюдалась. Не было выделено ни одного вакцинного штамма в группе плацебо. Хорошая приживляемость вакцинных вирусов не свидетельствует о возможности его высокой трансмиссивности, возможно, для передачи вируса контактным лицам требуется больше вирусных частиц, чем обычно выделяют привитые [4].
Таким образом, результаты выделения и типирования вакцинных штаммов от привитых лиц позволяют сделать вывод о том, что наилучший эффект выделения вакцинных вирусов дает использование комбинации двух систем культивирования – РКЭ и культуры клеток MDCK. В таком случае удается получить наиболее полный набор изолятов и более адекватно оценить приживляемость вакцинных штаммов ЖГВ. Изучение трансмиссивности ЖГВ показало, что вакцинные штаммы не передаются от привитых детей лицам, находящимся с ними в тесном контакте. Приживляемость вакцинного вируса в клетках респираторного тракта хорошо коррелирует с его иммуногенностью для детей. Хорошая приживляемость вакцинных вирусов не свидетельствует о возможности их трансмиссивности.
1. Александрова Г.И., Климов А.И. Живая вакцина против гриппа. СПб: Наука, 1994.
2. Klimov A.I., Kiseleva I.V., Desheva J.A. et al. Live attenuated reassortant influenza vaccine prepared using A/Leningrad/134/17/57 (H2N2) donor strain is genetically stable after replication in children 3–6 years of age In: Proceedings of options for the control of influenza IV. Hersonissos, Crete, Greece. 23–28 September 2000. Amsterdam: Elsever Sciense, 2001: 951–954.
3. van Voorthuizen F., Jens D., Saes F. Characterization and clinical evaluation of live influenza A vaccine prepared from a recombinant of the A/USSR/92/77 (H1N1) and the cold adapted A/Ann Arbor/6/60 (H2N2) strains. Antivir. Res. 1981; 1: 107–122.
4. Vesikari T., Karvonen A., Korhonen T. et al. A randomized, double–blind study of the safety, transmissibility and phenotypic and genotypic stability of cold–adapted influenza virus vaccine. Ped. Inf. Dis. J. 2006; 25 (7): 590–595.
5. Иванова В.Т., Бурцева Е.И., Слепушкин А.Н. и др. Характеристика штаммов вируса гриппа А(H3N2) в эпидемическом сезоне 2003–2004 гг. в России. Вопр. вирусол. 2006; 1: 19–23.
6. Litvinova O., Konovalova N., Lobova T. The etiological surveillance for influenza in Russia during the seasons 1993– 2003. International Congress Series 1263. 2004: 295–298.
7. Демидова С.А., Гадашевич В.Н., Кириллова Ф.М. и др. Выделение и изучение вирусов гриппа А на разных клеточных культурах. Вопр. вирусол. 1979; 4: 346–350.
8. Davies H.W., Appleyard G., Cunningham P. et al. The use of a continuous cell line for the isolation of influenza viruses. Bull. WHO 1978; 56: 991–993.
9. Инструкция по применению вакцины гриппозной аллантоисной интраназальной живой сухой. Утверждена Главным санитарным врачом РФ Г.Г. Онищенко 16 июня 2004 г.
отдел вирусологии им. акад. А.А.Смородинцева:
Киселева Ирина Васильевна, д-р биол. наук, рук. лаб.
Григорьева Елена Петровна, канд. мед. наук, ст. науч.сотр.
Исакова-Сивак Ирина Николаевна, канд. биол. наук, ст. науч. сотр.
Донина Светлана Александровна, канд. мед. наук, ст. науч. сотр.
Руденко Лариса Георгиевна, д-р мед. наук, проф., рук. отд.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Дриневский В. П., Дорошенко Е. М., Гаврилов А. А., Данини Г. В., Григорьева Е. П.
Проведенные нами исследования показали, что психические заболевания, сочетающиеся с хронической патологией, в том числе с туберкулезом легких, не являются противопоказанием к вакцинации против вирусного гепатита В. Практически у подавляющего большинства привитых (92,7%) формируется протективный уровень антител на введение вакцины Энджерикс В при отсутствии поствакцинальных реакций и клинического утяжеления специфических заболеваний.
Аналогичные данные были получены и в других исследованиях при вакцинопрофилактике вирусного гепатита В различных категорий пациентов с сопутствующей хронической психоневрологической, инфекционной (туберкулез) и соматической патологией вакцинными препаратами, зарегистрированными в Российской Федерации [3, 4, 7].
1. В результате проведения иммунизации против вирусного гепатита В пациентов психиатрического стационара с сопутствующим туберкулезом легких были установлены безопасность, ареактоген-ность, высокая иммунногенная активность и эпидемиологическая эффективность применявшейся вакцины.
2. Хронические психические и соматические заболевания с сопутствующим туберкулезом не долж-
ны считаться противопоказаниями к вакцинации против вирусного гепатита В.
1. Ясинский А.А., котова Е.А., Перевощикова А.Л. и соавт. Эпидемиологическая ситуация в России в 2004 голу // Эпидемиология и вакцинопрофилактика. 2005. Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Сотрудниками НИИ гриппа еще 15 лет назад было установлено, что парентеральное введение инактивированных вакцин ведет к иммуносупрессии: в 1-й и 2-й год вакцинации развивается нормальный иммунный ответ, на 3-й год - отмечается значительное снижение уровня протективных антител и уже на 4-й год развивается иммуносупрессия.
Таким образом, для того чтобы сохранялся адекватный иммунный ответ, целесообразно рекомендовать после 2 - 3 ежегодных иммунизаций ИГВ делать перерыв и прививать живой гриппозной вакциной.
Идея создания живой вакцины против гриппа принадлежит академику А.А. Смородинцеву и его сотрудникам [1], которые разработали специальный вариант метода дополнительной аттенуации вируса гриппа путем длительного пассирования при пониженной температуре. Данный метод позволяет получать безвредные для детей вакцинные штаммы из всех разновидностей вирусов гриппа типов А и В.
В дальнейшем был разработан метод генетической реассортации для быстрого получения штаммов гриппозных вакцин путем одномоментного скрещивания эпидемически актуальных вирусов с донорами аттенуации [2]. Благодаря этому методу достигались основные требования - устранение болезнетворных свойств эпидемического вируса и сохранение наружных антигенов (гемагглютенина и нейроминида-зы), ответственных за выработку противогриппозного иммунитета.
Первые годы вакцина вводилась с помощью распылителя двукратно с интервалом 3 - 4 недели, причем для детей существовал отличный от взрослых вариант. Безусловно, это вызывало некоторые неудобства.
В дальнейшем вакцина была усовершенствована и стала выпускаться в виде единого варианта для взрослых и детей (начиная с 3-летнего возраста) с однократным интраназальным введением.
С 1977 года НИИ гриппа и НИИ экспериментальной медицины были проведены 126 исследований с участием 150 тыс. детей. Во всех клинико-эпидемиологических наблюдениях в течение 4 - 5 дней после введения вакцины у привитых и получивших плацебо была обязательной регистрация реакций (температура тела, состояние носоглотки), кроме того, оценивался уровень соматической и инфекционной заболеваемости. Часть вакцинированных детей прошла углубленное клинико-иммунологическое обследование на побочное действие вакцины и определение состояния гематологических, биохимических и иммунологических показателей, а также наличия клинических проявлений аллергических реакций. клинико-лабораторные наблюдения за привитыми показали хорошую переносимость, низкую реак-тогенность, эпидемическую эффективность и низкую сенсибилизирующую активность [7].
Научный и практический интерес представляло сравнение эффективности ЖГВ и ИГВ в клиникоэпидемиологических наблюдениях.
Первые полевые испытания ЖГВ с проводились в г. Вологде в 1991 - 1992 годах. В качестве эталона использовали инактивированную гриппозную вакцину субъединичного типа, применяемую для иммунизации детей США. Это были совместные исследования с американскими специалистами из Центра по контролю и профилактике болезней (СЭС, Атланта) и медицинского Байлор-колледжа (Хьюстон).
Под наблюдением находилось 555 школьников в возрасте 9 - 12 лет, разделенных на три группы. В первой группе детей прививали американской ИГВ (внутримышечно), во второй - ЖГВ (интраназально), в третьей - плацебо (внутримышечно или интраназально). Все препараты вводились однократно.
ИГВ содержала в 0,5 мл прививочной дозы 15 мкг антигенов каждого из трех вирусов Д(Н1К11), Д(Н3№) и В.
Инфекционная активность живых моновакцин из тех же серотипов вируса гриппа составляла 7,0 -7,5 !§ ЭИД 50/0,2 мл. Трехкомпонентная ЖГВ вводилась в объеме 0,5 мл, интраназально.
Реактогенность обеих вакцин была незначительной и не превышала допустимых пределов. Средние титры антигемагглютенинов во всей группе привитых после иммунизации ИГВ возросли в 4 - 8 раз, после ЖГВ - не более чем в 2 раза. Однако по частоте се-роконверсий достоверное преимущество ИГВ проявлялось лишь в целом на группу, а в серонегативных подгруппах детей с исходным титром антител Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
4. Итоги изучения живой гриппозной интраназальной вакцины при иммунизации детей 3 - 15 лет / Л.Г. Руденко, Е.П. Григорьева, В.П. Дриневский и др. // Журнал микробиологии, эпидемиологии, и иммунобиологии. 1988.
Читайте также:


