Живые вирусные вакцины принципы получения достоинства и недостатки
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов. Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича). Ослабленные ( аттенуированные ) вакцины Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций. Дивергентные вакцины . В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Тканевые вакцины в своей основе содержат какую-либо ткань животных, в которой размножался и накапливался вакцинный вирус.
Культуральные вакцины готовят из зараженных культур клеток или переживающих тканей, при этом применяют роллерный (используют вращающиеся бутыли) или суспензионный (глубинный — используют реакторы) методы культивирования клеток и тканей.
Гомологические вакцины готовят из того вида вируса, против которого предполагается создать иммунитет, например, вакцины против вирусной диареи, чумы крупного рогатого скота, бешенства и др
Гетерологические вакцины готовят из вирусов другого вида, но имеющих в своем составе сходные антигены и обладающих перекрестной иммуногенностью.
Моновалентные вакцины содержат антигены одного типа (вида) вируса.
Поливалентные вакцины (бивалентные, трехвалентные и т. д.) готовят из нескольких типов одного вируса
Смешанные вакцины представляют собой смесь вирусных и бактерийных антигенов, например, вакцина против чумы плотоядных, ботулизма и вирусного энтерита собак.
Живые вакцины содержат живые селекционированные ослабленные (аттенуированные) штаммы вирусов.
Инактивированные вакцины содержат инактивированные штаммы вирусов. Чаще для этой цели используют эпизоотические штаммы, которые инактивируют (обезвреживают) физическими или химическими методами.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Живые вакцины - это биологические препараты, содержащие штаммы вирусов, утратившие способность вызывать клинически выраженное заболевание, но сохранившие способность репродуцироваться в организме восприимчивого животного и стимулировать выработку специфических факторов противовирусного иммунитета (антител).
Основной этап - получение аттенуированных (слабовирулентных) штаммов вирусов. Основные трудности связаны с получением стабильного иммуногенного вакцинного штамма вируса и разработкой методов его контроля.
Любой вакцинный штамм должен быть хорошо изучен, классифицирован, клонирован и паспортизирован. В паспорте указываются основные генетические признаки, выявляемые, постоянно воспроизводимые и контролируемые в процессе поддержания его жизнеспособности и хранения (остаточная вирулентность, способность репродуцироваться, активность в конкретной биологической системе, особенности проявления инфекционного действия, спектр гемагглютинации, степень чувствительности к физическим и химическим факторам). Вакцинные вирусные штаммы должны обладать генетической и фенотипической стабильностью. Их приживаемость в привитом организме должна быть выраженной, а способность к репродукции ограниченной. Эти признаки должны быть наследственно закрепленными. Вакцинные штаммы не должны подвергаться реверсии (возврату в исходное состояние) в том числе и при пассажах на естественно восприимчивых животных. Они не должны вызывать специфического инфекционного процесса у животных после введения им массивных доз вакцинного штамма (в 5—10 раз превышающих иммунизирующую дозу). Живые вакцины должны создавать напряженный иммунитет не менее чем у 70% однократно вакцинированных животных, этого достаточно для создания условий, препятствующих дальнейшему распространению болезни в неблагополучном стаде. Вакцинные штаммы размножаются в привитом организме до тех пор, пока его защитные механизмы не затормозят их развитие.
Технология изготовления живых вакцин сводится к культивированию вакцинного штамма в какой-либо биологической системе, накоплению вируса, очистке и концентрации, расфасовке, лиофилизации и контролю готового препарата.
Для предупреждения размножения бактерий, случайно попавших во время сбора и расфасовки вируссодержащего материала, в состав живых вакцин иногда включают антибиотики. Для профилактики контаминации живых авианизированных вакцин микоплазмами и вирусами применяют прединкубационную термообработку яиц при 42—45°С в течение 4 - 7 часов с последующим переводом их на обычный режим инкубации, кроме того, для инактивации вирусов лейкозов готовые вакцины выдерживают при 4°С не менее 4 педель. Наиболее желательно для изготовления живых вакцин использовать чистые биологические системы: эмбрионы и эмбриональные культуры клеток японских перепелок или кур, свободных от специфических патогенных факторов. Выпускаются живые вакцины, как правило, в лиофильно высушенном виде. В процессе высушивания активность вирусов не должна снижаться более чем в 10-15 раз, что обеспечивается за счет добавок стабилизирующих веществ.
В живой вакцине вирус сохраняет потенциальную способность изменяться в сторону снижения антигенности или повышения реактогенности, или даже вирулентности.
Преимущества и недостатки живых вакцин.
Технология изготовления живых вакцин, как правило, проста, они относительно дешевы, выпускаются чаще в сухом виде, поэтому удобны для применения. Вызывают активацию всех компонентов иммунной системы, стимулируют общий (системный) и местный иммунный ответ на каждый из защитных антигенов. Создают продолжительный и напряженный иммунитет за счет приживаемости, размножения и диссеминации в организме вакцинного штамма, при этом иммунитет формируется быстро, на первых этапах обычно за счет интерференции, а затем обусловливается накоплением вируснейтрализующих антител. Их можно вводить подкожно, внутримышечно, интраназально, а также аэрозольным (аэрогенным) и энтеральным (с кормом или водой) способом.
В зависимости от физиологического состояния животных живые вакцины могут вызвать поствакцинальные реакции. У животных может быть лихорадка, активация хронических и латентных инфекций, снижение продуктивности, избыточная смертность, аборты, аллергические реакции, врожденные уродства, низкая устойчивость к заражению. При использовании живых вакцин необходимо учитывать уровень остаточной вирулентности вакцинного штамма. Живые вакцины хранят в себе потенциальную опасность, связанную с возможной реверсией, т, е; возвратом вакцинного штамма в исходное (вирулентное) состояние. При культивировании вакцинных штаммов в эмбрионах птиц, культуре клеток или в организме животных имеется потенциальная опасность контаминации, что усложняет контроль и сдерживает широкое применение живых вакцин. Может наблюдаться длительная персистенция вакцинного штамма в организме животного. Чтобы сохранить жизнеспособность вакцинного штамма, необходимо соблюдать условия хранения и транспортировки живых вакцин (не выше 8°С) и применять в соответствии с инструкцией, прилагаемой к препаратам. Нарушение вакуума и попадание влаги в ампулу с вакциной, воздействие света и тепла инактивирует штамм, утрачиваются его иммуногенные свойства. Ввиду отсутствия в большинстве живых вакцин консервантов при вскрытии ампул и растворении содержимого необходимо строго соблюдать правила асептики. Место введения препарата в организм животного нельзя обрабатывать дезинфицирующими веществами. Разведенную живую вакцину необходимо быстро использовать (в течение 2 часов), остатки уничтожать сжиганием или кипячением
Создать активный иммунитет против некоторых тяжелых заболеваний помогает вакцинация. В настоящее время этот метод признан наиболее эффективным, позволяющим предотвратить развитие различных тяжелых патологий инфекционного, бактериального и вирусного характера. Живая вакцина способствует созданию длительного иммунитета. Это особая форма препаратов для иммунизации имеет ряд достоинств и недостатков, с которыми каждый должен быть ознакомлен.
Что собой представляют живые вакцины?
Для создания живых вакцин применяются ослабленные штаммы болезнетворных микроорганизмов, которые начинают размножаться в месте инъекции. Такие средства полностью сохраняют свои иммуногенные свойства. Клинической картины проявления заболевания иммунизация живыми вакцинами не вызывает (в большинстве случаев). Вакцинная инфекция приводит к формированию довольно стойкого иммунитета: гуморального, клеточного и секреторного.
Получить ослабленные (аттенуированные) штаммы можно благодаря инактивации гена, который отвечает за вирулентность микроорганизма. Для инактивации применяется химическое и физическое воздействие. Многие живые вакцины выпускают в сухом виде. Это позволяет продлить их срок хранения. Сухие живые вакцины можно хранить более 12 месяцев при определенной температуре (2-8 °C). Для создания стойкого иммунитета иногда бывает достаточно однократно ввести препарат.
Разновидностью живых вакцин являются дивергентные вакцины. При их изготовлении используют микроорганизмы, которые находятся в близком родстве с возбудителями инфекций, но не способные вызвать заболевание. Пример такой вакцины — БЦЖ, ее получают из микобактерий бычьего туберкулеза.
Преимущества
По сравнению с неживыми вакцинами препараты с ослабленными штаммами болезнетворных бактерий имеют ряд преимуществ:
- Минимальные дозы препарата.
- Быстрая выработка иммунитета.
- Наличие различных способов введения в организм.
- Максимально естественная иммуногенность.
- Высокая эффективность (при правильном применении).
- Невысокая стоимость.
- Отсутствие в составе консервантов.
- Активация всех типов иммунитета.
Недостатки живых вакцин
Согласно отзывам специалистов ослабленные штаммы патогенных микроорганизмов, используемые для создания вакцин, могут вызвать развитие настоящего заболевания (случается крайне редко). Это связывают с наличием у пациента ослабленного иммунитета.

Живая вакцина очень чувствительна к перепаду температур. Поэтому негативная реакция организма практически неизбежна, если была допущена халатность относительно правильного хранения или транспортировки препарата. Также испорченная таким образом вакцина может полностью утратить свои способности и не вызвать абсолютно никакой реакции организма.
Врачи рекомендуют избегать комбинирования живой вакцины с другими препаратами для прививания. В противном случае могут развиться негативные реакции организма или же средства потеряют свою эффективность.
Живая вакцина от полиомиелита
Тяжелым инфекционным недугом является полиомиелит, при котором поражается головной и спинной мозг. Патология приводит к поражению нервной системы и параличу. В середине прошлого столетия учеными была разработана живая вакцина (ОПВ), способная защитить человечество от этого страшного заболевания.
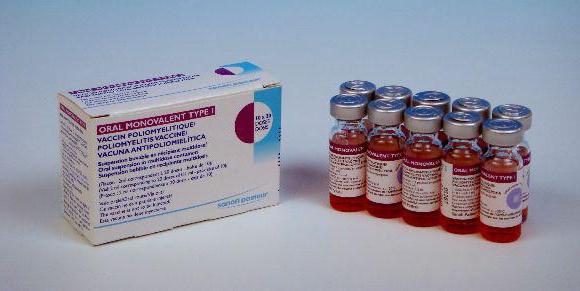
Согласно отзывам иммунологов вакцина содержит все три типа полиомиелита, что позволяет защитить организм от всех известных вариаций этого недуга. Осложнения препарат вызывает крайне редко. Однако многие родители стараются избегать прививания ребенка этой вакциной.
Как действует?
Вакцина Сэбина (ОПВ) после попадания в организм длительно сохраняется в кишечнике и вызывает формирование иммунитета, похожего на такой, который бы развился после перенесенного заболевания. Первую вакцинацию проводят в возрасте 6 месяцев. Предварительно малышей прививают инактивированной вакциной дважды – в 3 и 4,5 месяца. В результате должны начать вырабатывать антитела, способные распознать и защитить организм от патогенного возбудителя. Живая противополиомиелитная вакцина также стимулирует продуцирование интерферона, что также положительно влияет на состояние иммунной системы.
Отзывы
В процессе исследований было установлено, что ОПВ значительно эффективнее инактивированной вакцины. Врачи рекомендуют в обязательном порядке пройти полную схему прививания против полиомиелита и обязательно использовать живую ослабленную вакцину. В то же время родители не спешат соглашаться на использование такого препарата. Это связано с риском развития побочных явлений: вакциноассоциированный полиомиелит, повышение температуры тела, расстройство стула, потеря чувствительности в конечностях, нарушение походки.
Конечно, применение живых вакцин может спровоцировать появление негативной реакции организма. Однако такие случаи фиксируются крайне редко. Пострадать могут дети, рожденные с иммунодефицитом, врожденными патологиями ЖКТ или имеющие ослабленную защитную систему, например после перенесенного тяжелого недуга. В этих случаях разрешено применять только инактивированную вакцину.
Как защититься от кори?
Корь является высококонтагиозным инфекционным недугом, заразиться которым может любой человек, независимо от пола и возраста. В детстве патология переносится намного легче. Сформировать иммунитет поможет живая коревая вакцина. Однокомпонентную вакцину выпускает отечественный производитель. Также эффективной считается вакцина индийского производства.

Плановая первичная вакцинация показана в возрасте 12-14 месяцев. Повторно ввести вакцину необходимо в 6 лет. Существует возможность индивидуального графика прививания, который должен составить иммунолог.
Противопоказания и осложнения
Частыми негативными реакциями организма на введение живой противокоревой вакцины являются такие симптомы, как повышение температуры, высыпания на коже, воспаление лимфатических узлов, кашель. Специалисты уверяют, что это вполне нормальная реакция организма.
У детей такие признаки развиваются редко. В основном введение живой вакцины от кори переносится хорошо. Перед прививкой необходимо, чтобы врач осмотрел ребенка (взрослого пациента) и исключил наличие противопоказаний (постоянных и временных). Важно, чтобы человек был полностью здоров. Вакцину запрещено вводить женщинам в положении, лицам, имеющим в анамнезе туберкулез и осложнения, вызванные предыдущей вакцинацией.
Вакцинация от краснухи
Еще одним детским недугом, который достаточно тяжело переносят взрослые, является краснуха. Вакцина (живая) считается наиболее эффективным средством профилактики заражения. Особую опасность патология представляет для беременных.

Живую вакцину (однокомпонентную) производят хорватские, французские и индийские специалисты. Согласно отзывам побочные явления чаще развиваются у взрослых, которые были привиты ослабленной вакциной. Небольшое увеличение лимфатических узлов, общая слабость, повышение температуры, кожные высыпания проходят уже на второй день.
Лицам, склонным к появлению тяжелых аллергических реакций, рекомендуется находиться под наблюдением специалистов после введения препарата.
Это биопрепараты, содержащие штаммы вирусов, утратившие способность вызывать клинически выраженное заболевание, но сохранившие способность репродуцироваться в организме восприимчивого животного и стимулировать выработку факторов специфического противовирусного иммунитета.
Принцип получения живых вакцин. Основным в технологии производства живых вакцин является получение аттенуированных штаммов вирусов путем:
1) адаптации патогенных вирусов к маловосприимчивым или совсем невосприимчивым лабораторным животным. Так был получен штамм ЛЗ Накамура для профилактики чумы крупного рогатого скота (путем серийных пассажей на кроликах), штамм К для профилактики чумы свиней. При пассажах на животных успех во многом зависит от выбора метода заражения. Так, Л. Пастер путем серийных (130—140) интрацеребральных пассажей уличного вируса бешенства на кроликах получил вакцинный штамм, известный под названием вирус-фикс. Получены аттенуированные штаммы вирусов инфекционного бронхита, инфекционного ларинготрахеита птиц, катаральной лихорадки овец и другие путем адаптации к куриным эмбрионам. Методом адаптации к культурам клеток (пассирование в сочетании с селекцией в культуре клеток) вируса чумы крупного рогатого скота (штамма ЛЗ Накамура) удалось получить аттенуированный ареактогенный вакцинный штамм ЛТ. Аналогичным путем получены вакцинные штаммы вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи крупного рогатого скота, чумы плотоядных и др.
При многочисленных серийных пассажах вируса происходит накопление случайных мутаций.
В основе изменчивости вируса лежат мутации, т. е. изменения состава и последовательностей нуклеотидов вирусного генома.
Исследователь, используя различные методы селекции, отбирает штаммы по признаку утраты вирулентности (к естественно восприимчивому животному) при сохранении иммуногенности. Это очень длительная, кропотливая работа, которая не всегда может быть успешной;
2) селекции природно-ослабленных штаммов вирусов при атипично или латентно протекающих инфекциях. Так были выделены вакцинные штаммы вируса болезни Ньюкасла В1, Н, Ф, Ла Сота, Бор-74 (ВГНКИ), аттенуированные штаммы ротавирусов человека;
3) использование гетеротипичных антигеннородственных апатогенных штаммов в качестве живых вакцин. Например, вирус оспы голубей создает иммунитет против оспы кур; вирус герпеса индеек защищает кур от болезни Марека; вирус фиброматоза создает у кроликов иммунитет от миксоматоза; вирус кори человека в состоянии защитить щенков от чумы плотоядных;
Первые успехи в аттенуации вирусов с использованием методов генной инженерии достигнуты в опытах с ДНК-содержащими вирусами животных. Делеционные мутанты по тимидинкиназе получены у вируса инфекционного ринотрахеита крупного рогатого скота и вируса болезни Ауески. Так, мутанты вируса инфекционного ринотрахеита вследствие делении в гене тимидинкиназы не способны кодировать синтез этого фермента в клетках инфицированного организма. Нарушение этой функции генома вируса сопровождается его аттенуацией при сохранении антигенных свойств.
Основное требование к живым вакцинам на основе делеционных мутантов вирусов — их выраженная репликация in vitro и in vivo с тем, чтобы производство вакцин было экономически выгодным, а применение достаточно эффективным.
Любой вакцинный штамм должен быть хорошо изучен, клонирован, паспортизирован и комиссионно сдан во Всероссийский государственный научно-исследовательский институт контроля, стандартизации и сертификации ветеринарных препаратов, где он хранится, поддерживается и контролируется.
Так как свойства вакцины определяются вакцинным штаммом, то к ним предъявляются следующие основные требования:
генетическая стабильность — способность сохранять свои свойства в различных условиях пассирования на восприимчивых животных, в системе культивирования, хранения и т. д., т. е. штамм не должен подвергаться реверсии (возврату в исходное состояние);
При идеальном исходе аттенуации вирус должен практически утрачивать способность поражать клетки-мишени, но сохранять способность размножаться в других клетках, обеспечивая создание выраженного и напряженного иммунитета при минимальной реактогенности и полной безопасности.
Живые вакцины обладают рядом существенных преимуществ перед инактивированными вакцинами:
1) создают высокую напряженность и длительность иммунитета (более чем на 1 год, иногда на всю жизнь), так как в организме вакцинные штаммы размножаются, вызывая развитие вакцинной реакции, сходной с естественным постинфекционным процессом, происходит активация всех компонентов иммунной системы, стимулируется общий (системный) и местный ответ;
2) требуются малые прививочные дозы и для большинства из них однократное введение;
3) возможное применение их не только подкожно, внутримышечно, но и перорально, интраназально и аэрозольно;
4) иммунитет вырабатывается в более короткий срок, на первых этапах обычно за счет интерферона, а затем уже — накопления вируснейтрализирующих антител;
5) технология и экономичность изготовления их превосходят создание инактивированных вакцин.
Несмотря на преимущества живых вакцин по некоторым позициям, у них есть недостатки:
1) иногда возможны поствакцинальные осложнения у молодых, ослабленных и беременных животных;
2) возможно, хотя и в редких случаях, внесение в организм животных контаминантов (латентных вирусов, микроорганизмов), загрязняющих вакцины. Например, культуры клеток из тканей крупного рогатого скота нередко инфицированы аденовирусами, вирусами диареи, парагриппа-3; куриные эмбрионы — вирусами лейкозно-саркоматозного комплекса, аденовирусами, микоплазмами; культуры клеток свиного происхождения — парвовирусами, классической чумы свиней. Неконтролируемое попадание посторонних агентов в вакцину может привести к серьезным последствиям;
3) возможна реверсия вакцинного штамма;
4) живые вакцинные штаммы весьма чувствительны к неблагоприятным факторам, возникающим при производстве, хранении, транспортировке и применении;
5) нужен довольно длительный срок для получения аттенуированных вакцинных штаммов.
Генетический механизм аттенуации недостаточно изучен. Это обстоятельство не дает возможности предложить единое правило получения вакцинных штаммов. Несмотря на попытки многих исследователей, до сих пор не получено аттенуированных вакцинных штаммов вирусов ящура, инфекционной анемии лошадей и др.
Живые вакцины широко применяют в основном для животных на откорме и не рекомендуются в репродуктивных стадах. Готовят их на биофабриках, биокомбинатах или других предприятиях по производству биопрепаратов, которые получают вакцинные штаммы из Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов.
Таким образом, технология изготовления живых вакцин сводится к культивированию вакцинного штамма в какой-либо биологической системе (животные, эмбрионы птиц, культуры тканей и клеток); определению концентрации вируса (его титра) в вируссодержащем материале; контролю на стерильность (отсутствие посторонних контаминантов); фасовке и лиофилизации (перед лиофилизацией для сохранения биологической активности вируса добавляют стабилизирующие вещества). Затем вакцины проходят контроль на стерильность, биологическую активность, реактогенность, безвредность, антигенную и иммуногенную активности. Если вакцина отвечает всем установленным показателям, ее этикетируют и выпускают для применения.
Живую вакцину обычно называют вирусвакциной. Анализ данных применения живых вакцин свидетельствует о достаточно высокой эффективности многих из них, например, таких, как вакцины против чумы крупного рогатого скота, чумы плотоядных, болезни Ньюкасла и др.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
ЖИВЫЕ АТТЕНУИРОВАННЫЕ ВАКЦИНЫ - препараты из ослабленных микробов, потерявших вирулентность, но сохранивших иммуногенность.
Вакцинные штаммы – это ослабленные микробы.
Способы получения вакцинных штаммов:
а) метод отбора мутантов с ослабленной вирулентностью;
б) метод направленного (искусственного) снижения вирулентности (выращивание на неблагоприятных питательных средах, длительное пассирование (последовательное заражение) через организм маловосприимчивых лабораторных животных);
в) метод генной инженерии (инактивация гена, который отвечает за образование факторов вирулентности патогенных микробов).
Вакцинные штаммы микробов размножаются в организме. В результате этого возникает вакцинная инфекция - заболевание протекает в легкой форме. Вакцинная инфекция всегда приводит к формированию иммунитета к патогенным микробам данного вида, к которым относится вакцинный штамм.
ЖИВЫЕ ДИВЕРГЕНТНЫЕ ВАКЦИНЫ - препараты из живых микробов, не болезнетворных для человека, но сходных по антигенным свойствам с болезнетворными микробами.
Например, вакцина против натуральной оспы.
ЖИВЫЕ ВЕКТОРНЫЕ РЕКОМБИНАНТНЫЕ ВАКЦИНЫ:
-получают методом генной инженерии.
Для этого в геном вакцинного штамма встраивают ген (вектор), контролирующий образование антигенов другого возбудителя .
Например, в штамм вируса оспенной вакцины встраивают антиген вируса гепатита B (HBs - антиген).
Получение живых вакцин:
- выращивают вакцинный штамм в асептических условиях на питательной среде;
- биомассу микробов концентрируют, стандартизируют (определяют титр - количество микробов в 1мл),
- добавляют стабилизатор (сахарозожелатиновый агар, человеческий альбумин
- фасуют в стерильные ампулы или флаконы.
После получения вакцины проходят государственный контроль – проверяется реактогенность, безвредность и иммуногенность.
Преимущества живых вакцин:
1) создание прочного и длительного иммунитета (5-7 лет), т.к. содержат полностью сохраненный набор антигенов возбудителя;
2) прививки однократные простыми способами (перорально, интраназально, накожно, подкожно);
3) менее реактогенны, т.к. не содержат консервантов и адъювантов.
Недостатки живых вакцин:
1) трудоемкость получения вакцинных штаммов;
2) малый срок хранения (1-2 года);
3) хранение и транспортировка при пониженной температуре (+4°С - +8°С);
4) потеря аттенуации - необходимо проводить постоянный контроль реверсии вирулентности возбудителя.
Примеры живых вакцин:
1) бактериальные вакцины - туберкулезная (БЦЖ), чумная, туляремийная, сибиреязвенная, бруцеллезная, против Ку-лихорадки;
2) вирусные вакцины - полиомиелитная, коревая, гриппозная, паротитная, против желтой лихорадки.
Характеристика возбудителя сифилиса. Патогенез заболевания. Методы лабораторной диагностики на различных стадиях заболевания. Характеристика серологических реакций, используемых в диагностике сифилиса (трепонемные и нетрепонемные тесты). Препараты для лечения сифилиса. Неспецифическая профилактика.
Сифилис - это инфекционное венерическое заболевание с поражением кожи, внутренних органов, костей, нервной системы.
Характеристика возбудителя. Возбудитель сифилиса — Тгероnеmа раllidum (бледная трепонема). Относится к сем. Sрiгосhaetaceae.
Морфология: тонкие спиральноизвитые бактерии (4-14 мкм) с равномерными (одинаковыми по высоте) мелкими завитками. Передвигаются при помощи аксиальной нити, которая находится между клеточной стенкой и ЦПМ (совершают качательные, поступательные и др. движения тела). Спор и капсул не имеют. Бактерии могут иметь другие формы: цисты, гранулы, L-формы.
Тинкториальные свойства: окрашиваются с трудом, в бледные тона (название - бледная трепонема), грам ”-”. По Романовскому-Гимзе окрашиваются в слабо-розовый цвет
Культуральные свойства: облигатные анаэробы, с трудом растут на специальных питательных средах: асцитический МПБ с кусочками печени, почек, мозга, бульон из бычьего сердца с добавлением цистина, тиогликолата натрия, З5С (при 40С погибают).
Антигенная стриктура: имеется несколько антигенов (полисахаридный, липоидный, протеиновый); антигенные свойства бледной трепонемы сходны с другими трепонемами; липоидный антиген возбудителя идентичен липоидному экстракту из бычьего сердца, поэтому в серодиагностике сифилиса используются спиртовые экстракты из бычьего сердца (реакция Закса и Кана), из л1ошадиного сердца (реакция Мейнике).
Резистентность: малоустойчивы в окружающей среде, при 55С гибнут через 15 мин, чувствительны к высыханию, свету, солям ртути, висмута, мышьяку, пенициллину. Патогенность для животных: в естественных условиях бледная трепонема патогенна только для человека; экспериментальный сифилис можно вызвать в яичке и на коже кролика, в коже человекообразных обезьян (впервые экспериментальный сифилис вызвали Мечников и Ру в 1903 г. у шимпанзе, благодаря чему удалось испытать действие препаратов против сифилиса сальварсан и неосальварсан).
Эпидемиология сифилиса. Источник инфекции — больной человек; наибольшую опасность представляют лица на ранних этапах болезни, в третичном периоде человек не заразен (в среднем через 4 года после заражения). Механизм передачи — контактный. Пути передачи:
1) половой путь — преимущественный путь передачи; 2) возможно заражение через поцелуй; 3) через молоко кормящей матери; 4) через предметы обихода (стаканы, зубные щетки, сигареты) — очень редко; возбудитель сохраняет свою заразность на предметах обихода до высыхания (бытовой сифилис); 5) возможно инфицирование плода у женщин, больных сифилисом (трансплацентарно) или при прохождении по родовым путям (врожденный сифилис); возбудитель не способен проникать через плаценту в первые 4 месяца беременности и лечение матери на этих сроках препятствует заражению плода; б) не исключены случаи заражения при переливании крови от доноров, больных сифилисом.
Патогенез и клиника. Входные ворота: кожа и слизистые оболочки мочеполовых путей при половом контакте и другие слизистые оболочки, имеющие незначительные повреждения. От места внедрения возбудитель по лимфатическим сосудам и через кровь распространяется по органам и тканям, вызывая их повреждения в результате паразитирования. Вначале резистентность к возбудителю низкая (в это время он быстро распространяется по тканям), затем она возрастает и ограничивает дальнейшее распространение, но человек полностью не избавляется от возбудителя.
Инкубационный период: 3 - 4 недели. После инкубационного периода сифилис протекает циклически (со сменой периодов болезни). Первичный период: на месте внедрения (на половых органах, на губах) образуется твердый шанкр (резко ограниченное уплотнение, на поверхности которого появляется язва, которая заживает через 6 - 7 недель, а на ее месте остается звездчатый рубчик), трепонемы обнаруживаются и в припухших регионарных лимфоузлах. Вторичный период (после латентного периода б — 8 недель): развивается при отсутствии лечения множественные высыпания на коже, слизистых оболочках, гениталиях, наблюдается выпадение волос, существенные изменения во внутренних органах. Длится 3 - 4 года. Человек в это время заразен для окружающих. Эти проявления могут исчезнуть без лечения, но возбудитель сохраняется в организме и медленно развивается, вызывая резкие изменения в органах и тканях. Третичный период: развивается при отсутствии лечения обычно через 3 - 4 года, наблюдаются поражения кожи, слизистых оболочек, костей, суставов, внутренних органов, нервной системы, в них образуются гуммы - скопления, склонные к распаду и изъязвлению. Длится третичньий период годами. Без лечения (в среднем через 8 - 15 лет) может развиться нейросифилис - тяжелое поражение ЦНС (сифилис мозга, паралич и сухотка спинного мозга со стойкими нарушениями движений, нарушается психическая деятельность) и может наступить смерть. При врожденном сифилисе у детей наблюдается сыпь, насморк, изменения во внутренних органах, паралич конечностей
Иммунитет. Врожденного иммунитета нет. После заболевания и излечения иммунитет не развивается. Возможны повторные заболевания. В период болезни — нестерильный иммунитет. Инфекционный иммунитет сопровождается аллергией, которая исчезает после выздоровления. Возможна суперинфекция — повторное заражения во время болезни. При этом твердый шанкр не образуется, а трепонемы распространяются по всему организму, участвуя в генерализации процесса.
Лабораторная диагностика. Используемый материал и методы зависят от периода болезни. Выделение возбудителя обычно не проводят, т.к. доступные методы получения культур не разработаны. Первичный период. Исследуемый материал: тканевой сок твердого шанкра, пунктат из лимфоузлов.
Метод - микроскопический: трепонемы наблюдают в живом виде в темном поле, иногда используют окраску по Романовскому-Гимзе. Вторичный и третичный периоды.
Исследуемый материал - сыворотка крови больного. Метод - серологический обнаружение антител к возбудителю сифилиса в сыворотке крови больных. Для этого используются следующие серологические реакции;
1) реакция Вассермана – RW (реакция связывания комплемента - РСК); в этой ре- акции в качестве антигена используется кардиолипиновый антиген (экстракт из мышц сердца быка + спиртовой раствор холестерина). Этот антиген - неспецифический. Данная реакция в первые 3 недели болезни — отрицательная, антитела появляются с 4 недели (конец первичного, начало вторичного сифилиса). Последние годы данная проба стала менее специфичной и дает ложные результаты: на 5-ой неделе болезни она может быть отрицательной или может быть положительной при других заболеваниях — при заболеваниях печени, коллагенозах, других спирохетозах. Для более точной диагностики используются и другие пробы. 2) осадочные реакции: реакция Кана и Закса-Витебского, реакция Мейнике, цитохолевая проба; эти реакции основаны на образовании хлопьевидных осадков после добавления к сыворотке больного липоидных антигенов; 3) реакция иммобилизации бледных трепонем (РИБТ) — наиболее специфическая современная серологическая проба — при добавлении сыворотки крови больного и комплемента к культуральным трепонемам (специфический антиген) они теряют подвижность.
Для экспресс - диагностики (при массовых обследованиях) используется реакция иммунофлюоресценции (РИФ) — микрореакция на стекле с каплей крови или сыворотки со специальным антигеном.
Лечение. Используются антибиотики. Наиболее эффективен пенициллин. При его непереносимости применяют тетрациклины, левомицетин. Применяют препараты висмута — бийохинол, бисмоверол, пентабисмол. Раннее лечение, начатое в первые дни первичного сифилиса, обеспечивает излечение болезни в короткие сроки. Обычно же излечение сифилиса достигается этапной и комбинированной химиотерапией, проводимой несколькими курсами в течение 2 - 3 лет. При вторичном сифилисе излечивается не более 25% больных, у 25% процесс переходит в латентную фазу, а у 50% - превращается в третичную стадию. При третичном сифилисе лечение симптоматическое.
Профилактика. Средства специфической профилактики отсутствуют. специфическая профилактика — соблюдение правил гигиены, ранняя диагностика и обязательное лечение, исключение случайных половых связей.
Билет 12.
Препараты бактериофагов: механизм действия, получение и применение лечебно – профилактических препаратов бактериофагов (моновалентные, поливалентные и комбинированные препараты). Достоинства и недостатки.
Получение и применение бактериофагов. Для получения препаратов бактериофагов используют проверенные производственные штаммы фагов и соответствующие им типичные культуры бактерий. В бактериальную культуру в жидкой питательной среде вносят маточную взвесь фага. После просветления (лизиса) культуру фильтруют через бактериальные фильтры, и фильтрат вносят в свежую культуру соответствующих бактерий и т.д. После накопления достаточного количества фага лизированную им культуру бактерий вновь фильтруют, и получают препарат фага.
Таким образом, препараты фагов получают путем многократного пассирования через чувствительную бактериальную культуру, а сами препараты фагов – фильтраты бульонных культур лизированных ими бактерий. Это прозрачные жидкости светло-желтого цвета, а также на их основе готовят другие лекарственные формы - таблетки с кислотоустойчивым покрытием, мази, аэрозоли, свечи.
Применение фагов основано на их строгой специфичности. Они используются для:
а) диагностики инфекционных заболеваний (диагностические препараты): с помощью известного фага можно определить вид или подвид бактериальной культуры;
б) лечения и профилактики заболеваний (лечебно-профилактические препараты).
Лечебно-профилактические препараты бактериофагов.
В настоящее время в Российской Федерации выпускают бактериофаги для лечения и профилактики кишечных инфекций: дизентерийный поливалентный, сальмонеллезный поливалентный групп АВСДЕ, брюшнотифозный и бактериофаги против основных возбудителей гнойно-воспалительных заболеваний: стафилококковый, стрептококковый, синегнойный, протейный, клебсиеллезный, коли-фаг. Разработаны комбинированные препараты: коли-протейный, пиобактериофаг (против стафилококков, стрептококков, клебсиелл, протея, синегнойной и кишечной палочек), интести–бактериофаг (против шигелл, сальмонелл, стафилококков, энтерококков, кишечной и синегнойной палочек, протея).
Поливалентные препараты – смеси из нескольких фагов против различных типов одного вида бактерий. Комбинированные препараты – смеси из фагов против бактерий разных видов.
Механизм действия: 1) лизис (гибель) бактерий в очаге воспаления; 2) стимуляция иммунитета.
Преимущества: 1) специфичность действия (вызывают гибель определенного вида бактерий); 2) не подавляют нормальную микрофлору организма человека, как антибиотики; 3) нет противопоказаний и осложнений; 4) можно использовать в сочетании с другими лекарственными средствами; 5) активны против бактерий, устойчивых к антибиотикам; 6) можно использовать для профилактики заболеваний.
Недостатки: 1) быстро выводятся из организма; 2) срок годности 12 – 24 мес; 3) хранятся при температуре +2 - 10С.
Важное условие успешного применения бактериофагов: чувствительность возбудителя к данному бактериофагу. Лечение фагами нужно начинать в первые дни заболевания. Вводить препараты нужно в места локализации возбудителя.
Препараты назначают внутрь (через рот и в виде клизм), местно для орошения ран и слизистых оболочек, вводят в полости матки, мочевого пузыря, уха, придаточных пазух, в брюшную и плевральную полости, а также в полости абсцессов после удаления гноя и экссудата. Так как бактериофаги разрушаются кислотами, поэтому препараты, которые назначают для приема через рот, имеют кислотоустойчивое покрытие.
Отсутствие противопоказаний и осложнений, возможность использования в сочетании с другими средствами, в том числе антибиотиками, активность в отношении антибиотикорезистентных штаммов и адаптация бактериофагов к современным возбудителям – все это позволяет оценить препараты бактериофагов как высокоэффективное и перспективное средство экстренной терапии гнойно-септических и кишечных инфекций.
Читайте также:


