Жизненные циклы вирусов литический и лизогенный
Лизогенный цикл, также называемый лизогенией, является стадией процесса размножения некоторых вирусов, в основном тех, которые поражают бактерии. В этом цикле вирус вставляет свою нуклеиновую кислоту в геном бактерии-хозяина..
Этот цикл образует вместе с литическим циклом два основных механизма репликации вируса. Когда бактериофаг во время лизогенного цикла вставляет свою ДНК в бактериальный геном, он становится профаном.
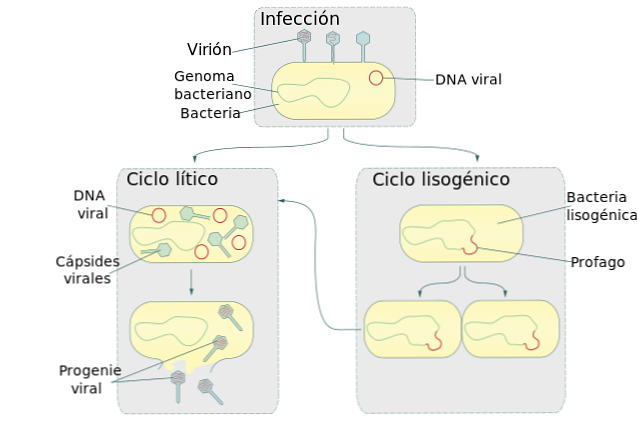
Бактерия, зараженная этим профаном, продолжает жить и размножаться. Когда происходит размножение бактерий, также получается копия профага. В результате каждая бактериальная дочерняя клетка также заражается профаном.
Размножение зараженных бактерий и, следовательно, их профагов-хозяев может продолжаться в течение нескольких поколений без проявления вируса..
Иногда самопроизвольно или в условиях стресса окружающей среды ДНК вируса отделяется от бактериальной. Когда происходит разделение бактериального генома, вирус запускает литический цикл.
Эта репродуктивная стадия вируса вызовет разрыв бактериальной клетки (лизис), что приведет к выпуску новых копий вируса. Эукариотические клетки также подвержены атаке лизогенных вирусов. Однако пока неизвестно, как происходит вставка вирусной ДНК в геном эукариотической клетки..
- 1 бактериофаг
- 2 Цикл вирусной инфекции
- 2.1 Литический цикл
- 2.2 Лизогенный цикл
- 2.3 Непрерывный цикл разработки
- 2.4 Псевдолизеногенный цикл
- 3 Лизогенная конверсия
- 4 Фаготерапия
- 4.1 Преимущества фаготерапии
- 5 ссылок
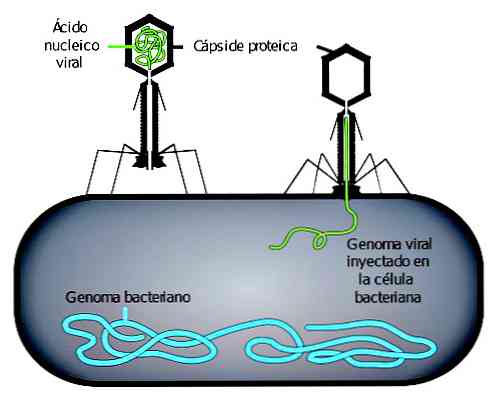
Бактериофаг
Вирусы, которые заражают только бактерии, называются бактериофагами. Они также известны как фаги. Размер этого типа вируса довольно изменчив, с диапазоном размеров, который может быть приблизительно между 20 и 200 нм..
Бактериофаги распространены повсеместно и способны развиваться практически в любой среде, где обнаружены бактерии. Подсчитано, например, что чуть менее трех четвертей бактерий, населяющих море, заражены фагами.
Цикл вирусной инфекции
Вирусная инфекция начинается с адсорбции фага. Фаговая адсорбция происходит в два этапа. В первом, известном как обратимое, взаимодействие между вирусом и его потенциальным хозяином слабое.
Любое изменение условий окружающей среды может привести к прекращению этого взаимодействия. Вместо этого в необратимом взаимодействии участвуют специфические рецепторы, которые предотвращают прерывание взаимодействия..
ДНК вируса может проникать внутрь бактерий только тогда, когда происходит необратимое взаимодействие. Впоследствии, в зависимости от типа фага, они могут выполнять различные репродуктивные циклы.
В дополнение к уже описанным литическим и лизогенным циклам существуют два других репродуктивных цикла: непрерывное развитие и псевдолиогенный..
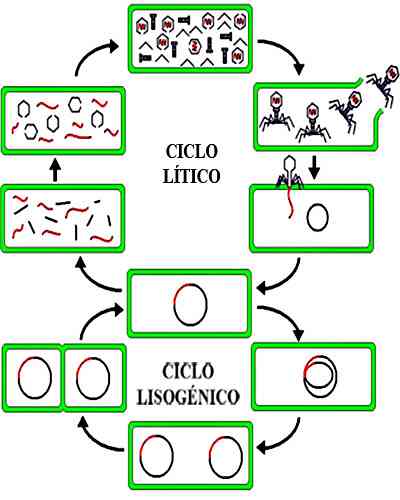
На этом этапе размножение вируса внутри бактерий происходит быстро. В конце концов бактерии будут страдать от лизиса клеточной стенки и новые вирусы будут выпущены в окружающую среду..
Каждый из этих недавно выпущенных фагов может атаковать новую бактерию. Последовательное повторение этого процесса позволяет экспоненциально расти инфекции. Бактериофаги, которые участвуют в литическом цикле, называются вирулентными фагами..
В этом цикле лизис клетки-хозяина не происходит, как это происходит в литическом цикле. После стадий адсорбции и проникновения стадия интеграции фаговой ДНК в бактериальную клетку продолжается и превращается в профаго..
Репликация фага будет происходить одновременно с размножением бактерий. Profagos, интегрированный в бактериальный геном, будет наследоваться дочерними бактериями. Вирус может продолжаться без проявления в течение нескольких поколений бактерий..
Этот процесс является частым, когда количество бактериофагов велико по сравнению с количеством бактерий. Вирусы, которые осуществляют лизогенный цикл, не являются вирулентными и называются умеренными..
В конце концов, profagos можно отделить от бактериального генома и трансформировать в литические фаги. Последние входят в литогенный цикл, что приводит к бактериальному лизису и заражению новых бактерий.
Некоторые бактериофаги выполняют многочисленные репликации внутри бактерий. В этом случае, вопреки тому, что происходит во время лизогенного цикла, он не вызывает бактериального лизиса..
Вновь реплицированные вирусы высвобождаются из бактерий в определенных местах на клеточной мембране, не вызывая их разрушения. Этот цикл называется непрерывным развитием.
Иногда доступность питательных веществ в окружающей среде недостаточна для нормального роста и размножения бактерий. В этих случаях считается, что доступной клеточной энергии недостаточно, чтобы фаги вызывали лизогению или лизис..
Из-за этого вирусы попадают в псевдолизеногенный цикл. Этот цикл, однако, еще мало известен.
Лизогенная конверсия
В конце концов, продукт взаимодействия между профаго и бактерией, первый может вызвать появление изменений в фенотипе бактерии..
Это происходит главным образом, когда бактерия-хозяин не является частью обычного цикла вируса. Это явление называется лизогенной конверсией.
Изменения, вызванные в бактериях ДНК профага, увеличивают биологический успех хозяина. Увеличивая биологическую способность и успех выживания бактерий, вирус также приносит пользу..
Этот тип выгодных отношений для обоих участников может быть классифицирован как тип симбиоза. Однако мы должны помнить, что вирусы не считаются живыми существами..
Основным преимуществом лизогенно-трансформированных бактерий является их защита от нападения других бактериофагов. Лизогенная конверсия может также увеличить патогенность бактерий у их хозяев..
Даже непатогенные бактерии могут стать патогенными вследствие лизогенного превращения. Это изменение в геноме является постоянным и наследуемым.
лечение обильной диета
Фаготерапия - это терапия, которая включает применение фага в качестве контрольного механизма для предотвращения распространения патогенных бактерий. Эта методология бактериального контроля была впервые использована в 1919 году..
В этом случае она использовалась для лечения пациента, страдающего дизентерией, и получила совершенно благоприятный результат. Фаготерапия была успешно использована в начале прошлого века.
С открытием пенициллина, а также других антибиотиков субстанция фаготерапии практически прекратилась в Западной Европе и на американском континенте..
Беспорядочное использование антибиотиков позволило создать штаммы бактерий, мультирезистентные к антибиотикам. Эти бактерии становятся все более частыми и устойчивыми.
В связи с этим в западном мире появился новый интерес к развитию фаготерапии для контроля за контаминацией и бактериальными инфекциями..
1) Рост фага происходит экспоненциально, усиливая его действие со временем, антибиотики наоборот, со временем теряют свое действие из-за метаболического разрушения молекулы.
2) Фаги обладают способностью подвергаться мутациям, что позволяет им бороться с сопротивлением, которое бактерии могут развить к их атаке. Напротив, антибиотики всегда имеют один и тот же активный ингредиент, поэтому, когда бактерии развивают устойчивость к таким активным ингредиентам, антибиотики бесполезны
3) Фаготерапия не имеет побочных эффектов, которые могут быть вредны для пациентов..
4) Разработка нового штамма фага является гораздо более быстрой и дешевой процедурой, чем открытие и разработка нового антибиотика..
5) Антибиотики воздействуют не только на патогенные бактерии, но и на другие потенциально полезные. Фаги, с другой стороны, могут быть видоспецифичными, так что лечение против бактерий, ответственных за инфекцию, может быть ограничено, не затрагивая другие микроорганизмы..
6) Антибиотики не убивают все бактерии, поэтому выжившие бактерии могут передавать генетическую информацию, которая придает устойчивость к антибиотику их потомкам, создавая таким образом устойчивые штаммы. Лизогенетические бактериофаги убивают бактерии, которые они заражают, уменьшая возможность развития устойчивых штаммов бактерий..
Совсем недавно казалось, что использование бактериофагов в качестве средства против инфекционных болезней стало неоправданным. Антибиотики были эффективнее, поэтому необходимости в более сложных методах, связанных с бактериофагами не возникло. Но на наших глазах ситуация меняется. С одной стороны, среди болезнетворных бактерий возникает всё больше форм, устойчивых к антибиотикам. С другой, бактериофаги теперь можно значительно усовершенствовать благодаря новым генетическим технологиям. Яркий пример современного применения бактериофагов содержится в недавней публикации журнала Nature.
Бактериофаги (коротко – фаги) – это название, данное вирусам, использующим для своей жизнедеятельности не эукариотические организмы (например, клетки табака или человека), а прокариоты: бактерии и археи.
Первый бактериофаг, поражающий стафилококков, был открыт в 1915 году, меньше чем через 20 лет после открытия первого вируса – вируса табачной мозаики. Открытие было сделано аналогичным образом: был обнаружен инфекционный агент, проходящий через поры специального фильтра, не пропускающего бактерии.
Снова вспомнили о фагах как о потенциальном антибактериальном средстве, когда устойчивость бактерий к антибиотикам стала серьезной проблемой. Результаты первых современных клинических испытаний появились в 2009 году. В одном исследовании смесью из нескольких бактериофагов пытались лечить инфицированные трофические язвы на ногах. Подход оказался неэффективен, но была показана его безопасность. В другом исследовании, в котором уже была обнаружена эффективность, бактериофагов применяли для лечения хронической ушной инфекции. Кроме того, эффективность бактериофагов против различных бактериальных инфекций была показана в экспериментах на животных.
Уже после того, как были открыты фаги, расшифровка структуры ДНК и последующее появление доступного секвенирования привели к расцвету генной инженерии, и теперь фаги можно модифицировать, придавая им желаемые свойства. С помощью генной инженерии можно улучшить распознавание фагами бактерий, а также можно ввести в геном фага ген, кодирующий белок, разрушающий биопленки – образуемые бактериями слои, в которых они становятся труднодоступны для антибиотиков.
Наконец, можно заставить фаг сменить лизогенное поведение на литическое. Как и многим другим паразитам, бактериофагам не всегда выгодно убивать своих хозяев. В некоторых случаях фаги действительно вскоре после инфицирования вызывают гибель клетки. При этом после попадания генетического материала фага в бактерию происходит синтез необходимых белков и сборка новых вирусных частиц, затем происходит лизис бактериальной клеточной мембраны, бактериальная клетка разрушается, и свежесобранные вирусные частицы отправляются заражать новые бактерии. Такой жизненный цикл вируса называется литическим. Однако часто после попадания генетического материала фага в бактерию больше ничего не происходит, и только некоторое время спустя, при наступлении благоприятных условий, может происходить (а может и нет) сборка новых частиц и лизис бактерии. Такой жизненный цикл вируса называется лизогенным. В природе вирус может сам, руководствуясь внешними условиями, переключаться между двумя стратегиями. Для нужд антибактериальной терапии подходит только литический цикл. Оказалось, что методами генной терапии можно заставить фаг всегда выбирать именно его.
Несколько лет назад была предпринята первая попытка персонализированного применения бактериофагов. 68-летний пациент-диабетик, принявший участие в этом эксперименте, страдал от панкреонекроза, осложнившегося внутрибольничной инфекцией, вызванной устойчивой к антибиотикам Acinetobacter baumannii. Состояние пациента непрерывно ухудшалось на протяжении четырех месяцев, а антибиотики не помогали. Тогда врачи приняли решение прибегнуть к терапии бактериофагами. В нескольких лабораториях из лабораторных коллекций были отобраны фаги, эффективные против бактерий, полученных прямо от пациента. Всего таких фагов нашлось девять, их вводили пациенту внутривенно и подкожно в абсцессы на протяжении восьми недель. После этого состояние пациента стало улучшаться, и бактериальная инфекция полностью прошла. Пациент был выписан домой и вернулся к работе.
И вот недавно была предпринята еще одна похожая попытка. В 2017 году пятнадцатилетней девочке, больной муковисцидозом, была проведена пересадка легких. Однако ее жизнь оказалась под угрозой из-за заражения нечувствительной к антибиотикам Mycobacterium abscessus. Антибиотики не помогали, прогноз был неутешительным и были применены бактериофаги. В коллекции, насчитывающей 15 тысяч фагов, нашлись три, эффективно заражающих M. abscessus. Сложность заключалась в том, что два из них относились к так называемым умеренным фагам, предпочитающим лизогенный жизненный цикл и не наносящим большого вреда бактериям. С помощью генной инженерии их, однако, удалось превратить в литические фаги, и коктейль из трех фагов стали вводить пациентке внутривенно дважды в сутки. Трое суток спустя ее состояние начало улучшаться, и через шесть недель она была почти здорова. Следы инфекции всё еще остаются, и пациентке до сих пор делают инъекции фагов. При этом она ведет обычный образ жизни и негативных эффектов от лечения не обнаружено.
Хотя бактериофаги по-прежнему гораздо сложнее (и, разумеется, дороже) в получении и использовании, чем антибиотики, они могут оказаться перспективным оружием против устойчивых к антибиотикам бактерий, которые с каждым днем представляют собой все большую проблему. Особенно эффективными могут быть фаги, генетически модифицированные с учетом этой задачи.
Лизогении или лизогенный цикл , является одним из двух циклов вирусной репродукции (The литического цикла является другим). Лизогении характеризуются интеграцией бактериофага нуклеиновой кислоты в геном или формации круговой бактерии - хозяина в репликоне в бактериальной цитоплазме. В этом состоянии бактерии продолжают жить и размножаться нормально. Генетический материал бактериофага, называется профаг , может быть передана дочерним клеткам при каждом последующем делении клеток, а на последующих событий (например, УФ - излучением или при наличии определенных химических веществ) может освободить его, вызывая распространение новых фагов с помощью литический цикл. Лизогенные циклы могут также возникать в эукариот , хотя способ введения ДНК до конца не изучен.
Разница между лизогенными и литическими циклами является то, что в лизогенных циклах, распространение вирусной ДНК происходит через обычный прокариот размножения, в то время как цикл литического более немедленный в том , что это приводит к большому количеству копий вируса создается очень быстро и клетка разрушается. Ключевое различие между циклом литического и лизогенным циклом является то , что лизогенная цикл не лизировать клетки - хозяина сразу. Фаги , которые копируют только через цикл литической известны как вирулентные фаги , а фаги , которые копируют с использованием как литические и лизогенных циклов известны как умеренные фаги.
В лизогенной цикле, ДНК фага первый интегрируются в хромосому бактерии для получения профага. Когда бактерия воспроизводит, профаг также копируется и присутствует в каждом из дочерних клеток. Дочерние клетки могут продолжать репликацию с профаг настоящим или профаг может выйти из бактериальной хромосомы, чтобы инициировать цикл лизогенную литического cycle.In хозяина ДНК не гидролизует, а в литическом цикле хозяина ДНК гидролизует в литической фазе.
содержание
Бактериофаги
Бактериофаги представляют собой вирусы , которые заражают и копируют в бактерии. Умеренные фаги (например, фаг лямбды ) можно воспроизвести с использованием как литического и лизогенный цикла. Через лизогенном цикла, геном бактериофага выражается не и вместо того, чтобы интегрироваться в геном бактерий, в формировать профаг . Так как генетическая информация бактериофаги является включена в генетическую информацию бактерий, в качестве профага, бактериофага размножается пассивно , как бактерия делится , чтобы сформировать дочерние клетки бактерий. В этом случае клетка дочерних бактерий содержит профаг и известна как лизогены . Лизогенов может оставаться в лизогенном цикле на протяжении многих поколений , но может переключиться на литический цикл в любое время с помощью процесса , известного как индукция. Во время индукции, профаг ДНК вырезал из бактериального генома и транскрипция и трансляция , чтобы белки оболочки для вируса и регулировать литический рост.
Модель организма для изучения лизогении лямбда фага. Профаг интеграция, обслуживание лизогении, индукции и контроля генома фага иссечения в индукции подробно описана в лямбда - фага статье.
Бактериофаги паразитируют , потому что они заражают своих хозяев, используют бактериальные механизмы репликации, и в конечном счете лизировать бактерии. Умеренные фаги могут привести как преимущества и недостатки для их хозяв с помощью лизогенного цикла. Во время цикла лизогенного, вирусный геном включен как профаг и репрессор предотвращает репликацию вируса. Тем не менее, умеренный фаг может избежать репрессий тиражировать, продуцировать вирусные частицы, и лизировать бактерии. Умеренный фаг избежать репрессий будет недостаток для бактерий. С другой стороны, профаг может передавать гены , которые повышают хозяин вирулентность и устойчивость к иммунной системе. Кроме того , репрессор получают профага , который предотвращает гены профаг от быть выражено дает иммунитет для хозяина бактерий из литической инфекции за счет соответствующих вирусов.
В некоторых взаимодействиях между лизогенными фагами и бактерий, лизогенная конверсия может произойти, который также можно назвать преобразованием фага. Это когда умеренный фаг вызывает изменение фенотипа из инфицированных бактерий , которые не являются частью обычного фага цикла. Изменения могут часто включать в себя внешнюю мембрану клетки, делая ее непроницаемой для других фагов или даже за счет увеличения патогенной способности бактерий для хозяина. Таким образом, умеренные бактериофаги также играют определенную роль в распространении вирулентных факторов , такие как экзотоксины и экзоферменты, среди бактерий. Это изменение затем остается в геноме зараженных бактериями и копируется и передается дочерним клеткам.
Преобразование лизогенного показало , чтобы позволить биопленки образования в Bacillus антрэкис штаммах B. антрэкис отвержденного все фага были неспособны образовывать биопленки, которые являются поверхностно-придерживались бактериальных сообществ , которые позволяют бактерии , чтобы лучше питательные веществам доступа и выживают экологические стрессы. В дополнении к образованию биопленки в B. антрэкис , лизогенное превращение Bacillus зиЫШза , Bacillus Thuringiensis и Bacillus сегеиза показало повышенную скорость и степень спорообразования. Спороношение производит эндоспоры , которые метаболически покоящиеся формы бактерий , которые обладают высокой устойчивостью к температуре, ионизирующее излучение, высыхание, антибиотики, дезинфицирующие средства и.
Номера вирулентные бактерии , также были показаны , чтобы превратить в высоко вирулентные патогены через лизогенную конверсию с факторами вирулентности , проведенных на лизогенной профаге. Гены вирулентности , проведенные в рамках профагов в виде дискретных автономные генетических элементов, известных как дебилы , давать преимущество к бактериям , которые косвенно приносят пользу вируса путем расширение выживания лизогена.
- Corynebacterium дифтерии производит токсин дифтерии только тогдакогда она заражена фага р. В этом случае генкоторый кодирует токсин осуществляетсяпомощью фага,не бактерии.
- Холерный вибрион является нетоксичным штаммкоторый может стать токсичным, производя холерный токсин , когда он инфицирован фагом CTXφ.
- Шигеллы дизентерия , которая производит дизентерию имеет токсины , которые попадают в две основных группы, Stx1 и stx2, чьи гены считаются частью генома ламбдовидных профагов .
- Streptococcus Пирролидонилпептидаза , производит пирогенный экзотоксин , полученный лизогенном преобразования, который вызывает лихорадку и алую-красная сыпь, скарлатину .
- Некоторые штаммы Clostridium ботулизма , который вызывает ботулизм , выражает ботулинический токсин из фага-tranduced генов.
Стратегии борьбы с определенными бактериальных инфекций путем блокирования профага индукции (переход от лизогенной к циклу литической ) за счет устранения в естественных условиях индукции агентов были предложены. Активные формы кислорода (ROS), такие как перекись водорода, являются сильными окислителями , которые могут разлагаются на свободные радикалы и вызывают повреждение ДНК бактерий, что приводит к индукции профага. Одна потенциальная стратегия борьбы профага индукции посредством использования глутатиона , сильный антиоксидант , который может удалить свободные радикалы промежуточных продуктов . Другой подход может быть , чтобы вызвать избыточную экспрессию CI - репрессор , так как профаг индукция происходит только тогда , когда концентрация CI репрессора является слишком низкой.
- 446
- 0,4
- 0
- 1
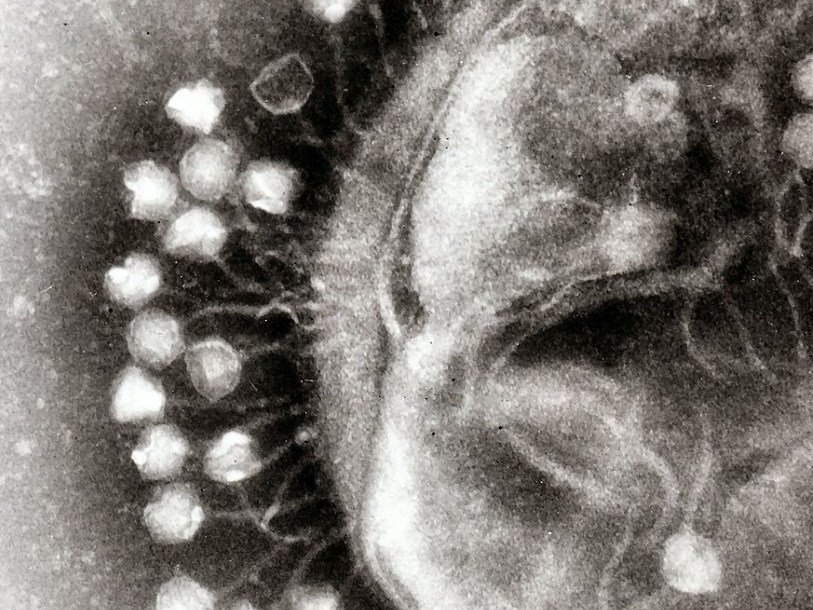
Электронная микрофотография вирионов φKO2.
[1] и рисунок автора статьи

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Обобщенная схема вариантов развития событий в жизненных циклах бактериофагов представлена на рисунке 1. После заражения клеток вирулентные фаги вступают в продуктивный (литический) цикл с образованием фаговых частиц и последующим лизисом клеток. Умеренные же фаги в ходе лизогенного цикла встраивают свой геном в бактериальную хромосому и остаются в неактивном состоянии до воздействия каких-либо внешних факторов [5]. Схема, изображенная на рисунке, репрезентативна для большинства известных умеренных фагов (Inovirus, Epsilon15-, phiC31-, Stx-, P4-, P22-, SfV-, P2- и Mu-подобных) [6], в том числе и для одного из немногих модельных объектов молекулярной биологии — фага λ. Этот значимый для истории биологии бактериофаг был открыт Эстер Ледерберг в 1951 году при работе со штаммом Escherichia coli K-12 [7], [8]. Современное представление об интеграции генома фага λ в бактериальную хромосому подразумевает att-сайт-специфическую рекомбинацию кольцевой ДНК фага и бактериальной хромосомы с участием продукта гена int — интегразы. Этот процесс проиллюстрирован в разделе, посвященном трансдукции.

рисунок автора статьи
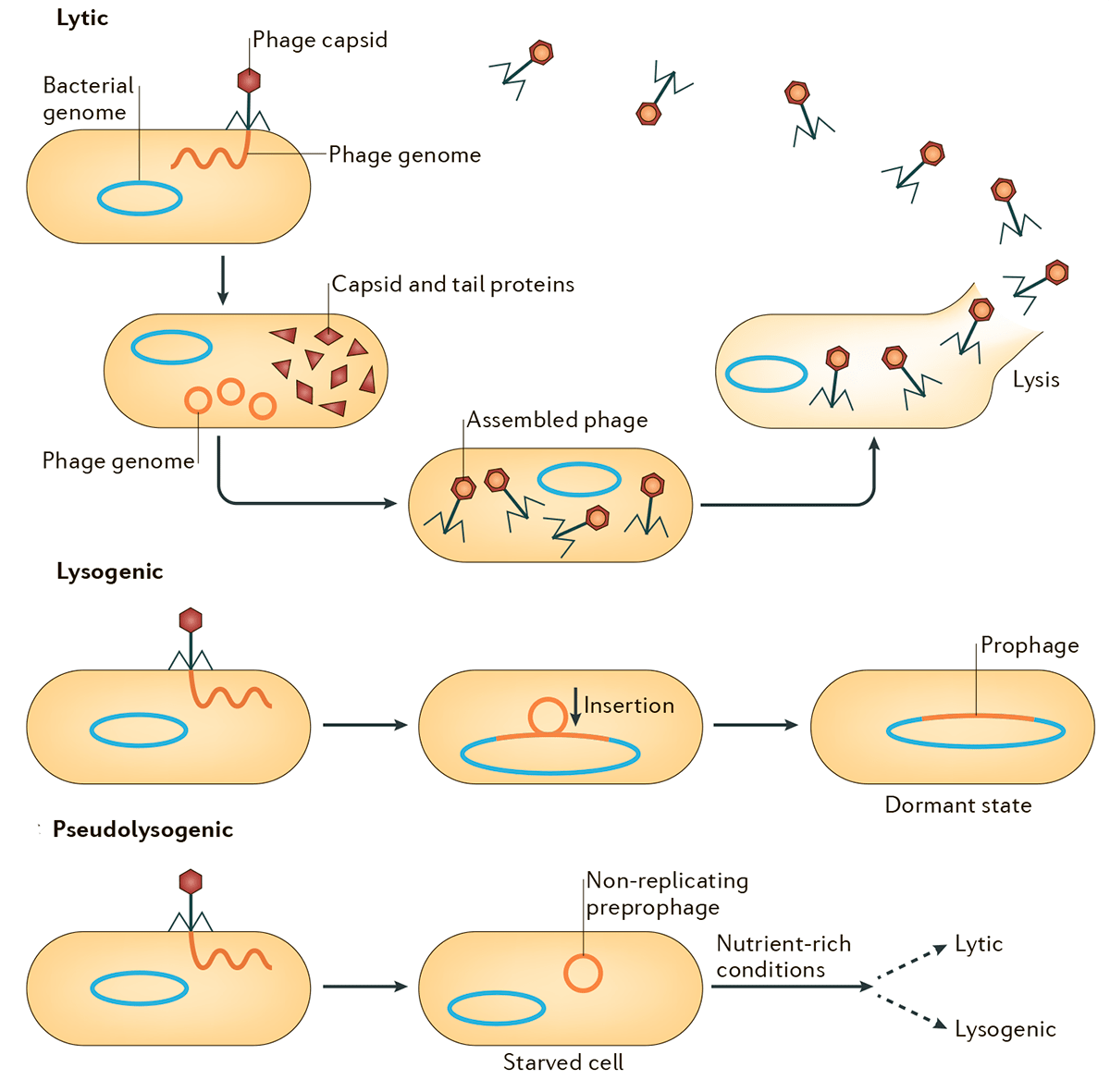
Рисунок 1. Схема литического, лизогенного и псевдолизогенного циклов. Лизогенный цикл может переключаться на литический, что будет сопровождаться продукцией частиц умеренного бактериофага и лизисом клеток. Псевдолизогения — нестабильное состояние фага, который не смог начать репликацию или стать профагом, — часто встречается при недостатке питательных веществ.
Однако, как и следует ожидать от Природы, такая форма пребывания умеренного фага в инфицированной клетке не может быть единственно возможной.
Бактерия Klebsiella oxytoca — оппортунистический патоген человека и животных, способный вызывать бронхопневмонию, воспаление мочевых путей, септицемию и колит [9], [10]. В 1980-е годы в Швеции из смазочно-охлаждающей жидкости для металлообработки выделили необычный штамм K. oxytoca, CCUG 15788, устойчивый к высокому содержанию Ni 2+ в среде [11], [12]. Тщательный электрофоретический и рестрикционный анализ геномной ДНК выявил в клетках CCUG 15788 две крупные плазмиды, правда, за устойчивость к никелю отвечали не они, а хромосома. Плазмида размером 160 т.п.н. оказалась стандартной, кольцевой, а вот меньшая, размером около 50 т.п.н., — линейной, что очень не типично для γ-протеобактерий [12]. Именно линейная плазмида, названная pKO2, через годы преподнесла исследователям сюрприз.

рисунок автора статьи
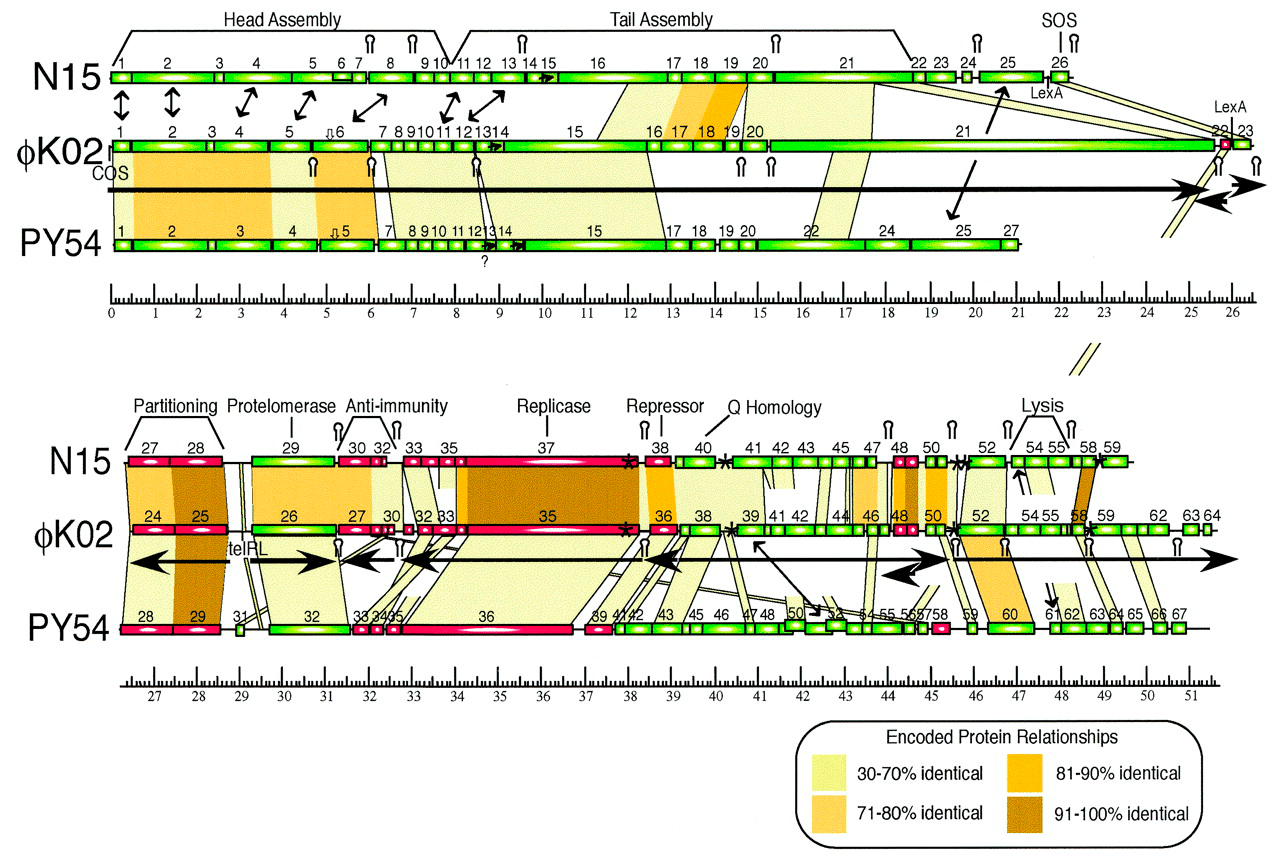
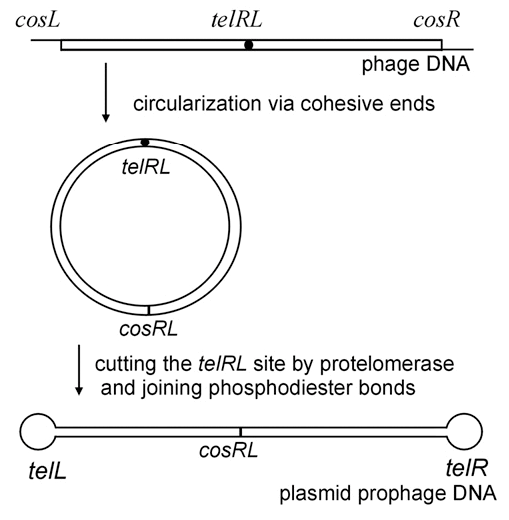
Охарактеризованный ранее фаг N15 представляет пока немногочисленную группу бактериофагов, профаги которых способны существовать в виде плазмид . N15 — первый исследованный пример линейной ДНК с ковалентно замкнутыми концами (теломерами) у прокариот [14]. Семья теломерных фагов-плазмид сейчас включает лямбдоидные N15, pY54 и φKO2 (Siphoviridae), а также фаги ΦHAP-1, VHML, VP882, Vp58.5 и vB_VpaM_MAR морских γ-протеобактерий (Myoviridae). У всех них очень схожи гены протеломераз и репликативного аппарата, а также модулей контроля лизогении [15].

рисунок автора статьи
Внедрение бактериофага, умеренного или вирулентного, в бактериальную клетку связано с риском для вируса и требует молекулярной продуманности и подготовки для успешного выполнения лизогенной или продуктивной программ. Для каждой стадии жизненного цикла вируса у бактерии есть специальные антифаговые барьеры и капканы (рис. 4а).
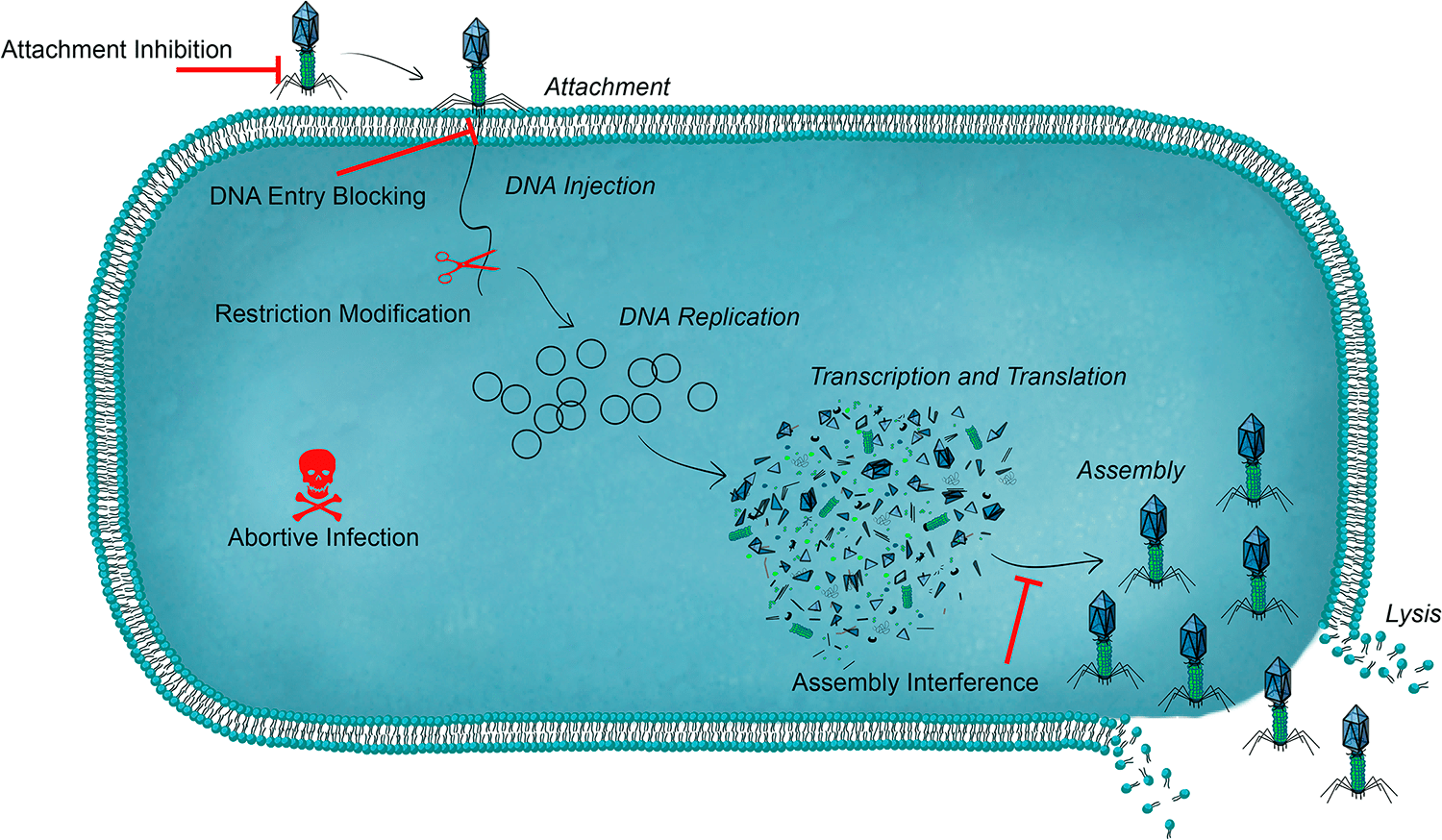
Рисунок 4а. Противофаговые системы бактерий. Этапы литического цикла выделены курсивом. Красным обозначены бактериальные системы противодействия вирусной инфекции. Клеточная оболочка изображена упрощенно, в виде цитоплазматической мембраны.
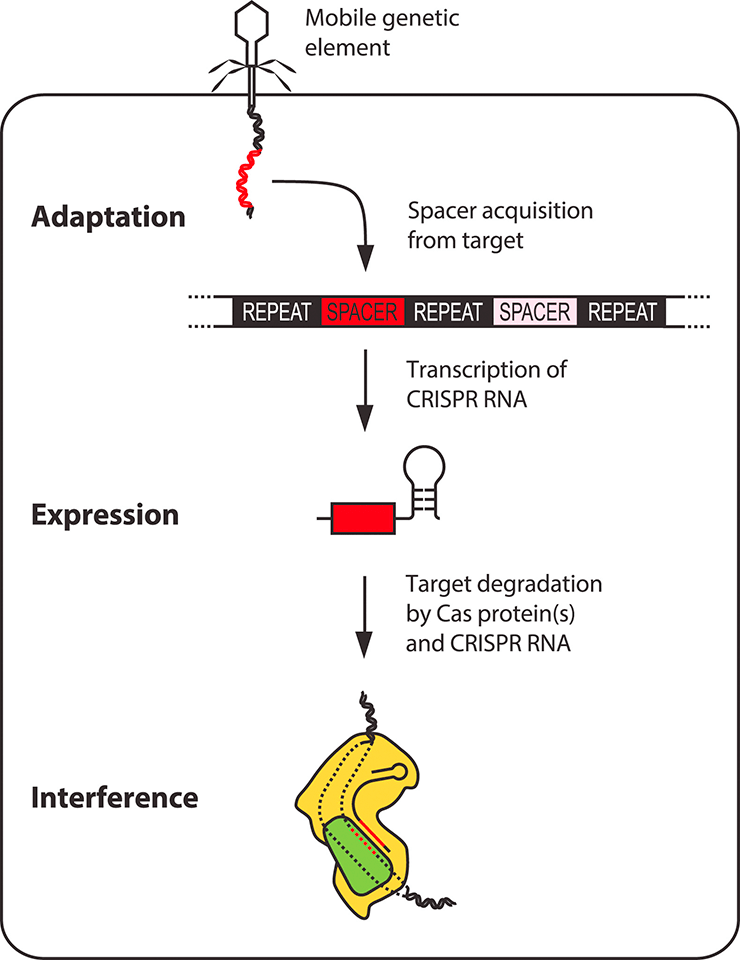
Рисунок 4б. Ключевые этапы работы иммунитета CRISPR-Cas. Адаптация — вставка новых спейсеров в локус CRISPR. Экспрессия — транскрипция локуса CRISPR и процессинг CRISPR-РНК. Интерференция — узнавание и деградация мобильных генетических элементов комплексом из CRISPR-РНК и Cas-белка.
Но преодолеть перечисленные барьеры — это еще не всё. Для успешной реализации лизогенного сценария умеренный бактериофаг должен обладать механизмом торможения литического цикла развития. Ключевую роль в переключении программы жизненного цикла бактериофага играют закодированные в геноме фага антагонистические репрессоры. Так, у φKO2 и N15 есть область иммунитета immB, содержащая гены репрессора профага CB, литического репрессора Cro и антитерминатора Q, подобные генам cI, cro и q модельного фага λ (рис. 5). Однако количество операторов, с которыми связываются репрессоры CB (CI) и Cro, у λ и теломерных φKO2/N15 неодинаково — шесть и пять соответственно [20], [21].
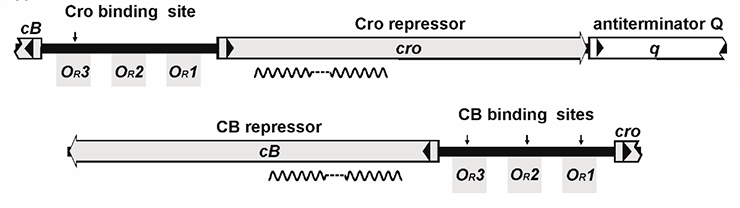
Рисунок 5. Репрессия транскрипции φKO2. Репрессор CB связывается с тремя операторами OR (между генами cB и cro) и двумя операторами OL (между cB и геном репликазы, repA). В этих зонах находится ряд промоторов, поэтому CB репрессирует транскрипцию cro, собственного гена, поздних генов, а также repA, что предполагает участие CB в контроле репликации плазмиды. Репрессор Cro связывается только с оператором OR3 и подавляет транскрипцию cB, но не своего собственного гена. Белки Q и Cro инициируют транскрипцию генов сборки фаговых частиц.
Роль умеренных, а иногда и вирулентных, фагов в микромире не ограничивается уничтожением с той или иной эффективностью своих хозяев. Бактериофаги — агенты горизонтального переноса генов и, соответственно, мощная движущая сила эволюции прокариот. А значит, в биографиях отдельных людей и человечества в целом они тоже оставляют заметные следы.
Находясь в клетках бактерий, умеренные фаги могут придавать своим хозяевам новые свойства — осуществлять лизогенную конверсию. Например, изменять морфологию колоний, ферментативную активность, бактериальные антигены, чувствительность к антибиотикам и другим веществам, а также к гомологичным фагам [3], [23–24]. Первой системой, на которой продемонстрировали лизогенную конверсию, была бактерия Corynebacterium diphtheriae. Ее штамм именно после инфицирования умеренным фагом β стал токсигенным [3]. В таблице приведены некоторые примеры фаговых генов, ответственных за патогенность бактерий.
| Бактерия | Фаги | Кодируемые фагом гены вирулентности и их продукты |
|---|---|---|
| C. diphtheriae | Beta | tox — дифтерийный токсин |
| E. coli | Stx | stx1, stx2 — шига-токсины; stk — тирозинкиназа, влияющая на передачу сигналов; cif, espI/nleA, espI, espK, espEU/tccP, nleI — эффекторные белки системы секреции III типа (T3SS), способствующие вторжению в клетки жертвы |
| λ | lom — белок внешней мембраны, обеспечивающий связывание с эпителиальными клетками; bor — белок внешней мембраны, помогающий уклоняться от иммунитета | |
| CP-933C | Факторы, регулирующие синтез T3SS | |
| S. enterica | φSopE | sopE — T3SS-эффектор |
| Gifsy-1 | gipA, gogB — факторы, способствующие колонизации пейеровых бляшек и выживанию в макрофагах | |
| Gifsy-2 | sodC1 — фермент-антиоксидант, способствующий выживанию в макрофагах; sseI — T3SS-эффектор | |
| Gifsy-3 | sspHI — T3SS-эффектор | |
| P. aeruginosa | D3 | Факторы, меняющие свойства внешней мембраны, а потому препятствующие фагоцитозу |
| S. mitis | SM1 | pblA, pblB — поверхностные белки, необходимые для прикрепления к тромбоцитам |
| C. jejuni | CJIE1 | Факторы, облегчающие адгезию и инвазию |
| V. cholerae | CTX | ctx — холерный токсин |

рисунок автора статьи
Помимо собственных генов фаги способны переносить в инфицируемые клетки и генетический материал предыдущего хозяина (фрагменты его хромосомы или мобильных генетических элементов). Этот процесс называется трансдукцией. Тех бактерий, чью ДНК фаг переносит, называют донорами, а тех, что этот материал принимают, — реципиентами. С помощью неспецифичной, или общей, трансдукции может передаваться любой признак: это происходит при случайном захвате в вирусную частицу фрагмента генома бактерии. При специфичной трансдукции фаговые частицы переносят из генома бактерии строго определенные маркеры. На это способны, как правило, только умеренные фаги — те, что встраиваются в бактериальный геном в строго определенных местах [2]. Классический пример специфичной трансдукции фагом λ бактериальных локусов gal и bio (или их частей) представлен на рисунке 6. В результате такой трансдукции возможно приобретение бактерией-реципиентом способности к утилизации галактозы и/или синтезу биотина, если, конечно, ранее она была лишена этих свойств [25].
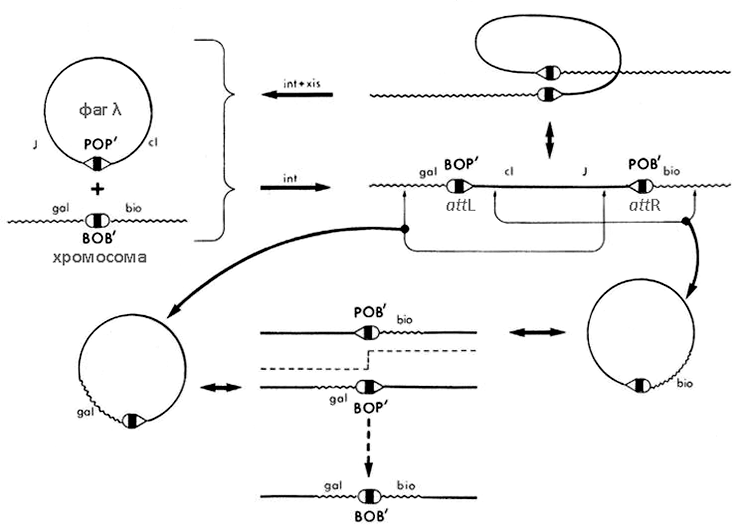
[25], рисунок с изменениями

рисунок автора статьи
Умеренные фаги образуют устойчивые ассоциации с бактериями-хозяевами. Для образования лизогенной бактерией фаговых частиц необходимо воздействие особых факторов, часто очень сильное. Известно, что в популяции лизогенных бактериальных штаммов всегда есть некоторое количество вирусных частиц. Это объясняется спонтанным высвобождением бактериофагов.
Фаговая индукция — переключение лизогенного цикла профага на литический, продуктивный — может быть обусловлена случайностями в экспрессии генов (генетический шум) или включением SOS-ответа, например, при повреждении ДНК УФ-облучением или активными формами кислорода (АФК). Объясняется это просто: во время SOS-ответа выводится из строя репрессор, поддерживающий профаг в неактивном состоянии, и запускается экспрессия литических генов.
Обобщенная схема активации продукции фаговых частиц представлена на рисунке 7а [26]. Повысить вероятность их выхода из клеток можно направленным воздействием физических, химических и биологических факторов.
- Из физических факторов индуцирующее действие показано для УФ-излучения, видимого света после предварительной сенсибилизации бактериальной культуры красителем, ионизирующего излучения, высокой температуры, высокого гидростатического давления, ультразвука и высушивания.
- Из химических — для глутатиона, серной, сероводородной и азотистой кислот, сульфатиазола, иприта, галогензамещенных аналогов урацила.
- Из биологических — для некоторых антибиотиков, ферментов, бактериоцинов и др. [3].
На рисунке 7б представлен еще один, необычный, вариант индукции профагов, связанный со снятием репрессии фаговых генов при попадании фага в цитоплазму новой, свободной от профага и, следовательно, репрессоров, клетки. Такая индукция называется зиготной и наблюдается при скрещивании лизогенной клетки-донора (Hfr) с нелизогенным реципиентом (F − ) [27].
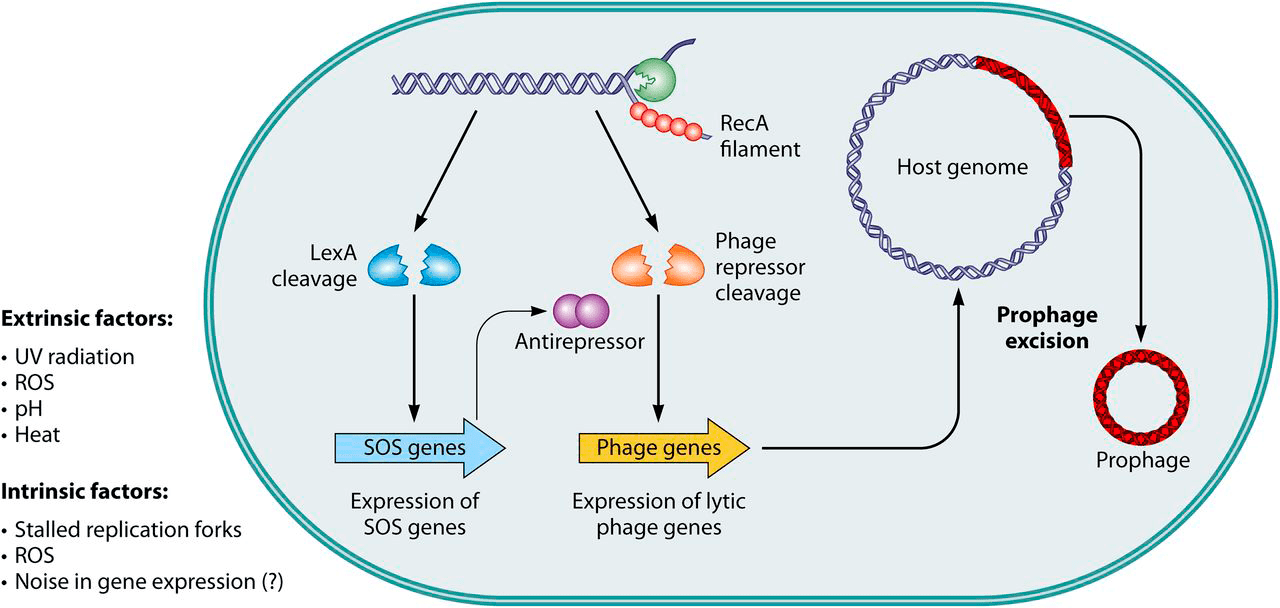
Рисунок 7а. SOS-зависимая фаговая индукция. Множество внешних и внутренних факторов оказывает влияние на геном бактерии и может привести к спонтанным повреждениям ДНК или остановке полимераз. На образовавшиеся одноцепочечные участки ДНК наслаиваются молекулы белка RecA. Это запускает автокаталитическое расщепление двух типов репрессоров — LexA (бактериальный белок) или CI-подобных (фаговые репрессоры). Из-за ослабления LexA-репрессии начинают экспрессироваться SOS-гены, тормозящие деление клеток и запускающие репарацию их ДНК. Для некоторых фагов, включая теломерных, показана SOS-зависимая инактивация фаговых репрессоров путем связывания с антирепрессорами. Это ведет к активации литических промоторов с последующим вырезанием профага из хозяйского генома и упаковкой в вирионы, которые высвобождаются из клетки при ее лизисе.
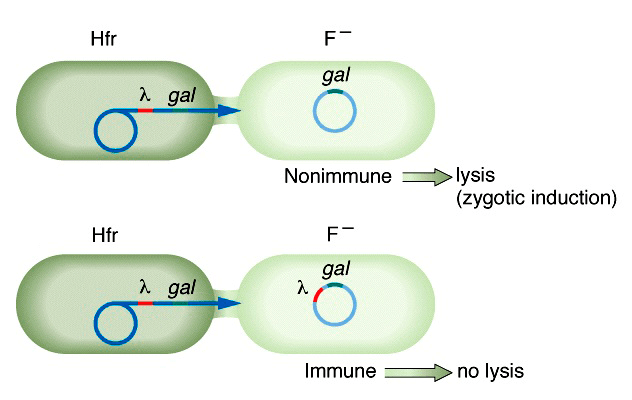
Рисунок 7б. Зиготная индукция

рисунок автора статьи
В качестве заключения
Мир простых на первый взгляд бактериальных вирусов по мере углубления его изучения оказывается всё более многоликим. Одних из них можно брать в союзники на антимикробные сражения, другие внезапно проявляют себя лизисом полезных для человека культур. И того хуже: заручившись поддержкой прокариотического хозяина, кто-то из них провоцирует вспышку опасной инфекции у эукариот. Ну а кто-то прекрасно справляется с переносом между бактериями метаболических генов или даже целых путей.
Умеренные бактериофаги сыграли важную роль в становлении понятий молекулярной биологии. Благодаря исследованиям фага λ получены представления о сайт-специфической и общей рекомбинации, положительной и отрицательной регуляции генов, репликации ДНК. И даже относительно недавно описанные теломерные бактериофаги уже нашли применение в биотехнологии: линейные плазмидные векторы в ряде случаев показали преимущество над суперскрученными кольцевыми плазмидами, способными к образованию крестообразных структур и реорганизации. К тому же на их основе можно создавать низкокопийные векторы, пригодные для экспрессии генов токсичных продуктов.
Несмотря на то, что умеренные фаги говорят лаконично на языке последовательности нуклеотидов и обладают сдержанными потребностями, в их коллективную историю несомненно еще будут вписаны интересные открытия и практические изобретения.
Читайте также:



