Ангиогенный путь передачи инфекции
Факторами передачи чаще всего выступают пыль, вода, продукты питания, оборудование и медицинские инструменты.
Ведущими путями заражения в условиях ЛПУ являются контактно-бытовой, воздушно-капельный и воздушно-пылевой. Также возможен парентеральный путь (характерно для гепатитов В, С, D и др.)
Механизмы передачи инфекции: аэрозольный, фекально-оральный, контактный, гемоконтактный
Основной путь передачи — это:
- прямой (от источника к хозяину)
- косвенный (через промежуточные объекты: руки, предметы);
воздушно-капельный (аэрозольный) - вдыхая капельки и пылинки;
- фекально-оральный - пищевой (алиментарный)и водный.
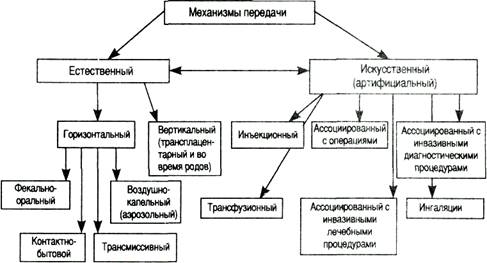
Рис. Механизмы и пути передачи ВБИ.
Воздушно-капельный (аэрозольный) путь передачи инфекции играет ведущую роль в распространении стафилококковой и стрептококковой инфекции.
Инфицированный воздух обусловливает возникновение вспышек болезни легионеров, зарегистрированных в госпиталях ряда стран мира. При этом большую роль в распространении инфекции играли кондиционеры с увлажнителями, вентиляционные системы, реже заболевания были связаны с вдыханием водного или пылевого аэрозоля при физиотерапевтических процедурах или проводившихся недалеко от стационара строительных земляных работах. Следует иметь в виду, что постельные принадлежности — тюфяки, матрасы, одеяла, подушки — также могут стать факторами передачи стафилококков, энтеропатогенных и других возбудителей.
Контактно-бытовая передача свойственна главным образом инфекциям,
вызываемым грамотрицательными бактериями. При этом нужно учитывать возможность интенсивного размножения и накопления этих микроорганизмов во влажной среде, в жидких лекарственных формах, в сцеженном грудном молоке, на влажных щетках для мытья рук персонала и влажной ветоши. Факторами передачи инфекции могут служить также контаминированный инструментарий, дыхательная аппаратура, белье,
постельные принадлежности, поверхность влажных предметов (ручки кранов, поверхность раковин и т.д.), инфицированные руки персонала. Бытовая передача реализуется и при стафилококковой инфекции, особенно в тех случаях, когда она вызывается эпидермальным стафилококком.
Пищевой путь передачи может реализоваться при инфекциях, вызываемых различными этиологическими агентами. У детей, находящихся на грудном вскармливании, возможно заражение стафилококками при кормлении или докорме сцеженным молоком или вскармливании матерью, страдающей маститом. Нарушения технологии приготовления пищевых продуктов, наличие нераспознанных, источников инфекции у работников пищеблоков приводят к возникновению вспышек кишечных инфекций в стационарах. Однако основное значение в распространении ВБИ играет
правил асептики и антисептики, нарушения режима стерилизации и дезинфекции медицинского инструментария и приборов приводят к реализации артифициального пути передачи инфекции. При этом в каждом типе стационаров важно выявить факторы и контингента риска, вероятность возникновения ВБИ у которых особенно велика.
6.Факторы, влияющие на восприимчивость хозяина к инфекции.
Основными факторами являются возраст человека, неблагоприятные условия окружающей среды, недостаточная иммунная защита организма, множество лечебно-диагностических процедур,хронические заболевания организма, скопление возбудителей ВБИ из-за нарушений санитарно-противоэпидемического режима лечебно-профилактических учреждений, невыполнение правил асептики и антисептики, нарушение правил дезинфекции и стерилизации медицинского инструментария и приборов.
(со стороны микроорганизма)
Развитие инфекционной болезни зависит как от дозы, патогенности, вирулентности, инвазивности и токсигенности возбудителя, так и от восприимчивости хозяина к инфекции.
Патогенность - закреплённая генетически потенциальная способность микроорганизма данного вида вызывать определённое инфекционное заболевание.
Инвазивность - способность микроорганизма проникать в ткани и органы макроорганизма и распространятся в них.
Токсигенность - способность микроорганизма вырабатывать и выделять токсины.
Вирулентность – степень патогенности.
Здоровый человек, как правило, устойчив к инфекции. Однако, когда нарушаются основные механизмы биологической защиты человека, возбудитель инфекции, получает лучшую возможность вызвать инфекционное заболевание.
7. Группы риска развития внутрибольничной инфекции.
1) пациенты без определенного места жительства, мигрирующее население, с длительными не долеченными хроническими соматическими и инфекционными заболеваниями, не имеющие возможность получать специальную медицинскую помощь;
- назначена терапия подавляющая иммунную систему (облучение, иммунодепрессанты);
- проводятся сложные диагностические, операционные вмешательства;
3) родильницы и новорождённые, особенно недоношенные и переношенные;
4) дети с врождёнными аномалиями развития, родовой травмой;
5) пациенты, посетители и родственники, ухаживающие за тяжелобольными в хирургических, урологических, реанимационных отделениях, отделениях гемодиализа и т.д.;
6) медперсонал МО (медицинских организаций).
7) пациенты хирургических, урологических, реанимационных отделений.
Не нашли то, что искали? Воспользуйтесь поиском:
Госпитальные инфекции - (внутрибольничные (ВБИ), нозокомиальные, госпитальные гнойно-септические инфекции (ГГСИ) — инфекции, развивающиеся вследствие оказания медицинской помощи больному, независимо от степени клинической выраженности, сроков развития (до или после выписки из стационара) или у сотрудников больницы вследствие их работы в данном учреждении, если инфекционный процесс не является закономерным развитием основного заболевания [1].
В США госпитальные инфекции развиваются у 5,7% пациентов, в Великобритании – 9,2%; в Испании – 8,5%; Германии – 3,6-6,3%.
ПРИЧИНЫ РОСТА ГОСПИТАЛЬНЫХ ИНФЕКЦИЙ:
· Увеличение степени агрессии и инвазии лечебно-диагностического процесса.
· Недостаточная антиинфекционная защита внедряемых медицинских технологий.
· Нерациональное применение антимикробных препаратов (антибиотиков, антисептиков, дезинфицирующих препаратов и т.д.) и как следствие этого формирование резистентных форм бактерий, селекция госпитальных штаммов.
· Рост числа пациентов с иммунодефицитами, злокачественными новообразованиями, сахарным диабетом.
· Трудности стерилизации некоторых видов аппаратуры.
· Успехи реаниматологии и анестезиологии, позволяющие выхаживать таких пациентов, которые ранее считались иноперабельными и инкурабельными.
· Гигиеническая беспечность, нарушение асептики персоналом.
· Недостаточные знания персоналом мер профилактики и защиты от внутрибольничных инфекций.
· Рост числа родильниц с экстрагенитальной патологией, низкий удельный вес рождаемости здоровых новорожденных и другие причины.
КЛАССИФИКАЦИЯ ГОСПИТАЛЬНЫХ ИНФЕКЦИЙ:
По характеру патологического процесса:
· Традиционные (сальмонеллез, дизентерия, вирусные гепатиты и др.).
· Гнойно-септические (инфекции родильниц и новорожденных и инфекции у хирургических больных).
По этиологии: стрептококковые, стафилококковые, сальмонеллезные, синегнойные и другие инфекции.
По локализации инфекционного процесса ГГСИ делятся на :
· Гнойные инфекции ран
· Инфекции мочевыделительной системы
· Инфекции дыхательной системы
· Инфекции желудочно-кишечного тракта
По форме проявлений процесса:
· Экзогенные - (инфицирование возбудителями связаны с манипуляциями, операциями и другими процедурами, выполняемые персоналом больницы; инфицированные лекарственные препараты, пищевые продукты, изделия медицинского назначения).
· Эндогенные - (возбудители распространяются из очага хронической инфекции пациента, при вскрытии полого органа, декомпенсации дисбактериоза, транслокации микроорганизмов из кишечника в кровеносное русло и др.)
· Истинный госпитализм - (инфекции, вызванные госпитальными штаммами микроорганизмов).
КАТЕГОРИИ ИСТОЧНИКОВ ИНФЕКЦИИ:
· Больные традиционными и гнойно-септическими инфекциями
ПУТИ ПЕРЕДАЧИ ВБИ:
· Инструментально-контактный – реализуется через инфицированные инструменты, перевязочный материал, руки персонала и является основным в группе ГГСИ. Его разновидностью является аппаратный путь (эндоскопическая аппаратура, аппараты ИВЛ, искусственного кровообращения и т.д.);
· Имплантационный (Эксплантационный) – реализуется через вживляемые в организм различные имплантационные материалы – сосудистые протезы, протезы клапанов сердца, суставов, металлические конструкции, применяемые в травматологии и ортопедии, шовный материал и т.д..
· постинфузионный (посттрансфузионный) – реализуется через инфицированные инфузионные растворы, трансфузионные среды (кровь и препараты крови).
· Посткатетеризационный – реализуется посредством катетеризации центральных и периферических сосудов.
· Аэрогенный – реализуется воздушно-капельным путем – грипп, ветряная оспа, краснуха и т.д. Особое значение имеет у больных со сниженным иммунитетом.
Раздел 24
Вирусные гепатиты. Общие сведения
Вирусные гепатиты — большая группа вирусных антропонозных заболеваний, протекающих с поражением печеночной ткани и отличающиеся выраженным полиморфизмом клинических проявлений [5,6].
Классификация вирусных гепатитов:
· Гемоконтактный механизм передачи: В,С,D,G (GBV-A, GBV-B, GBV-C), SEN, TTV.
· Фекально-оральный механизм передачи: А и Е.
Гепатит В и С - глобальная проблема мирового и отечественного здравоохранения. Вирусом гепатита В пораженоболее 2 млрд. человек, что составляет 1/3 населения мира, 380 млн. больные хроническим гепатитом В; 7,5 млн. – хроническим гепатитом С.
Исходы: развитие цирроза печени или гепатокарциномы при хроническом гепатите В через 25-30, при хроническом гепатите С через 15-18 лет.
Вирусы гепатитов устойчивы во внешней среде, выживают при воздействии высоких и низких температур, химических и физических факторов. В условиях комнатной температуры сохраняется в течение 3-х месяцев, в холодильнике – 6 месяцев, в замороженном виде – 15-20 лет, в высушенном виде – 25 лет. При автоклавировании 120 0 С погибает в течение 45 минут.
Источники инфекции: больные острыми или хроническими формами и вирусоносители.
Инкубационный период: гепатит В – 30-180 дней
Гепатит С - от 2-х до 26 недель
Пути передачи вирусных гепатитов В, С:
- Искусственные: гемоконтактный (парентеральные манипуляции, косметические процедуры, гемотрансфузии, внутривенное введение наркотиков);
- Естественные: половой, вертикальный (пери-, интранатально, трансплацентарно, через поврежденную кожу во время родов), горизонтальный (контактно-бытовой).

Общие сведения
Частота регистрации ИСМП в разных странах варьирует в широких пределах. Так, в РФ этот показатель составляет 1-1,5% (40-60 тыс. случаев/год), США — 3-5 % (2,5 млн. случаев/год), Великобритании — 5-6 %, Германии —3,5 %, Китае — 7-8 %. Однако, эти показатели, особенно в странах СНГ и, в частности, России не отражают реальную эпидемиологическую ситуацию. Результаты научных исследований ведущих специалистов-эпидемиологов РФ свидетельствуют, что реальное количество ИСМП составляет в среднем около 10% и находится на уровне 2-2,5 миллионов случаев/год. Присоединение ИСМП к основному заболеванию увеличивает продолжительности лечения (пребывания в стационаре) пациента на 7-10 дней, а прямые затраты лечебных учреждений на 65-85 млрд рублей в год. Летальность при различных нозологических формах ИСМП варьирует в пределах 3,5-35%.
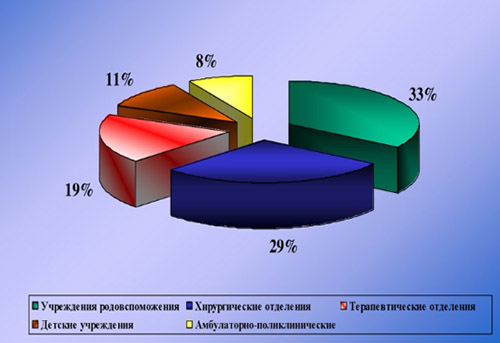
Наибольший удельный вес ИСМП приходится на хирургические и акушерские стационары (отделения травматологии, урологии, реанимации, абдоминальной хирургии, гинекологии, ожоговой травмы, стоматологии, отоларингологии, онкологии). Наиболее драматичны проявления ИСМП в отделениях интенсивной терапии и реанимации, где они в различных нозологических формах регистрируются в 25-30% случаев.
Патогенез
Патогенез внутрибольничных инфекций существенно различается и определяется видом заболевания, этиологическим фактором (видом возбудителя, факторами его вирулентности), механизмом и путями передачи инфекции.
Классификация
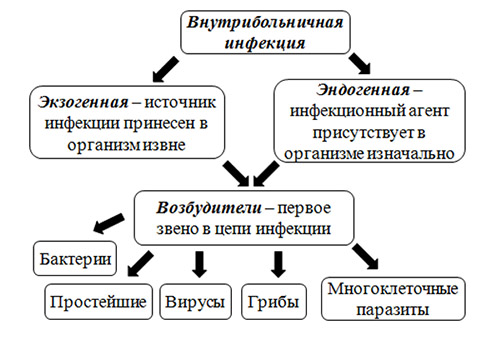
Прежде всего, различают две больших группы ИСМП (рис. ниже):
- Экзогенная инфекция — обусловлена заражением пациента инфекционным агентом в условиях посещения/нахождения в ЛПУ.
- Эндогенная инфекция — инфекции, вызванных условно-патогенными микроорганизмами, вегетирующими в пищеварительном тракте, на кожных и слизистых покровах, которые при неблагоприятных условиях становятся патогенными. В структуре ВБИ роль эндогенной инфекции незначительна.
Группы и этиологический фактор ИСМП
В основу классификации ВБИ положены различные факторы. В зависимости от путей/факторов передачи различают воздушно-капельные, контактно-бытовые, контактно-инструментальные, постоперационные, постинфекционные, постэндоскопические, послеродовые, посттрансфузионные, постдиализные, посттравматические, постгемосорбционные и другие инфекции.
В зависимости от степени распространения инфекции различают:
- Генерализованные: бактериемия, септицемия, септикопиемия, токсико-септическая инфекция.
- Локализованные инфекции, включающие:
- Респираторные инфекции (ОРЗ, бронхит, плеврит, пневмония, легочный абсцесс и др.).
- Инфекции подкожной клетчатки/кожи (послеожоговые, послеоперационные, послетравматические), дерматомикозы, постинъекционные — абсцессы/флегмоны подкожной.
- Стоматологические инфекции (абсцесс, стоматит).
- ЛОР-инфекции (ринит, отиты, синуситы, ангина, ларингит, фарингит).
- Урологические инфекции.
- Инфекции пищеварительного тракта (энтерит, колит, гастроэнтероколит, холецистит, гепатиты др.).
- Постоперационные инфекции (перитонит, абсцессы брюшины).
- Инфекции глаза (конъюнктивит).
- Инфекции урологической и половой системы (пиелонефрит, уретрит, цистит, бактериурия, эндометрит, сальпингоофорит).
- Инфекции костно-cуставного аппарата (остеомиелит, бурсит, артрит).
- Инфекции сердечно-сосудистой системы (миокардит, эндокардит, перикардит, инфекции артерий и вен).
- Инфекции ЦНС (менингит).
- По характеру течения: острые, подострые, хронические. По тяжести течения: легкие, тяжёлые и среднетяжелые.
Причины
Этиологическим фактором ИСМП может быть чрезвычайно широкий спектр микроорганизмов (около 250 видов), принадлежащих к разным таксономическим группам: бактерии, вирусы, простейшие, грибы. При этом, инфекционным агентом могут быть патогенные, условно-патогенные микроорганизмы, а в ряде случаев и сапрофитная микрофлора. Наибольшей удельный вес в этиологической структуре ИСМП принадлежит возбудителям гнойно-септических инфекций (80-85%), кишечных инфекций (8-10%), вирусам гепатитов В, С, D (6-7%), инфекции дыхательных путей (2-3%). В целом, структура ВБИ изменчива и зависит преимущественно от профиля отделения/вида стационара и микробного пейзажа конкретного лечебного отделения (рисунок ниже).
К возбудителям ВБИ, имеющими наибольшее значение относятся:
- грамположительная флора: стафилококки (золотистый, эпидермальный), стрептококки (пневмококк, энтерококк, пиогенный стрептококк);
- грамотрицательная флора: энтеробактерии (эшерихия, сальмонелла, шигелла, синегнойная палочка, клебсиелла, протей, иерсиния).
- вирусы (аденовирусной инфекции, простого герпеса, кори, ветряной оспы, гриппа, парагриппа, респираторно-синцитиальной инфекции, эпидпаротита, ротавирусы, риновирусы, энтеровирусы, возбудители вирусных гепатитов);
- грибы (рода Candida, аспергиллы).
Значимость различных видов ИСМП во многом определяется профилем ЛУ. Так, в гинекологических и родильных отделениях ведущую роль играет стафилококковая инфекция (золотистый стафилококк), кишечная палочка, энтерококки, диплоидный грибок (молочница); в ожоговых стационарах — синегнойная инфекция; в урологических отделениях — грамотрицательная микрофлора: кишечная, синегнойная палочка; в детских отделениях — вирусы краснухи, кори, эпидемического паротита, ветряной оспы.
Формирование госпитального штамма (с приобретенной устойчивостью) обеспечивается за счет их преимущества (доминирования) перед другими представителями микробной популяции. Основными отличиями госпитального штамма микроорганизма от стандартного являются: повышенная вирулентность (патогенность), формирующаяся за счет многократного пассажа через организм больных ЛПУ, высокая устойчивость к воздействию неблагоприятных факторов (дезинфектантам, антисептикам, химиопрепаратам, применяемым в конкретном мед. учреждении) и способность к длительному выживанию, постоянная циркуляция в среде больничного стационара среди больных и персонала.
Основную массу всех форм ВБИ (около 80%) составляют:
- инфекции мочевыделительной системы;
- ОРЗ и вентилятор-ассоциированные пневмонии;
- послеоперационные раневые гнойно-септические инфекции;
- кожные инфекции;
- интраабдоминальные инфекции;
- ангиогенные катетер-ассоциированные инфекции.
Любая нозологическая форма ВБИ развивается только при наличии всех звеньев эпидемического процесса: источника инфекции, механизма (факторов) передачи и восприимчивого организма человека.
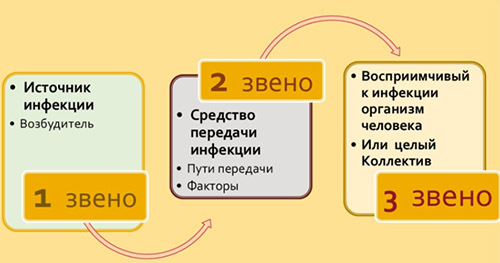
Основные источники внутрибольничной инфекции:
- больные и носители, находящиеся в стационаре;
- персонал лечебных учреждений;
- лица, ухаживающие за больными и посетители стационаров (студенты, лица, навещающие пациентов).
Аэрогенный — процесс заражения осуществляется через воздушную среду. Выделяют:
- воздушно-капельный путь (этим путем возбудитель передается при большинстве ОРЗ, пневмониях) при разговоре, кашле;
- воздушно-пылевой путь (передаются заболевания, возбудитель которых устойчив во внешней среде — кишечные инфекции, туберкулез, зоонозы).
- Контактно-бытовой путь – инфекционный агент передается через грязные рук, предметы личной гигиены, игрушки, посуду.
- Пищевой (реализуется через зараженные продукты питания при нарушениях технологии приготовления или хранения готовых блюд и пищевых продуктов).
- Водный (через воду).
- Прямой — передача возбудителя непосредственно через физический контакт между резервуаром инфекции (инфицированный индивидуум/контаминированный предмет) с кожей, слизистой или раневой поверхностью восприимчивого организма человека.
- Непрямой — посредством механического переноса инфекционного агента через руки медицинского персонала, предметы обихода, инструменты и оборудование лечебного учреждения. Непрямой контакт является наиболее часто задействованным путем распространения. Этот путь передачи часто называют артифициальным (искусственным) или парентеральным путем передачи возбудителя, который реализуется путем проведения различных инвазивных манипуляций (инъекции, забор крови, инструментальные манипуляции, вакцинацию, местные/общие операции) или использовании специальной аппаратуры при проведении гемодиализа, ИВЛ.
- Гемоконтактный — передается через кровь при обширных хирургические вмешательствах, инфузионной терапии, программном гемодиализе.
Заболеваемость ИСМП носит преимущественно эндемический характер и обусловлена индивидуальными факторами риска и клиническими процедурами. Значительно реже ИСМП протекают в виде локальных эпидемий. Развитию эпидемических вспышек способствует несвоевременная диагностика стертых форм заболевания и выявление носителей инфекционных агентов, как среди поступающих пациентов, так и среди медицинского персонала, контаминация предметов общего пользования, систематическое нарушение методов асептики при выполнении инструментальных процедур.
Специфичны для каждого вида инфекционного возбудителя. Однако, в целом для большинства нозологических форм ИСМП определяющими факторами являются параметры, характеризующие организм хозяина:
- возраст (пожилой/старческий, дети — новорожденные и раннего возраста, особенно недоношенные, со сниженной сопротивляемостью организма и перенесшие родовую травму);
- пациенты, страдающие тяжелыми хроническими заболеваниями, с алиментарной дистрофией;
- длительно находящиеся в стационаре и особенно на постельном режиме;
- беременные/роженицы;
- пациенты, получающие лучевую/иммуносупрессивную терапию;
- имунноскомпрометированные лица;
- больные после обширных хирургических операций, получающие кровезаместительную/инфузионную терапию, с программным гемодиализом, находящиеся на ИВЛ.
Факторы риска ИСМП, связанные с предметами окружающей среды (загрязнение поверхностей, воздуха, воды в распространении инфекции) имеют меньшую значимость.
Возникновению и распространению ИСМП способствуют:
Симптомы
Симптоматика внутрибольничных инфекций определяется конкретной нозологической формой и симптомами основного заболевания, формой и тяжестью их течения, вирулентностью инфекционного агента и состоянием организма больного.
Анализы и диагностика
К ВБИ относятся случаи, отвечающие следующим критериям:
- Повторное поступление пациента в стационар с установленной инфекцией (с клиническими признаками, данными инструментальных и лабораторных методов исследовани — микробиологических, серологических и методов экспресс-диагностики), являющееся следствием предыдущей госпитализации.
- Период развития клинической симптоматики заболевания ВБИ после поступления в лечебный стационар должен составлять не менее 48 часов и более.
- Выявляется четкая взаимосвязь между симптоматикой заболевания и проведенными вмешательства инвазивного типа (после ингаляции, инъекций, перевязки и т.д.) или в ряде случаев — с выявленным источником инфекционного агента (поступивший больной со стертой формой заболевания/носитель) и фактором ее распространения.
Для точной диагностики заболевания и определения конкретного штамма возбудителя инфекции, требуется проведение лабораторных—бактериологических/серологических исследований различных биоматериалов (мазок из зева, мокрота, кровь, моча, кал, раневое отделяемое).
Лечение
Проблема лечения госпитальных инфекций представляет значительную трудность, что обусловлено неэффективностью большинства широко применяемых антибиотиков, в частности цефалоспоринов. Для лечения таких инфекций применяются карбапенемы (Меропенем, Дорипенем), имеющие широкий спектр антимикробной активности, в частности к микроорганизмам, устойчивым к пенициллинам/цефалоспоринам или в ряде случаев комбинированные лекарственные препараты пенициллинов с ингибиторами бета-лактамаз (Пиперациллин + Тазобактам, Тикарциллин, Амоксициллин-Клавуланат и др.).
Карбапенемы используются для лечения тяжелых нозокомиальных пневмоний и других инфекций верхних дыхательных путей; инфекций органов малого таза, гинекологических, абдоминальных, мочеполовых инфекций; кожи и мягких тканей; сепсиса. Однако, препараты этой группы могут вызывать побочные реакции в виде крапивницы, сыпи, диспепсических расстройств, поражения печени и почек, дисбактериоза.
При выявлении метициллинрезистентных штаммов золотистого стафилококка, являющегося частым возбудителем внутрибольничных резистентных стафилококковых инфекций для лечения, используются гликопептидные антибиотики (Ванкадицин, Тейкопланин-Тева, Ликованум, Таргоцид и др.), которые высокоактивны по отношению к грамположительным аэробным/анаэробным инфекционным агентам — стафилококкам, стрептококкам, пневмококкам, энтерококкам, клостридиям, листериям, коринебактериям и другим. Показаниями к назначению являются тяжелые инфекции, вызванные энтерококками, инфекционный эндокардит, ассоциированный с зеленящими стрептококками, менингит и пневмонии, вызванные пневмококком, катетер-ассоциированный сепсис, перитонит, антибиотик-ассоциированная диарея и других инфекций, угрожающих жизни. В ряде случае гликопептидные антибиотики сочетаются с цефалоспоринами 3 поколения (Цефтибутен, Цефиксим, Цефотаксим, Цефоперазон, Цефтазидим и др.) или фторхинолонами (Офлоксацин, Ципрофлоксацин, Пефлоксацин, Норфлоксацин, Левофлоксацин и другие).
Необходимо отметить, что спектр возбудителей внутригоспитальных осложнений, а также их антибиотикорезистентность существенно различаются в отделениях различного профиля, поэтому при выборе антибиотика следует ориентироваться на чувствительность выделенной микрофлоры к ним, в также учитывать эпидемиологическую ситуацию в каждом конкретном лечебном учреждении.
Кроме антибиотикотерапии назначается специфическое лечение при той или иной конкретной нозологической форме ВБИ с учетом клинических проявлений, тяжести течения, риска развития осложнений. В индивидуальном порядке проводится симптоматическое лечение. В качестве дополнительной терапии назначают иммуностимуляторы: интерферон; бактериофаги, витаминно- минеральные комплексы.
В настоящее время для борьбы с тяжелыми проявлениями ВБИ разработана стратегия деэскалационной терапии, базирующаяся на нескольких принципах:
- Безотлагательное начало проведения антибактериальной терапии.
- Выбор антимикробных препаратов (АМП) с учетом чувствительности микроорганизмов и способности проникать в ткани, при отсутствии таких данных — использование антибиотиков широкого спектра действия.
- Назначение высоких доз антибиотиков, подбираемых индивидуально.
Эта стратегия предполагает безотлагательное назначение стартового антибиотика широкого спектра действия (комбинации антибиотиков) с целью максимально полного охвата спектра вероятных возбудителей с последующим переходом на антибиотик, к которому отсутствует устойчивость согласно данным микробиологического исследования. Именно своевременная и адекватная антимикробная терапия является ключевым условием и благоприятным прогностическим фактором, увеличивающей вероятность благоприятного исхода заболевания.
Ангиогенная инфекция — первичная инфекция кровотока, источник которой находится в кровеносных сосудах или в полостях сердца. Лабораторным показателем ангиогенной инфекции считают бактериемию, а клиническим — сим- птомокомплекс сепсиса.
Отечественных данных о частоте развития ангиогенной инфекции, в том числе КАИК, в отделениях интенсивной терапии не существует. По данным Центра контроля и профилактики болезней США, средний уровень КАИК, связанных с ЦБК, в ОРИТ составляет 5,3 на 1000 катетеродней (сумма дней использования катетеров). Ежегодно в США сумма катетеродней всех пациентов ОРИТ составляет 15 млн, соответственно за год происходит приблизительно 80 ООО случаев КАИК, связанных с ЦБК. Уровень летальности, обусловленной случаями внутрисосуди- стой системной инфекции, остается неопределённым.
Если оценивать число случаев КАИК не только в ОРИТ, а во всех стационарах, ежегодно регистрируется 250 000 подобных эпизодов. В этих случаях летальность от данного осложнения оценивают в 12-25%, минимальные затраты здравоохранения составляют 25 000 долларов на каждый случай.
Большинство случаев внутрисосудистой системной инфекции связано с использованием ЦБК. Среди пациентов с ЦБК доля инфекций кровотока значительно выше, чем у пациентов без катетеров. Частота КАИК, связанных с ЦБК, различается в зависимости от размера и профиля отделений и колеблется от 2,9 (в кардиохирургических ОРИТ) до 11,3 (в отделениях для недоношенных детей) случаев на 1000 катетеродней.
Наиболее частые возбудители КАИК в ОРИТ — коагулазонегативные стафилококки и 81арку1ососсиз аигеиз. Они составляют соответственно 27% и 13-16% всех случаев КАИК. Более 50% изолятов 81арку1ососсиз аигеиз, полученных от пациентов ОРИТ, характеризуются устойчивостью к оксациллину. За последние годы возросла доля энтерококков (с 8% до 12,5%) и появились штаммы, резистентные к ванкомицину. Грибы рода СапйАа служат причиной 8% случаев внутрибольничных инфекций кровотока. При этом растёт доля штаммов СатИАа, резистентных к широко используемым противогрибковым препаратам. До 10% изолятов С. аШсапз, полученных из крови госпитализированных больных, резистентны к флуконазолу. В 48% случаев кандидозной инфекции кровотока возбудителями являются виды С. %1аЪгаХа и С. кгизе1, которые ещё чаще бывают резистентны к флуконазолу и итраконазолу, чем С. аШсапз.
Число случаев КАИК, вызванных грамотрицательными бактериями, составляет 14-19% общего числа КАИК. При этом среди грамотрицательных возбудителей увеличился процент изолятов, полученных у пациентов ОРИТ. Это повышение произошло за счёт бактерий рода Еп1егоЪас1епасеае, продуцирующих |3-лактамазы расширенного спектра, в частности за счёт КкЬзгеПа рпеитотае.
Инфицирование катетера может происходить тремя путями. Первый — миграция микроорганизмов с кожи через место выхода катетера по наружной его поверхности в направлении дистального сегмента. Этот механизм наиболее актуален в первые 10 дней после установки катетера. В более поздние сроки приоритетным становится попадание микроорганизмов в кровоток через просвет катетера, при этом главными источниками инфекции служат загрязнённые канюли катетера, инфузионные системы и растворы. Третий путь — эндогенный, когда микроорганизмы, попадающие в кровоток из других источников, осаждаются на внутрисосудистом сегменте катетера. В этой ситуации катетер может стать вторичным источником бактериемии.
Патогенез КАИК основан на комплексном взаимодействий нескольких факторов. Катетер ведёт себя как инородное тело, в ответ на внедрение которого организм хозяина продуцирует фибриновую плёнку, покрывающую поверхность внутрисосудистого сегмента катетера. Эта плёнка богата фибрином и фибронектином, к которым имеют сродство 81арку1ососсш аигеиз и СагкЫа зрр. Оба вида продуцируют коагулазу, получая преимущество в тромбогенном процессе, происходящем на поверхности катетера, и плотно прикрепляясь к плёнке. Коагулазонегативные стафилококки могут прикрепляться к фибронектину. Они продуцируют клейкое вещество, гликокаликс, которое облегчает прикрепление и защищает от воздействия комплемента, фагоцитов и антибиотиков. Этот факт может объяснить, почему именно коагулазонегативный стафилококк доминирует при КАИК. Другие микроорганизмы, такие как РзеиАотопаз аегщтоза и СапсНйа зрр., могут синтезировать схожие вещества, особенно когда они растут на среде, богатой глюкозой. Прикрепившиеся микроорганизмы, размножаясь, формируют микроколонии, секретируют внеклеточный полисахаридный матрикс, формирующий архитектурную структуру биоплёнки. Увеличение массы биоплёнки и её фрагментация приводят к попаданию микроорганизмов в кровоток (планктонные формы), что клинически проявляется бактериемией и симптомокомплексом сепсиса.
В настоящее время в мировой практике используют классификацию катетер- ассоциированных инфекций, разработанную Рекомендательным комитетом практического контроля госпитальных инфекций США.
• Колонизация катетера: рост >15 КОЕ при полуколичественном методе микробиологического исследования или >102 КОЕ при количественном методе исследования дистального сегмента удалённого катетера при отсутствии сопутствующих клинических симптомов.
• Инфекция места выхода катетера: эритема, болезненность, инфильтрат, нагноение в пределах 2 см вокруг наружного участка катетера, выделение гноя и появление лихорадки нередко сочетаются с бактериемией.
• Карманная инфекция: эритема и некроз кожи над резервуаром имплантируемого порта или гнойный экссудат в подкожном кармане, содержащем порт, может сопровождаться бактериемией.
• Тоннельная инфекция: эритема, болезненность и инфильтрация тканей, окружающих катетер, выходящая за пределы 2 см от места выхода катетера, распространяющаяся по ходу подкожного тоннеля, может сопровождаться бактериемией.
• КАИК: выделение одного и того же микроорганизма (т.е. один и тот же вид и антибиотикограмма) при полуколичественном или количественном методе исследования сегмента удалённого катетера и периферической крови у пациента с сопутствующими симптомами инфекции кровотока и при отсутствии другого источника инфекции; при отсутствии лабораторного подтверждения снижение температуры после удаления катетера может быть косвенным доказательством КАИК.
• Инфекция кровотока, связанная с инфузатом (редкий вариант инфекции, возникающий при внутривенном введении через катетер контаминированных инфузионных растворов или компонентов крови, определяется выделением одного и того же микроорганизма из инфузата и в гемокультуре из периферической вены при отсутствии другого источника инфекции).
К осложнениям КАИК относят инфекционный эндокардит, остеомиелит, септический артрит, метастатические гнойные отсевы другой локализации.
Учитывая разные сроки использования катетеров, оценка и сравнение частоты различных вариантов катетер-ассоциированной инфекции проводятся не только по количеству случаев на 100 функционировавших ЦБК (в%), но и по числу случаев на 1000 катетеродней (сумма дней использования катетеров).
Диагноз КАИК устанавливают на основании клинических и микробиологических тестов.
Для диагностики КАИК недостаточно только клинических данных из-за низкой специфичности наиболее чувствительных симптомов (таких как лихорадка, озноб) или низкой чувствительности специфических симптомов (например, воспаление или нагноение в зоне катетера). Поэтому появление у больного симптомов системной инфекции при наличии сосудистого катетера в течение 72 ч и более и отсутствии других очагов инфекции должно расцениваться как вероятная КАИК. Выделение из гемокультур, полученных при пункции периферической вены, коагулазонегативных стафилококков, 81:арку1ососсиз аигеиз или СагкШа зрр. повышает вероятность диагноза КАИК. Для дальнейшей более точной диагностики необходимо выполнить количественные микробиологические исследования.
При удалении катетера выполняют полуколичественное или количественное микробиологическое исследование дистального (внутрисосудистого) сегмента катетера. В асептических условиях после обработки кожи в зоне катетера последовательно раствором антисептика и 70% раствором этилового спирта катетер извлекают, дистальный его конец длиной 5-6 см срезают стерильными ножницами и помещают в стерильную чашку Петри. При полуколичественном анализе сегмент катетера прокатывают по поверхности кровяного агара. Рост >15 КОЕ свидетельствует о колонизации катетера и высокой вероятности КАИК. Рост 102 КОЕ.
В сочетании с одновременно выполненным посевом крови из периферической вены результаты бактериологического исследования трактуются следующим образом. При клинических симптомах системной инфекции, выделении из гемокультуры, полученной при пункции периферической вены, микроорганизмов и колонизации катетера (>15 КОЕ при полуколичественном и >102 КОЕ при количественном методе) последний считается источником бактериемии. При выделении из гемокультуры, полученной при пункции периферической вены, микроорганизмов и контаминации катетера (102 КОЕ при количественном методе) бактериемия, источником которой служит катетер, носит интермиттирующий характер.
Для тех случаев, когда удаление катетера или смена его по проводнику невозможны или нежелательны, предложены количественные методы, не требующие удаления катетера. Одновременно берут равные объёмы крови из катетера и периферической вены, затем высевают на расплавленный кровяной агар и инкубируют в течение 24-48 ч, после чего подсчитывают количество колоний. При пятикратном и более превышении числа колоний в посеве из катетера над числом колоний, высеянных из периферической вены, КАИК считается доказанной. Современные автоматические диагностические системы позволяют выполнять аналогичный количественный тест, сравнивая время положительного ответа в гемокультурах, одновременно полученных из ЦБК и периферической вены. Появление роста одного и того же микроорганизма в пробе из ЦБК раньше, чем в периферической крови с разницей более 120 мин, свидетельствует о КАИК (чувствительность метода 91%, специфичность 94%).
При подозрении на инфекцию, связанную с нахождением катетера в лёгочной артерии, необходимо выполнить бактериологическое исследование внутрисосудистого сегмента интродьюсера, так как он подвержен инфицированию значительно чаще, чем сегмент катетера, находящийся в лёгочной артерии.
Инфицированный периферический венозный катетер удаляют с обязательным последующим полуколичественным микробиологическим исследованием. Одновременно необходимо произвести посев крови из интактной перифирической вены до начала лечения антибиотиками.
При местной инфекции необходимо произвести посев экссудата из места выхода катетера для исследования мазка по Граму и посева на питательные среды.
Исследование гемокультуры из катетера или посев сегмента удалённого катетера следует выполнять только при подозрении на КАИК. При этом целесообразно выполнение количественных или полуколичественных исследований, в то время как качественные посевы не рекомендуются в связи с их малой информативностью. Для выявления бактериемии должны быть исследованы две культуры крови: одна из ЦБК, другая из периферической вены. Если культура выделена из крови, взятой только из катетера, сложно установить, имеет ли место обсеменение катетера, колонизация катетера или бактериемия. Однако отрицательный результат посева крови из катетера с высокой степенью вероятности свидетельствует об отсутствии инфекции, связанной с установленным катетером. Если посев с сегмента удалённого катетера или гемокультура, собранная из катетера, отрицательны, необходимо продолжать поиск другого источника инфекции.
У пациентов ОРИТ, имеющих другие очаги инфекции (пневмонию, перитонит, гнойные раны), КАИК имеет свои особенности. Системное лечение антибиотиками предупреждает развитие КАИК или отодвигает сроки её развития, однако способствует селекции устойчивых штаммов бактерий (81арку1ососсиз аигеиз, К1еЪз1е11а зрр., РзеиАотопаз аегидтоза) и увеличивает вероятность грибковой инфекции. Фоновая инфекция маскирует клинические проявления КАИК, поэтому необходимо иметь определённую настороженность по отношению к возможности развития КАИК и при малейшем подозрении выполнять микробиологическое исследование. При каждом новом эпизоде нарастания лихорадки, лейкоцитоза и других признаков системного воспаления помимо оценки состояния основных очагов инфекции необходимо повторять количественные микробиологические исследования крови из катетера и периферической вены.
Сохранение лихорадки и бактериемии после удаления катетера и начала антибиотикотерапии указывает на высокую вероятность развития осложнений. Сочетание симптомов системного воспаления и признаков венозной недостаточности или болей по ходу катетеризированной вены свидетельствует о развитии септического тромбофлебита, подтвердить который можно УЗИ (дуплексным сканированием), флебографией или компьютерной томографией с контрастированием сосудов. При выделении в гемокультурах 5. аигеиз или СапсИйа зрр. необходимо выполнить чреспищеводную или трансторакальную эхокардиографию для оценки состояния створок митрального клапана, выявления типичных для септического эндокардита вегетаций. Метастатические гнойные отсевы другой локализации (остеомиелит, септический артрит) диагностируют на основании локальных клинических симптомов и подтверждают рентгенологическими методами.
Лечение КАИК включает ряд мероприятий.
При тяжёлой инфекции (тяжёлый сепсис, септический шок) или снижении иммунитета (нейтропения, приём глюкокортикоидов, уремия, сахарный диабет) незамедлительно необходимо эмпирически назначить антибиотикотерапию, которую корректируют после получения данных микробиологических анализов. Для эмпирического лечения обычно используют препараты, эффективные в отношении 51арку1ососсиз ерШегтШз или 5. аигеиз. Антибиотики, активные в отношении грамотрицательных микроорганизмов, необходимо назначать больным с иммуносупрессией, нейтропенией или другими факторами риска развития грамотрицательной инфекции. При среднетяжёлой или лёгкой инфекции лечение антибиотиками должно быть предусмотрено, однако при исчезновении симптомов инфекции после удаления ЦБК антибиотикотерапия необязательна.
Выбор препарата и путь введения антибиотика определяется свойствами выделенного микроорганизма, тяжестью клинических проявлений инфекции, конструкцией ЦБК. Используют три пути введения антибиотиков:
• системная терапия путём внутривенного введения используется на первом этапе и при тяжёлом клиническом течении инфекции;
• приём антибиотиков внутрь целесообразен при стабилизации состояния больного и необходимости продолжения системного лечения антибиотиками;
При выявлении коагулазонегативных стафилококков, если выделенный штамм чувствителен к метициллину, назначают внутривенно оксациллин в дозе 2 г с интервалом 4 ч. Альтернативные препараты — цефалоспорины I поколения (цефазолин по 2 г каждые 8 ч), ванкомицин в дозе 1 г с интервалом 12 ч или ко-тримоксазол по 3-5 мг/кг каждые 8 ч. Ванкомицин имеет преимущества перед оксациллином и цефалоспоринами I поколения, однако последние предпочтительнее из-за роста резистентности к ванкомицину. При выявлении метициллинрезистентных штаммов коагулазонегативных стафилококков препарат выбора — ванкомицин в дозе
1 г каждые 12 ч внутривенно. Препаратом второго ряда служит линезолид (зивокс) в дозе 600 мг каждые 12 ч внутривенно (для взрослых весом
Читайте также:


