Бактериологическое исследование анаэробных инфекций
Раневую анаэробную инфекцию у человека вызывают как спорообразующие анаэробные бактерии (Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum), так и неспорообразующие анаэробные микроорганизмы родов Bacteroides, Peptococcus, Peptostreptococcus, Veilonella и др.
Методы микробиологических исследований при анаэробной инфекции представлены в схеме 3.
Бактериоскопический метод. Проводится микроскопия окрашенных по Граму, Цилю-Нильсену и Гинсу-Бурри мазков, приготовленных из раневого отделяемого, отечной жидкости, некротизированной ткани. Обнаружение в препаратах крупных прямых грамположительных палочек, образующих капсулы и центрально или субтерминально расположенные споры (рис. 3), дает основание поставить предварительный диагноз газовой гангрены. Для экспресс-диагностики применяют прямой метод иммунофлюоресценции.
Бактериологический метод.Производят посев исследуемого материалана среды Цейсслера (анаэробный кровяной МПА), Китт-Тароцци, железо-сульфитный агар (ЖСА) и молоко. В молоке через 3-4 часа образуется губкообразный сгусток, погруженный в прозрачную жидкость. На среде Китт-Тароцци через сутки регистрируется помутнение и образование газа, на ЖCA - черные колонии в глубине агарового столбика, на среде Цейсслера – шероховатые (реже – гладкие), крупные, плоские сероватые колонии с зоной гемолиза. В глубине плотных питательных сред образуются колонии в виде чечевичек, дисков, комочков ваты и т.д. В мазках из колоний обнаруживают крупные грамположительные палочки (рис. 5). Для выделения чистой культуры возбудителей газовой гангрены типичные колонии пересевают на среду Китт-Тароцци и идентифицируют до вида в соответствии с таблицами 4 и 5.
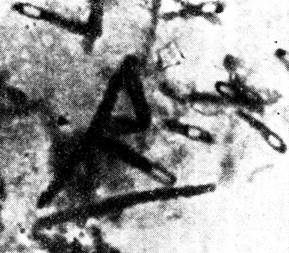 | 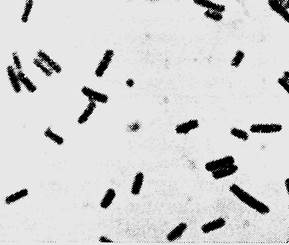 |
| Рис. 4. Возбудитель газовой гангрены (Clostridium perfringens) в материале от больного. Окраскапо Граму. х 900 | Рис. 5. Возбудитель газовой гангрены. Чистая суточная культура Clostridium perfringens. Окраскапо Граму. х 900 |
Таблица 4. Биологические свойства неспорообразующих и спорообразующих анаэробов
| Свойства | Бактерии | ||||||||
| Peptococcus | Peptostreptococcus | Veilonella | Bacteroides | C.perfringens | C.novy | C.septicum | C.sordelli | C.histolyticum | |
| Морфология | кокки | кокки | кокки | палочки | палочки | палочки | палочки | палочки | палочки |
| Подвижность | - | - | - | ± | - | + | + | + | + |
| Споры | - | - | - | - | + | + | + | + | + |
| Окраска по Граму | + | + | - | - | + | + | + | + | + |
| Ферментация углеводов | + | + | - | + | + | + | + | + | - |
| Свертывание молока | - | - | + | + | + | v | - | + | + |
| Продукция H2S | + | - | + | ± | - | - | - | v | v |
| Продукция индола | - | - | - | ± | - | - | - | - | - |
| Разжижение желатины | - | - | - | ± | + | + | + | + | + |
| Редукция нитратов | ± | - | + | ± | ± | ± | ± | - | - |
| Гемолиз эритроцитов | - | - | ± | + | + | + | + | + | |
| Образование токсина | - | - | - | - | + | + | + | + | + |
Обозначения:(+) - постоянный признак, (±) - непостоянный признак, (-) – отсутствие признака, V- вариабельный признак
Таблица 5.Биологические свойства основных возбудителей газовой гангрены и столбняка
| Виды клостридий | Капсула | Подвижность | Лецитиназа | Индол | Ферментация | ||
| лактозы | сахарозы | маннита | |||||
| Clostridium perfringens | + | - | + | - | + | + | + |
| Clostridium Novy | - | + | + | - | - | - | - |
| Clostridium septicum | - | + | _ | - | + | - | - |
| Clostridium Tetani | - | + | _ | + | - | - | - |
Обозначения:(+) - постоянный признак, (-) – отсутствие признака,
Определение лецитиназной активности. Положительная реакция на лецитиназу проявляется в виде помутнения взвеси лецитина. При отрицательной реакции, которая наблюдается при нейтрализации фермента соответствующей антисывороткой, жидкость остается прозрачной.
Окончательную идентификацию выделенных клостридий газовой гангрены проводят с помощью биопробы (см. ниже) путем постановки реакции нейтрализации с поливалентными и моновалентными сыворотками для выявления и типирования экзотоксинов клостридий.
Биопроба. Смесь исследуемого материала с моновалентными антитоксическими сыворотками против различных видов клостридий вводят подкожно морским свинкам. Контролем служит морская свинка, которой вводят исследуемый материал без сывороток. При наличии токсина контрольная морская свинка погибает через 30 минут – 4 часа после инъекции материала. В опытах нейтрализации токсина антитоксическими сыворотками выживает одна морская свинка, при этом вид сыворотки соответствует виду токсина.
Не нашли то, что искали? Воспользуйтесь поиском:
Бактериологическая диагностика анаэробной инфекции. Принципы забора материала на исследование. Чувствительность микроорганизмов к антибиотикам. Выделение чистой культуры анаэробной бактерии. Методы определения чувствительности микробов к антибиотикам.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 08.06.2016 |
| Размер файла | 26,3 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Бактериологическое исследование на анаэробные бактерии и чувствительность к антибиотикам
студент 2 курса
Науменко Николай Петрович
1. Бактериологическое исследование
1.1 Бактериологическая диагностика анаэробной инфекции
1.2 Принципы забора материала на исследование
1.3 Метод выделения чистой культуры анаэробной бактерии
2. Чувствительность микроорганизмов к антибиотикам
2.1 Методы определения чувствительности микробов к антибиотикам
1. Бактериологическое исследование
- бактериологический анаэробный инфекция антибиотик
Бактериологическое исследование -- совокупность методов, применяемых для обнаружения и установления природы бактерий, выделенных от больных, бактерионосителей или из объектов окружающей среды. Б. и. проводят с диагностической целью при инф. болезнях, а также при обследовании на бактерионосительство и определении сан.-гиг. состояния объектов окружающей среды.
Для бактериологического исследования определяется целью исследования, биологическими свойствами микробов, условиями обитания их в исследуемом объекте, патогенезом заболевания (с учетом места наибольшей концентрации возбудителя и путей его выведения из организма).
Так, при сепсисе или болезни, сопровождающейся бактериемией (напр., прибрюшном тифе), для обнаружения возбудителя берут кровь, при дизентерии - испражнения, при пневмонии - мокроту, при подозрении на анаэробную инфекцию - материал из глубоких слоев тканей и т. д. Успех бактериологического исследования в значительной степени зависит от правильности взятия материала и соблюдения определенной осторожности при его транспортировке. У больного материал для исследования рекомендуется брать до начала лечения химиотерапевтическими препаратами!
1.1 Бактериологическая диагностика анаэробной инфекции
Анаэробные микроорганизмы, являясь представителями нормальной микрофлоры, в то же время они имеют потенциальные способности для развития инфекционного процесса практически в любом органе. Вследствие разных причин, например, при длительной терапии иммунодепрессантами, антибиотиками, а также в результате травмы, хирургического вмешательства, эти микроорганизмы попадают в кровяное русло, брюшную полость, различные органы и ткани и становятся причиной тяжелых гнойно-воспалительных процессов, сопровождающихся высокой смертностью, особенно при анаэробном сепсисе.
Важную роль анаэробы играют при развитии осложнений после хирургических вмешательств. В амбулаторной практике анаэробные инфекции с большой частотой встречаются у стоматологических, гинекологических больных, у женщин с отягощенным акушерским анамнезом.
Анаэробы являются участниками гнойно- воспалительных процессов, возникающих во всех отделах генитального тракта женщин. Их выделяют как единственного возбудителя или в составе ассоциации с аэробами при таких распространенных заболеваниях, как вагинит, вагиноз, послеродовый эндометрит. Установлена этиологическая роль анаэробов при возникновении воспалительных заболеваний придатков матки и околоматочного пространства, которые часто являются следствием абортов, инструментальных диагностических мероприятий, применения внутриматочных спиралей, хирургических вмешательств. Анаэробы также играют важную роль при возникновении пародонтоза - воспалительного процесса в тканях, прилегающих к зубам. По данным ВОЗ, около 95% взрослого населения планеты и 80% детей имеют признаки пародонтоза. Воспалительный процесс в тканях десны изначально возникает из-за массивных микробных скоплений и выделяемых ими ферментов и токсинов.
Бактериологическая диагностика при подозрении на анаэробную инфекцию весьма актуальна поскольку позволяет назначить наиболее эффективное лечение.
1.2 Принципы забора материала на исследование
Материал для исследования следует брать по возможности до начала химиотерапии и лучше во время вскрытия или дренирования гнойного очага.
Особенно актуально проведение бактериологического анализа при неэффективности антимикробной терапии и при неблагоприятном течении заболевания и возникновении осложнений.
Отбор проб клинического материала при подозрении на анаэробную инфекцию и транспортировка этих образцов в бактериологическую лабораторию имеет ряд трудностей, связанных с необходимостью избежать агрессивного действия кислорода воздуха на строгие анаэробы.
Так как анаэробы являются представителями нормальной микрофлоры человека, материал для исследования следует брать с соблюдением правил асептики и строго с места локализации очага, чтобы исключить загрязнение посторонней микрофлорой.
Оптимальным способом получения проб материала является его аспирация с помощью шприца. Материал, забранный в шприц, должен быть доставлен в лабораторию для исследования в максимально короткий срок. Транспортные среды позволяют сохранить жизнеспособность анаэробных бактерий в течение достаточно продолжительного срока, указанного в инструкции.
Исследование клинического материала на анаэробы включает в себя все этапы культурального исследования, принятого в бактериологии, в том числе: выделение анаэробных микроорганизмов на искусственных питательных средах, изучение их свойств и идентификацию. Однако, учитывая физиологические особенности этой обширной группы микроорганизмов и их высокие питательные потребности, культивирование этих микробных патогенов представляется сложным и недоступным для большинства бактериологических лабораторий.
В лабораториях клинической микробиологии проводятся исследования на анаэробную инфекцию с использованием специального оборудования , импортных питательных сред и тест-систем для идентификации изучаемых микроорганизмов до рода и вида.
1.3 Метод выделения чистой культуры анаэробной бактерии
Выращивание чистой культуры анаэробов производят путем посева материала из изолированной колонии на среду Китта-Тароцци, в составе мясной бульон, глюкоза и кусочки печени или фарша. Для предотвращения доступа кислорода среда покрыта слоем вазелинового масла.
Метод Цейсслера-исследуемый материал рассевают штрихами по поверхности плотной питательной среды, помещают в анаэростат и выдерживают в термостате при 37°С в течение 24-72 часов.
Метод Вейнберга- несколько капель исследуемого материала вносят в пробирку с 4-5 мл изотонического раствора хлористого натрия, перемешивают запаянным капилляром и переносят в пробирку с расплавленным и охлажденным до 45-50°С сахарным агаром, разлитым высоким столбиком. После перемешивания этим же капилляром последовательно засевают еще две пробирки с сахарным агаром и быстро охлаждают. Пробирки инкубируют в обычном термостате. Метод Виньяля-Вейона.
2. Чувствительность микроорганизмов к антибиотикам
Чувствительность микроорганизмов к антибиотикам и химиопрепаратам - это свойство микроорганизмов реагировать на действие данных препаратов приостановкой размножения или гибелью. Каждый вид или близкая группа видов имеют характерный спектр и уровень природной чувствительности по отношению к определенному препарату или группе препаратов.
Для чего нужна чувствительность к антибиотикам?
Для успешного проведения лечения антибиотиками, особенно в случаях хронической инфекции, необходимо предварительно определить степень чувствительности к антибиотикам микробов, вызвавших заболевание.
Мерой чувствительности микробов является минимальная концентрация препарата (мкг/мл), которая подавляет рост микробов на питательных средах в стандартных условиях постановки опыта. Выделяют 3 категории чувствительности-устойчивости микробов:
а) чувствительные подавляются при назначении обычных доз антибиотиков;
б) умеренно-устойчивые штаммы микробов подавляются при введении максимальных доз препарата;
в) устойчивые штаммы микробов не подавляются при введении в организм человека максимально допустимых доз.
2.1 Методы определения чувствительности микробов к антибиотикам
Современные стандартизованные методы определения чувствительности микроорганизмов к антибактериальным препаратам подразделяют на две группы:
1. Диффузные методы:
2. Методы серийных разведений антибиотика в питательной среде:
-разведение препарата в жидкой питательной среде;
-разведение препарата в плотной питательной среде.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Это модификация диско-диффузного метода, однако, пользуясь этим методом, можно определить МПК. Для реализации этого метода используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. Полоски помещают на поверхность засеянной питательной среды. Если бактерии чувствительны к действию препарата, вокруг участков полоски, содержащих его ингибирующие концентрации, образуется эллипсовидная зона задержки роста, в месте пересечения которой с полоской Е-теста получают значение МПК.
Методы серийных разведений
Основаны на прямом определении основного количественного показателя, характеризующего микробиологическую активность антибактериальных препаратов - величины его МПК. МПК - минимальная концентрация, подавляющая видимый рост исследуемого микроорганизма в бульонной культуре или на плотной питательной среде.
Метод серийных разведений в жидкой питательной среде
Антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон). Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком. После инкубации при температуре 37 С проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной концентрацией, подавляющая видимый рост исследуемого микроорганизма. Измеряется МПК в мг/л или мкг/мл (рис. 6). МПК - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий
Метод серийных разведений в плотной питательной среде
Этот метод аналогичен методу серийных разведений в жидкой питательной среде, однако определение МПК требует более сложных манипуляций. Готовят двойные серийные разведения препарата от 1:10000 до 1:320000, затем вносят по 1 мл каждого разведения в пробирки, содержащие расплавленный и остуженный до 45 С агар. Затем содержимое пробирок быстро выливают в стерильные чашки Петри и после застывания питательной среды засевают исследуемый микроорганизм. После инкубации определяют МПК по отсутствию роста на чашках, содержащих наименьшие концентрации препарата.
1. Методичка по антибиотикам авторы : Нечаева О.В., Швиденко И.Г., Шуб Г.М.. Информация взята со страниц 59-65
2. Медицинская микробиология ,вирусология и иммунология - под редакцией академика РАММ А.А. Воробьева - Взята информация (Метод выделения чистой культуры анаэробной бактерии)

Бактериологическая диагностика анаэробной инфекции
Анаэробные микроорганизмы, являясь представителями нормальной микрофлоры, в то же время они имеют потенциальные способности для развития инфекционного процесса практически в любом органе. Вследствие разных причин, например, при длительной терапии иммунодепрессантами, антибиотиками, а также в результате травмы, хирургического вмешательства, эти микроорганизмы попадают в кровяное русло, брюшную полость, различные органы и ткани и становятся причиной тяжелых гнойно-воспалительных процессов, сопровождающихся высокой смертностью, особенно при анаэробном сепсисе.
Важную роль анаэробы играют при развитии осложнений после хирургических вмешательств. В амбулаторной практике анаэробные инфекции с большой частотой встречаются у стоматологических, гинекологических больных, у женщин с отягощенным акушерским анамнезом.
Анаэробы являются участниками гнойно- воспалительных процессов, возникающих во всех отделах генитального тракта женщин. Их выделяют как единственного возбудителя или в составе ассоциации с аэробами при таких распространенных заболеваниях, как вагинит, вагиноз, послеродовый эндометрит. Установлена этиологическая роль анаэробов при возникновении воспалительных заболеваний придатков матки и околоматочного пространства, которые часто являются следствием абортов, инструментальных диагностических мероприятий, применения внутриматочных спиралей, хирургических вмешательств. Анаэробы также играют важную роль при возникновении пародонтоза - воспалительного процесса в тканях, прилегающих к зубам. По данным ВОЗ, около 95% взрослого населения планеты и 80% детей имеют признаки пародонтоза. Воспалительный процесс в тканях десны изначально возникает из-за массивных микробных скоплений и выделяемых ими ферментов и токсинов.
Бактериологическая диагностика при подозрении на анаэробную инфекцию весьма актуальна поскольку позволяет назначить наиболее эффективное лечение.
Принципы забора материала на исследование.
Материал для исследования следует брать по возможности до начала химиотерапии и лучше во время вскрытия или дренирования гнойного очага.
Особенно актуально проведение бактериологического анализа при неэффективности антимикробной терапии и при неблагоприятном течении заболевания и возникновении осложнений.
Отбор проб клинического материала при подозрении на анаэробную инфекцию и транспортировка этих образцов в бактериологическую лабораторию имеет ряд трудностей, связанных с необходимостью избежать агрессивного действия кислорода воздуха на строгие анаэробы.
Так как анаэробы являются представителями нормальной микрофлоры человека, материал для исследования следует брать с соблюдением правил асептики и строго с места локализации очага, чтобы исключить загрязнение посторонней микрофлорой.
Оптимальным способом получения проб материала является его аспирация с помощью шприца. Материал, забранный в шприц, должен быть доставлен в лабораторию для исследования в максимально короткий срок. Транспортные среды позволяют сохранить жизнеспособность анаэробных бактерий в течение достаточно продолжительного срока, указанного в инструкции.
Методы исследования.
Исследование клинического материала на анаэробы включает в себя все этапы культурального исследования, принятого в бактериологии, в том числе: выделение анаэробных микроорганизмов на искусственных питательных средах, изучение их свойств и идентификацию. Однако, учитывая физиологические особенности этой обширной группы микроорганизмов и их высокие питательные потребности, культивирование этих микробных патогенов представляется сложным и недоступным для большинства бактериологических лабораторий.
В лаборатории клинической микробиологии ГБУЗ НО "КДЦ" проводятся исследования на анаэробную инфекцию с использованием специального оборудования , импортных питательных сред и тест-систем для идентификации изучаемых микроорганизмов до рода и вида.
В статье приводится краткое описание анаэробной инфекции, профилактика которой должна осуществляться на всех этапах оказания медицинской помощи, учитывая ее опасность и значимость в повседневной клинической практике.
Анаэробная инфекция – это крайне опасный для жизни и здоровья патологический процесс, причинами которого становятся развитие анаэробной микрофлоры в мягких тканях организма.
Особенностями данного вида инфекции является то, что активизация размножения микроорганизмов наступает лишь при попадании их в среду без доступа кислорода.
Такие условия могут формироваться при попадании микробов в ткани при любом виде ранения.
Потенциально любая рана, проникающая в подкожно-жировую клетчатку может привести к развитию этого вида инфекции. Однако наиболее часто причинами развития данного вида инфекции являются размозженные, огнестрельные, колотые ранения, ожоги и обморожения. При создании благоприятных условий скорость развития инфекции становится настолько быстрой, что без немедленной хирургической помощи состояние больного ухудшается в считанные часы и в большинстве случаев приводит к летальному исходу. Развивающаяся в тканях микрофлора оказывает агрессивное разрушительное воздействие на ткани вызывая их гибель (некробиоз), а также начинает вырабатывать токсины, быстро всасывающиеся в кровь и нарушающие обменные процессы во всех органах и тканях (сердце, легкие, печень, почки) и тем самым замыкая порочный круг развития патологического процесса. Даже при своевременно начатом лечении летальность колеблется в пределах 30-50%. Анаэробные микроорганизмы присутствуют в почве, а так же входят в состав нормальной микрофлоры толстой кишки и вызывают патологический процесс при попадании в рану извне, в момент ранения. Однако отсутствия загрязнения раны почвой, как содержащей большое количество данного вида микроорганизмов носит условный характер, так как спорообразующие микроорганизмы могут присутствовать на коже у здоровых людей не вызывая никаких патологических процессов. Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.) при нарушении асептики, перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах .
Анаэробная инфекция может возникнуть у пациентов любого возраста.
Анаэробные микроорганизмы делятся на облигатные и факультативные: развитие и размножение облигатных анаэробов осуществляется в бескислородной среде; факультативные анаэробы способны выживать как в отсутствии, так и в присутствии кислорода.
Облигатные возбудители анаэробной инфекции делятся на две группы: клостридии и неспорообразующие анаэробы (бактероиды, вейллонеллы, пропионибактерии, пептострептококки, фузобактерии и др.). К факультативным анаэробными бактериями принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др.
Симптомы анаэробной инфекции. Независимо от вида возбудителя и локализации очага анаэробной инфекции, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток). Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Первичная диагностика основывается на клинических признаках. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях.
Особенности течения анаэробной инфекции нередко требуют проведения повторных операций, вскрытия формирующихся гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т.д. При обширной деструкции тканей может быть показана ампутация конечности. Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, зачастую назначается комплекс из трех антибактериальных препаратов. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, ультрафиолетовое облучение крови, методы экстракорпоральной детоксикации. При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
В случае выявления случая анаэробной инфекции в лечебном учреждении, последнее закрывается на карантин с обязательной генеральной дезинфекцией всех помещений с последующим контролем сотрудниками санитарно-эпидемиологической службы.
Микробиологическое исследование на анализаторе VITEK bioMerieux, позволяющее с более высокой чувствительностью и специфичностью, чем обычный посев, идентифицировать около 200 видов клинически значимых бактерий и подобрать антибиотикотерапию с расчетом минимальной эффективной дозировки препарата. Преимущества исследования по сравнению с обычным посевом: срок выполнения короче на 24 часа; чувствительность определяется к расширенному списку антибиотиков (до 20 шт.); результат выдается как в виде критических значений (чувствителен, умеренно-устойчив, устойчив), так и в виде значений минимальных ингибирующих концентраций антибиотика (МИК). Что, в свою очередь, позволяет выбрать наиболее эффективную минимальную дозу антибиотика, снизив его негативное влияние на человеческий организм. * Чувствительность к антибиотикам будет определена при выявлении патогенных и/или условно-патогенных микроорганизмов. При обнаружении микроорганизмов, составляющих нормальную микрофлору, чувствительность к антибиотикам не определяется, т.к. не имеет диагностического значения.
Бактериологическое исследование клинического материала с определением чувствительности к антибиотикам на анализаторе VITEK bioMerieux; посев на микрофлору в аэробных условиях.
Какой биоматериал можно использовать для исследования?
Грудное молоко, мазок из десневого кармана, мазок из зева, мазок с конъюнктивы, мазок из носа, мазок из носоглотки, мазок урогенитальный (с секретом предстательной железы), мокроту, отделяемое уха, рвотные массы, синовиальную жидкость, смыв из бронхов, среднюю порцию утренней мочи, эякулят.
Как правильно подготовиться к исследованию?
- Рекомендуется употребить большой объем жидкости (чистой негазированной воды) за 8-12 часов до сбора мокроты.
- За 3-4 часа до взятия мазков из ротоглотки (зева) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
- Женщинам исследование (процедуру взятия урогенитального мазка или сбор мочи) рекомендуется производить до менструации или через 2-3 дня после её окончания.
- Мужчинам - не мочиться в течение 3 часов до взятия урогенитального мазка или сбора мочи.
Общая информация об исследовании
Анаэробная микрофлора – это микроорганизмы, для жизнедеятельности и размножения которых не требуется кислород, для многих из них он, наоборот, является губительным. Анаэробы населяют организм человека в норме (в пищеварительном тракте, органах дыхания, мочеполовой системе). При снижении иммунитета или травмах, повреждениях возможна активация инфекции с развитием воспалительного процесса. Организм человека тогда может становиться по сути источником заражения сам для себя (эндогенное инфицирование). Реже анаэробы попадают в организм снаружи (глубокая колотая рана, инфицированный аборт, ранения брюшной и грудной полости, введение спиц и протезов). Развиваясь в толще кожи, мягких тканей и мышц, анаэробные организмы способны вызывать целлюлиты, абсцессы, миозиты. Симптомы, позволяющие заподозрить анаэробную инфекцию мягких тканей: плотный отёк, газообразование (ощущение, что лопаются пузырьки воздуха под кожей при надавливании), гнилостное воспаление, зловонный запах.
Основное лечение анаэробного воспаления – хирургическое. При этом необходимо устранить источник воспаления либо раскрыть рану, обеспечив доступ кислорода, губительного для анаэробов.
Жизнедеятельность аэробной флоры возможна лишь при наличии свободного кислорода. В отличие от анаэробов, у них он участвует в процессе выработки энергии, необходимой им для размножения. Эти бактерии не имеют выраженного ядра. Они размножаются почкованием или делением, при окислении образуя токсичные продукты. Культивирование аэробных бактерий подразумевает не только использование подходящей для них питательной среды, но также и количественный контроль кислородной атмосферы и поддерживание оптимальных температур. Для каждого микроорганизма данной группы существует минимум и максимум кислородной концентрации в среде, окружающей его, необходимой для его нормального размножения и развития.
Факультативные анаэробы – организмы, которые существуют и выполняют все энергетические и репродуктивные циклы по анаэробному пути, но при этом при этом способны существовать и развиваться в присутствии кислорода. Последней характеристикой облигатные и факультативные анаэробы и отличаются, т.к. облигатные не способны существовать в условиях кислорода и при его появлении гибнут. Всю необходимую для своего существования, развития и размножения энергию факультативные анаэробы получают с помощью расщепления органических и неорганических соединений.
Для дифференциальной диагностики анаэробной и аэробной инфекции проводят посев биоматериала на флору, так как принципы лечения в том или ином случае будут разные. По выросшей культуре определяется вид микроорганизмов, которые участвуют в формировании воспалительной реакции. Зная вид возбудителя, можно подобрать антибактериальный препарат, который способен успешно влиять на данные микроорганизмы.
В ходе данного исследования определяется наличие аэробной и факультативно-анаэробной флоры.
Микробиологическое исследование на анализаторе VITEK bioMerieux позволяет с более высокой чувствительностью и специфичностью, чем обычный посев, идентифицировать около 200 видов клинически значимых бактерий и подобрать антибиотикотерапию с расчетом минимальной эффективной дозировки препарата. Система анализатора предназначена для идентификации грамотрицательных палочек, грамположительных кокков, анаэробных бактерий, нейссерий, гемофильных палочек, других прихотливых бактерий, коринбактерий, лактобактерий, бацилл, грибов (более 450 таксонов). Система анализатора состоит из анализатора бактериологического и персонального компьютера. Автоматизация процесса снижает риск контаминации материала и ошибок в результатах исследования.
После выявления культуры бактерий целесообразно провести определение их чувствительности к разным антибиотикам. Зная вид возбудителя, можно подобрать антибактериальный препарат, который способен успешно влиять на данные микроорганизмы. В связи с тем что все чаще наблюдается развитие антибиотикорезистентности микроорганизмов, подбор антибиотиков по их спектру действия на бактерии может привести к малоэффективному или вообще безрезультатному лечению. Преимуществом метода определения чувствительности к антибиотикам является точное определение антибактериального препарата, имеющего наивысшую эффективность в конкретном случае.
Для чего используется исследование?
- Дифференциальная диагностика анаэробной и аэробной инфекций, подбор адекватного терапевтического лечения с учетом обнаруженной микрофлоры.
- Диагностика латентных, скрытых и хронических инфекций: обнаружение персистирующих, труднокультивируемых и/или некультивируемых форм микроорганизмов.
- Для выбора антибиотика для успешного лечения инфекции.
Когда назначается исследование?
- При различных патологиях воспалительно-инфекционного генеза - для своевременной, быстрой идентификации возможного возбудителя.
- При симптомах, позволяющих заподозрить анаэробную инфекцию (газообразование, гнилостное воспаление).
Что означают результаты?
Причина выявления микроорганизмов - присутствие роста колоний данного вида микроорганизмов на питательной среде (при этом данная микрофлора может быть нормальной: Streptococcus mitis, Neisseria mucosa, Staphylococcus aureus, Streptococcus viridans group).
Данное исследование не предусматривает выделение анаэробной микрофлоры, вирусов, хламидий, а также микроорганизмов, требующих особых условий культивирования, таких как Neisseria meningitidis, Neisseria gonorrhoeae, Bordetella pertussis, Bordetella parapertussis, Corynebacterium diphtheriae, Mycoplasma spp, Ureaplasma spp, Mycobacterium tuberculosis. При отсутствии роста диагностически значимой микрофлоры при бактериологическом посеве и наличии клинической картины рекомендуется назначение дополнительных исследований.
Кто назначает исследование?
Инфекционист, терапевт, гинеколог, врач общей практики, оториноларинголог, педиатр.
Литература
- Fermin A Carranza, Paulo M. Camargo. The Periodontal Pocket. / Carranza's Clinical Periodontology, 2012, 127-139.
- Mirela Kolakovic, Ulrike Held, Patrick R Schmidlin, Philipp Sahrmann. An estimate of pocket closure and avoided needs of surgery after scaling and root planing with systemic antibiotics: a systematic review. / BMC Oral Health. 2014; 14: 159.
Читайте также:


