Болезнь аддисона и ревматоидный артрит
Исследуем причины и симптомы, которыми проявляется болезнь Аддисона. Изучим также, как проводится диагностика и какие используются лекарства для лечения, позволяющие увеличить продолжительность нормальной жизни.
Что такое болезнь Аддисона
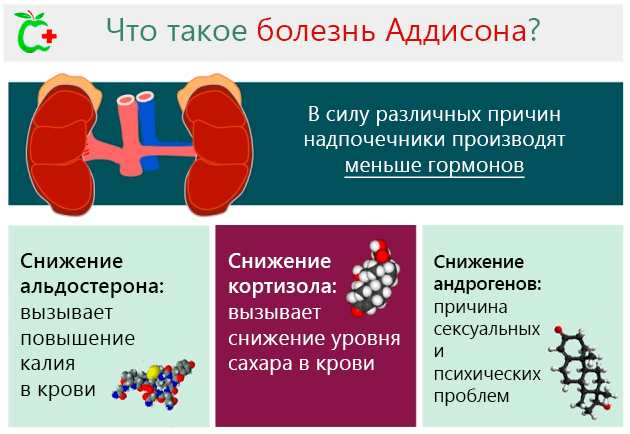
Болезнь Аддисона (Addison's Disease) – это патология обмена веществ, при которой надпочечники производят гормоны в недостаточном количестве.
В этом состоянии секреция надпочечников не в состоянии обеспечить физиологические потребности организма, в результате чего появляется острая симптоматика, которая, если не лечить, может угрожать жизни больного.
Заболевание может поразить любого человека и в любом возрасте, но обычно возникает около 40 лет. Предполагается, что заболеваемость в мировом масштабе составляет 1 случай на каждые 100 000 человек.
Надпочечники, являющиеся эндокринными железами, размещены справа и слева от позвоночника на уровне последнего грудного позвонка, на верхней части обеих почек.
Каждый из 2 надпочечников состоит из двух различных частей. Внешняя часть, которая является истинной железой, выделяющей гормоны, и называемой корой надпочечников, и внутренней нервной ткани, называемой медуллярной областью.
Область коры надпочечников, в свою очередь, разделена на три отдельных слоя, продуцирующих гормоны:
- Минералокортикоиды: набор гормонов, принадлежащих к кортикостероидам (производные от деградации холестерина), функцией которых является регулировка баланса минеральных солей (натрия и калия, а, следовательно, водного баланса). Они производятся корой надпочечников, которая известна как клубочковая. Главный из этих гормонов – альдостерон, чья секреция увеличивается пропорционально увеличению в крови концентрации калия, который является регулятором артериального давления.
- Глюкокортикоиды: точнее кортизол и кортизон, которые ускоряют метаболические реакции и расщепляют жиры и белки в глюкозу внутри клетки. Стимуляция производства этих гормонов осуществляется посредством адренокортикотропного гормона (продуцируется гипофизом головного мозга).
- Андрогены и эстрогены. Андрогены выделяются в большом количестве, а эстрогены только в малых дозах. Всё это происходит как у женщин, так и у мужчин.
В медуллярной области синтезируются два нейротрансмиттера, которые имеют очень похожие химические свойства: адреналин и норадреналин.
Из сказанного ясно, что:
- снижение производства альдостерона вызывает дисбаланс воды, натрия и калия в организме, что определяется изгнанием натрия и задержкой калий. Такое состояние может привести к гипотензии (снижению объема крови) и обезвоживанию;
- дефицит кортизола вызывает нарушения обмена веществ и проблемы гипогликемии, из-за чего организм ослабевает.
- снижение андрогенов может привести к снижению желания, выпадению волос и потери чувства благополучия всвязи с возникновением психических проблем.
Симптомы снижения уровня гормонов надпочечников
Симптомы заболевания зависят от уровня концентрации гормонов коры надпочечников в крови. Снижение концентрации, в большинстве случаев, связано с разрушением клеток надпочечников. Разрушение, как правило, развивается медленно.
Таким образом, клиническая картина болезни Аддисона в начальной стадии отличается очень мягкой и неспецифической симптоматикой, которая медленно прогрессирует, по мере распространения разрушительных поражений железы.
Когда повреждение охватывает 90% секретирующих клеток, то развивается хроническая надпочечниковая недостаточность.
Резюмируя основные симптомы болезни Аддисона, следует отметить следующие:
- Астения. Снижение мышечной силы до такой степени, что трудно выполнять повседневные движения. Усталость присутствует даже в состоянии покоя или после абсолютно незначительного усилия.
- Гипотензия. Сопровождающаяся головокружением, а в тяжелых случаях даже обмороками и падениями. Пониженное давление крови, которое ещё больше уменьшается при переходе в вертикальное положение, является непосредственным результатом низкого уровня альдостерона. Это гормон блокирует экскрецию натрия с мочой. Низкий уровень концентрации альдостерона приводит к потере натрия и жидкости, в результате уменьшается объем крови и артериальное давление.
- Гипогликемия. Снижение уровня сахара в крови в результате низких уровней кортизола. Снижение концентрации последнего, на самом деле, снижает глюконеогенез, а именно производство глюкозы из белков и липидов, вызывая гипогликемию. Это усугубляется гипотонией и астенией.
- Обезвоживание. Обуславливается чрезмерным диурезом, вызванным потерей солей натрия с мочой. Сопровождается непреодолимой тягой к соленым продуктам.
- Потеря веса и анорексия. Это следствие гипогликемии и впечатляющие потери жидкости с мочой.
- Гиперпигментация кожи. Пигментация может отмечаться как на открытой солнцу коже, так и на скрытых участках тела, которые обычно не доступны для солнечных лучей: слизистые оболочки полости рта, десны, складки кожи, шрамы и др. Всё это происходит от того, что гипофиз стимулирует надпочечники к производству большего количества кортикотропина, который, в свою очередь, стимулирует производство меланина, отвечающего за пигментацию кожи.
- Желудочно-кишечные. То есть тошнота, рвота, диарея, спастические боли в животе.
- Боли в суставах и мышцах.
- Мигрень.
- Проблемы, связанные с настроением: раздражительность, чрезмерная тревожность, плохое настроение и меланхолия, а в тяжелых случаях депрессия. Все эти проблемы связаны с пониженной секрецией андрогенов, которые действуют на психику, обеспечивая ощущение общего благополучия.
- Потеря волос на теле. Симптом также связан с низким уровнем андрогенов.
В небольшом количестве случаев симптомы болезни, вместо хронической формы, развиваются быстро и внезапно, такое состояние называют острой надпочечниковой недостаточностью или кризис Аддисона. Эта ситуация требует немедленной медицинской помощи и правильного ухода за пациентом.
Симптоматология, которая характеризует кризис Аддисона, состоит в следующем:
- Резкие и мучительные боли, которые охватывают живот, спину, нижнюю часть или ноги.
- Лихорадка и спутанность сознания, проблемами в проведением осмысленных бесед.
- Рвота и понос с опасностью обезвоживания.
- Очень низкое артериальное давление.
- Потеря сознания и неспособность держаться на ногах.
- Очень низкий уровень глюкозы в крови.
- Очень низкий уровень натрия в крови.
- Высокий уровень калия в крови.
- Высокий уровень кальция в крови.
- Непроизвольные сокращения мышц.
Причины болезни Аддисона – первичные и вторичные
Гормональная недостаточность, которая характерна для болезни Аддисона, может быть вызвана проблемами, возникающими как из надпочечников (первичная недостаточность надпочечников), так из других источников (вторичная недостаточность надпочечников).
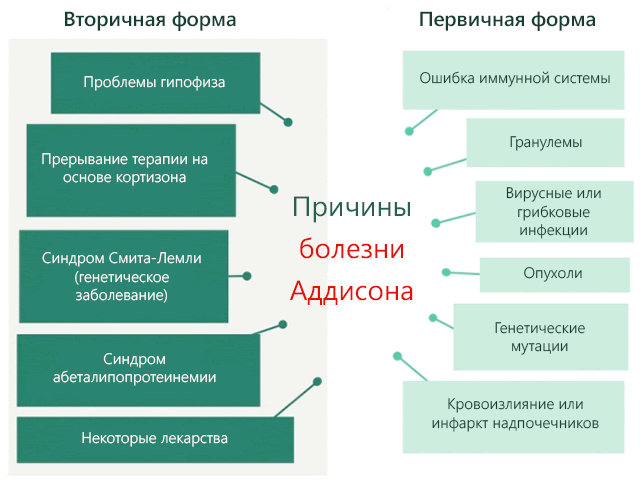
В случае первичной надпочечниковой недостаточности сокращение уровня гормонов является следствием разрушения клеток железистой ткани, что, в свою очередь, может быть вызвано:
- Ошибка иммунной системы. Которая, по неизвестным причинам, распознает клетки коры надпочечников как чужеродные и разрушает их, приводя к развитию патологии.
- Гранулемы от туберкулеза. В данном случае гранулемы являются следствием воспалительного процесса, вызванного вирусной инфекцией.
- Грибковые инфекции или цитомегаловирусные инфекции. Они встречаются у пациентов, страдающих от иммуносупрессивных расстройств.
- Первичные или метастатические опухоли надпочечников (чаще всего лимфома или рак легких).
- Кровотечение из надпочечников. Примером такого заболевания является синдром Уотерхауса-Фридериксена. Это сильнейшее кровотечение в результате тяжелой бактериальной инфекции, вызванной, как правило, менингококками Neisseria meningitidis.
- Инфаркт надпочечника. Некроз соединительной ткани железы из-за недостаточного кровоснабжения.
- Генетические мутации, которые влияют на работу надпочечников. Они достаточно редки.
В случае вторичной надпочечниковой недостаточности надпочечники сохраняют работоспособность и эффективность, а низкий уровень гормонов является следствием:
- Проблем в работе гипофиза. Он несёт ответственность за секрецию адренокортикотропного гормона, который имеет задачу стимулировать кора надпочечников.
- Прекращение терапии кортикостероидами. Такая терапия часто осуществляется в случае пациентов, страдающих от астмы и ревматоидного артрита. Высокий уровень кортикостероидов уменьшает в крови уровень адренокортикотропного гормона. Уменьшение последнего приводит к резкому снижению стимуляции клеток надпочечников, отчего, в конечном итоге, происходит, своего рода, атрофия. Восстановления их нормальной работы может занять значительное время (порядка 6 месяцев). В этот период у пациента может случиться кризис Аддисона.
- Нарушение биосинтеза стероидов. Для производства кортизола надпочечники должны получать холестерин, который преобразуется с помощью соответствующих биохимических процессов. Поэтому в любой ситуации, когда прекращается поступление холестерина в надпочечники, развивается состояние дефицита кортизола. Такие ситуации, хотя и очень редко, случаются при синдроме Смита-Лемли-Опитц, синдроме абеталипопротеинемии и приёме некоторых лекарств (например, кетоконазол).
Диагностика надпочечниковой недостаточности
Первое предположение диагноза врач озвучивает на основе анамнестической истории пациента и детального анализа симптомов и признаков. Эта гипотеза затем проверяется рядом обследований и тестов.
Анализ крови, в котором должны отмечаться:
- Низкие уровни кортизола.
- Высокие уровни АКТГ.
- Низкий ответ кортизола на стимуляцию АКТГ.
- Наличие специфических антител к надпочечниковой системе.
- Уровень натрия ниже 130.
- Уровень калия более 5.
Измерение уровня глюкозы после введения инсулина. Пациенту вводят инсулин и через определенные интервалы времени оценивают уровень сахара и кортизола в крови. Если пациент здоров, уровень сахара в крови снижается, а уровень кортизола увеличивается.
Стимуляция надпочечников АКТГ. Пациенту вводят синтетический адренокортикотропный гормон, а затем измеряют концентрацию кортизола. Низкие уровни указывают на надпочечниковую недостаточность.
Компьютерная томография брюшной полости. Определяет размеры и любые аномалии желез.
Магнитно-резонансная томография турецкого седла (область черепа, где располагается гипофиз). Определяет возможные неисправности в гипофизе.
Терапия болезни Аддисона – восстановить уровень гормонов
Независимо от причины, болезнь Аддисона может быть смертельно опасной, поэтому в организм необходимо поставлять те гормоны, которые надпочечники вырабатывают в недостаточном количестве.
Лечение болезни предусматривает введение:
- Кортикостероиды. В частности, флудрокортизон, чтобы компенсировать дефицит альдостерона и кортизона.
- Андрогены. Введение в достаточном количестве улучшает чувство благополучия, а, следовательно, улучшает качество жизни.
- Добавки натрия. Служат для уменьшения потери жидкости с мочой и увеличения артериального давления.
В случае кризиса Аддисона необходимо немедленное лечение, потому что это очень опасно для жизни пациента.
- Гидрокортизон.
- Инфузии физиологического раствора для увеличения объема крови.
- Введение глюкозы. Для повышения значений уровня сахара в крови.
Из-за опасности внезапного кризиса Аддисона, пациентам, страдающим от болезни, следует носить браслет экстренной медицинской помощи. Таким образом, медицинский персонал будет немедленно оповещен от тревоге.
Продолжительность жизни при болезни Аддисона
Если правильно лечить болезнь Аддисона, то продолжительность жизни нормальная. Единственно возможная опасность может исходить от кризиса Аддисона. Поэтому больным рекомендуется носить информационный браслет, а также шприц для инъекций кортизола в экстренных случаях.
Иммунная система человека – это сложный природный механизм противодействия болезнетворным агентам, представляющим собой белковые тела и проникающим в организм извне.
Ложная иммунная реакция становится причиной хронических патологических состояний, ощутимо нарушающих функциональность организма.
Больной с аутоиммунными нарушениями нуждается в пожизненной медикаментозной терапии. Чем раньше у человека будет диагностирована аутоаллергия, тем положительнее прогноз.
Аутоиммунные заболевания — что это такое простыми словами?
Аутоиммунные болезни – это результат сбоев в работе иммунной системы. Что это такое: по различным причинам клетки, которые должны реагировать на чужеродные белковые тела, начинают воспринимать клетки собственного организма как враждебные и пытаются их уничтожить. Это приводит к нарушению жизнедеятельности органов. Такую гипериммунную реакцию ещё называют аутоаллергией, простыми словами – аллергией на собственные клетки.

Эти заболевания поражают женщин гораздо чаще, чем мужчин. Медицина объясняет это тем, что у женщин иммунитет сильнее, соответственно, и аутоиммунная реакция будет более сильной. Исключение – болезнь Бехтерева: из 10 заболевших 9 – мужчины. Кроме того, у женщин более лабильная нервная система, они чаще подвержены депрессиям, тревожным состояниям, а учёные доказали, что психосоматика часто становится спусковым крючком для запуска аутоиммунной реакции.
Причинами развития таких болезней могут стать:
- вирусные и бактериальные инфекции;
- лечение с применением медикаментозных препаратов;
- нарушение гистогематических барьеров (естественным путём отделяющих ткани от крови и соответственно лимфоцитарной иммунной агрессии).
У детей с сахарным диабетом I типа (инсулинозависимым) в анамнезе часто обнаруживается инфицирование вирусом Коксаки В, воспаление околоушной слюнной железы и гепатит типа А. Иммунореактивные заболевания у взрослых могут быть следствием перенесенной в детстве кори или герпеса, а ревматоидный артрит появляется на фоне стрептококковой инфекции.
Существует мнение, что одной из причин развития аутоаллергии может быть вакцинирование: сходств компонента вакцины с производимым организмом белком вызывает аутоиммунную реакцию – например, прививка от гепатита А приводит к выработке антител, разрушающих клетки печени. Такое поствакцинальное явление получило название молекулярной мимикрии.
Но каковы бы ни были причины, в основе патологии в большинстве случаев лежит изначальное генетическое нарушение иммунного механизма.
Аутоиммунные заболевания делятся на три группы:
- органоспецифические;
- органонеспецифические (системные);
- промежуточные.
При органоспецифическом аутоиммунном расстройстве поражаются отдельные органы либо отдельный вид тканей (соединительная, мышечная, эпидермис и пр.). Видоизменяются и ткани паренхиматозных органов (сердца, печени, лёгких и других).
При системной аутоаллергии патологический процесс охватывает группы органов и тканей, в которых присутствует общий для них аутоантиген.
Третья группа относится к промежуточным: в неё включены аутоиммунные заболевания, которые имеют признаки и органоспецифических, и системных – например, рассеянный склероз и волчанка. Для уточнения в этом разделе классификации выделены две разновидности в зависимости от изменения функции Т-лимфоцитов:
- сниженная супрессорная функция (пример – Базедова болезнь, или болезнь Грейвса);
- повышенная хелперская функция (склеродермия, лекарственная волчанка).
Первичный диагноз аутоиммунных заболеваний ставится на основании клинической картины болезни, окончательно определяется после лабораторных анализов на основе таких серологических показателей как циркулирующие антитела, иммуноглобулины и т.д. При необходимости делаются гистологические исследования образцов тканей – в некоторых случаях они являются определяющими для диагностирования болезни (например, при дискоидной красной волчанке). Точно определяют иммунный фактор маркеры аутоиммунных заболеваний (другое название антител, которые вырабатываются к антигенам).
В лечении выделяются две линии: одна направлена на патогенез (по возможности устраняются причины нарушения иммунной реакции) и симптоматическая (больного лечат от проявлений болезни). Терапия назначается в зависимости от вида аутоиммунной патологии и стадии заболевания. В медикаментозных назначениях – иммуномодуляторы и гормоны вилочковой железы (иммунологическая стадия), Контрикал и Гордекс (угнетение протеолиза), кортикостероидные препараты и НПВП (нестероидные противовоспалительные препараты).
Применяется и физиотерапия – в частности, для стимуляции процессов регенерации поражённых тканей и ликвидации очагов хронических воспалений). В некоторых случаях необходимо хирургическое вмешательство (иссечение щитовидной железы при токсическом диффузном зобе, спленэктомия при аутоиммунной гемолитической анемии и т.п.).
20 аутоимунных болезней: коротко о главном
В список аутоиммунных заболеваний входят болезни:
- эндокринной системы;
- лёгких;
- нервной системы;
- желудочно-кишечного тракта и печени;
- крови;
- сердца;
- кожи;
- почек;
- суставов.
Системные иммунные патологии часто бывают совмещенными, можно диагностировать у одного человека несколько аутоаллергий. Среди всех этих групп заболеваний патологии эндокринной системы единственные, при которых не нужно проводить иммуносупрессивную терапию (лечение, направленное на подавление иммунитета).
Суть заболевания заключается в том, что развивается иммунная реакция на собственные эритроциты. В половине случаев аутоиммунная гемолитическая анемия является идиопатическим заболеванием (причина неизвестна).

Часто вместе с этой болезнью у пациента диагностируется волчанка и лимфома. Данная анемия делится на два основных типа в зависимости от того, какие аутоантитела её вызывают:
- тепловые;
- холодовые.
При тепловой анемии антитела разрушают эритроциты при нормальной температуре, при холодовой происходит уничтожение красных кровяных телец, когда температура ниже нормальной.
У больных вначале обычная симптоматика анемии: вялость, бледность, слабость, апатия. При быстром разрушении красных кровяных телец наблюдается иктеричность кожи и склер, боль в сердце, увеличивается селезёнка. Диагностируется на основании анализа крови.
- Медикаментозное лечение с использованием кортикостероидов (Преднизон и др.), в тяжёлых случаях иммуносупрессанты (Циклоспорин).
- При большой потере эритроцитов – переливание крови.
- Тяжёлое протекание болезни может требовать удаления селезёнки как основного очага разрушения эритроцитов.
При холодовой форме аутоиммунной гемолитической анемии требуется избегать холода.
Хроническое заболевание, вызванное поражением печёночных клеток аутоантителами. Существует два типа аутоиммунного гепатита, которые различаются по положительным титрам антинуклеарных или микросомальных тел. Больные АИГ одновременно страдают ревматоидным артритом, витилиго и другими иммунно-опосредованными заболеваниями.

Симптомы сходны с клинической картиной обычного гепатита: слабость, утомляемость, суставная боль, желтуха. Болезнь имеет тенденцию перерождаться в цирроз печени. Для диагноза необходим анализ крови на антитела и биопсия печени.
Показана длительная (не менее 5 лет) иммуносупрессивная монотерапия глюкокортикостероидами или в комбинации с цитостатиками (Азатиоприн). При развитии резистентности к гормональным препаратам используют альтернативные схемы с использованием препаратов Ритуксимаб, Циклоспорин А и др.
Тиреоидит Хашимото возникает в результате поражения клеток щитовидной железы аутоиммунной реакцией. Причина заболевания неизвестна.

Симптомы: усталость, отёчность лица, птоз (опущение) век, изменение кожи и волос (огрубение, сухость), увеличение массы тела. Развивается гипотиреоз. Щитовидная железа увеличена, при пальпации безболезненна. Характерным признаком зоба Хашимото является идиосинкразия к холоду. Болезнь может сочетаться с ревматоидным артритом, системной волчанкой, аутоиммунной анемией.
Для диагностики делают анализ крови на гормоны щитовидной железы и антитиреоидные тела.
Специфическое лечение аутоиммунного тиреоидита отсутствует как таковое, рекомендовано избегать продукты с избыточным содержанием йода. Показана пожизненная гормонозаместительная терапия из-за гипофункции щитовидной железы.
У 70% пациентов первичная или хроническая недостаточность коры надпочечников (болезнь Аддисона) – результат аутоиммунной реакции. У оставшихся 30% причины – туберкулёз, онкологические заболевания, опухоли надпочечников. Обнаружение заболевания в детском возрасте свидетельствует о наследственной патологии.

Дефицит кортикостероида, вырабатываемого надпочечниками, приводит к высокой чувствительности к инсулину, вплоть до гипогликемической комы. Из-за нарушения калиево-натриевого баланса организм не может регулировать артериальное давление.
Симптомы болезни Аддисона: слабость, потеря веса, обезвоживание, резкая гиперпигментация, периодическое снижение сахара в крови. Один из первых симптомов – ортостатическая дистония (головокружение при перемене лежачего или сидячего положения на стоячее).
Диагностика строится на определении в крови уровня магния и калия, кортизола и кортикотропина.
Другое название этой аутоиммунной патологии – анкилозирующий спондилит. Особенность данной спондилоартропатии состоит в том, что болеют в основном молодые мужчины. На данные момент болезнь Бехтерева неизлечима, но раннее диагностирование и необходимое лечение замедляют патологические процессы.

Истинные причины заболевания неизвестны. Болезнь поражает позвоночник: он теряет подвижность, окостеневает. Страдают и другие отделы опорно-двигательной системы – кости, связки, суставы. Костная ткань становится хрупкой, что требует осторожного подбора физиотерапии и лечебной физкультуры.
Характерный симптом, отмечаемый в начале болезни – боли в спине в период покоя (со второй половины ночи и утром), которые проходят после прогревания, приёма анальгетиков и противовоспалительных лекарств. Дальше становится труднее наклоняться и поворачиваться, отмечается ограниченность дыхательных движений (скованность грудной клетки). Припухают суставы. Может развиться увеит.
Для диагностики достаточно рентгенологического исследования, диагноз уточняется анализом крови. Дополнительную информацию может дать МРТ.
Лечение главным образом поддерживающее консервативное: противовоспалительные препараты для уменьшения болей, глазные капли при увеите, белковая диета с преобладанием рыбы и контролем веса. При тяжёлой деформации бёдер возможно хирургическое вмешательство для протезирования ТБС (тазобедренного сустава).
Более известна как Базедова болезнь. Другое название – диффузный токсический зоб. Вызван нарушением иммунной реакции, вследствие чего антитела разрушают клетки щитовидной железы.

Диагностика диффузного токсического зоба не представляет сложности. Характерная симптоматическая триада:
- зоб;
- тахикардия;
- экзофтальм.
Больные диффузным токсическим зобом испытывают чувство жара, у них учащённое сердцебиение и гипергидроз (повышенная потливость). Характерна повышенная возбудимость, быстрая перемена настроения, повышенный аппетит и при этом потеря веса.
Для диагностики производится УЗИ щитовидной железы, анализ крови на уровень гормонов и антител.
Лекарств от аутоантител, вызывающих Базедову болезнь, не существует. Главная задача – устранение тиреотоксикоза. Для медикаментозной терапии применяют препараты, подавляющие синтез гормонов щитовидной железой (тиреостатики): Пропицил, Тиамазол. Лечение радиоактивным йодом доступно не всем. В тяжёлых случаях железу удаляют и принимают пожизненно препараты для компенсации функций этого органа.

Для болезни Крона характерно низкое всасывание питательных веществ из кишечника.
Симптомы – хроническая диарея, иногда кровавая, потеря веса, спастические боли и повышение температуры. Заболевание опасно осложнениями:
- свищами;
- абсцессами;
- перитонитом.
Диагноз основывается на результатах колоноскопии, эндоскопии, рентгена с барием, МРТ или КТ.
Медикаментозное лечение базируется на приёме антидиарейных препаратов, иммуномодуляторов, антибиотиков, кортикостероидов. При тяжёлом протекании заболевания производится хирургическое вмешательство – удаление поражённых участков кишечника.

Симптомы – наличие неокрашенных участков кожи на лице, конечностях, в генитальной области. Диагностика основывается на результатах наружного осмотра, для дифференциальной диагностики используется лампа Вуда.
Витилиго причиняет в основном неудобства эстетического характера, но лишённую меланина кожу следует прятать от солнца, так как солнечный ультрафиолет вызывает на ней сильные ожоги.
- мази с кортикостероидом;
- солнцезащитные средства;
- псоралены.
Для уменьшения контраста со здоровой кожей иногда используют отбеливающие препараты, но чаще прибегают к косметическим средства (тональные кремы, пудры).
Псориаз считается неизлечимым. Это аутоиммунное заболевание кожи, характеризующееся хроническим течением с рецидивами. У больных псориазом отмечают общее снижение иммунного статуса, что отражается на работе многих органов.
Ревматоидный артрит представляет собой системное иммуновоспалительное заболевание соединительной ткани, проявляющееся хроническим эрозивно-деструктивным полиартритом с преимущественно симметричным поражением суставов кистей и стоп и сопровождающееся у бо
Ревматоидный артрит представляет собой системное иммуновоспалительное заболевание соединительной ткани, проявляющееся хроническим эрозивно-деструктивным полиартритом с преимущественно симметричным поражением суставов кистей и стоп и сопровождающееся у большинства больных образованием особого вида аутоантител (ревматоидный фактор). Женщины болеют в 3–4 раза чаще мужчин, причем заболевание у них начинается обычно в возрасте 35–45 лет.
Болезненные, тугоподвижные суставы не только мешают выполнять самые простые повседневные движения, но и значительно нарушают ритм нормальной жизни.
Ревматоидный полиартрит — тяжелое системное заболевание, которое проявляется прогрессирующим воспалительным синовитом, симметрично поражающим периферические суставы конечностей.
В соответствии с рекомендациями Американской ревматологической ассоциации (1987) при диагностике ревматоидного артрита целесообразно придерживаться следующих критериев:
- утренняя скованность суставов или вблизи суставов длительностью не менее 1 ч до ее полного исчезновения;
- опухание мягких тканей (артрит) трех суставов или более, наблюдаемое врачом (т. е. в период осмотра или в анамнезе под наблюдением врача);
- опухание (артрит) проксимальных межфаланговых, пястно-фаланговых или запястных суставов;
- симметричное опухание (артрит) как минимум в одной паре суставов;
- ревматоидные узелки;
- наличие ревматоидного фактора;
- обнаружение при рентгенологическом исследовании эрозий и (или) периартикулярного остеопороза в суставах кистей и стоп.
При длительно текущем заболевании деформируются пораженные суставы. Помимо суставов, при ревматоидном полиартрите нарушаются околосуставные структуры (связки, сухожилия и др.), развиваются ревматоидный васкулит (поражение мелких сосудов), остеопороз, происходит поражение внутренних органов.
В пользу иммунопатологического/аутоиммунного характера воспалительного процесса при ревматоидном артрите свидетельствует обнаружение у большинства больных в сыворотке крови и синовиальном выпоте из пораженных суставов аутоантител — ревматоидного фактора.
Большое значение в развитии ревматоидного артрита имеет генетическая предрасположенность. Это подтверждается выраженной семейной агрегацией заболевания, наличием у части больных ревматоидным артритом антигенов II класса главного комплекса гистосовместимости HLA DR4 и Dw4 (с носительством которых связывают тяжелое течение артрита и быстрое прогрессирование эрозивных изменений суставов). Рассматривается роль наследственных или приобретенных нарушений Т-супрессорной регуляции иммунных реакций, недостаточной функции моноцитарно-макрофагальной системы. Пусковую роль в развитии ревматоидного артрита могут играть: хронические очаги инфекции, гормональная перестройка организма, пищевая аллергия, предшествующие травмы суставов, длительное воздействие влажного холода и физическое перенапряжение.
При хроническом воспалении у края суставного хряща в месте прикрепления к эпифизам суставной капсулы происходит разрушение и замещение паннусом участков субхондральной костной ткани с образованием эрозий. Иногда разрастающиеся грануляции проникают через субхондральную замыкательную пластинку в костную ткань. Продукты костно-хрящевой деструкции, в свою очередь, оказывают раздражающее воздействие на синовиальную оболочку, что способствует поддержанию в ней воспалительного процесса. Одновременно возникают воспалительные изменения в капсуле сустава, связках, синовиальной выстилке сухожилий и синовиальных сумках с последующим их склерозированием, приводящему к стойкому ограничению подвижности пораженных суставов, подвывихам и контрактурам. Иногда наблюдается некроз и разрыв сухожилий, синовиальных сумок. Нередко отмечается развитие вторичного остеоартроза.
Воспалительный процесс при ревматоидном артрите характеризуется неуклонным прогрессированием, темпы которого зависят от активности воспалительного процесса. Даже в периоды клинической ремиссии в синовиальной оболочке сохраняются признаки воспаления. Постепенно паннус разрушает хрящ на значительной поверхности эпифиза, а замещающая его грануляционная ткань соединяет между собой противоположные суставные поверхности и в последующем трансформируется вначале в фиброзную, а затем в костную ткань, что приводит к образованию соответственно фиброзного и костного анкилоза, обусловливающего полную неподвижность пораженных суставов.
При рентгенологическом исследовании суставов отмечается асимметричность эрозивных изменений с частым и ранним анкилозированием суставов запястий.
Течение серонегативного ревматоидного артрита менее тяжелое, в прогностическом плане более благоприятное, чем при серопозитивной форме заболевания: слабее выражены деструктивные (эрозивные) изменения и функциональные нарушения суставов, реже наблюдаются ульнарная девиация пальцев кистей, контрактуры и анкилоз (за исключением анкилоза суставов запястья). Вместе с тем серонегативный ревматоидный артрит хуже, чем серопозитивный, поддается терапии базисными и иммуносупрессивными препаратами. Чаще развивается вторичный амилоидоз.
При лечении ревматоидного артрита используются НПВП, в тяжелых случаях применяются глюкокортикостероиды, иммуносупрессоры, с целью профилактики остеопороза обычно назначают комбинацию препаратов кальция и витамина D.
Несмотря на все успехи фармакологии, ревматоидный артрит до настоящего времени остается тяжелым заболеванием с неблагоприятным прогнозом.
Приведем пример из личного опыта ведения больной с ревматоидным артритом, представляющим, по мнению автора, научный интерес.
Больная В., возраст — 71 год, обратилась к неврологу в августе 2006 г. с жалобами на боли в суставах кистей, коленных суставах, в пояснице. Боль в суставах беспокоила днем и ночью, обычно была выраженной, нередко мигрирующей, обусловливала ограничение всех активных и пассивных движений в пораженных суставах. Артралгия зачастую сочеталась с выраженной миалгией, оссалгией, болями в сухожилиях. Из анамнеза: проявления полиостеоартроза в течение 15 лет, дебют суставного синдрома воспалительного характера в июне 2002 г. (отек и воспаление в области суставов, фебрильная лихорадка, подтвержденная лабораторно активность воспалительного процесса). Амбулаторно (сначала периодически, в последние 3 года постоянно) получала НПВП (ибупрофен, индометацин, диклофенак, ацеклофенак). С 2004 г. регулярно принимала кальций D3 (1 г кальция в сутки).
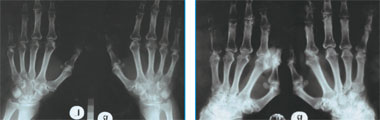 |
| Рис. 1. Рентгенограмма кистей больной В. 2003 г.: проявления полиостеоартроза, явных эрозий нет. Рис. 2. Рентгенограмма кистей больной В. 2006 г.: множественные кисты и эрозии, отрицательная динамика с 2003 г. |
Стационарно проходила лечение в городском ревматологическом центре г. Санкт-Петербурга (апрель 2003 г., июнь–июль 2006 г.) с диагнозом: ревматоидный артрит, серопозитивный, с системными проявлениями (субфебрилитет, амиотрофия, миалгии), активность 2-й степени, функциональная недостаточность суставов 1–2-й степени. Сопутствующая патология: ишемическая болезнь сердца, стенокардия II ФК. Гипертоническая болезнь 3-й степени, ОНМК (декабрь 2002 г.). Хронический бронхит вне обострения. Диффузный зоб второй стадии. Эутиреоз. Полиостеоартроз. Желчно-каменная болезнь.
С 2003 г. постоянно получает метотрексат в дозировке 2,5 мг 2 раза в неделю. Несмотря на проводимое лечение, суставной болевой синдром нарастал, учащались обострения, ухудшалось состояние костей (остеопороз, эрозии). Показательна рентгенография кистей (рис. 1–2).
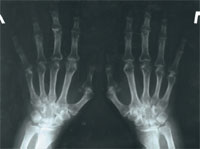 |
| Рис. 3. Рентгенограмма кистей больной В. 2007 г.: проявления полиостеоартроза, положительная динамика с 2006 г. |
С августа 2006 г. на фоне лечения метотрексатом неврологом был дополнительно назначен Структум в дозировке 500 мг 2 раза в день. Больная ориентирована врачом на длительный, до полугода, прием препарата. Некоторое уменьшение интенсивности (непрекращающегося в течение 2 последних месяцев) болевого синдрома наступило через 3 нед. Эпизоды обострений ревматоидного артрита были в течение 4 мес. К концу 5-го месяца комбинированной терапии (метотрексат + Структум) болевой синдром значительно снизился, уменьшилась утренняя скованность, спала отечность лучезапястных и коленных суставов.
В феврале 2007 г. была сделана рентгенография кистей (рис. 3). Результат сравнения с предыдущими рентгенографиями оказался более чем положительным (уменьшились эрозии костей). Прием структума продлен на 3 мес. По состоянию на май 2007 г. обострений суставного синдрома не наблюдалось в течение 4 мес, сохранялась небольшая отечность на лучезапястных (больше слева) и коленных суставах. С целью коррекции противоревматической терапии (снижение дозы метотрексата) больной рекомендована консультация в городском ревмоцентре.
И. Н. Бабурин
СПбНИПНИ им. В. М. Бехтерева, Санкт-Петербург
Читайте также:


