Что такое пневмоцистная инфекция
Пневмоцистоз вызывается малопатогенными микроорганизмами, поэтому среди здоровых людей не возникает симптомов болезни при наличии антител в крови. Клинически выраженные формы болезни способны формироваться лишь в организме с иммунодефицитами, что составляет до 45-50% от всех пациентов с иммунной недостаточностью. Среди ВИЧ-инфицированных пациентов эта доля составляет до 70%, вследствие чего пневмоцистоз является СПИД-индикаторнымили оппортунистическим заболеванием.
Пневмоцистная пневмония – это антропонозное инфекционное заболевание, вызываемое простейшими Pneumocystisjiroveci (ранее Pn. carini), с воздушно-капельным путем передачи, возникающее на фоне иммунологической недостаточности и проявляющаяся слабо выраженным инфекционно-токсическим синдромом и поражением органов дыхания – легких и мелких бронхов с возможностью развития дыхательной недостаточности.
Впервые Pneumocystiscarinii описана в 1909 году и выделена в 1912 году, в те времена возбудитель не считался патогенным для человека. Именно в 1942 году пневмоциста былы указана как причина интерстициальной пневмонии во время вспышки у новорожденных детей и у детей с дефектами иммунитета. С 1980 года ранее отнесенная к простейшим пневмоциста была отнесена уже в класс, занимающий промежуточное положение между грибами фагомицетами и высшими грибами, о чем свидетельствуют общие биохимические свойства и морфология.
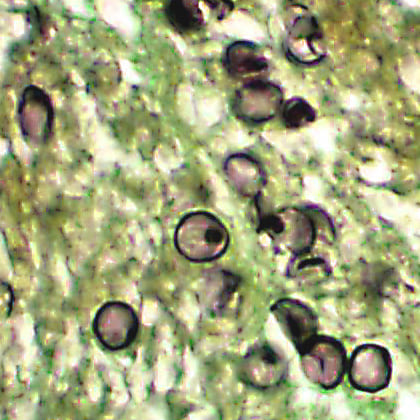
Причины появления пневмоцистной пневмонии
Возбудитель болезни – среднее между простейшими и грибами Pneumocystisjiroveci по фамилии чешского ученого Отто Йировица, впервые описавшего возбудителя легочной формы заболевания (предыдущее название рода Pneumocystiscarinii ). Это малопатогенный для здоровых людей возбудитель, следовательно, заболевание может возникнуть у иммунокомпроментированных лиц. Пневмоцисты тропны исключительно к легочной ткани, то есть основными симптомами являются симптомы поражения легких. При размножении возбудитель выделяет различные продукты обмена, обладающие слабыми патогенными свойствами, поэтому инфекционно-токсический синдром (лихорадка и интоксикация) при пневмоцистной пневмонии не выражен.
Цикл развития пневмоцист. Pneumocystisjiroveci(carinii) является внеклеточным паразитом и имеет свой цикл развития, протекающий внутри альвеолы – структурного элемента легкого. Цикл включает 4 стадии: трофозоит, прециста, циста, спорозоит.
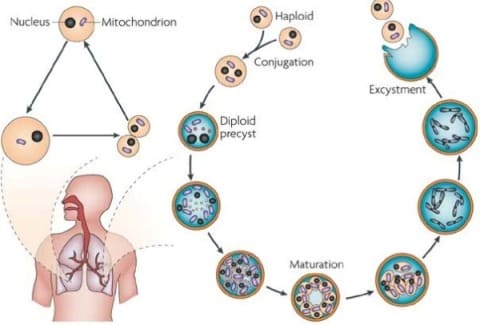
Цикл развития пневмоцист
При размножении пневмоцист образуются вегетативные формы возбудителя – трофозоиты (одноклеточные микроорганизмы, имеющие ядро, 2хслойную мембрану, диаметром до 5 мкм). Трофозоиты прикрепляются к клеткам эпителия - альвеоцитам и начинает видоизменяться: становится овальным, а мембрана его утолщается (формируется прециста). Дальнейшее развитие продолжается в цисту диаметром до 8 мкм, имеющую толстую стенку, состоящую из 3х слоев. Стенка цисты содержит гликопротеины, один из которых р120 необходим для связывания с альвеоцитами эпителия легких. Внутри цисты находятся внутрицистные мелкие до 3х мкм образования – спорозоиты, количество которых может варьировать от 5 до 8 штук. Если при исследовании обнаружены зрелые цисты с большим количеством спорозоитов, то это является доказательством активной инфекции.
Существует 2 фазы развития: сексуальная и асексуальная. Разница в том, что при сексуальной фазе зрелые цисты разрушаются, выделяются спорозоиты, которые сливаясь попарно, образуют трофозоиты и далее по стадиям. При асексуальной фазе происходит деление трофозоитов и каждый превращается в цисту.
Источник инфекции – человек больной или носитель: это могут быть члены семей, работники организованных детских коллективов, лечебных учреждений. Носителями пневмоцист могут быть и животные – крысы, мыши, кошки, собаки, свиньи, кролики. Среди здоровых до 10% носители пневмоцист.
Механизм заражения – аэрогенный, а путь – воздушно-капельный. Пневмоцисты распространяются с частичками слизи, мокроты при кашле, чихании. Также возможен воздушно-пылевой путь передачи. Дополнительный механизм – трансплацентарный (от матери плоду), причем доказательством внутриутробного инфицирования служит возникновение пневмоцистной пневмонии в течение 1го месяца жизни ребенка.
Восприимчивость населения всеобщая, однако, в общей группе больных преобладают мужчины. Заболеваемость регистрируется спорадически (то есть выявляются отдельные случаи пневмоцистной пневмонии человека). Отчетливая сезонность не характерна, однако прослеживается повышение численности больных в весеннее-летний период. Основная масса пациентов с пневмоцистозом – это лица с иммунодефицитом.
Примеры иммунодефицита у человека:
1) физиологическая возрастная недостаточность (дети раннего возраста, пожилые люди);
2) грудные дети до 1 года, рожденные с признаками недоношенности, асфиксии, врожденных пороков развития легких, сердца;
3) дети более старшего возраста и взрослые, имеющие какое-либо хроническое или тяжелое заболевание либо вынужденно принимающие цитостатические препараты, глюкокортикостероиды, лучевую терапию (онкологические болезни, болезни крови);
4) пациенты с хроническими заболеваниями (ревматоидный артрит, системная красная волчанка, хронические неспецифические заболевания легких, циррозы печени и прочие состояния);
5) ВИЧ-инфекция (до 70% пациентов с пневмоцистозом).
Соответственно, группами риска для заражения пневмоцистами являются:
• Дети - воспитанники домов ребенка.
• Люди преклонного возраста, находящиеся в домах престарелых.
• Онкологические больные, получающие иммунодепрессанты.
• Пациенты с заболеваниями крови (лейкоз и другие).
• Больные туберкулезом, ВИЧ-инфекцией, цитомегаловирусной и другими инфекциями.
• Пациенты, находящиеся на лечении глюкокортикостероидами.
Иммунитет после перенесенной инфекции не стойкий, возможны повторные заражения, связанные с инфицированием новым генотипом возбудителя. У иммунодефицитных лиц, перенесших пневмоцистную пневмонию, рецидивы возможны в 10% случаев, у пациентов с ВИЧ-инфекцией в стадии СПИД – в каждом 4м случае.
Патогенное действие на организм
1) Пневмоцисты попадают в организм человека через дыхательные пути и оказываются в просвете мелких бронхов, альвеол, где активно размножаются (в результате продольного деления образуется ооциста, которая впоследствии оказывается окруженной слизистой капсулой). В этот период у больного просвет мелких бронхов и альвеол заполняется слизью практически полностью. Все это приводит к затруднению продвижения воздуха по дыхательным путям пациента – выраженная дыхательная недостаточность.
2) При размножении пневмоцист образуются продукты обмена, которые попадают в кровь и вызывают сенсибилизацию организма и образование специфических антител. Параллельно продукты обмена оказывают раздражающее действие на клетки фагоцитоза, которые притягиваются в очаг поражения. Все это приводит к воспалительной инфильтрации стенок альвеол легких и нарушению диффузии газов (кислород – углекислый газ), что является другой причиной дыхательной недостаточности.
3) При далеко зашедшем процессе – затяжном характере заболевания – образуются фибробласты, а
иными словами фиброз легких. Могут возникнуть осложнения (эмфизема легких, закрытый пневмоторакс).
Симптомы пневмоцистной пневмонии
Инкубационный период при пневмоцистной пневмонии от недели до 10 дней, в среднем 6-7 дней. Пневмоцистоз может протекать в виде ОРЗ, ларингита, обострений хронического бронхита, но чаще всего в виде пневмоцистных интерстициальных пневмоний.
Выделяют 3 стадии заболевания:
1) отёчная (7-10 дней);
2) ателектатическая (до 4х недель);
3) эмфизематозная (1-3 и более недель).
1 стадия – отечная.
Симптомы интоксикации и лихорадки не являются ведущими. Температура может быть и нормальной, и субфебрильной (менее 38º). Больных может беспокоить слабость, усиление утомляемости, снижение работоспособности, снижение аппетита, масса тела может быть нормальной или сниженной. Респираторный синдром выражен слабо – может быть редкий кашель с трудно отделяемой вязкой мокротой. При выслушивании легких (аускультации) жесткое дыхание, хрипов нет. Перкуторно (при простукивании легких) – укорочение перкуторного звука в межлопаточной области.
3 стадия – эмфизематозная.
В данную стадию происходит улучшение самочувствия – кашель уменьшается, одышка купируется. Длительно сохраняется коробочный звук при перкуссии легких, а также сухие хрипы при аускультации.
Чаще всего процесс при пневмоцистной пневмонии ограничен легочной тканью, однако при выраженном иммунодефиците возможно гематогенное и лимфогенное распространение с появлением внелегочных проявлений: поражение печени, селезенки, щитовидной железы, надпочечников, сердца и других. Крайне редко возможна ЛОР-патология (гаймориты, отиты, синуситы).
1) У большей части больных заболевание протекает атипично: некоторые пациенты напоминают больных ОРЗ, сопровождаемое обструктивным бронхитом, плохо поддающееся терапии; у некоторых больных болезнь имеет абортивное течение (резкое прерывание симптомов болезни).
2) Пневмоцистная пневмония имеет склонность к рецидивирующму течению, способствующему развитию хронических фиброзирующих процессов в легких.
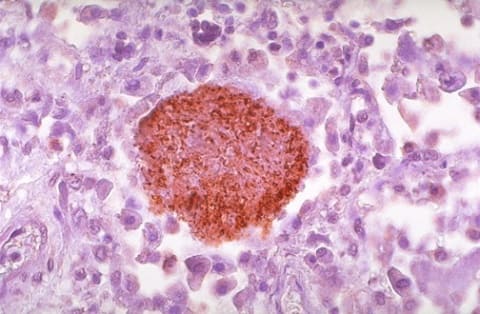
Пневмоцистная пневмония у ВИЧ-инфицированных, микроскопия
Гистологическая картина пневмоцистоза также может быть охарактеризована тремя стадиями:
В начальную стадию нет воспалительных изменений в альвеолах, возможно выявление трофозоидов и цист.
Промежуточная стадия гистологической картины совпадает с клиническими проявлениями и характеризуется изменениями альвеолярного эпителия, обилия макрофагов внутри альвеол, обнаружением большого количества цист.
Финальная стадия характеризуется развитием альвеолита, изменением альвеолярного эпителия, интерстициональной инфильтрацией эпителия. Обилие цист выявляется как в просвете альвеол, так и внутри макрофагов.
Осложнения пневмоцистной пневмонии
Осложнениями пневмоцистной пневмонии могут быть абсцесс легкого, спонтанный пневмоторакс, эксудативный плеврит.
Исходами пневмоцистоза могут быть: выздоровление, летальный исход от 1 до 100% при выраженном иммунодефиците (например, стадия СПИД при ВИЧ-инфекции). Причиной летального исхода является дыхательная недостаточность с резкими нарушениями газообмена.
Диагностика пневмоцистоза
Предварительный диагноз – клинико-эпидемиологический. Необходимы данные о контакте больного, выявление групп риска по ВИЧ-инфекции либо другим выраженным иммунодефицитам. Имеют значение и особенности клиники – отсутствие выраженной интоксикации при респираторном синдроме.
Окончательная диагностика проводится с помощью лабораторно-инструментальных исследований:
1) Общий анализ крови: выраженный лейкоцитоз (до 20-30*109), увеличение лимфоцитов,
моноцитов, эозинофилов, умеренная анемия – снижение гемоглобина, СОЭ может быть в норме или измененным до 50 мм/ч.
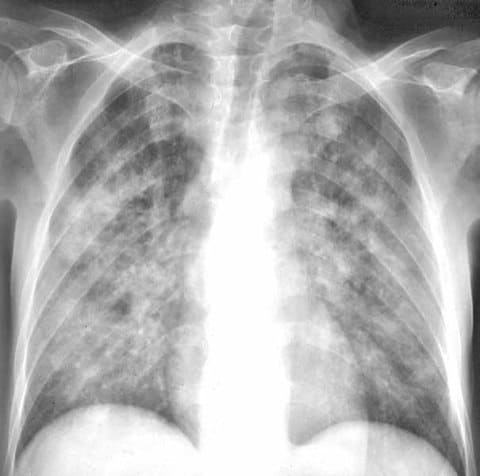
Пневмоцистная пневмония, рентгенологическая картина
4) Серологические исследования на выявление антител к пневмоцистам в крови – ИФА, НРИФ.
Используются парные сыворотки, взятые с интервалом в 10-14 дней, в которых только нарастание титра в 2 и более раз служит подтверждением болезни. Это делается для исключения обычного носительства, антитела обычно выявляются у 70% населения.
5) ПЦР диагностика с целью определения антигенов пневмоцист в мокроте, биопсийном материале, бронхо-альвеолярном лаваже.
Лечение больных пневмоцистной пневмонии
1. Организационно режимные мероприятия, которые включают обязательную госпитализацию больных с выраженной клинической формой заболевания. Диета сбалансированная с учетом состояния больного.
2. Медикаментозная терапия включает в себя этиотропное лечение (воздействие на возбудитель), патогенетическое (действие на звенья патогенного действия пневмоцисты), симптоматическое (устранение симптомов заболевания).
- Этиотропное лечение проводится пентамидином внутримышечно 1 раз в сутки 4 мг/кг курсом на
10-14 дней (однако требуется назначение только доктором в силу токсичности препарата); фуразолидоном 10 мг/кг/сут; трихополом 25-30мг/кг/сут; бисептолом 120 мг/кг/сут сначала внутривенно 3 раза в день, затем пероральный прием 2 раза в день общим курсом до 3х недель.
- Для ВИЧ-инфицированных пациентов назначается антиретровирусная терапия, поскольку ПП у
таких пациентов возникает при существенном угнетении иммунитета.
- Патогенетическое и симптоматическое лечение включает противовоспалительные препараты,
муколитики, препараты, облегчающие отхождение мокроты, отхаркивающие; профилактика дыхательной недостаточности и борьба с ее последствиями.
Профилактика пневмоцистоза
- Для исключения внутрибольничного инфицирования по эпидемическим показаниям должен быть обследован медицинский персонал детских учреждений, онкологических и гематологических стационаров, домов ребенка и домов престарелых.
- Медикаментозная профилактика групп риска. Она может быть первичной (до наступления заболевания) и вторичной (профилактика рецидивов). У ВИЧ-инфицированных пациентов первичная профилактика проводится при снижении Т-хелперов (CD4+) до300 клеток/мл и ниже проводится превентивная (профилактическая) терапия бисептолом внутрь взрослому 960 мг/сут 2 р/день каждые 3 дня пожизненно. Вторичная профилактика проводится бисептолом 480 в профилактических дозах.
- Своевременное выявление и изоляция больных с пневмоцистной пневмонией.
- Заключительная дезинфекция в очагах пневмоцистоза – влажная уборка 5% раствором хлорамина.
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено: увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей; внедрением в практику пересадки донорских органов, трансплантации кос
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено:
- увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей;
- внедрением в практику пересадки донорских органов, трансплантации костного мозга и других форм гематологических манипуляций, выполняемых с гематопоэтической и гематопротезирующей целью;
- эпидемией СПИДа/ВИЧ-инфекции;
- врожденными нарушениями иммунитета, а также ростом числа лиц с аутоиммунными заболеваниями;
- проводимыми многолетними курсами иммуносупрессивной терапии у пациентов с болезнями соединительной ткани;
- алкоголизмом, наркоманией и расширением контингента лиц с асоциальным типом поведения [11].
Объединяющим свойством различных популяций пациентов в данном случае является их повышенная восприимчивость к различным инфекционным агентам, что объясняется снижением пороговых значений вирулентности [1, 6]. Повреждения легочной ткани как инфекционной, так и неинфекционной природы являются едва ли не самой часто описываемой патологией среди пациентов с различными нарушениями иммунитета. При этом легочная инфекция занимает лидирующее положение среди всех инвазивных инфекций, которые диагностируются у такого рода больных [6, 9, 10].
Риск возникновения инфекций нижних дыхательных путей (ИНДП) в группе больных со сниженным иммунитетом весьма различается и зависит от ряда факторов, наиболее важными среди которых являются: нейтропения, аспирация, характер и степень выраженности изменений со стороны иммунной системы (табл. 1), а также эпидемиологическая ситуация в регионе. Одним из наиболее серьезных факторов риска возникновения ИНДП у данной категории пациентов является выраженная и продолжительная нейтропения [5, 8].
Пациент с нарушениями иммунитета, с одной стороны, постоянно находится под воздействием патогенов окружающей среды, а с другой — именно наличие дефекта иммунитета определяет тип легочной инфекции, которая у него развивается. У таких пациентов наиболее распространенными причинами развития ИНДП являются: нозокомиальная инфекция, зачастую резистентная к антибиотикам; воздействие факторов окружающей среды (воздушно-капельная инфекция и/или инфекция, передающаяся через питьевую воду); инфекции, порог вирулентности которых высок среди популяции; реактивация ранее перенесенных инфекций (например, туберкулез) [10, 12].
Каковы же основные особенности респираторных инфекционных процессов у больных со сниженным иммунитетом, знание которых помогает своевременно распознать и как можно быстрее начать проводить специфическое, адекватное терапевтическое лечение.
- При выявлении незначительных по степени интенсивности затемнений легочной ткани во время обычного рентгенологического исследования органов грудной клетки (ОГК) в данной группе пациентов должна в обязательном порядке назначаться компьютерная томография ОГК.
- В случае выявления многофокусных легочных инфильтраций инфекционной (вирусной, бактериальной или грибковой) этиологии, неинфекционной природы, а также при подозрении на метастатическое поражение легочной ткани выполнение рентгенографии ОГК в сочетании с исследованием мокроты не может являться адекватной диагностической процедурой из-за низкой результативности.
- Серологическая диагностика обычно малоинформативна у этих пациентов, в организме которых не генерируется своевременная выработка антител в ответ на инфекцию; в силу этого чаще используются методики, основу которых составляет определение антигена и/или ДНК - полимеразные цепные реакции (ПЦР).
- Выполнение в наиболее сжатые сроки компьютерного томографического исследования легких, а также постановка патоморфологического диагноза (по результатам гистологического и культурального исследований полученных образцов тканей и смывов из трахеи и бронхов) в значительной степени повышают выживаемость пациентов в данной группе.
- В легочной ткани одновременно могут протекать несколько процессов, в частности инфекционный с наличием одного или нескольких патогенов (Pneumocystis сarinii/jiroveci, цитомегаловирусная инфекция (ЦМВ) и т. д.). Нередко выявляется суперинфекция на фоне течения других процессов (например, на фоне развития острого респираторного дистресс-синдрома (ОРДС) или лекарственного поражения легочной ткани).
- Использование сокращенных схем назначаемой иммуносупрессивной химиотерапии (особенно кортикостероидами) может являться столь же значительным фактором риска развития инфекции, как и назначаемая антибактериальная терапия.
Успешность проводимой эмпирической антибактериальной терапии во многом зависит от предварительно проведенного микробиологического обследования и идентификации возбудителя. В абсолютном большинстве случаев речь идет о грибковой или смешанной бактериально-грибковой флоре. Этиологическая расшифровка ИНДП у данной категории больных представлена следующим образом [1–3, 6, 11]:
- типичные бактерии - 37%;
- грибы - 12%;
- вирусы - 15%;
- Pneumocystis carinii/jiroveci - 8%;
- Nocardia asteroides - 7%;
- Mycobacterium tuberculosis - 1%;
- микст-инфекция - 20%.
Довольно часто в популяции пациентов с нейтропенией [11, 12] возникают микст-инфекции, основу которых составляют: инфекции респираторно-сентициального вируса, либо ЦМВ, или инвазия Aspergillus spp. в сочетании с грамотрицательной флорой или P. carinii/jiroveci. Пневмоцистоз в виде моноинфекции и/или в виде микст-инфекции чаще всего описывается у пациентов, получающих системную кортикостероидную терапию (это касается как длительных курсов монотерапии кортикостероидами, так и использования их в качестве составной части режима химиотерапевтической поддержки у онкологических больных).
В современной литературе описывается увеличение количества грибковых поражений и их торпидное течение у пациентов со сниженным иммунитетом, несмотря на применение новейших противогрибковых препаратов [8, 11, 12]. В настоящее время наиболее актуальными являются три инфекционных агента, вызывающих легочные изменения: Pneumocystis carinii/jirovici, представители рода Aspergillus (особенно A. fumigatus) и Cryptococcus neoformans [12, 14].
Таксономически пневмоцисты относят к грибам. В начале нового тысячелетия тип Pneumocystis carinii, вызывающий инфекции у человека, был выделен в отдельный вид Pneumocystis jiroveci — в честь чешского ученого-паразитолога Отто Йировеца, впервые описавшего этот микроорганизм как причину заболевания у человека.
P. jiroveci, являющийся внеклеточным паразитом с преимущественным тропизмом к легочной ткани, поражает пневмоциты 1-го и 2-го порядков. Сложности при проведении дифференциальной диагностики в случае подозрения на развитие у пациента пневмоцистной пневмонии (ПП) в основном объясняются тем фактом, что стандартное обследование больных малоинформативно, до 20% из них имеют стертую клинику, а рентгенологическое обследование не выявляет патологии. Первыми признаками развивающейся ПП являются медленно нарастающая гипоксемия, одышка и кашель при скудности данных физического осмотра и рентгенологических проявлений.
С клинических позиций выделяют три стадии болезни.
- Отечная стадия, продолжительностью в среднем 7-10 дней, характеризуется медленно нарастающей одышкой, которая неуклонно прогрессирует, вплоть до выраженной одышки в покое, и сопровождается сухим непродуктивным кашлем. В легких хрипы не выслушиваются, дыхание, как правило, ослабленное. Симптомы общей интоксикации незначительны (субфебрилитет, общая слабость). Рентгенологическая картина в начале заболевания неясная, чаще всего описываемая как вариант нормы; реже выявляется прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка.
- Для ателектатической стадии (продолжительность около 4 нед) характерна выраженная одышка в покое (до 30-50 дыхательных движений в 1 мин), пациентов беспокоит малопродуктивный кашель с выделением вязкой мокроты, нередко описывается вздутие грудной клетки. Часто отмечается фебрильная лихорадка. Аускультативная картина характеризуется жестким и/или ослабленным дыханием (локально или над всей поверхностью легких), иногда выслушиваются сухие хрипы. На более поздних этапах в клинической картине заболевания на первый план выходят симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологи на этой стадии более чем в половине случаев выявляют билатеральные облаковидные инфильтраты (симптом "бабочки"), а также - обильные очаговые тени ("ватное" легкое).
- Последняя, эмфизематозная стадия характеризуется развитием эмфизематозных лобулярных вздутий и, возможно, разрушением альвеолярных перегородок с развитием пневмоторакса. Клинически может наблюдаться некоторое улучшение состояния больных, уменьшение одышки.
Диагностические мероприятия, направленные на выявление Pneumocystis jiroveci, начинают с получения индуцированной мокроты. Материал исследуют методом прямой микроскопии окрашенных мазков. В последнее время для более точной диагностики разработаны и применяются метод ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами. Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет почти в 100% случаев обнаружить возбудителя и, следовательно, является наиболее эффективным и достоверным методом диагностики ПП. В тех случаях, когда пациенты прибегали к лечению пентамидином, эффективность диагностики с использованием бронхоальвеолярного лаважа снижалась до 60%. Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости [7, 9].
В настоящее время обследование пациентов с подозрением на развитие ПП проводится по следующей схеме — всем больным с пневмонией лечение назначается эмпирически, и только при тяжелом легочном процессе проводится легочная биопсия. В отсутствие адекватного специфического лечения пневмоцистоза летальность достигает 100% у пациентов с иммунодефицитами и 50% — у недоношенных детей. Прогноз остается неблагоприятным (зависит от фонового состояния), и без коррекции иммунного статуса у 15% пациентов возникают рецидивы ПП [4, 8].
У пациентов, не получающих триметоприм-сульфаметоксазол (или иные антибактериальные препараты, назначаемые в режиме химиопрофилактики при высоком риске развития пневмоцистоза (табл. 2), сохраняется высокая вероятность возникновения пневмоцистоза на фоне развития ЦМВ-инфекции, что, возможно, связано с блокировкой альвеолярных макрофагов и снижением функции CD4-лимфоцитов.
Относительно частоты выявления пневмоцистоза в группе пациентов с иммунодефицитными состояниями (в которую не вошли пациенты с ВИЧ-инфекцией), следует отметить, что при отсутствии своевременно проводимых профилактических мероприятий примерно у 5–12% пациентов развивается развернутая клиника пневмоцистоза [13]. Применение активной антиретровирусной терапии существенно снижает риск развития ПП при СПИДе. В случае снижения уровня CD4 Рисунок 1. Обзорная рентгенография органов грудной клетки от 11.11.04.
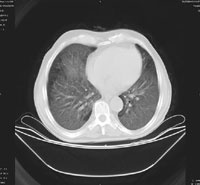
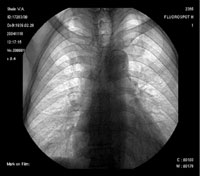
На момент госпитализации: состояние средней степени тяжести, обусловленное дыхательной недостаточностью. При осмотре кожных покровов видны сухие следы расчесов, акроцианоз. В подмышечных, паховых областях с обеих сторон пальпируются единичные, мягко-эластичной консистенции безболезненные лимфатические узлы. В легких при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхания — 23–24 в минуту, пульс — 87 в минуту, артериальное давление — 140/80 мм рт. ст. Со стороны пищеварительной, мочеполовой, нервной систем патологии не выявлено. Больному была назначена антибактериальная терапия, включающая ципрофлоксацин, рифампицин. Помимо антибиотиков пациент получал муколитики, фестал, альмагель, бисакодил. На фоне проводимого лечения сохранялись гектические подъемы температуры, нарастала дыхательная недостаточность. С учетом затяжного течения пневмонии больной повторно был осмотрен фтизиатром, данных, подтверждающих туберкулез, снова не было выявлено. В ходе обследования методом иммуноферментного анализа и иммунного блотинга были выявлены антитела к ВИЧ, что заставило пересмотреть диагностический алгоритм и предположить развитие у больного ПП либо поражения легких в рамках ЦМВ-инфекции; окончательно не был исключен из диагностического ряда и вариант развития туберкулезного процесса в легких. Ввиду вышесказанного к проводимой терапии был добавлен бисептол в адекватных дозах. При иммунологическом исследовании выявлено абсолютное снижение CD4 до 19,3/ мкл. Все вышеперечисленное позволило диагностировать у больного ВИЧ-инфекцию в стадии 3Б (СПИД-ассоциированный комплекс), двустороннюю субтотальную пневмонию. При проведении (11.11.04) повторного рентгенологического исследования ОГК (рис. 1) отмечалась отрицательная динамика в виде нарастания объема и интенсивности инфильтрации легочной ткани. При ультразвуковом исследовании органов брюшной полости обнаружены диффузные изменения печени, поджелудочной железы, селезенки, увеличение лимфоузлов подмышечных, паховых областей. При контрольной компьютерной томографии ОГК отмечалась отрицательная динамика в виде прогрессирования диффузных изменений в обоих легких (рис. 2, 3). На фоне лечения у больного нарастала дыхательная недостаточность, сохранялись гектические подъемы температуры, развился ОРДС, в связи с чем пациент был переведен в отделение реанимации и интенсивной терапии, где осуществлялись респираторная поддержка, проводились антибактериальная, дезинтоксикационная терапия, противоязвенное и антитромботическое лечение, симптоматическая терапия. Однако, несмотря на все перечисленные мероприятия, 23.11.04 г. наступила остановка сердечной деятельности по типу асистолии.
 |
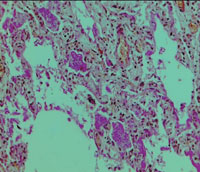
| Рисунок 4. Гиалиновые мембраны на стенках альвеол (окраска гематоксилином и эозином). Микрофотография |
 |
| Рисунок 5. Скопления Pneumocystis jiroveci в просветах альвеол (окраска PAS-методом). Микрофотография |
Согласно материалам аутопсии у больного было подтверждено наличие двухсторонней полисегментарной ПП, ОРДС: полнокровие капилляров альвеолоцитов и наличие гиалиновых мембран на стенках альвеол (рис. 4, 5).
- Collin B. A., Ramphal R. Pneumonia in the compromised host including cancer patients and transplant patients//Infect. Dis. Clin. North. Am. 1998; 12: 781.
- Junghanss C., Marr K. A. Infectious risks and outcomes after stem cell transplantation: are nonmyeloablative transplants changing the picture?//Curr. Opin. Infect. Dis. 2002; 15: 347.
- Bodey G., Rodriguez V., Chang H. et al. Fever and infection in leukemic patients: A study of 494 consecutive patients. Cancer. 1978; 41: 1610.
- Coker D. D., Morris D. M., Coleman J. J. et al. Infection among 210 patients with surgically staged Hodgkin's disease//Am. J. Med. 1983; 75: 97.
- Sickles E. A., Greene W. H., Wiernik P. H. Clinical presentation of infection in granulocytopenic patients//Arch. Intern. Med. 1975; 135: 715.
- Rubin R. H., Greene R. Clinical approach to the compromised host with fever and pulmonary infiltrates//In: Clinical Approach to Infection in the Compromised Host, 3rd edition, Rubin R. H., Young L. S. (Eds), Plenum Press, New York. 1994; 121.
- LiPuma J. J., Spilker T., Coenye T., Gonzalez C. F. An epidemic Burkholderia cepacia complex strain identified in soil//Lancet. 2002; 359: 2002.
- Escalante C. P., Rubenstein E. B., Rolston K. V. Outpatient antibiotics therapy for febrile episodes in low-risk neutropenic patients with cancer//Cancer Invest. 1997; 15: 237.
- Talcott J. A., Whalen A., Clark J. et al. Home antibiotic therapy for low-risk cancer patients with fever and neutropenia: A pilot study of 30 patients based on a validated prediction rule//J. Clin. Oncol. 1994; 12: 107.
- Rosenow E. C., Wilson W. R., Cockerill F. R. Pulmonary disease in the immunocompromised host//Mayo. Clin. Proc. 1985; 60: 473.
- Junghanss C., Marr K. A., Carter R. A. et al. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoietic stem cell transplantation: a matched control study//Biol. Blood. Marrow. Transplant. 2002; 8: 512.
- Ascioglu S., Rex J. H., de Pauw B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus//Clin. Infect. Dis. 2002; 34: 7.
- Fishman J. A. Prevention of infection due to Pneumocystis carinii//Antimicrob. Agents. Chemother. 1998; 42: 995.
- Fishman J. A. Treatment of infection due to Pneumocystis carinii//Antimicrob Agents. Chemother. 1998; 42: 1309.
- Furrer H., Egger M., Opravil M. et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV-1-infected adults treated with combination antiretroviral therapy. Swiss HIV Cohort Study//N. Engl. J. Med. 1999; 340: 1301.
А. Ф. Шепеленко, доктор медицинских наук, доцент
М. Б. Миронов, кандидат медицинских наук
А. А. Попов
Главный военный клинический госпиталь им. Н. Н. Бурденко,
ММА им. И. М. Сеченова, ГИУВ МО РФ, Москва
Читайте также:


