Что такое впч инфекция и cin
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье приведена тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и рассмотрена необходимость применения противовирусной терапии
Для цитирования. Зароченцева Н.В., Логутова Л.С., Джиджихия Л.К. Тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и необходимость применения противовирусной терапии // РМЖ. 2016. No 5. С. 305–311.
Поздние гены кодируют структурные белки вириона. Гены Е-6 и Е-7 всегда выявляются в опухолевых клетках, зараженных ВПЧ, в то время как другие фрагменты вирусного генома могут быть утеряны в процессе его длительной персистенции в организме.
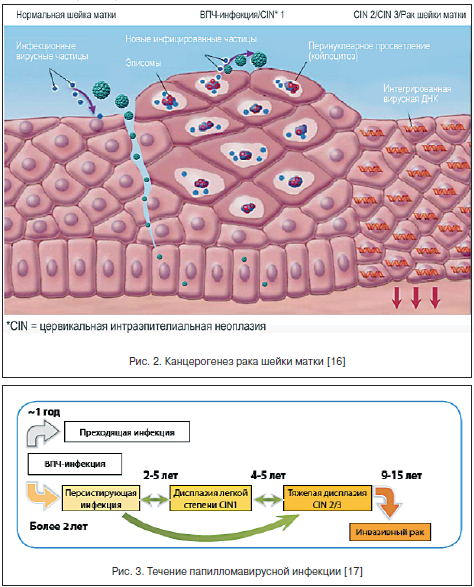
ВПЧ инфицирует пролиферирующие эпителиальные клетки базального слоя эпителия и отличается высоким тропизмом именно к этому типу клеток. Инфицирование многослойного плоского эпителия происходит через микроповреждения (механические, бактериальные и др.), когда глубина их достигает базального слоя, где и обнаруживается эписомальный вирусный геном (рис. 2). При этом репликация ДНК ВПЧ происходит только в клетках базального слоя, эти клетки являются постоянным источником инфицирования эпителиальных клеток, а в клетках других слоев вирусные частицы лишь персистируют.
Папилломатозные разрастания формируются в роговом слое в локусах максимальной репродукции вируса (рис. 3). В зараженных клетках вирусный геном может существовать в 2-х формах: эписомальной (вне хромосом) и интегрированной в клеточный геном [16, 17].
Репликация ДНК вируса и синтез связанных с ней капсидных белков изменяют клеточный цикл и приводят к клеточной атипии, что занимает от 1 до 3-х лет.
Пока вирус находится в эписомальном состоянии, наблюдаются доброкачественные процессы. После инфицирования ВПЧ в эпителиальных клетках нарушается нормальный процесс дифференцировки, особенно в клетках шиповатого слоя, в котором наблюдается клональная экспансия инфицированных ВПЧ-клеток базального слоя, прошедших только первичную стадию дифференцировки. Эта клональная экспансия связана с их трансформацией и последующей малигнизацией. В стадии развитой инфекции наблюдается синтез вирусной ДНК в клетках шиповатого слоя при переходе в зернистый слой. Причем экспрессия поздних генов L1 и L2 на этом этапе отсутствует. Она наступает только на конечной стадии дифференцировки, где и наблюдаются активная сборка зрелых вирусных частиц, их выделение из клеток и почкование прямо на поверхности при формировании кондилом. Именно эти участки инфекционно опасны в отношении контактного заражения.
Однако многие авторы приходят к выводу, что инфицирование эпителиальных клеток ВПЧ – необходимое, но недостаточное событие для ракового перерождения. Для формирования необратимой неоплазии дополнительно необходимы:
– активная экспрессия генов Е-6 и Е-7 вируса;
– индукция метаболических механизмов конверсии эстрадиола в 16,2-гидроксистерон (16,2-ОН);
– индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Крайне неблагоприятна сочетанная персистенция ВПЧ с вирусом простого герпеса 2-го типа, цитомегаловирусом, вирусом Эпштейна – Барр, вирусом иммунодефицита человека, хламидиями и микоплазмами.
Развитие РШМ – не молниеносный процесс, он занимает 10–15 лет. Из всех факторов риска РШМ огромное значение имеет возраст сексуального дебюта. По данным D.R. Brown et al. (2005) [18], раннее начало половой жизни в сочетании с ВПЧ-инфекцией увеличивает риск РШМ в 22 раза. По результатам исследований F.X. Bosh et al. (2006) [19], 13% женщин с РШМ начали половую жизнь ранее 14 лет против 3,5% женщин с РШМ, имевших коитархе в возрасте 20 лет.
Несмотря на то что лица 15–19 лет составляют лишь 25% сексуально активного населения, более 50% сексуально-трансмиссивных заболеваний, в т. ч. ВПЧ, возникают именно в этой возрастной группе. ВПЧ-инфекция чаще встречается среди лиц 15–19 лет с кумулятивной частотой заболевания 17% в течение 1 года и 35,7% – в течение 3-х лет с момента коитархе.
По результатам нескольких современных эпидемиологических исследований изучена распространенность ВПЧ-инфекции в подростковой популяции. У лиц в возрастной группе от 13 до 21 года частота инфицирования равна 38,2%, причем пациентки 13–18 лет приблизительно в 2 раза чаще инфицированы ВПЧ, чем в возрасте 19–21 года [20].
Пути передачи и инфицирования ВПЧ
1. Половой путь. Инфицирование ВПЧ происходит при генитально- генитальном половом акте, мануально-генитальном и орально-генитальном контактах.
2. Вертикальный путь. Доказаны повышенная чувствительность эпителия шейки матки к ВПЧ в период беременности, а также возможность внутриутробного инфицирования плода и новорожденного.
3. Бытовой путь. Возможна передача вируса через нижнее белье, хирургические перчатки, хирургический инструментарий для биопсии и другие предметы, обсемененные ВПЧ. Медперсонал может инфицироваться ВПЧ во время лазерной деструкции генитальных бородавок, вдыхая образующийся дым.
Инкубационный период составляет 1–6 мес., максимальное содержание вируса в пораженных тканях обнаруживается на 6-й мес.
Частота передачи ВПЧ от матери к плоду, по данным разных исследователей, различается весьма существенно – от 4 до 87%. При этом ВПЧ в течение многих лет может персистировать в клетках слизистой оболочки рта ребенка и являться причиной участившегося в последнее время рецидивирующего респираторного папилломатоза гортани.
Течение ПВИ
Большинство случаев выявления ПВИ и характерные изменения, наблюдаемые при цитологическом исследовании, нередко разрешаются самостоятельно в течение 1 года (преходящая, или латентная, инфекция), не оставляя повреждений и присутствия ПВИ [16, 21–23].
При наличии ВПЧ в организме более 2-х лет развивается персистирующая инфекция, которая приводит к развитию CIN [24].
По мнению L.G. Koss (1987), патология шейки матки подобна айсбергу: лишь незначительная часть процессов находится на поверхности и может быть замечена глазом [25, 26]. Рутинный осмотр шейки матки в зеркалах далеко не всегда позволяет выявить наличие патологии. Принципы диагностики давно изучены и не представляют сложностей. Основными методами обследования являются цитологический метод (РАР-тест), расширенная кольпоскопия, проведение ВПЧ-тестирования (качественного и количественного), гистологическое исследование биоптата шейки матки и выскабливание цервикального канала шейки матки. Обследование на урогенитальную инфекцию (УГИ): микроскопия мазка, посев на условно-патогенную флору, ПЦР-диагностика ИППП также включены в перечень необходимых исследований при патологии шейки матки.
Тактика ведения женщин с CIN I в биоптате
CIN I характеризуется высоким уровнем спонтанной регрессии и низким уровнем прогрессии этих поражений. Алгоритм ведения пациенток с CIN I четко не определен. Ведение пациенток с CIN I требует активного наблюдения с использованием цитологического исследования и кольпоскопии, однако хирургическое лечение, как правило, можно не проводить в течение 1,5–2 лет ввиду возможной спонтанной регрессии у молодых женщин [36].
Существуют два тактических варианта, выбор одного из них основан на предпочтениях пациентки и врача:
1. Наблюдение CIN I с цитологическим контролем через 6 и 12 мес. или ВПЧ-тестированием через 12 мес. После 2-х последовательных отрицательных цитологических результатов или негативного ВПЧ-теста пациентка подлежит рутинному скринингу, в случае повторного результата цитологического исследования, соответствующего >ASC-US, или положительного ВПЧ-теста – направлению на кольпоскопию.
Проводятся лечение УГИ, бактериального вагиноза, обязательное восстановление микробиоценоза влагалища. Назначается Изопринозин по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней.
Лечение CIN I проводится с использованием методов аблации или эксцизии. Оба метода приемлемы при удовлетворительной кольпоскопии (ЗТ I или II типа).
2. В случае неудовлетворительной кольпоскопии (ЗТ III типа), при наличии поражения в эндоцервикальном образце и у женщин с рецидивом CIN рекомендуется диагностическая эксцизия.
Активное ведение пациенток с CIN I с применением аблации или эксцизии рекомендовано при:
– неудовлетворительных результатах кольпоскопии;
– обширном поражении;
– персистенции CIN I > 18 мес.;
– возрасте пациентки > 35 лет;
– нежелании женщины посещать врача регулярно.
Тактика ведения женщин с CIN II–III в биоптате
Поражения эпителия тяжелой степени (HSIL) сопровождаются значительным риском трансформации в РШМ, поэтому требуют активного лечения.
CIN II–III считаются предраковыми поражениями, они чаще персистируют и прогрессируют, чем регрессируют, и поэтому должны подвергаться лечению (исключение составляют CIN II–III у беременных и CIN II у юных женщин).
Предпочтение, безусловно, следует отдавать эксцизионным методам лечения (петлевая эксцизия или конизация), а не деструктивным, поскольку конизация позволяет, как уже упоминалось, получить биоматериал, пригодный для гистологического исследования, что гарантирует врачу объективные данные о стадии патологического процесса [37].
Эксцизия необходима при:
– большой площади поражения;
– несовпадении цитологического и кольпоскопического заключений;
– рецидиве заболевания;
– неудовлетворительной кольпоскопии (ЗТ III типа, когда поражение локализуется внутри цервикального канала и недоступно визуализации при кольпоскопии); лечение пациенток с CIN III проводят онкогинекологи.
Особенности тактики ведения CIN у девочек-подростков и юных женщин
У юных женщин с CIN I предпочтительна тактика наблюдения, только при наличии CIN III – лечение. Девочки-подростки и юные женщины с CIN I наблюдаются в течение 2-х лет с повторными цитологическими исследованиями через 12 и 24 мес. Кольпоскопическое исследование необходимо, если в мазке через 12 мес. >HSIL или через 24 мес. >ASC-US (атипичные изменения клеток плоского эпителия неясного значения).
Особенности ведения пациенток с CIN в постменопаузе
Наибольший уровень заболеваемости РШМ наблюдается у женщин старше 45 лет. В то же время диагностика заболевания шейки матки в постменопаузе может быть затруднена. Эстрогенная недостаточность приводит к развитию атрофии слизистой цервикса и втягиванию зоны стыка эпителия в эндоцервикс. До наступления менопаузы только 8% CIN находятся эндоцервикально, после менопаузы 48% CIN располагаются в цервикальном канале. Поэтому при кольпоскопическом выявлении ЗТ III и наличии аномального цитологического мазка необходимо проведение кюретажа эндоцервикса (тестирование на ВПЧ) и конизации шейки матки. При подозрении на поражение низкой степени CIN I необходимо проведение санации и гормонального лечения до повторного исследования. При получении аномального мазка высокой степени проводятся санация и кюретаж эндоцервикса, конизация. Рекомендуется применение Изопринозина по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней или без перерыва курсом 30 дней.
Использование эстрогенной терапии – наиболее простой способ улучшить эффективность кольпоскопии. Эстрогены способствуют вывороту эндоцервикальной слизистой оболочки, расширению цервикального канала с образованием слизи, которая благодаря своей прозрачности улучшает визуализацию эндоцервикса. Маленькие дозы эстрогенов достаточны для коррекции атрофии, исчезновения небольших атипий CIN I–II, связанных с атрофией. Предварительная санация влагалища и местная гормональная терапия в течение 15 дней улучшают условия обследования женщин в постменопаузе и облегчают интерпретацию проведенного цитологического исследования мазков и кольпоскопического исследования.
Наблюдение после лечения CIN
Уровень остаточных поражений и рецидивов после лечения CIN составляет 5–15%, большинство из них обнаруживают в течение первых 2-х послеоперационных лет.
В период наблюдения после лечения используют те же методы, что и для диагностики перед лечением: цитологию, кольпоскопию и ВПЧ-тестирование. Чувствительность ВПЧ-теста в идентификации остаточных или рецидивных CIN II–III и прогностическая ценность его негативного результата превосходят аналогичные показатели цитологического исследования.
Отрицательный ВПЧ-тест через 6 мес. после лечения CIN II–III или 3 последовательных негативных цитологических результата, полученных с 6-месячным интервалом, позволяют перевести пациентку на ежегодное цитологическое исследование. При положительном ВПЧ-тесте или цитологии >ASC-US необходимо кольпоскопическое исследование.
Если CIN II–III присутствует в краях иссеченного конуса или в материале, полученном из оставшейся части канала сразу после эксцизии, необходимо цитологическое исследование с получением эндоцервикального образца через 4–6 мес., для женщин старшего возраста предпочтительна повторная процедура эксцизии. У женщин с гистологически верифицированной остаточной или рецидивной CIN II–III допустимы повторная процедура эксцизии или гистерэктомия.
Профилактика – вакцинация
Международная организация по исследованиям в области рака (IARC) определила, что ПВИ – вакциноуправляемая инфекция, а предотвращение заражения и персистенции ВПЧ однозначно можно считать профилактикой РШМ [6, 18, 20, 37, 38].
В настоящее время в мире и, в частности, в России зарегистрировано 2 вакцины против ВПЧ: бивалентная и квадривалентная.
Профилактическая вакцина зарегистрирована в 117 странах мира. Национальные программы ВПЧ-вакцинации рекомендованы в 60 странах, причем в 6 странах рекомендуется и вакцинация мальчиков.
Обе вакцины в установленном порядке зарегистрированы Министерством здравоохранения РФ, в 2007 г. в России вакцинация против РШМ одобрена правительством страны. ВОЗ рекомендует проведение массовой вакцинации от ВПЧ для первичной профилактики ВПЧ- ассоциированных раков.
Вирус папилломы человека -что это такое?
Очень часто приходится сталкиваться с такой проблемой как ВПЧ- инфекция.
Обращаются молодые женщины с аногенитальными бородавками (остроконечными кондиломами) или с патологическими изменениями на шейке матки, вызванными влиянием ВПЧ- вирусом папилломы человека.
Это вызывает у женщин определенный страх, так как сегодня большинство женщин уже информированы о том, что вирус папилломы человека может вызывать развитие онкологических процессов и в частности рака шейки матки.
Поэтому хотелось бы дать немного информации о ВПЧ, устранить излишний страх, но в то же время насторожить, чтобы своевременно проходить скрининговое обследование.
ВПЧ –это вирусы, принадлежащие к роду папилломавирусов. ВПЧ состоит 2-х цепочек ДНК, окруженных белками. ВПЧ — безкапсульный вирус, но он имеет капсид.
В настоящее время идентифицировано более 200 типов ВПЧ, 40 из них могут вызывать различные заболевания аногенитальной области.
ВПЧ поражает до 85% женщин в течении жизни!
Большинство женщин инфицируются с началом половой жизни и максимальная частота инфицированных достигается к 25 годам, а затем падает за счет самостоятельной элиминации, то есть ухода вируса из организма. Если элиминация не произошла, развиваются изменения шейки матки, ассоциированные с ВПЧ.
- Половой путь (!) является наиболее частым путем передачи! ВПЧ относят к 6 -ой инфекции, передаваемой половым путем.

Генитально-генитальный
- Мануально-генитальный
- Орально-генитальный и др.
Неполовой путь (эстрагенитальный)
- Контакт с предметами/поверхностями, через которые можно возможна передача инфекции
- Вертикальная передача (от матери к новорожденному)
- Через кровь до рождения
![]()
- Во время прохождения через родовые пути
- Во время кесарева сечения с /без раннего повреждения оболочек
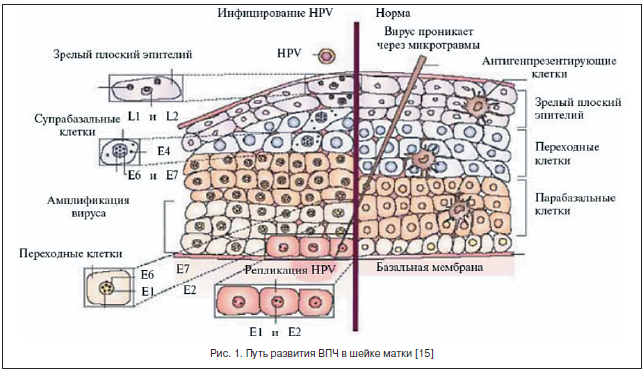
ВПЧ проникает в клетки при тесном контакте эпителиальных тканей, к клеткам базального слоя эпидермиса. Вирус не располагается в поверхностных слоях эпителия, а проникает и инфицирует базальные клетки.

ВПЧ обладает тропностью только к клеткам кожи и слизистых. ВПЧ проникает через поврежденный эпителий, в то время как здоровые эпителиальные клетки способны противостоять вирусу. Таким образом, лечение вагинальных инфекций и восстановление нормального биоценоза влагалища позволяет снизить онкологические риски!
В зависимости от типа, ВПЧ обладает высоким или низким онкогенным потенциалом, то есть способностью вызывать или не вызывать опухолевые процессы. ВПЧ низкоонкогенного типа как правило вызывают бородавки на коже, аногенитальные бородавки.
- Неонкогенные ВПЧ типы: 1−4,7,10, 28, 41 вызывают подошвенные, плоские и вульгарные бородавки.
- ВПЧ низкого онкогенного риска. Типы: 5−8, 11, 12, 14, 15, 17, 19−25, 42−44: аногенетальные кондиломы (АГК), ларенгиальный папилломатоз, бородавчатую эпидермоплазию.
- ВПЧ высокого онкогенного риска 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 могут вызывать раки самой различной локализации:
CIN I,II,III. (предраковое состояние)
Рак шейки матки
Рак прямой кишки
Рак влагалища и вульвы
Рак полового члена
Рак ротовой полости
Онкогенные типы –6−24 месяца.
Таким образом, молодые женщины с ВПЧ могут наблюдаться в течение 2-х лет, рассчитывая на самостоятельную элиминацию, но не более.
Из всех зараженных женщин вирусом папилломы человека, только у 7-10% процесс идет дальше переходя в CIN разной степени и рак, при определенных условиях!
Проникая в клетку вирус долгое время может находится в организме в эписомальном состоянии, перстистируя, не проникая в ядро и не внедряется в геном клетки. Такое состояние называется вирусоносительство.
При бессимптомном носительстве и вирусовыделении: вирус спонтанно элиминирует в 90% случаев.
Постепенно базальные клетки проходят свой жизненный цикл: дифференцируются, поднимаются в поверхностные слои эпителия и слущиваются вместе с вирусом.
В этих случаях никаких изменений в клетках не происходит. Патологический процесс не развивается.
Латентная форма ВПЧ – это когда вирус выявляется в клетках эпителия, а морфологических изменений на шейке матки или в органах другой локализации нет.
Клиническая форма ВПЧ. При длительной персистенции вируса повышается риск внедрения ДНК вируса в геном базальных клеток — начинаются изменения, которые приводят к клиническим проявлениям в виде : CIN 1, CIN 2, CIN 3 или РШМ. Процесс может прогрессировать в течение 10−30 лет
В зависимости от степени поражения шейки матки вирусом различают предпатологическую стадию -CIN 1 — поражения низкой степени риска.
Спустя годы СIN 1 может прогрессировать до СIN 2 и CIN -3. Это уже поражение высокой степени риска и относится к предраковым состояниям.
CIN1 регрессирует самостоятельно в 60% случаев, персистирует — 30%, прогрессирует до CIN3 — 10%, прогрессирует до РШМ ( рак шейки матки)— менее 1%.

CIN2: регрессия — 40%, персистенция — 40%, прогрессирование — 20%, из них — 5% до инвазии.
CIN3: регрессия — 33%, персистенция — 55%, прогрессирование и инвазия — 12%.
Спустя десятилетия — рак.
Течение ВПЧ-инфекции зависит от активности иммунной системы. И может приводит либо к персистенции, либо кразвитию клинически значимых форм, либо к регрессу.
- Визуальный осмотр. Осмотр шейки матки в зеркалах при гинекологическом осмотре.
- Жидкостная цитология. Забор мазка с шейки матки цитощеткой на раковые клетки и помещения ее в контейнер со специальной средой.
![]()
- Кольпоскопическое исследование. Осмотр шейки матки микроскопом с использованием проб с 3-5% уксусной кислотой и водным раствором Люголя.
![]()
Кольпоскопическое исследование шейки матки необходимо проводить в 1 фазу цикла до 10-12 дня. Накануне исследования за 2-4 дня исключить половой контакт, свечи и другие манипуляции. Этот метод позволяет визуально увидеть поражения на ш/матки, характерные для ВПЧ инфекции и предположить вероятную степень поражения. Позволяет делать прицельные биопсии ш/матки
- ВПЧ-тестирование. ВПЧ тестирование – очень важный метод диагностики. Это определение ВПЧ методом ПЦР в материале, взятом из ц/канала. При ВПЧ — тестировании необходимо:
— Определять все онкогенные типы, а не только 16 и 18
— Обязательно определять вирусную нагрузку. Единицей измерения служит количественное содержание возбудителя на 100 000 клеток эпителия человека.
- Lg 5 (геномных эквивалентов ВПЧ 10 в 5 степени и более)
- Молекулярные маркеры. В последние годы наибольшее внимание привлекают молекулярные маркеры пролиферации и озлокачествления p16INK4а и Е6/Е7 тРНК. Его применяют гистологи, когда не могут дифференцировать степень поражения.
- Биопсия. Это взятие ткани шейки матки на гистологическое исследование. Оно является последней инстанцией в постановке диагноза и определения степени поражения.
- У молодых женщин с CIN 1 , подтвержденном гистологически
- Жидкостная цитология проводится через 6 и 12 месяцев или альтернативно с ВПЧ –тестом через 12 месяцев.
- Интенсивное наблюдение необходимо в виду возможного риска нераспознанного поражения высокой степени в этой группе
Выжидательная тактика при CIN 1 сопряжена с риском, т.к. небольшой риск прогрессии сохраняется. И нет гарантии, что при биопсии не было пропущено CIN 2, 3
— За исключением беременных
— Молодых пациенток с CIN2 при небольшом поражении и удовлетворительной кольпоскопии.
Основной метод лечения это эксцизия или конизация ш/матки c обязательным гистологическим исследование. То есть удаление патологического участка на ш/матке с помощью радиоволн или лазерного луча.
Вирус может исчезнуть сам без какого либо лечения. Поэтому доказать эффективность препаратов, используемых для лечения ВПЧ очень трудно.
Все так называемые противовирусные препараты назначаются дополнительно к основному деструктивному лечению, с целью:
* Предупреждения прогрессирования заболевания.
* Устранения клинических проявлений заболевания.
* Уменьшения числа рецидивов.
Выбор препаратов иммунотропного действия для лечения вирусных инфекций
Существует ряд зарегистрированных препаратов, в показаниях к которым значится ВПЧ, однако, они не включены в рекомендации.
При применении лекарственных препаратов, воспроизводятся биологические эффекты эндогенных интерферонов, поэтому они являются средствами патогенетической терапии.
Наибольшее количество убедительных доказательных данных получено по 4 препаратам:
- изопринозин пранобекс
- ИФН
- глюкозаминилмурамилдипептид (ликопид)
- интерферон альфа-2b
В основе действия неспецифических иммуностимуляторов лежит активация клеток врожденного иммунитета и продукция эндогенных цитокинов, включая ИФН (интерферон) I и II типов, которые влияют на разные этапы жизненного цикла практически всех вирусов
Изопринозин пранобекс и глюкозаминилмурамилдипептид ( ГМДП) действуют системно, оказывая иммуностимулирующее и противовирусное действие + ГМДП обладает противовоспалительным эффектом, что очень важно, учитывая сочетание ВПЧ с другими инфекциями в 70−80% случаев. Оба препарата действуют за счет активации врожденного клеточного иммунитета.
Рекомендуемая продолжительность лечения: инозин пранобекс — 3−4 10-дневных курса с интервалом в 10−14 дней либо 28 дней; ГМДП — 1 курс 10 дней.
- ВПЧ тест или ВПЧ-тест + цитология через 6 месяцев после лечения.
- При отрицательном ВПЧ-тесте, необходимо ежегодное комбинированное тестирование – ВПЧ тест + жидкостная цитология.
- Позитивный ВПЧ-тест может обнаружить неудачу терапии рано и точно, даже при наличии нормальной цитологии, поэтому женщина продолжает интенсивно наблюдаться.
ВПЧ-тест — это стандарт постлечебной оценки!
В 2008 году была присуждена Нобелевская премия за открытие роли ВПЧ в генезе рака шейки матки. В 99,7% случаев возникновения РШМ доказана роль ВПЧ! Рака шейки матки без ВПЧ насколько известно в настоящее время, не бывает!
На основе этого открытия были созданы профилактические вакцины:

- 2-х валентная- Церварикс — содержит инактивированные вирионы 16 и 18 типов
- 4- х валентная –Гардасил — содержит инактивированные вирионы 6, 11, 16 и 18 типов.

На сегодня существуют 9-валентная вакцина, но в РФ они не зарегистрированы.

В настоящее время уже прошло достаточно времени с момента начала применения вакцин, чтобы дать оценку эффективности вакцинации.
Австралийский анализ 2018г – у вакцинированных женщин от 18-35 лет наблюдается снижение аногенитальных бородавок и РШМ до 92%
Анализ Финляндии показывает практически 100% защиту от различных видов рака, ассоциированных с ВПЧ. Общая эффективность приравнивается к 100%
Вакцина показывает высокий профиль безопасности.
Вакцина безопасна! Редко могут быть покраснение, зуд в месте иньекции.
Исследования показывают, что иммунитет сохраняется и не требует повторной вакцинации.
На сегодняшний день время иммунного ответа от введения 4-х валентной вакцины пока не ограничивается.
Вакцина является профилактической, а не лечебной! Поэтому самым лучшим и оптимальным вариантом является вакцинация до начала половой жизни, т.к с начала половой жизни большая вероятность заразиться ВПЧ
Вакцинацию оптимально делать с 9 до 12 лет. Можно вакцинировать двукратно, этого достаточно
На десять лет этой вакцины по наблюдениям хватает.
Вакцина к бесплодию не приводит. Это полная глупость, ерунда!
Сегодня вакцинировать можно до 45 лет!
Для вакцинации НЕТ необходимости определять наличие ВПЧ.
Сегодня определение ВПЧ делают с целью определения факторов риска и оценки излеченности после деструктивных методов лечения.
Если при скрининге ВПЧ нет, то можно следующее скрининговое исследование сделать через 3- 5 лет, т.к отсутствие ВПЧ не приведет к развитию онкологического процесса.
Наличие вируса - это всегда риск.! Но просчитать риск невозможно! Нужно наблюдение!
Вирус может как уйти из организма, так и начать неопластические процессы.
Какая вакцина эффективнее?
И Церварикс, и Гардасил одинаково эффективны.
При использовании Церварикса титр антител выше, присутствует перекрестный эффект в отношении нескольких других типов.
У подростков и молодых женщин лучше использовать 4-х валентную вакцину Гардасил (лучше иммунный ответ и чаще встречаются генитальные кондиломы), а чем старше женщина, тем больше предпочтение — двухвалентной вакцине (более иммуногенна).
Имеет ли смысл вакцинировать уже инфицированных женщин?
Если речь идет о подростках и молодых женщинах — да, поскольку она на данный момент может быть инфицирована не онкогенным типом, а вакцина ее защитит в будущем от более опасного варианта инфекции или от рецидива ВПЧ-инфекции онкогенными типами.
РШ матки в РФ на первом месте в структуре смертности от злокачественных новообразований у женщин детородного возраста
В РФ в 2014 году этот показатель составил 20 человек на 100 000 (прирост на четверть по сравнению с 2004 годом).
Ежегодно в России регистрируется около 30 000 новых случаев ВПЧ – ассоциированных раков и более 1 000 000 случаев АБ (аногенитальных бородавок)
Показатели заболеваемости РШМ в РФ характеризуются тенденцией к росту и омоложению. Сегодня РШМ можно встретить у женщин в возрасте от 20 до 30 лет
Высокая доля запущенных случаев РШМ (3-4 ст — = 35%)
Высокий показатель смертности и одногодичной летальности (15,2%)
По данным ВОЗ в мире — более 270 000 женщин умирает ежегодно, но данные по разным странам сильно разнятся (в РФ — 8 человек на 100 000, прирост смертности за 10 лет — 7%).
ДИСПЛАЗИЯ ШЕЙКИ МАТКИ – ЭТО ПРЕДРАКОВЫЙ ПРОЦЕСС, ХАРАКТЕРИЗУЮЩИЙСЯ НАРУШЕНИЕМ СОЗРЕВАНИЯ МНОГОСЛОЙНОГО ПЛОСКОГО ЭПИТЕЛИЯ В РЕЗУЛЬТАТЕ ДЛИТЕЛЬНОЙ ПЕРСИСТЕНЦИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА.
Синонимы: цервикальная интраэпителиальная неоплазия (CIN), плоскоклеточное интраэпителиальное поражение (SIL).
Если коротко, дисплазия шейки матки — это заболевание, которое в будущем может привести к раку. Вероятность этого тем выше, чем выше степень дисплазии. К дисплазии 1 степени (CIN 1, LSIL) относят любые изменения эпителия, порой даже минимальные и субъективные. Это позволяет взять женщину под контроль и не допустить прогрессирования процесса. На практике, для диагностики дисплазии 1 степени достаточно поражение эпителиальных клеток вирусом папилломы человека. Опасаться этого не стоит! Легкая степень дисплазии самостоятельно проходит у 70% женщин в течение нескольких лет. За это время собственная иммунная система уничтожает вирус и заболевание регрессирует. Обычно дисплазия 1 степени требует только наблюдения, в части случаев может назначаться прижигание. Дисплазия 2 и 3 степени (CIN 2-3, HSIL) — это уже предопухолевый процесс с высоким риском, поэтому требует серьезного лечения. В таких случаях показана широкая эксцизия или конизация шейки матки. Диагностировать дисплазию эпителия можно с помощью мазка на цитологию или биопсии. В принятии решения и тактике лечения важную роль играет тест на ВПЧ.
Подробнее читайте ниже, а также посмотрите комментарии, там Вы найдете ответы на свои вопросы.
Основной причиной развития дисплазии шейки матки является вирус папилломы человека, а именно его онкогенные штаммы — 14 серотипов, среди которых наиболее важными являются 16 и 18. Зрелый многослойный плоский эпителий, покрывая наружную часть шейки, создает непреодолимую преграду для вируса. Единственным же уязвимым местом является граница с железистым эпителием у наружного зева, называемая зоной трансформации . При эрозии (эктопии) шейки матки зона трансформации смещается на наружную часть шейки матки, что создает предпосылки для инфицирования.
Более 80% случаев дисплазии и рака шейки матки развивается именно в зоне трансформации.
Большинство женщин переносит ВПЧ-инфекцию без каких либо изменений со стороны организма. В течение нескольких лет иммунная система самостоятельно избавляется от вируса. Однако 10% женщин не могут уничтожить вирус, который в свою очередь встраивается в ДНК эпителиальных клеток и модифицирует их, приводя к опухолевой трансформации. Это может быть связано как с индивидуальной предрасположенностью, так и с иммунодефицитом или длительными стрессами. Также известно, что курение способствует снижению специфического иммунитета против ВПЧ.
Дисплазия шейки матки — это качественное изменение клеток плоского эпителия, которое указывает на возможное начало опухолевой трансформации.
Различают несколько степеней дисплазии шейки матки по тяжести, что обычно выражается в числовых значениях от 1 до 3. Каждая степень отражает прогноз патологического процесса и позволяет выбрать соответствующий алгоритм лечения. Так, дисплазия 1 степени имеет низкий потенциал к малигнизации и в большинстве случаев самостоятельно регрессирует в течение нескольких лет без какого-либо вмешательства. В противоположность, дисплазия 3 степени в течение одного года обязательно трансформируется в рак и требует уже специализированного хирургического лечения.

Прогрессирование дисплазии шейки матки
В международной практике термин “дисплазия шейки матки” имеет различные синонимы. Наиболее широко распространена аббревиатура CIN – цервикальная интраэпителиальная неоплазия, что означает развитие неоплазии (новообразования) в пределах эпителиального пласта. В отличие от рака, CIN не обладает способностью к инвазивному росту и метастазированию. На этом этапе можно предотвратить развитие злокачественной опухоли.
1) LSIL (low grade squamous intraepithelial lesion) — плоскоклеточное интраэпителиальное поражение легкой степени. LSIL соответствует CIN 1 или дисплазии 1 степени.
| Pap class System 1954 | Классификация ВОЗ 1956 | Классификация Bethesda 1988 |
| Class | Дисплазия/CIN (ЦИН — цервикальная интраэпителиальная неоплазия) | SIL (плоскоклеточное интраэпителиальное поражение) |
| Class 3 | Дисплазия 1 степени/CIN 1 | LSIL — плоскоклеточное интраэпителиальное поражение легкой степени |
| Class 4 | Дисплазия 2 степени/CIN 2 | HSIL — плоскоклеточное интраэпителиальное поражение тяжелой степени |
| Дисплазия 3 степени/CIN 3 | ||
| Рак in situ (рак в пределах эпителиального пласта, без инвазивного роста) |

Первым методом в диагностике дисплазии шейки матки чаще всего является мазок на онкоцитологию . Это скрининговый метод для обследования большого количества женщин. Является самым простым и безопасным для женщины, однако не самым точным. Чувствительность метода составляет 60-70%, и только трехкратное исследование позволяет с высокой точностью определить или опровергнуть дисплазию эпителия. Кроме этого у молодых женщин часто бывают ложно-отрицательные результаты, когда дисплазия может быть пропущена; а у пожилых женщин часты ложно-положительные результаты, когда мазок показывает наличие дисплазии, в то время как более качественные методы ее исключают.
При определении LSIL в мазке необходимо только лишь активное наблюдение. Под этим диагнозом подразумеваются клеточные изменения с низким потенциалом опухолевой трансформации. К LSIL относятся различные дегенеративные изменения клеток при раздражении, воспалении или вирусном поражении. Гинеколог, получив такое заключение может порекомендовать проведение кольпоскопии с последующей точечной биопсией.
При наличии HSIL в мазке на цитологию проведение кольпоскопии с гистологическим подтверждением становится обязательным!
Кольпоскопия — это метод осмотра наружной поверхности шейки матки с помощью специального микроскопа. Кольпоскопия является достаточно субъективным методом диагностики, сильно зависящим от опыта и умения врача. Кольпоскопические картины дисплазии шейки матки размыты и очень часто ее можно спутать с банальными физиологическими процессами, такими как плоскоклеточная метаплазия, вирусным поражением или лейкоплакией. Несмотря на это, кольпоскопия позволяет определить подозрительные места на шейке матки и взять биопсию — участок ткани для дальнейшего гистологического исследования.
К кольпоскопическим признакам дисплазии относятся: ацетобелый эпителий, йод-негативные зоны, изъеденность или нерегулярность эпителиального покрова, атипичные сосуды, мозаика, пунктация, контактная кровоточивость и др. Гинеколог должен оценить не только степень, но и скорость наступления тканевой и сосудистой реакции при обработке уксусной кислотой или йодом.
Цель кольпоскопии — это определить анатомическую локализацию зоны трансформации, что имеет решающее значение для дальнейшей тактики диагностики и лечения.
Биопсия является “золотым” стандартом диагностики дисплазии и рака шейки матки. Гистологическое исследование позволяет определить качество плоского эпителия и степень его созревания. Биопсия может быть точечной, получаемой с помощью специального инструмента — конхотома, или широкой (эксцизионной), получаемой с помощью электропетли.
Изменения при дисплазии 1 степени обычно носят характер цитопатического действия вируса папилломы человека. В эту категорию так же относят остроконечную и плоскую кондиломы. Морфологические изменения при CIN 1 (LSIL) включают: нарушение стратификации плоского эпителия преимущественно в базальных отделах, нарушение поляризации клеток относительно базальной мембраны, единичные делящиеся клетки, незначительный дискариоз, а также признаки вирусного поражения — койлоцитарную атипию в поверхностных отделах эпителия, дискератоз, пара- и гиперкератоз эпителия.

Патологическая эпидермизация желез с CIN III
Морфологические изменения при CIN 2-3 (HSIL) носят уже неопластический характер, а цитопатическое действие вируса может проявляться слабо. Нарастает клеточная атипия, которая затрагивает весь пласт плоского эпителия с минимальными признаками созревания. Клетки активно делятся, замещая нормальный эпителий цервикальных желез, в ряде случаев пролиферирующий плоский эпителий может замещать выстилку цервикального канала. Характерно обилие как нормальных, так и патологических митозов.
Тяжелая дисплазия шейки матки отличается от рака отсутствием инвазивного роста.
Тест на ВПЧ помогает в диагностике дисплазии шейки матки и выборе тактики лечения в сложных ситуациях.
ВПЧ тест рекомендуется делать женщинам после 25 лет, поскольку имеется большая вероятность, что инфекция уже длительное время персистирует в организме и могла вызвать какие-либо изменения в шейке. В более молодом возрасте при нормальном мазке на цитологию ВПЧ-тистирование не дает полезной информации.
С возрастом ВПЧ-тестирование приобретает все большую значимость. К примеру, при наличии 16 или 18 штаммов ВПЧ у 50 летней женщины можно с высокой вероятностью утверждать, что у нее уже имеется тяжелое интраэпителиальное поражение эпителия. Мазок на цитологию менее эффективен в данном случае. Женщине тот час может рекомендоваться диагностическая биопсия и выскабливание цервикального канала.
Тактика лечения и ведения пациенток с дисплазией зависит от гистологического заключения, кольпоскопической картины, типа зоны трансформации, возраста и планирования беременности. Основными методами являются абляция (прижигание), или эксцизия (удаление тканей). Эти методы могут проводиться с помощью различных инструментов, использующих низкие или высокие температуры, электро-, лазеро- или радиоволновую энергию.
По западным протоколам LSIL необходимо динамически наблюдать. Так как LSIL обладает низким злокачественным потенциалом и часто регрессирует самостоятельно, женщине рекомендуется проходить цитологическое исследование не менее 2 раз в год. В отечественной медицине часто рекомендуют абляцию (прижигание), хотя это не всегда оправдано. С прижиганием связывают некоторое повышение риска невынашивания беременности. Однако, часть авторов, опровергает это.
Наиболее оптимальным является радиоволновая абляция Сургитроном. Патологический эпителий и подлежащая строма выпариваются радиоволнами, после чего пораженная зона эпителизируется заново. Минусом абляции является отсутствие материала для последующего гистологического исследования, плюсом — сохранение анатомического строения шейки матки и небольшое количество осложнений.
HSIL обладает высоким злокачественным потенциалом, поэтому в данном случае показано удаление патологически изменненых тканей. Обычно, рекомендуется широкая эксцизионная биопсия или конизация шейки матки — это конусообразное удаление тканей, включающая наружную часть шейки матки и ткани вокруг цервикального канала. Весь удаленный материал отправляется на гистологическое исследование для подтверждения и уточнения диагноза. В удаленном материале гистолог оценивает края резекции, так как важно, чтобы патологический эпителий был удален в пределах здоровых тканей. При наличии в краях резекции патологии, или глубоком поражении цервикального канала, а также наличии инвазивного роста может быть принято решение об ампутации шейки матки.
Изредка, если женщина молода и планирует беременность, допускается лечение HSIL абляцией. Это возможно только лишь в случае 1 или 2 типа зоны трансформации при кольпоскопии, когда гинеколог видит глазом все измененные ткани и может обеспечить полную их абляцию. Если зона трансформации смещена глубоко в цервикальный канал — показана только глубокая конизация или ампутация шейки матки.
Читайте также:






