Цитомегаловирусная инфекция в акушерств

Цитомегаловирусная инфекция (ЦМВИ) – широко распространенная оппортунистическая инфекция. В большинстве случаев ЦМВИ протекает бессимптомно. Клинические ее проявления возможны только у пациентов в условиях иммунодефицита, в частности – при иммуносупрессии беременных.
ЦМВИ – наиболее распространенная врожденная инфекция и ведущая инфекционная причина умственной отсталости и нейросенсорной тугоухости. Частота врожденной ЦМВИ составляет от 0,3 до 2,4 % от всех родившихся живыми, в среднем 1 % в популяции. Интранатальное и постнатальное инфицирование в течение первых 6 мес. жизни встречается еще у 1 -15 % от всех новорожденных.
Большинство людей заражаются CMV на каком-либо этапе своей жизни. Из-за низкой концентрации вируса в выделениях и лабильности возбудителя CMV не отличается высокой контагиозностью, для его передачи требуется близкий или интимный контакт между людьми с инфицированными секретами. Считается, что в 43-53 % случаев источником CMV для взрослых являются инфицированные дети, которые в течение многих лет выделяют вирус с мочой и слюной.
Попав в организм человека, CMV сохраняется на протяжении всей его жизни. Время от времени у инфицированного человека происходит реактивация CMV. В большинстве случаев реактивация у взрослых людей с нормальным состояние иммунной системы происходит бессимптомно.
При активных фазах инфекции вирус обнаруживается практически во всех биологических жидкостях: в слюне, слезах, моче, мокроте, крови, отделяемом из влагалища и шейки матки, в уретре, сперме, секрете простаты фекалиях, ликворе (при поражении ЦНС), грудном молоке, бронхо-альвеолярных смывах.
Работами американских и отечественных исследователей показано, что CMV выявляется у 3,5-20,0 % практически здоровых женщин в цервикальном канале, примерно у 30,0 % здоровых мужчин – в сперме. По данным инфицированность шейки матки беременных и небеременных женщин CMV составляет 8,6 % и 10,8 %, мочи – 3,9-2,6 %, зева – 1,8 % у беременных. В генитальных мазках женщин репродуктивного возраста г. Хабаровска ДНК CMV определяли в 0,8-6,2 % случаев. На популяционном уровне в любом возрастном периоде жизни не менее 10 % от числа обследуемых лиц выделяют CMV.
Уровень серопозитивности (частота обнаружения IgG к CMV) зависит от возраста, социального статуса, условий проживания, сексуальной активности. Серопозитивность беременных женщин в Москве составляет -78,8%. Этот показатель несколько выше, чем в развитых странах (США – 70 %, Норвегия – 58,5- 72,1 %, Япония – 69,1 %), но ниже, чем в развивающихся (Китай-98,7 %, Нигерия- 91,1 %, Турция- 97,3 %). В Хабаровске серопозитивны к CMV 97,2 % беременных и небеременных женщин репродуктивного возраста.
Передача CMV от матери плоду и ребенку может происходить антенатально, интранатально и постнатально. При антенатальном инфицировании в большинстве случаев имеет место трансплацентарный путь передачи CMV. При интранатальном инфицировании вирус поступает в организм ребенка за счет аспирации или заглатывания инфицированных околоплодных вод или инфицированных секретов родовых путей матери.
Постнатальное заражение (через грудное молоко) связано с тем, что у серопозитивных женщин в 30 % наблюдений CMV выявляется в грудном молоке. Если антенатальная передача CMV связана с риском развития поражения плода, то интранатальное и постнатальное инфицирование не несет с собой угрозы жизни и здоровья новорожденных вследствие достаточного количества противовирусных антител, переданных матерью, за исключением недоношенных детей и детей с различными иммунодефицитными состояниями.
У абсолютного большинства внутриутробно инфицированных новорожденных ЦМВИ протекает бессимптомно. Клинические проявления при рождении имеются только у 5-10 % внутриутробно инфицированных детей, чаще всего это петехии, задержка роста, желтуха, микроцефалия, гепатоспленомегалия, перивентрикулярная кальцификация головного мозга, хориоретинит, тромбоцитопения, анемия. 20-30 % из них умирает от ДВС-синдрома, нарушения функции печени или бактериальной суперинфекции. Остальные 90-95 % детей развиваются нормально. Но у 5-10 % из них впоследствии отмечаются неврологические расстройства, чаще всего нейросенсорная тугоухость, задержка психомоторного развития, хориоретинит.
Лабораторную диагностику ЦМВИ необходимо проводить в случаях, когда беременная женщина перенесла гриппоподобное заболевание или заболевание, сходное с инфекционным мононуклеозом (длительная субфебрильная температура, ознобы, слабость, быстрая утомляемость, головная боль, миалгия, кашель, боли в горле, тошнота, диарея, шейная лимфоаденопатия, редко – гепатит, пневмония, сыпь), а также при появлении подозрительных эхо-графических данных (СЗРП, вентрикуломегалия, асцит, внутричерепные кальцификаты, маловодие или многоводие, микроцефалия, гидроцефалия, гиперэхогенный кишечник, плеврит, водянка плода, увеличение печени). Лабораторные тесты выявляют атипичный лимфоцитоз или лимфопению, тромбоцитопению, повышение уровня трансаминаз. Решающим в диагностике ЦМВИ являются вирусологические и серологические лабораторные исследования.
Рутинный скрининг, т. е. выявление антител к CMV у всех беременных женщин, обратившихся в женскую консультацию, в настоящее время не проводится. Но скрининг можно рекомендовать первобеременным на этапе прегравидарной подготовки и серонегативным беременным женщинам. Основной риск заболевания ребенка при рождении и более поздних последствий связан с первичной инфекцией у матери, при рецидивирующей инфекции у матери – риск неонатальной цитомегалии невысок.
Лабораторная диагностика ЦМВИ у беременных женщин позволяет дифференцировать: отсутствие инфекции, первичную инфекцию, латентную инфекцию, реактивацию латентной (возвратной) инфекции.
- Не инфицированная беременная женщина, у которой нет ни клинических, ни лабораторных маркеров инфекции представляет группу риска, так как она может быть инфицирована во время беременности. Необходимо информировать эту женщину о главных источниках инфекции (половое сношение, тесный контакт со слюной и мочой инфицированных детей при уходе за ними дома или на работе), о риске заражения, о гигиенических мероприятиях после смены пеленок или прикосновения к игрушкам, об отказе от поцелуев в губы детей грудного возраста, которые могут выделять вирус. Рекомендуются повторные исследования в период беременности раз в 3 месяца для обнаружения опасной для плода первичной инфекции.
- Первичная инфекция у беременной женщины развивается в случаях заражения вирусом, если женщина не была инфицирована ранее. В большинстве случаев клинические проявления отсутствуют. Вероятность инфицирования плода при первичной инфекции – 24-75 %, в среднем 40 %. При этом у 5-18 % инфицированных новорожденных отмечается клинически выраженная врожденная инфекция с тяжелым течением. Среди выживших детей в большинстве случаев в дальнейшем сохраняются осложнения, приводящие к инвалидизации. В г. Хабаровске вероятность первичной ЦМВИ у беременной женщины с высоким риском передачи плоду невысока, поскольку 97-98 % женщин инфицированы цитомегаловирусом до беременности.
Инкубационный период при первичной инфекции составляет 2-12 недель. Процесс размножения вируса медленно нарастает, продолжительность активной фазы первичной инфекции – 2-8 мес. Только при первичной инфекции определяются низкоавидные анти-CMV IgG (индекс авидности, ИА 60-70 %) на 16-18 неделе – хороший показатель прошлой инфекции.
Тест на авидность антител в настоящее время является наиболее надежной процедурой для выявления первичной ЦМВИ у беременных женщин, тест на авидность высокоспецифичен (100 %) и высокочувствителен (94,3 %).
Другие маркеры первичной ЦМВИ: сероконверсия – появление de-novo анти-CMV IgG в ранее негативных сыворотках, 4-кратный и выше прирост анти – CMV IgG в парных сыворотках крови, анти-CMV IgM и IgG к IEA – к предранним белкам, анти-CMV IgM к L-структурным белкам. Тест на ДНК CMV в крови, в моче или цервикальном секрете (Kimberlin D.W., Jill Batey M.D.), может быть или не быть обнаружен при первичной инфекции и не коррелирует ни с клиническим течением, ни с риском внутриутробной передачи, ни с тяжестью состояния новорожденного.
В случае доказанного первичного инфицирования беременной должен ставиться вопрос о прерывании беременности по показаниям, полученным при наблюдении женщины: необычные данные УЗИ, контроль маркеров беременности (ХГЧ, АФП, ТБГ), угроза выкидыша.
УЗИ – осмотры и ультрасонографические исследования должны проводиться каждые 2-4 недели для выявления аномалий, что может помочь в определении прогноза для плода. Наиболее частые эхографические находки: задержка роста плода, церебральная вентрикуломегалия, асцит, внутричерепные кальцификаты, маловодие, многоводие, микроцефалия, гиперэхогенный кишечник, водянка плода, плеврит, увеличение печени. Родители должны быть проинформированы о риске. Отсутствие эхографических находок не гарантирует нормальный результат.
Женщинам с доказанной первичной ЦМВИ по данным проводят амниоцентез с тестированием амниотической жидкости количественным методом ПЦР. Выявление >103 GE/мл с вероятностью 100 % свидетельствует о врожденной инфекции с клиническими симптомами. Значение
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
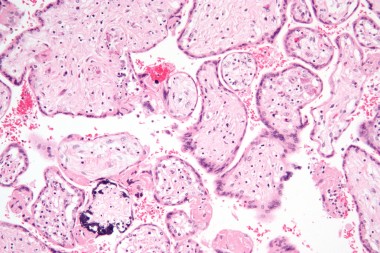
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ.
Цитомегаловирус (ЦМВ) является возбудителем распространенной инфекции, протекающей как правило бессимптомно и способной при определенных условиях к эпидемическому распространению. Особое внимание отводится ЦМВ-инфекции потому, что она может являться причиной невынашивания, акушерской патологии, эмбрио- и фетопатии, внутриутробной перинатальной инфекции и бесплодия. ЦМВ отнесен к семейству герпесвирусов. В мире зарегистристрировано 3 штамма, от одного человека иногда можно выделить все 3 (6).
ЦМВ не устойчив во внешней среде, быстро инактивируется, он имеет вирион сферической двадцатигранной формы. Размер вириона 150-300 нм, плотность 1,27, он содержит 705 белков. ЦМВ состоит из четырех структурных элементов, из непрозрачной для электронов сердцевины, окружающего ее капсида, ассиметрично расположенного вокруг капсида плотного материала и наружной мембраны(6).
Наиболее интенсивно ЦМВ размножается в культурах фибробластов и действует цитопатически с образованием гигантских клеток с типичными внутриядерными и цитоплазматическими включениями, от которых вирус и получил свое название(21).
Согласно последним эпидемиологическим данным, большинство (70%) людей инфицированы цитомегаловирусом. При этом частота развития инфекции варьирует от 40 до 80%. При чем среди беременных эта цифра достигает 89-99% (21,31).
Источниками инфекции могут быть носители ЦМВ или больные. Вирус передается через биологические жидкости и выделения, кровь. мочу, фекалии , сперму, отделяемре цервикального канала, влагалища, спиномозговую жидкость. Пути передачи разнообразны, заражение происходит легко. Наиболее вероятный путь передачи это контактный, когда инфекция передается через поврежденные кожные покровы и слизистые оболочки. Возможна его передача при половом контакте, но поскольку он имеет особый тропизм к слюнным железам, не исключена передача вируса при поцелуях, поэтому ЦМВ инфекцию называют “болезнью поцелуев” (21).
Переход возбудителя от матери к плоду происходит вертикальным путем. Этот путь наиболее вероятен для передачи внутриутробной инфекции. Развитие этого процесс возможно в течение всей беременности, однако, в раннем сроке гестации является прогностически более неблагоприятным. Наиболее вероятные пути инфицирования половой и через грудное молоко(10,21).
На распространение ЦМВ влияют не только возраст человека, но и социальный статус, состояние иммунной системы.
Входными воротами инфекции являются слизистые оболочки ротовой полости, половых путей. Наиболее вероятной считается локализация вируса в слюнных железах, куда вирус попадает гематогенно в результате виремии, где может длительно персистировать. В каждой пораженной клетке может находиться до 10000 вирусных частиц. Находящиеся в лимфоцитах вирусы устойчивы к действию специфических антител, что обусловливает латентное течение ЦМВ инфекции. В случае реактивации развивается виремия и происходит гематогенная генерализация процесса в плоть до генерализации процесса.
В случае трансплацентарного пути передачи, вирус нарушает плацентарный барьер, проникает в межворсинчатое пространство, оттуда в кровоток плода и диссеменируется в органах и тканях плода. Возможно развитие инфицирования околоплодных вод. В этом случае возможно развитие инфицирования плода и при аспирации и при прохождении через инфицированные родовые пути(31).
Клиническая картина ЦМВ очень вариабельна, что зависит от пути инфицирования, состояния иммунной системы. У пациенток с нормальным состоянием иммунной системы первичное заражение ЦМВ протекает бессимптомно. Только у 5% при первичном инфицировании возникает острый процесс с характерным гриппоподобным состоянием, с увеличением шейных и подчелюстных лимфатических узлов. У пациентов с иммунодефицитом возможно развитие генерализованного процесса и септического состояния (21).
Генитальная цитомегаловирусная инфекция у женщин может характеризоваться развитием воспалительных реакций в виде вульвовагинита, кольпита, цервицита, эндометрита, сальпингоофорита, с возможным поражением подчелюстных, околоушных слюнных желез, шейных лимфатических узлов. Больных беспокоят выделения из половых путей и прямой кишки беловато-голубоватого цвета. При осмотре обращают на себя внимание уплотнения диаметром 1-2 мм располагающиеся на малых и больших половых губах. Слизистая как правило гиперемирована, отечна, покрыта беловато-голубоватым налетом, снимающимся шпателем (43,50).
Во время беременности ЦМВ инфекция может быть как первичной, так и в форме реактивации хронического процесса. Беременность, как правило, протекает с различными осложнениями, такими как неразвивающаяся беременность, невынашивание, недонашивание, фетоплацентарная недостаточность, синдром задержки развития плода, многоводие, преждевременная отслойка плаценты (21).
Мы не станем осттанавливаться на цитомегаловирусной инфекции плода и новорожденных, это проблема полно освещена в ряде статей и монографий (21 г.)
Учитывая оппотрунистический характер течения цитомегаловирусной инфекции, диагностика ее с помощью общеклинических методов доволно сложна. При сборе анамнеза обращает на себя внимание количество выкидышей и неразвивающихся беременностей, течение беременности патология родов и неонатального периода.
Вирусологический метод не является диагностически ценным в виду трудоемкости и длительности.
При цитологическом исследовании осадков слюны, мочи, молока и других секретов с окраской по Папаниколау в 50% случаев возможно обнаружение характерных клеток с цитомегаловирусным патоморфозом.
Серологический метод является наиболее чувствительным, его чувствительность равна 99%. Обязательное обследование беременных с определением титра иммуноглбулинов М и Д, не реже 1 раза в 1,5-2 месяца. Выявление иммуноглобулина М и нарастание титров имуноглобулина Д в парных сыворотках является неблагопрятным прогностическим признаком и требует обследования плода(18)
Молекулярно-биологические методы оличаются высокой точностью и чувствительностью. Метод позволяет выявить ЦМВ в любой клетке, если в ней есть хотя бы одна молекула вирусной ДНК.
В настоящее время для лечения ЦМВ-инфекции применяются следующие препараты,
Ганцикловир, который является синтетическим аналогом нуклеозида гуанина. Его назначают внутривенно по 5 мг/кг в течение 1 часа каждые 12 часов. Курс терапии составляет 10-21 день.
Фоскарнет , который является аналогом пирофосфата, действующий непосредственно на вирусную ДНК-полимеразу.
Возможно применение препаратов ацикловира при цитомегаловирусной инфекции. Препараты назначается по 200 мг, 5 рах в сутки, однако курс терапии должен быть более длительным.
Валтрекс применяется внутрь по 200 мг 2 раза в сутки, длительностью до 20 дней.
Нами накоплен опыт монотерапии цитомегаловирусной инфекции препаратом ПАНАВИР. Препарат назначался пациентам с клиническим и серологически верифицированным диагнозом ЦМВ инфекции, внутривенно струйно по 5 мл 0,04% раствора, 3 инъекции с интервалом 48 часов и 2 инъекции с интервалом 72 часа. Эффективность лечения определялась на основании снижения до диагностических титров иммуноглобулинов класс Д в сыворотке крови, отрицательным ПЦР тестом. Данный метод терапии можно рекомендовать пациенткам с ЦМВ скрытой инфекцией и вирусоносительством при подготовке и планировании беременности.
Поражение гениталий вирусом папилломы человека.
Генитальная папилломавирусная инфекция (ПВИ) является распространенным заболеванием, передаваемым половым путем. Ее частота колеблется, по данным разных авторов, от 5 до 87,9%, что зависит от региона проживания, социального статуса больной, наличия субклинических форм ПВИ и методов диагностики (7,11,25) В работах большинства авторов в течение последних лет доказано прямое участие вируса папилломы человека (ВПЧ) в развитии рака шейки матки (7,8,9). Рак шейки матки является актуальной проблемой онкогинекологии, занимая у женщин 2-е место по частоте возникновения после рака молочной железы. Рост онкопатологии шейки матки связан, по мнению многих авторов, прежде всего с ростом инфицирования вирусом папилломы человека среди молодых женщин. Многочисленные эпидемиологические исследования подтвердили причинную связь между папилломавирусной инфекцией и развитием цервикальных интраэпителиальных неоплазий шейки матки (11,13). Этиологическая значимость ВПЧ определяется необходимой частью для создания опрухолевого процесса.
ВПЧ- икосаэдрический, ДНК-содержащий вирус, относящийся к семейству паповавирусов с двухцепочечной ДНК.
Геном ВПЧ функционально делится на два основных фрагмента, поздний и ранний. Ранний фрагмент генома ВПЧ занимает около 70 % и осуществляет реализацию двух основных функций, репродукцию вируса и трансформацию клеток, пораженных ВПЧ. Вирусный геном существует в двух формах, эписомальной и интегрированной. Установлено, что в клетках ЦИН вирус находится в эписомальной форме, а в опухолевой ткани в интегрированной (5,50).
ВПЧ не содержит липидов и инактивируется растворителями жиров.
Основной мишенью для ВПЧ инфкции является эпителиальная выстилка аногенитального тракта. Вирус папилломы человека высоко контагиозен, его инкубационный период от 4 недель до 8 меяцев, а в среднем 3-4 месяца. Однако в ряде исследований указывается, что наличие вируса в организме может существовать и насколько лет, не вызывая плоскоклеточных повреждений и необходимы какие-либо инициирующие факторы для развития повреждения тканей(51).
Эпителиальные поражения на коже и слизистых высококонтагиозны, быстро передаются от человека к человеку, известны случаи метастазирования. Вирус папилломы размножается в глубоких слоях кожи и слизистой, но наиболее интенсивно идет процесс размножения в поверхностных слоях.
Клетки поверхностного слоя в процессе деления перемещаются к поверхности, затем перестают делиться становятся резервуаром для репликации вируса.
По даным Европейской ассоциации по генитальным инфекциям и неоплазии 10% случаев ПВИ спонтанно регрессируют в течение 3-4 месяцев. Однако, даже после исчезновения вируса могут сохраняться субклинические проявления инфекции, которые переходят в клиническую фазу у женщин с нарушением иммунитета (18,19).
ВПЧ способен персистировать в промежуточном слое многослойного плоского эпителия шейки матки достаточно долго, что дает большое количество рецидивов заболевания. Однако частое инфицирование и спонтанный регресс заболевания характерны для молодых пациенток и особенно для подростков. У женщин перименопаузального возраста ВПЧ, персистирует в организме годами и чаще вызывает неопластические процессы.
В настоящее время выделено около 100 типов вируса папилломы человека. 70 из них являются тропными к эпителию человека.
Остроконечные кондиломы гениталий чаще всего (95%) содержат ДНК ВПЧ 6 и/или 11 типа, однако могут иметься и 2, 16, 30, 40, 41, 42, 44, 45, 54, 55, 61 типа, диагностика этих поражений не вызывает особой трудности в виду выраженной клинической картины (25,26).
Наибольший интерес вызывают типы ВПЧ индуцирующие цервикальные интраэпителиальные неоплазии, чаще это 16. 18, 31, 33 типы, но при ПЦР исследовании выявляются 30,33, 34,40,42,43,44, 45,51,52,56,57,58,59.61,62,64,66,67,69. Возможна ассоциация различных типов вируса как между собой, так и с ВПЧ 6,11,26 и другими типами. Аногенитальный рак ( кроме рака шейки матки) ассоциирован с ВПЧ 6,16, 18, 11, 31,33, злокачественные перерождения остроконечных кондилом в опухоль Бушке-Левенштейна происходит очень редко и ассоциируется, как правило, с ВПЧ 6 и 11 типов. На основании данных исследований и большого клинического опыта все типы ВПЧ разделены на ВПЧ высокого онкологического риска, среднего и низкого онкологического риска. ВПЧ 6 и 11 типов относятся к низким онкотипам, 16, 18,31 и 33 типы являются высокоонкогенными, 42, 48,45 и другие относятся к ВПЧ среднего онкотипа.
Внедрение ВПЧ в организм требует непосредственного прямого контакта с вирусом. Обычный путь инфицирования при половом контакте от одного партнера к другому (51,75).
Папилломавирусы инфицируют незрелые, делящиеся клетки, их внедрение происходит через микротравмы, непосредственно в базальный клеточный слой или на границе эпителиев ( зона трансформации многослойного плоского эпителия и цилиндрического). Нет доказательств о барьерной роли презерватива. Возможно инфицирование происхотит при мануальном переносе вируса, с кожи мошонки на вульву и далее во влагалище и на шейку матки. По данным ряда авторов инфицирование вирусом папилломы человека происходит при первом половом контакте, что объясняет высокий процент инфицирования подростков, живущих половой жизнью (25).
Клинически ВПЧ инфекция проявляется в виде клинической, субклинической и латентной формах. По данным Неп1еу(1994 г.) клиническая форма инфекции характеризуется визуальными проявлениями в виде экзофитных и эндофитных кондилом, выделяются бородавки, локализующиеся на вульве, влагалище и шейке матки и симтоматические внутриэпителиальные неоплазии на ранних стадиях (гистологически койлоцитоз, дискератоз, при отсутствии неоплазии- плоские кондиломы)
Субклиническая форма определяется при расширенной кольпоскопи и и пробы с 3% уксусной кислотой, цитологическом исследовании и патоморфологическом исследовании прицельно взятых биоптатов. Она, как правило, является асимптоматической внутриэпителиальной неоплазией на ранних стадиях, характеризуется койлоцитозом, дискератозом при отсутствии признаков плоскоклеточного интраэпителиального повреждения.
Латентная ПВИ характеризуется отсутствием кинических, морфологических или цитологических отклонений при обнаружении ДНК ВПЧ с помощью молекулярно-биологических методов.
По данным Г.Н.Минкиной (1999), остроконечные кондиломы встречаются в 1-5% инфицирования ВПЧ, значительная часть приходится на субклиническую и латентную формы инфекции (25).
За последнее десятилетие установлено, что ВПЧ является критическим фактором развития цервикальных интраэпителиальных неоплазий и рака шейки матки. Однако длительная персистенция вируса, его спонтанное регрессирование и низкий уровень прогресии ЦИН в рак дает возможность предположить, что вирус папилломы человека является необходимым, но не достаточным фактором в акте канцерогенеза. Основными кофакторами, для прогресса заболевания являются, как эндогенные, так и внешние иннициирующие факторы (36,41).
Кофакторами в развитии заболевания являются нарушения клеточного и гуморального иммунитета. Клеточный иммунитет играет критическую роль в развитии ВПЧ инфекции. Известно, что пациенты с нарушенным клеточным иммунитетом имеют более высокий уровень ВПЧ, индуцирующий как доброкачественные, так и злокачественные опухоли. Первичными представителями иммунной реакции в ответ на ПВИ являются клетки Лангенгарса, кератиноциты и интраэпителиальные лимфоциты. Все эти компоненты находятся в эпидермисе и цервикальном эпителии, однако их взаимодействие может быть нарушено.
Установлено, что цитотоксическая реакция Т-лимфоцитов на онкоиндуцирующие протеины более часто выявляется у пациенток с ВПЧ без неоплазии. Это подтверждает роль реакции клеточного иммунитета на предотвращение развития заболевания (9,25.41,42,47).
Не исключается и роль генетической предрасположенности к клеточным иммунным реакциям и степени экспрессии цитокинов.
Помимо системы клеточного иммунитета в патофизиологию ВПЧ-инфекции вовлечен и гуморальный иммунитет, так как обнаружены антитела против вирусных протеинов. При хронической инфекции определяется повышенный уровень антител. Установлено, что значительная часть антител продуцируется интравагинально(52,43).
Нами проводилось изучение местного иммунитета при папилломавирусных поражениях шейки матки, выявлено значительное снижение секреторного иммуноглобулина А в цервикальном секрете у пациенток с различными степенями распространения ВПЧ (26).
Определенную роль играют факторы неспецифической защиты (цитокины) интерлейкин-2 и гамма интерферон являются иммуностимуляторами и способны ограничивать опухолевой рост, а цитокины интерлейкин 4 и интерлейкин 10 являются ингибиторами имунитета и соответственно могут стимулировать опухолевой рост (30).
Нами проведен анализ содержания ИЛ-1 и ФНО ( фактора некроза опухоли) в сыворотке крови больных с поражением шейки матки вирусом папилломы человека. Отмечено достоверное увеличение как ИЛ-1, так и ФНО в зависимости от распространенности процесса на шейке матки и степени плоскоклеточного интраэпителиального повреждения (26).
Основными противовирусными цитокинами являются интерфероны. Они проявляют антипролиферативную и иммуномодулирующие функции. Интерфероны индуцируют апоптоз (запрграмированную гибель клеток) и играют роль в ограничении распространения вируса и повышении антивирусного статуса инфицированных клеток.
Другим инициирующим фактором прогресса канцерогенеза является коинфицирование другими сексуально-трансмиссивными заболеваниями. Нами проведен анализ инфицирования ИППП среди женщин с поражением шейки матик вирусом папилломы человека.
На основании ПЦР диагностики, иммуноферментного анализа и ДНК исследования нами проведен сравнительный анализ с пациентками без поражений шейки матки вирусом папилломы человека (2,11,20,48).
Нами проведен анализ выявления сексуально-трансмиссивных заболеваний у женщин с папилломаирусными поражениями гениталий по сравнению с пациентками не имеющими патологии шейки матки и являющихся отрицательными на ДНК ВПЧ. Данные представлены в таблице (15,26).
Таблица 1. Заболеваемость ИППП среди пациенток с ВПЧ и без ВПЧ.
Читайте также:
- Бецкой а дисбактериоз профилактика и лечение
- Государственная программа профилактики инфекционных заболеваний
- Геморрагическая лихорадка меры предосторожности
- Торч инфекции в хеликсе
- Анализ на паразитарные инфекции в инвитро


