Давление насыщенных паров над мениском
Для определения зависимости давления насыщенных паров жидкости от кривизны поверхности рассмотрим следующий мысленный опыт. Пусть под непроницаемым для газа колоколом в достаточно широком сосуде А (рис. 5.26, а) находятся жидкость и ее насыщенный пар. Давление и плотность пара

под колоколом на различных высотах не одинаковы, они уменьшаются с увеличением высоты. Нижний слой пара у самой поверхности жидкости в сосуде А находится в равновесии с ней и обладает давлением и плотностью насыщенного пара; по мере увеличения высоты давление и плотность пара соответственно уменьшаются. Обозначим упругость пара над плоской поверхностью на уровне жидкости в сосуде А через р«,, а на высоте h—через р/г Тогда в соответствии с барометрической формулой
Отсюда при Л = 0 р«,—ph = 0, при /г>0 р„—р/;>0. Для малых значений h разность р„ — рЛ незначительна. Поместим под колокол еще один более высокий и также достаточно широкий сосуд В с жидкостью. В этом сосуде непосредственно у поверхности жидкости пар является насыщенным, и его давление также равно рх. Но на этом же уровне вне сосуда В оно ниже. Таким образом, на высоте h над сосудом Л и на этом же уровне у поверхности сосуда В пар находится при различных давлениях и, следовательно, не может быть в равновесии: он начнет перемещаться от большего давления к меньшему, как показано на рис. 5.26, а стрелкой. В результате жидкость в сосуде В будет испаряться, избыток пара переходит в область меньшего давления и конденсируется в сосуде А. После того как уровни в обоих сосудах сравняются, наступит равновесие, перемещение пара прекратится. Итак, независимо от того, соединены ли между собой сосуды А и В трубкой и образуют сообщающиеся сосуды или имеют общую атмосферу насыщенного пара, для равновесия необходимо, чтобы в них сохранялся одинаковый уровень жидкости.
Пусть в аналогичном опыте сосуд В заменен капиллярной трубкой, опущенной одним концом в жидкость, которая полностью смачивает стенки трубки (рис. 5.26,6). Тогда в соответствии с законами капиллярного движения жидкость поднимется в капилляре на высоту h = 2a/rgp. (В случае полусферической поверхности радиус кривизны поверхности мениска Rc равен радиусу капилляра г.) Согласно барометрической формуле, на этой же высоте давление насыщенного пара над плоской поверхностью
Опыт показывает, что давление рк пара на высоте h равно давлению рг над вогнутой поверхностью мениска на той же высоте, т. е. на уровне жидкости в капилляре давление такое же, как и на той же высоте вне трубки. В противном случае не было бы равновесия и жидкость испарялась бы из капилляра и конденсировалась в широком сосуде. При этом давление Лапласа стремилось бы восстановить первоначальную разность уровней и наблюдалось бы непрерывное движение жидкости вверх по капилляру и вечное движение пара с уровня В на уровень А. Но такое вечное движение противоречит закону сохранения энергии.
Решая уравнения (5.17) и (5.20) совместно, получим выражение для давления рг пара над вогнутой поверхностью мениска на высоте h:
Если в аналогичном опыте капилляр опущен одним концом в жидкость, которая не смачивает его стенки, то мениск будет выпуклый в сторону пара. В этом случае путем аналогичных рассуждений для давления пара над выпуклым мениском получим выражение
Р, = Рсоехр(-^М (5.23)
V rpRT ]
In -В*- = (5.24)
Таким образом, давление насыщенного пара над вогнутой поверхностью меньше, а над выпуклой — больше, чем над плоской. Полученные выше выражения (5.21) — (5.24) применимы к шарообразным каплям: чем меньше радиус капли, тем больше давление пара над ее поверхностью превышает давление над плоской по-jBepxHOCTbio. Отсюда следует, что две капли различных размеров в закрытом сосуде не могут находиться в равновесии между собой, поскольку упругость пара над меньшей каплей выше, чем над большей. Поэтому пар начнет перемещаться от меньшей капли к большей, что будет сопровождаться растворением первой и ростом второй. Равновесие наступит лишь тогда, когда большая капля полностью поглотит меньшую.
Зависимостью давления насыщенных паров жидкости от кривизны поверхности объясняется ряд общеизвестных явлений. Капиллярно-пористые материалы (бетон, кирпич, дерево, древесный уголь и др.) прочно удерживают некоторое количество воды капиллярными силами. Даже в сухом состоянии они содержат до 10% капиллярной воды. Объясняется это тем, что в воздухе всегда имеется водяной пар, который в обычных условиях не насыщен. Однако над вогнутыми поверхностями этот же пар является насыщенным или даже пересыщенным. Поэтому для смачивающих поверхностей (упомянутые материалы обладают этим свойством) мениски в порах вогнуты и па них происходит конденсация влаги из воздуха. Испарение при этом затруднено, так как для таких поверхностей содержащийся в воздухе пар может быть насыщенным или даже пересыщенным.
5.11. Адсорбция
Концентрация (сгущение) одного из веществ (компонентов) на поверхности раздела двух фаз называется адсорбцией. Она может происходить из газов, жидкостей или путем адсорбирования растворенного вещества из раствора. Адсорбируемое вещество может концентрироваться на поверхности раздела твердое тело—газ, твердое тело — жидкость, жидкость —• жидкость и жидкость— газ. Тело, на поверхности которого адсорбируются молекулы другого вещества, называется адсорбентом, а концентрирующееся на границе раздела — адсорбтивом или адсорбатом. Явление, при котором вещество не только не накапливается на поверхности, но, наоборот, переходит с поверхностного слоя в объем, называют отрицательной адсорбцией.
Поверхностное натяжение жидкости зависит не только от температуры и других параметров состояния, но и от наличия в ней растворимых примесей. Так, например, поверхностное натяжение воды а существенно понижается при растворении в ней|поверх-ностно-активных веществ (многих спиртов, жирных кислот и их солей). Объясняется это тем, что при наличии поверхностно-активных веществ минимальное значение свободной энергии Fmin — = aS„ поверхностного слоя достигается за счет уменьшения а, поскольку 5П сохраняется при этом постоянной. Чтобы это условие выполнялось, поверхностно-активное вещество не должно равномерно распределяться по всему объему раствора, а концентрироваться на его поверхности, обеспечивая тем самым понижение а. Если же растворимое вещество способно увеличивать поверхностное натяжение жидкости, то система, стремясь уменьшить свободную энергию поверхности, заставит его уйти внутрь жидкости, обеспечивая тем самым минимальное увеличение а. Эти явления можно объяснить взаимодействием между молекулами. В самом деле, если силы взаимодействия Faa между молекулами АА поверхностно-активного вещества слабее, чем Fbb между молекулами ВВ растворителя (т. е. / г да Fbb, и, следовательно, Fab>Fbb-
При адсорбции молекулы газа сталкиваются с поверхностью адсорбента и прекращают поступательное движение; при этом избыток энергии выделяется в виде теплоты. Опыты показали, что теплота адсорбции совпадает с энергией дисперсионных сил, вычисленных теоретически. Если адсорбция происходит под действием сил Ван-дер-Ваальса (ориеитационных, индукционных и дисперсионных) и характеризуется сравнительно низкой энергией связи, то ее обычно называют физической или ван-дер-ваальсо-вой. Когда поглощение вещества сопровождается образованием на поверхности химических соединений, то адсорбция называется химической или хемосорбцией. Примером хемосорбции является адсорбция кислорода поверхностями металлов.
Адсорбционное равновесие определяется конкуренцией двух процессов: молекулярным притяжением, стремящимся концентрировать частицы определенного сорта на поверхности, и тепловым движением, стремящимся равномерно распределить их по всему объему. Количественно адсорбция характеризуется массой или числом молей вещества, находящихся на единице поверхности раздела фаз. Единицы измерения адсорбции: моль/см 2 , г/см 2 , см 3 см 2 и др.
Характерной особенностью адсорбционных взаимодействий является то, что каждая адсорбирующаяся молекула взаимодействует не содним центром на поверхности адсорбента (ионом, атомом, молекулой), а со многими соседними центрами. Поэтому суммарное взаимодействие молекулы адсорбата всегда больше, чем с одним центром адсорбента, тогда как, например, суммарное электростатическое взаимодействие может быть и меньше электрического взаимодействия с одним центром адсорбента.
При наличии пористости или дефектов строения твердой подложки вследствие поверхностей подвижности молекул (двумерной миграции) адсорбция распространяется и наобъемную часть тела. Процесс поглощения вещества объемом фазы называется абсорбцией. Понятие сорбции включает как поглощение паров, газов или растворимых веществ поверхностью — адсорбцию, так иобъемное поглощение вещества — абсорбцию. Явление, обратное процессу сорбции, т. е. отделение от поверхности поглощенного ею вещества, называется десорбцией.
Адсорбция может происходить не только на свободной поверхности жидкости или твердого тела, но и на границе соприкосновения двух жидких или кристаллических фаз. Главным условием адсорбции является понижение поверхностного натяжения па фазовой границе. Это явление нашло широкое применение в красильном производстве, биологических и других процессах, а также для очистки, например, воды от растворенных в ней примесей. Известно, что многие растворимые вещества хорошо адсорбируются на поверхности угля. Поэтому воду фильтруют через мелко раздробленный уголь, при этом она очищается не только в результате механического задерживания взвешенных в ней частиц, по и благодаря адсорбции растворенных в пей примесей.
П. А. Ребипдер обнаружил (1928) явление понижения твердости и прочности кристаллических и аморфных, сплошных и пористых тел в ад-сорбционно-активных средах, получившее название эффекта Ребиндера. Этот эффект проявляется при деформациях и разрушениях твердых тел с металлическим, ковалентным, ионным и молекулярным строением. Он нашел широкое применение для улучшения технологии обработки твердых материалов и увеличения долговечности машин и приборов. Природа этого явления обусловлена облегчением разрушения и перестройки межмолекулярных связей в присутствии инородных атомов или молекул, а следовательно, уменьшением работы образования новых поверхностей в процессе деформации. Изучение поверхностных явлений и реологии позволило также разработать эффективные методы дробления, перемешивания и формирования материалов.
Лекция 20
Испарение жидкости происходит с ее поверхности, поэтому изменение свойств поверхностного слоя должно изменять условие равновесия между жидкостью и паром над ней. В частности на условие равновесия и, следовательно, на давление насыщенного пара должна влиять кривизна поверхности жидкости.
При горизонтальной поверхности равновесие жидкости и насыщенного пара определяется только давлением насыщенного пара. Равновесие определяется силами, действующими на молекулу пара со стороны молекул жидкости. Величина этих сил зависит только от расстояния между молекулой пара и поверхностью жидкости (рис.1):
Рис.1. Силы, действующие на молекулу пара
Если поверхность жидкости вогнутая, то на молекулу, находящуюся на том же расстоянии над жидкостью будет действовать другая сила притяжения, потому что боковые поверхности жидкости находятся ближе к молекуле, чем в случае плоской поверхности. Равнодействующая молекулярных сил будет больше и она сильнее затягивает молекулу в жидкость, чем в случае плоской поверхности. Поэтому состояние динамического равновесия будет наблюдаться при меньшем давлении насыщенного пара, чем в случае плоской поверхности.
Если поверхность выпуклая, то силы, действующие на молекулу меньше, чем в случае плоской и вогнутой поверхности. Боковые части жидкости находятся на большем расстоянии от молекулы и действуют на нее слабее. Поэтому динамическое равновесие будет наблюдаться при большем давлении насыщенного пара, чем в случае плоской и вогнутой поверхностей.
Определим давление насыщенного пара над искривленной поверхностью жидкости. Пусть в закрытом сосуде с жидкостью находится капилляр, погруженный в жидкость. Жидкость смачивает капилляр (рис.2):
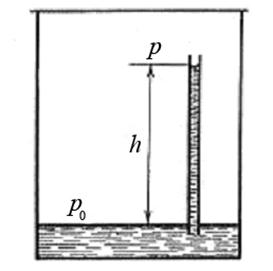
Рис.2. К выводу зависимости давления насыщенного пара от кривизны поверхности жидкости
С течением времени установится динамическое равновесие. Насыщенный пар будет находиться как над плоской поверхностью жидкости в сосуде, так и над вогнутой поверхностью жидкости в капилляре. Однако давление насыщенного пара изменяется с высотой согласно барометрической формуле:
Согласно (1) давление насыщенного пара p на высоте h над вогнутой поверхностью жидкости в капилляре будет меньше, чем давление p0 над плоской поверхностью жидкости в сосуде. Если жидкость не смачивает капилляр, то она опускается ниже уровня жидкости в сосуде на высоту h и давление над выпуклой поверхностью жидкости в капилляре будет больше чем p0.
Определим изменение давления. Из рис.2 и формулы (1):
Разложим экспоненту в ряд, ограничившись двумя первыми членами:
С учетом (4) перепишем (3) в виде:
Из уравнения Клапейрона-Менделеева:
где m/V = ρп – плотность насыщенного пара.
Учитывая (6) из (5) получим:
Известно, что высота поднятия жидкости в капилляре определяется формулой:
где R – радиус мениска, ρж – плотность жидкости. С учетом (8) из (7) получим:
Определим давление p из (2) и (9):
При несмачивании, когда поверхность жидкости выпуклая:
Из (10) и (11) следует, что давление насыщенного пара над вогнутой поверхностью жидкости меньше, а над выпуклой поверхностью больше, чем давление насыщенного пара над плоской поверхностью жидкости.
Величина давления при T = const, а, значит и плотность насыщенного пара над искривленной поверхностью жидкости зависит только от радиуса кривизны поверхности. Уравнения (10) и (11) справедливы для любой искривленной поверхности, как для капель жидкости – выпуклая поверхность, так и для пузырьков газа в жидкости – вогнутая поверхность.
Согласно (11) капли с разными радиусами не могут существовать в равновесии. Маленькие капли будут интенсивно испаряться (давление насыщенного пара больше), а на больших каплях жидкость будет конденсироваться (давление насыщенного пара меньше). Этот процесс будет продолжаться до тех пор, пока маленькие капли не исчезнут.
Аналогичные процессы происходят в облаках, где увеличение капель на центрах конденсации приводит к выпадению осадков.
Растворами называются физически однородные (гомогенные) смеси двух или нескольких веществ. Физическая однородность достигается равномерным перемешиванием молекул. Если одного вещества в растворе больше чем других оно называется растворителем. Подобно смеси газов раствор является однофазной системой.
В данной массе растворителя, при данной температуре может раствориться только определенное количество некоторого вещества. Полученный при этом раствор называется насыщенным, а максимальное количество растворенного вещества в единице объема растворителя называется растворимостью. Обычно растворимость увеличивается с повышением температуры, однако для некоторых веществ растворимость уменьшается с ростом температуры. Растворимость также зависит от свойств растворителя. Вода очень хороший растворитель, потому что молекулы воды полярные.
Растворы бывают слабые (разбавленные) – если число молекул растворенного вещества мало по сравнению с числом молекул растворителя. Растворы бывают крепкими. Очень крепкие растворы называются концентрированными. Самые простые растворы - бинарные – состоят из двух веществ: растворителя и растворенного вещества.
Относительное количество растворенного вещества характеризуется концентрацией раствора. Различают весовую, молярную и объемную концентрации.
Растворение обычно происходит с выделением или поглощением теплоты. В результате растворения молекулы растворенного вещества разделяются и сближаются с молекулами растворителя. Разделение молекул требует затрат энергии, а при сближении молекул энергия выделяется. Только в случае, когда энергия, необходимая для разделения молекул, равна энергии, выделившейся при сближении молекул тепловой эффект при растворении равен нулю.
Растворы с нулевым тепловым эффектом называются идеальными.
Количество теплоты, выделяющейся или поглощающейся при растворении 1 моля вещества, называется теплотой растворения.
Если теплота выделяется, то тепловой эффект положительный, если поглощается – отрицательный.
Например: нашатырь (NH4Cl) - -16,5 кДж/моль, едкий калий (KOH) - +54,2 кДж/моль. При смешивании поваренной соли со снегом или со льдом можно получить температуру до -21 о C.
В единице объема раствора находится меньше молекул растворителя, чем в чистом растворителе. Следовательно, давление насыщенного пара над раствором должно быть меньше, чем над чистым растворителем. Рауль показал, что для слабых растворов справедливо соотношение:
где p0 – давление насыщенного пара чистого растворителя, p - давление насыщенного пара раствора, n – число молекул (молей) растворенного вещества, N – число молекул (молей) растворителя.
Для слабых растворов n
| | | следующая лекция ==> | |
| Свойства жидкого состояния. Поверхностный слой. Поверхностное натяжение. Смачивание. Формула Лапласа. Капиллярные явления | | | Лекция 21 |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
- 14. Закономерности ионного обмена в коллоидных растворах. Ацидоиды. Роль pН в ионном обмене
- 15. Основные методы измерения поверхностного натяжения
- 16. Особенности ионного обмена в амфолитоидах, изоэлектрическое состояние амфолитоидов. Понятие об обменной емкости
- 17. Методы приготовления коллоидных растворов
- 18. Поверхность раздела между двумя конденсированными фазами. Правило Антонова. Межфазное натяжение
- 19. Капиллярное давление. Закон Лапласа
- 20. Закон Томсона. Капиллярная конденсация
- 21. Зависимость растворимости от кривизны поверхности дисперсных частиц (закон Гиббса-Оствальда-Фрейндлиха)
- 22. Смачивание. Закон Юнга (силовой и энергетический выводы)
- 23. Флотация
- 24. Определение краевого угла. Причины, затрудняющие это определение
- 25. Капиллярное поднятие жидкости, уравнение Жюрена
- 26. Поверхностные силы второго рода и расклинивающее давление. Линия трехфазного контакта (линия смачивания)
- 27. Использование ПАВ (вытеснение нефти, течение в невесомости и др.)
- 28. Разрушение и измельчение твердых тел как физико-химический процесс образования новой поверхности
- 29. Условие самопроизвольного распространения трещин. Влияние ПАВ на механические свойства твердых тел
- 30. Эффект Ребиндера. Основные особенности и формы проявления эффекта. Понижение прочности. Теория Гриффитса
- 31. Эффект Ребиндера: изменение прочности и пластичности как следствие снижения поверхностной энергии твердых тел
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка (С. В. Егоров, 2009) предоставлен нашим книжным партнёром — компанией ЛитРес.
20. Закон Томсона. Капиллярная конденсация
В пористых телах наряду с адсорбцией часто имеет место явление капиллярной конденсации. Под капиллярной конденсацией понимают конденсацию пара адсорбата при давлениях, которые меньше давления насыщенного пара. При адсорбции происходит образование тонкой пленки адсорбированного вещества на стенках пор, которые довольно хорошо смачиваются жидким сорбатом, в результате чего имеет место образование вогнутого мениска жидкости. Согласно закону Томсона давление пара, равновесное вогнутой поверхности, меньше упругости насыщенного пара. Следовательно, конденсация пара в порах над вогнутым мениском начинается при давлениях, которые меньше давления насыщенного пара. Изотерма адсорбции в случае капиллярной классификации принадлежит к одному из типов 2–5 по классификации Брунаура.
dW1 = [RT ln (p0 / p)] dm / M,
где М – молярная масса.
Однако при переносе данного количества вещества увеличивается радиус капли на величину dr и ее поверхность на величину ds, следовательно, происходит работа увеличения поверхности:
dW1 = [RT ln (p0 / p)] dm / M = —σds.
Преобразовав данное уравнение получим уравнение Томсона для выпуклой поверхности:
r = —2σ v / [RT ln p0 / p].
Уравнение Томсона для вогнутой поверхности имеет вид:
r = —2σv / [RT ln p / p0].
Уравнение Томсона находит широкое применение при исследовании пористой структуры сорбентов. Объем адсорбата, заполнившего пространство пор адсорбента при капиллярной конденсации при определенном давлении (при этом имеет место изотермический процесс) считается равным объему пор, имеющих определенный размер (радиус). Кривую распределения объемов пор по радиусам определяют по экспериментального построения десорбционной ветви изотермы адсорбции. Последняя имеет следующий вид:
а = f (p / ps), v = f(r), v = a / ρ, r = 2σ v / RT ln p / ps,
где p – давление пара над вогнутым мениском;
ps – давление насыщенного пара при данной температуре; r – плотность жидкости; a – величина адсорбции.
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
- 14. Закономерности ионного обмена в коллоидных растворах. Ацидоиды. Роль pН в ионном обмене
- 15. Основные методы измерения поверхностного натяжения
- 16. Особенности ионного обмена в амфолитоидах, изоэлектрическое состояние амфолитоидов. Понятие об обменной емкости
- 17. Методы приготовления коллоидных растворов
- 18. Поверхность раздела между двумя конденсированными фазами. Правило Антонова. Межфазное натяжение
- 19. Капиллярное давление. Закон Лапласа
- 20. Закон Томсона. Капиллярная конденсация
- 21. Зависимость растворимости от кривизны поверхности дисперсных частиц (закон Гиббса-Оствальда-Фрейндлиха)
- 22. Смачивание. Закон Юнга (силовой и энергетический выводы)
- 23. Флотация
- 24. Определение краевого угла. Причины, затрудняющие это определение
- 25. Капиллярное поднятие жидкости, уравнение Жюрена
- 26. Поверхностные силы второго рода и расклинивающее давление. Линия трехфазного контакта (линия смачивания)
- 27. Использование ПАВ (вытеснение нефти, течение в невесомости и др.)
- 28. Разрушение и измельчение твердых тел как физико-химический процесс образования новой поверхности
- 29. Условие самопроизвольного распространения трещин. Влияние ПАВ на механические свойства твердых тел
- 30. Эффект Ребиндера. Основные особенности и формы проявления эффекта. Понижение прочности. Теория Гриффитса
- 31. Эффект Ребиндера: изменение прочности и пластичности как следствие снижения поверхностной энергии твердых тел
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка (С. В. Егоров, 2009) предоставлен нашим книжным партнёром — компанией ЛитРес.
а = f (p / ps), v = f(r), v = a / ?, r = 2? v / RT ln p / ps,
где p – давление пара над вогнутым мениском;
ps – давление насыщенного пара при данной температуре; r – плотность жидкости; a – величина адсорбции.
Для выражения зависимости равновесия твердых частиц по отношению к жидкому раствору пользуются уравнением, аналогичным уравнению Томсона. Данная формула выведена В. Оствальдом и Г. Фрейндлихом. Запишем данное уравнение, учитывая, что в растворе мерой интенсивности перехода вещества в другую фазу является концентрация насыщенного раствора:

где с0 – концентрация насыщенного раствора вещества, или его растворимость; с – концентрация вещества в растворе, равновесном с кристалликами размером r.
В отличие от капель, поверхность которых искривлена, поверхность кристаллов представляет собой совокупность плоских граней, однако аналогия данного уравнения объясняется тем, что доля поверхностных молекул, отличных по своим свойствам, несущих избыточную энергию, велика.
Следовательно, при растворении высокодисперсного вещества возможно получение раствора с концентрацией, превышающей его обычную растворимость. Такая система термодинамически неравновесна, что обусловливает перекристаллизацию вещества: появление и рост крупных кристаллов в пересыщенном растворе за счет растворения мелких.
Так, подтверждено, что для сульфата бария растворимость частиц размером r = 2 мкм равна 15,3 ммоль/л, а растворимость частиц с r = 0,3 мкм равна 18,2 ммоль/л. Однако значение поверхностной энергии и в том, и в другом случае будет одинаковым и будет равно 1250 ? 10 –3 Дж/м 2 .
Высокодисперсные частицы отличаются от частиц крупных размеров также тем, что при повышении давления насыщенного пара имеет место некоторое понижение температуры их плавления. Например, уменьшение размера частиц салола до 8 мкм приводит к понижению температуры плавления от +42 до +38°С.
Такие данные позволяют составить представление о возможных значениях поверхностной энергии твердых тел. Особенности условий равновесия на искривленных поверхностях лежат в основе капиллярных явлений.
Форма поверхности раздела фаз способна изменяться под влиянием поверхностного натяжения, стремясь к такой форме, при которой площадь поверхности была минимальна.
При смачивании жидкостью стенок капилляра имеет место образование вогнутого мениска, при этом происходит подъем жидкости в капилляре для компенсации уменьшения давления.
С этими явлениями связано возникновение пересыщений при образовании новой фазы.
Вначале происходит образование зародышевых частиц, которые имеют весьма малый размер. Концентрация раствора, равновесная по отношению к таким высокодисперсным агрегатам, заметно выше концентрации насыщенного раствора.
Таким образом, для образования мелких зародышевых частиц необходимо накопление избыточной энергии или создание пересыщенных состояний (пересыщенный пар при конденсации, пересыщенный раствор при кристаллизации), что сильно тормозит образование новой фазы.
Смачивание – это поверхностное явление, заключающееся во взаимодействии жидкости с твердым телом при наличии одновременного контакта трех несмешивающихся фаз. Смачивание часто рассматривают как результат межмолекулярного (вандерваальсова) взаимодействия, однако во многих случаях (например, при соприкосновении жидких металлов с твердыми металлами) смачивание обусловлено скорее, образованием химических соединений, твердых и жидких растворов и диффузионными процессами в поверхностном слое смачиваемого тела.
Смачивание – самопроизвольный процесс, идущий с уменьшением поверхностной энергии. Поэтому при смачивании выделяется теплота. Чем лучше твердое тело смачивается жидкостью, тем выше теплота смачивания. Тепловой эффект, сопровождающий соприкосновение жидкости со смачиваемой поверхностью, называется теплотой смачивания.
Величиной угла ? оценивают лиофильность и лиофобность поверхностей по отношению к различным жидкостям. На лиофильной поверхности жидкость растекается, т. е. имеет место частичное (0° 90°). Краевой угол зависит от соотношения сил сцепления молекул жидкости с молекулами или атомами смачиваемого тела (адгезии) и сил сцепления молекул жидкости между собой (когезии). Обратимую работу адгезии и когезии вычисляют, соответственно, по уравнениям:
При Wa 0°, причем с увеличением отношения Wa 1 – ? 11 )g,
где r 1 , r 11 – плотности жидкости и ее насыщенного пара; g – ускорение свободного падения; H – высота подъема жидкости.
Кривизна поверхности жидкости в капилляре может определяться условиями смачивания, т. е. значениями краевого угла ?. Высота капиллярного поднятия жидкости может определяться по формуле Жюрена:
H = P? / (? 1 – ? 11 )g.
Из уравнения Жюрена следует, что чем лучше жидкость смачивает стенки капилляра, тем выше происходит поднятие жидкости в капилляре при данном значении напряжения.
Если происходит несмачивание поверхности, жидкость способна образовывать некий выпуклый капиллярный мениск, этому условию будет отвечать повышение давления в жидкости под поверхностью самого мениска, и вместо поднятия жидкости происходит опускание жидкости.
Смачивание идет с уменьшением поверхностной энергии, при котором выделяется теплота. При лучшем смачивании твердого тела жидкостью теплота смачивания повышается. Метод капиллярного поднятия жидкости основан на рассмотренной выше формуле Жюрена.
При этом используют достаточно тонкие капилляры, что необходимо для обеспечения сферической поверхности мениска, но использование капилляров, которые смачиваются хорошо, позволяет избежать всех неувязок, которые могут возникать при определении краевого угла.
Существуют также полустатические методы определения поверхностного натяжения на границе жидкости.
Такое условие возможно при нарушении равновесия системы. Но при исследовании каждой новой системы необходим новый подбор оптимальных скоростей приближения к состоянию равновесия.
Этот процесс необходим, чтобы измерения не были очень долгими, т. к. для установления равновесия в системе требуется время.
Во всех методах используют приближенные значения и сравнивают с полученными данными для другой жидкости, для которой значение поверхностного натяжения известно с высокой точностью.
В дисперсных системах частицы могут оставаться разделенные прослойками среды, или может происходить т. н. полное вытеснение последних. Прорыв прослойки может означать возникновение контакта для твердых частиц и полное слияние, которое будет происходить для капелек и пузырьков. При этом устойчивость прослоек дисперсионной среды может существенно изменяться под действием поверхностно-активных веществ.
Изменение энергии системы, когда происходит изменение толщины пленки, может рассматриваться как результат действия в этой пленки некоторого довольно избыточного давления.
Расклинивающее давление – это избыточное давление, которое необходимо применить к поверхностям, ограничивающим, в свою очередь, тонкую пленку, причем толщина пленки должна оставаться постоянной или может быть изменена в процессе, который термодинамически выгоден.
Расклинивающее давление было принято рассматривать как некоторое избыточное давление со стороны прослойки на ограничивающие ее поверхности и стремящееся как бы раздвинуть их. Расклинивающее давление может быть положительным препятствовать утончению пленки, и отрицательным, которое способствует ее утончению. Если средой, где возникает такое давление, является воздух, то расклинивающее давление отрицательное. Также можно упомянуть о составляющих расклинивающего давления. Молекулярная составляющая способствует сближению частиц и может нарушать агрегативную устойчивость дисперсных систем.
Ионно-электростатическая составляющая является лучшим примером стабилизации дисперсных систем.
Смачивание – самопроизвольный процесс, идущий с уменьшением поверхностной энергии. Поэтому при смачивании выделяется теплота. Чем лучше твердое тело смачивается жидкостью, тем выше теплота смачивания. Тепловой эффект, сопровождающий соприкосновение жидкости со смачиваемой поверхностью, называется теплотой смачивания. Мерой смачивания является краевой угол смачивания ? между смачиваемой поверхностью и раствором. В зависимости от значения краевого угла различают следующие случаи.
1. ? > 90°, краевой угол тупой, наблюдается плохое смачивание поверхности.
2. ? 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
Читайте также:


