Гемофильная палочка микробиологическая диагностика
Таксономическое положение.Бактерии рода Haemophilus относятся к семейству Pasteurellaceae и насчитывают около 20 видов. Наибольшее значение в патологии человека
имеют Н. influenzae (в том числе биовар aegyp-tius) и Н. ducreyi. Морфология и тинкториальные свойства.
Культуральные свойства.Гемофильные бактерии — факультативные анаэробы, однако лучше растут в аэробных условиях. Практически все виды нуждаются в готовых факторах роста, присутствующих в крови: Х-факторе (протопорфирин IX в составе гематина или гемина), а также V-факторе (никотинами-дадениндинуклеотид — НАД или НАД-фос-фат — НАДФ). Это связано с тем, что гемофилы не способны синтезировать гем, входящий в состав ферментов дыхательной цепи, и/или НАД (НАДФ), являющийся кофактором окислительно-восстановительных ферментов.
Для культивирования гемофильной палочки применяют шоколадный агар — питательную среду коричневого цвета, которую получают путем прогревания кровяного агара при 80 °С в течение 15 мин. В результате нагревания происходит гемолиз и высвобождение из эритроцитов гемина и НАД. Оптимальная температура роста бактерий 35—37 "С. Колонии появляются через 36-48 ч. Для Н. influenzae характерна способность к образованию R- и S-форм колоний (R-, S-диссоциация). Слизистые, более крупные (3—4 мм в диаметре) радужные S-формы колоний характерны для капсульных штаммов. Слабовирулентные бескапсульные варианты гемофильной палочки образуют R-колонии — более мелкие (около 1 мм), мелкозернистые, с неровными краями.
в их способности расти на кровяном агаре вокруг колоний стафилококков или других бактерий, продуцирующих НАД или вызывающих alfa-гемолиз. Для самих гемофильных палочек способность вызывать гемолиз не характерна. Таким образом, мелкие радужные колонии гемофильных бактерий могут быть обнаружены на кровяном агаре в зоне гемолиза, образуемой S. aureus.
Идентификация гемофильных палочек основана на их потребности в факторах роста (табл. 16.17) и некоторых биохимических тестах.
Биохимическая активность.Гемофильные бактерии — хемоорганотрофы. Метаболизм дыхательный и бродильный. Утилизируют глюкозу до кислоты, восстанавливают нитрат до нитрита. Другие углеводы ферментируют плохо. Н. influenzae разделяют на 8 биоваров (I—VIII) в зависимости от их способности продуцировать индол, уреазу, орнитиндекар-боксилазу. Кроме того, вид Н. influenzae включает биовар aegyptius (табл. 16.18). Каталазная и оксидазная активность у различных видов гемофильных бактерий — вариабельный признак.
Факторы вирулентности.Ведущим фактором вирулентности Н. influenzae является капсула, которая защищает бактерии от фагоцитоза, обеспечивает выживаемость бактерий в организме и способствует распространению инфекции. Штаммы, имеющие капсулу (преимущественно типа b), вызывают наиболее тяжело протекающие инфекции.
Гемофильные палочки могут продуцировать IgA-протеазу, способную инактивировать секреторные антитела. Лили и IgA-протеаза возбудителя играют ведущую роль в прикреплении микроорганизмов к эпителию респираторного тракта и его колонизации.
Экзотоксин Н. influenzae не продуцирует. ЛПС наружной мембраны играет роль эндотоксина, участвуя также в процессах адгезии и инвазии гемофильной палочки. Эндотоксин может также вызывать паралич ресничек мерцательного эпителия респираторного тракта человека, способствуя тем самым микробной колонизации верхних дыхательных путей.
Резистентность.Бактерии малоустойчивы в
окружающей среде: быстро погибают, нахо
дясь вне организма человека. Гемофилы до
вольно чувствительны к нагреванию и обыч
ным дезинфицирующим средствам. Однако у
Н. influenzae выявлена способность к продук
ции р-лактамаз, что обуславливает их высо
кую устойчивость к некоторым Р-лактамным
антибиотикам.
Эпидемиология.Н. influenzae патогенны только для человека.
Источник инфекции — человек, больной или бактерионоситель. Бескапсульные маловирулентные штаммы способны в норме колонизировать слизистые оболочки верхних дыхательных путей здоровых детей (около 60—90 %) и взрослых (около 35 %). Однако и имеющие капсулу штаммы Н. influenzae типа b выделяются из носоглотки у 2 % бессимптомных носителей.
Ведущий механизм заражения гемофильной инфекцией — респираторный, путь передачи — воздушно-капельный (при распылении капель секрета верхних дыхательных путей при кашле, разговоре, чихании).
Наиболее подвержены гемофильной инфекции дети в возрасте от 2 месяцев до 6 лет. Однако менингиты и септицемии, вызванные Н. influenzae типа b, чаще встречаются у детей от 6 месяцев до 2 лет. Пневмонии, синуситы и другие инфекции дыхательных путей встречаются также и у пожилых людей, пациентов с хронической легочной паталогией, со сниженным иммунитетом, а также у курильщиков.
Патогенез.Проникая через верхние дыхательные пути, В. influenzae прикрепляется к
мерцательному эпителию и колонизирует его. Бескапсульные варианты гемофильных бактерий часто остаются во входных воротах инфекции, не вызывая симптомов заболевания (бессимптомное носительство). Тем не менее, у людей со сниженным иммунитетом они способны проникать в подслизистый слой и с помощью эндотоксина вызывать местные ГВЗ — средние отиты (поражение среднего уха), синуситы (воспаление придаточных пазух носа), ларинготрахеиты, бронхиты, пневмонии.
N influenzae, преимущественно типа b, может распространяться в организме гематоген-но, вызывая септицемию, септический артрит, эндокардит. После проникновения через ге-матоэнцефалический барьер, капсульные варианты гемофильной палочки вызывают тяжелые гнойные менингиты. Поражение мозга является следствием воспалительной реакции в ответ на инвазию возбудителя. Воспалительный экссудат накапливается в спинномозговом канале и желудочках мозга и служит хорошей питательной средой для гемофильной палочки, способствуя ее размножению. Нарушение оттока жидкости из субарахноидального пространства приводит к повышению внутричерепного давления, субдуральному отеку, а васкулит и тромбофлебит мягкой мозговой оболочки ведут к некротическим изменениям мозговой ткани. Гнойный менингит, вызванный N. influenzae типа b, заканчивается летально в 5 % случаев, даже при проведении адекватной терапии.
N. influenzae типа b является также возбудителем острого бактериального эпиглоттита (воспаление надгортанника) у детей 2—5 лет, который приводит к нарушению проходимости дыхательных путей и асфиксии.
Клиника.Клиническая картина заболевания определяется локализацией воспалительного процесса. Симптомы менингита, вызванного гемофильными бактериями, не отличаются от таковых при менингококковой или пневмококковой инфекциях, поэтому диагностика базируется, главным образом, на выделении и идентификации возбудителя. Гнойные поражения твердой и мягкой мозговых оболочек приводят к тяжелым осложнениям — потере зрения, глухоте, гидроцефалии, слабоумию.
У детей возможны фулминантные молниеносные формы ларинготрахеита и эпиглот-
тита с отеком гортани, требующие срочной трахеотомии и интубации.
По данным мировой статистики, гемо-фильная инфекция занимает одно из первых мест среди причин детской смертности. Летальность при гнойном менингите, сепсисе и эпиглоттите в отсутствие адекватного лечения составляет 90 %.
Иммунитет. Втечение первых 3—6 месяцев жизни дети защищены от инфекции материнскими IgG, полученными пассивно через плаценту. Поэтому в этом возрасте заболевания редки, а пик заболеваемости гемофильной инфекцией (в особенности типа b) приходится на возраст от 6 месяцев до 2 лет, когда концентрация материнских IgG снижается, а ребенок не способен самостоятельно синтезировать необходимое количество антител к полисахаридному капсульному антигену N. influenzae. Это объясняется тем, что поли-рибозорибитолфосфат капсульного антигена типа b является Т-независимым антигеном, антитела к которому образуются без участия Т-хелперов. У младенцев способность синтезировать антитела к таким антигенам снижена. Антитела же против других антигенов N. influenzae не способны опсонизировать капсульные штаммы гемофильной палочки.
Иммунитет после перенесенной гемофильной инфекции мало изучен. Однако известно, что к 5—6 годам в сыворотке крови многих детей (даже не иммунизированных и не переболевших) имеются естественно приобретенные протективные антитела против капсульного антигена N. influenzae типа b (анти-PRP антитела). Тем не менее, пневмония и артрит, вызванные N. influenzae, могут развиваться у взрослых в присутствии таких антител.
Микробиологическая диагностика.Материал для исследования — мазок из носоглотки, кровь, мокрота или ликвор. При отитах или синуситах исследуют также гнойное отделяемое, а при септических артритах — суставную жидкость.
Методы диагностики. Микроскопическое исследование малоинформативно, однако применяется при гнойном менингите (изучение мазков из цереброспинальной жидкости, окрашенных по Граму). Для ускоренной диагностики и дифференциации гемофильной палочки
Для выделения и идентификации возбудителя из материала от больных применяют бактериологический метод исследования. Посев для выделения гемофилов производят на шоколадный или кровяной агар (как описано выше) и инкубируют до появления колоний в течение 24—48 ч. Н. influenzae дифференцируют от других близкородственных грамнегативных палочек по их потребности в Х- и V-факторах роста, отсутствию гемолиза на кровяном агаре и другим тестам.
При синуситах, отитах и других инфекциях дыхательных путей, вызванных гемофилами, назначают Р-лактамные антибиотики с ингибиторами Р-лактамазы (например, амоксициллин с клавулановой кислотой) или бисептол.
Профилактика.Для создания искусственно приобретенного активного иммунитета против Н. influenzae типа b применяют субкорпускулярную вакцину, содержащую очищенный капсульный антиген (RPR).Однако ввиду низкой иммуногенности этого препарата его назначают только детям старше 1,5 лет.
Для повышения эффективности вакцинации против Н. influenzae b-инфекции предложено использовать конъюгированные вакцины,
содержащие RPR-антиген на белке-носителе. В качестве таких носителей применяют дифтерийный либо столбнячный анатоксины, или белки наружной мембраны менингококка группы В (комбинированная вакцина для профилактики менингококкового и гемофильного менингитов). Схема вакцинации предусматривает повторное многократное введение препарата детям, начиная с 2—3-месячного возраста, вместе с введением АКДС, а также вакцин против гепатита В и полиомиелита.
Массовая вакцинация против гемофильной инфекции за рубежом позволила значительно снизить частоту развития менингитов гемофильной этиологии у детей. Применение вакцины, однако, не защищает от носительства гемофильных палочек. В России отечественной вакцины нет, но разрешены к применению зарубежные препараты. Иммунизация против гемофильной инфекции в России пока не включена в календарный план обязательной вакцинации детей.
Пассивная иммунизация с помощью донорских сывороточных препаратов, содержащих высокие концентрации IgM, может быть назначена детям со слабым иммунным ответом на вакцину и иммунодефицитным лицам.
Контакт с пациентами, страдающими гемофильной инфекцией, малоопасен для взрослых, но представляет определенный риск для неиммунизированных детей. Поэтому детям в возрасте до 4 лет, находившимся в тесном контакте с больным, а также для санации бактерионосителей рекомендуется введение рифампицина с профилактической целью. Рифампицин выделяется со слюной, что уменьшает концентрацию возбудителя в верхних дыхательных путях, снижая тем самым риск распространения возбудителя в популяции. Однако злоупотреблять химиопрофи-лактикой гемофильной инфекции не следует из-за возможности развития лекарственной устойчивости Н. influenzae.
Дата добавления: 2016-02-04 ; просмотров: 2828 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Возбудитель гемофильной инфекции- Haemophilus influenzae, способен вызывать гнойный менингит, острое воспаление верхних дыхательных путей, бронхит, пневмонию, эмпиему, конъюнктивит, отит и другие оппортунистические заболевания. Уровень носительства гемофильной палочки среди здоровых лиц высокий (до 90 %). Гемофильная инфекция у детей в возрасте до 3 лет протекает исключительно тяжело, особенно в случае возникновения острого эпиглоттита (воспаления надгортанника).
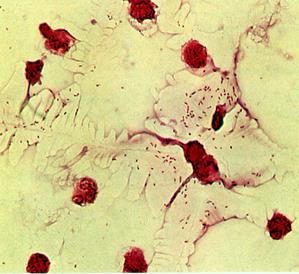
Бактериоскопический методможет быть использован при исследовании спинномозговой жидкости при подозрении на гнойный менингит (рис.18а).
а б
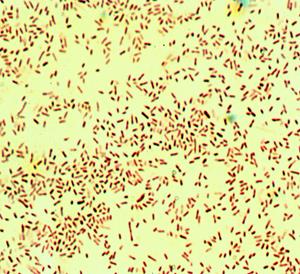
Рис. 18. Гемофильная палочка - Haemophilus influenzae. а –мазок из спинно-мозговой жидкости, б - мазок из чистой культуры.Окраска по Граму. мелкие грамотрицательные палочки. х900
Серозную и спинномозговую жидкости центрифугируют, осадок засевают бактериальной петлей на шоколадный агар (МПА с 5% дефибринированной крови человека, лошади или кролика выдерживают 2-3 минуты при температуре 80 0 С, повторно добавляют 5% крови и вновь выдерживают при той же температуре 2-3 минуты) или среду Филдса (МПА с добавлением пептического перевара крови лошади или барана). Параллельно делают посев на обычный МПА, на котором гемофильная палочка не растет.
Колонии Haemophilus influenzae мелкие, прозрачные или полупрозрачные, вырастают через 18-24 часа; в мазках из этих колоний обнаруживаются мелкие капсулообразующие или капсулонеобразующие грамотрицательные палочки (рис. 17б). Оставшуюся часть колонии пересевают на скошенный шоколадный МПА для выделения чистой культуры. Идентификацию гемофильных бактерий проводят на основании изучения биохимических (каталазная, оксидазная активность, ферментация углеводов, гемолитическая активность, питательные потребности) и антигенных (постановка РА на стекле с групповыми сыворотками а,b,с, d, e, f к капсульному антигену) свойств.
Для идентификации Haemophilus influenzae применяют также тест сателлитных колоний, для чего на поверхность шоколадного МПА наносят исследуемую культуру и в некоторые участки среды - штамм Staphylococcus aureus. Гемофильная палочка вырастает в виде мелких сателлитных колоний, окружающих колонии S. aureus, так как стафилококк, гемолизируя кровь, высвобождает X и Vфакторы – стимуляторы роста Haemophilus influenzae.
Каталазу гемофильной палочки определяют по пенообразованию в капле 10% перекиси водорода на предметном стекле при внесении в нее исследуемой культуры. Оксидазу выявляют путем нанесения на диск фильтровальной бумаги, диаметром 5-7 см , 2-3 капель 1% раствора тетраметилпарафенилендиамина и исследуемой культуры, в результате чего через
10-15 сек. появляется фиолетовое окрашивание. Уреазу определяют общепринятым методом по разложению мочевины с образованием щелочных продуктов в присутствии индикатора фенолового красного; при наличии уреазы среда приобретает ярко-малиновый цвет. Порфириновый тествыявляет способность Н. influenceк синтезу Δ-аминолевуленовой кислоты (АЛК) - потребности в факторе X. При внесении АЛК в среду только АЛК-независимые гемофильные бактерии синтезируют и секретируют порфобилиноген и порфирины (промежуточные соединения биосинтеза гема), тогда как АЛК-зависимые гемофильные палочки, нуждающиеся в факторе X, не способны к образованию указанных продуктов. Исследуемые бактерии засевают на шоколадный МПА, наносят на поверхность среды диски, пропитанные АЛК, и после 24-часовой выращивания в термостате при 37 0 С облучают УФ-лучами. При наличии Х-независимых микроорганизмов наблюдают кирпично-красную флюоресценцию.
Для специфической профилактики гемофильной инфекции в России лицензирована полисахаридная вакцина, конъюгированная со столбнячным анатоксином (вакцина Act-HIB) фирмы Пастер Мерье Коннот, которая не содержит консервантов и антибиотиков.
Не нашли то, что искали? Воспользуйтесь поиском:
Для подтверждения этиологии заболевания и определения чувствительности выделенного возбудителя к антимикробным препаратам обязательно микробиологическое исследование. Оно состоит из следующих основных этапов:
1) получение и транспортировка клинического материала;
2) предварительное исследование: микроскопия клинического материала;
3) выделение чистой культуры при исследовании спинномозговой жидкости, крови и другого клинического материала;
4) идентификация выделенной культуры.
а) Получение и транспортировка клинического материала. В связи с тем, что гемофильная палочка вызывает широкий спектр инфекций, для микробиологического исследования может направляться различный клинический материал. Наибольшую диагностическую ценность представляют исследования стерильных в норме биологических жидкостей: крови, плевральной, перикардиальной, синовиальной, спинно-мозговой жидкостей (СМЖ). Для доказательства этиологической роли Н. influenzae в инфекции НДП необходимо предупреждение контаминации клинического материала микрофлорой ВДП.
б) Предварительное исследование: микроскопия клинического материала. Предварительным этапом, предшествующим непосредственному выделению бактерий, является исследование мазков клинического материала, окрашенных по Граму и/или метиленовым синим. 11ри окраске по Граму бактерии рода Haemophilus представляют собой мелкие, бледно окрашенные сафранином или фуксином грамотрицательные палочки, обладающие полиморфизмом, иногда образующие длинные нити. При окраске метиленовым синим гемофилыгые палочки имеют синий цвет на серо-голубом фоне. Отрицательный результат микроскопии не исключает возможности гемофильной инфекции, гак как в клиническом материале может присутствовать недостаточное количество микробов. Поэтому обязательно культуральное бактериологическое исследование, которое остается золотым стандартом микробиологической диагностики.
При исследовании материалов, содержащих микробные ассоциации (мокрота, материал из среднего уха, пазух носа), следует провести микроскопическое исследование мазка. Критерием пригодности мокроты для посева является наличие более 25 сегментоядерных лейкоцитов и не более 10 эпителиальных клеток в поле зрения при просмотре 20 полей зрения мазка, окрашенного по Граму (при увеличении х100).
- капсульные штаммы образуют слизистые круглые сочные колонии сероватого цвета в диаметре до 2 мм, дающие радужную окраску в проходящем свете (иридиирующие);
- штаммы со слабовыраженной капсулой дают полупрозрачные круглые гладкие неиридиирующие колонии;
- бескапсульные штаммы образуют мелкие непрозрачные неиридиирующие колонии с неровными краями.
Дальнейший анализ проводится в соответствии со схемой, приведенной ниже, в которой этап накопления биомассы и приготовления мазка соответствует второму дню микробиологического исследования.
Третий день. Определение каталазной активности. Определение цитохромоксидазной активности. Посев на чашку для определения потребности в факторах X и V (или с тест-стрипами). Определение β-галактозидазной активности (предварительный учет). Определение чувствительности к ампициллину и другим антибактериальным препаратам на среде НТМ. Выявление β-лактамазы (тест с нитроцефином).
Четвертый день. Учет потребности в факторах X и V. Учет р-галактозидазной активности.
Ответ о наличии Н. influenzae или другого вида Haemophilus выдается при идентификации капсульного типа Н. influenzae с учетом результатов чувствительности к ампициллину и другим антибактериальным препаратам.
При необходимости биотипирования выделенного штамма производятся постановка пробы на индолообразование, определение наличия уреазы, определение наличия орнитиндекарбоксилазы..
Пятый день. Учет результатов биотипирования Н. influenzae.
3. Определение чувствительности к антибиотикам. Потенциальной активностью в отношении Н. influenzae обладают следующие антибиотики: аминопенициллины, ингибиторозащищенные пенициллины, цефалоспорины II—IV поколений, тетрациклины, фторхинолоны и др. В соответствии с международными и национальными рекомендациями, для выявления ампициллинорезистентности у гемофильной палочки в лабораторной практике достаточно определить чувствительность к ампициллину дискодиффузионным методом и провести тест на продукцию β-лактамаз с нитроцефином. Эти два теста позволяют подразделить штаммы Н. influenzae на ампициллиночувствительные, β-лактамазопродуцирующие ампициллинорезистентные (чувствительные к ингибиторозащищенным пенициллинам и цефалоспоринам II—IV поколений) и БЛНАР-штаммы, которые следует расценивать как резистентные к ингибиторозащищенным пенициллинам и некоторым цефалоспоринам.
Чашки с посевами и нанесенными на них дисками с антибиотиками инкубируют в течение 16-18 ч при 35°С в атмосфере с 5-7% CO2. Определяют чувствительность к ампициллину, амоксициллин/клавулонату, хлорамфениколу, тетрациклину, ципрофлоксацину или левофлоксацину, цефогаксиму или цефтриаксону, меропенему, ко-тримоксазолу, азитромицину.
Редактор: Искандер Милевски. Дата публикации: 24.1.2020
Таксономия:род Haemophilus, семейство Pasteurellaceae, отдел Gracilicutes, возбудитель H.influenzae
Морфология и физиология:Haemophilus influenzae имеет вид мелких палочек. Встречаются нитевидные формы. Свежевыделенные бактерии имеют капсулу. Спор не образуют. Палочки инфлюэнцы требовательны к условиям культивирования, они нуждаются в присутствии гемина и НАД (никотинамиддинуклеотида). Гемин освобождается из эритроцитов при нагревании. Для культивирования используют агар с гретой кровью. Выросшие колонии небольшие, прозрачные, плоские. Обладают небольшой ферментативной активностью. Расщепляют глюкозу и сахарозу с образованием кислоты, менее постоянно расщепляют галактозу, фруктозу, мальтозу и ксилозу.
Антигены:Видовая антигенная специфичность обусловливается капсульным полисахаридом.
Патогенность и патогенез:Вирулентные свойства Н.influenzae связаны с капсульным полисахаридом, который защищает бактерии от фагоцитоза. Токсичность связана с ЛПС и продукцией мембранотоксина (гемолизина). Гемофилы инфлюэнцы выделяют фермент протеазу, разрушающую секреторные иммуноглобулины (SIgA). В организме человека Haemophilus influenzae локализуется на слизистой оболочке верхних дыхательных путей и вызывает у человека заболевания с различными клиническими проявлениями: менингит, эндокардит, поражения дыхательного тракта, отит, конъюнктивит, гнойные воспалительные поражения суставов и др. Некапсульные варианты возбудителя часто выделяются от больных хроническими бронхитами, бронхиальной астмой. Наиболее часто болеют дети до 5 лет.
Экология и эпидемиология:У здоровых людей средой обитания Н. influenzae является слизистая оболочка верхних дыхательных путей. Источник инфекции - человек. Передача происходит воздушно-капельным путем.
Инфекции, вызванные гемофильной бактериями
Часто возбудителем менингита, септицемии, пневмонии, бронхита, отита, эндокардита, острых респираторных и вторичных инфекций может быть Haemophilus influenzae. Наиболее чувствительными к гемофильная бактерий дети от 3-х месяцев до 6 лет.
Материалы для исследования:Материалом для исследования при менингите служит ликвор, септицемии - кровь, при пневмонии - мокроты, при других процессах - навоз и слизь из носоглотки, которые забирают от больных с помощью ватных тампонов.
Микроскопические исследования:Изготовлены и зафиксированы мазки окрашивают по Граму или водным фуксином в течение 5 мин. При микроскопии видны мелкие палочковидные грамотрицательные бактерии, которые не образуют спор, но имеют капсулы, располагаются поодиночке, реже в виде цепочек. При большом количестве возбудителя в исследуемом материале (спинномозговая жидкость, гной, слизь, мокрота) его легко и быстро можно обнаружить с помощью феномена набухание капсул или реакции иммунофлуоресценции, если использовать соответствующие диагностические сыворотки.
Бактериологические исследования:Чистые культуры гемофильная бактерий выделяют путем немедленного посева исследуемого материала на специальные питательные среды (кровяной, шоколадный или сердечно-мозговой агар, среда Левинталя или Файлдса). Из типичных колоний готовят мазки и окрашивают по Граму.
Лечение: антимикробная терапия, симптоматическое лечение
Профилактика: вакцины на основе капсульных полисахаридов, но они не приводят к образованию АТ в необходимом колистве у детей младше 2 лет.
Возбудители холеры. Лабораторный диагноз холеры. Дифференциация рода Vibrio от сходных родов микроорганизмов; классического вибриона от вибриона Эль-Тор, Нагов и холероподобных вибрионов. Эпидемиология и профилактика. Особенности современной холеры.
Таксономия: род Vibrio, семейство Vibrionaceae, отдел Gracilicutes, возбудитель V.cholerae
Морфологические и культуральные свойства.Вибрион имеет один полярно расположенный жгутик. Под действием пенициллина образуются L-формы. Грамотрицательны, спор не образуют. Факультативный анаэроб. Не требователен к питательным средам. Температурный оптимум 37C.На плотных средах вибрионы образуют мелкие круглые прозрачные S-колонии с ровными краями. На скошенном агаре образуется желтоватый налет. В непрозрачных R-колониях бактерии становятся устойчивыми к действию бактериофагов, антибиотиков и не агглютинируются О-сыворотками.
Биохимические свойства.Активны: сбраживают до кислоты глюкозу, мальтозу, сахарозу, маннит, лактозу, крахмал. Все вибрионы делятся на шесть групп по отношению к трем сахарам (манноза, сахароза, арабиноза). Первую группу, к которой относятся истинные возбудители холеры, составляют вибрионы, разлагающие маннозу и сахарозу и не разлагающие арабинозу: разлагают белки до аммиака и индола. H2S не образуют.
Антигенная структура.Термостабильный О-антиген и термолабильный Н-антиген. Н-АГ являются общими для большой группы вибрионов.
Возбудители классической холеры и холеры Эль-Тор объединяются в серогруппу 01. Антигены серогруппы 01 включают в различных сочетаниях А-, В- и С-субъединицы.
Эпидемиология.Острая кишечная инфекция с фекально-оральным механизмом передачи. Путь передачи - водный, пищевой. Источник инфекции — больной человек или вибрионоситель.
Факторы патогенности.Пили адгезии;фермент муциназа, разжижающий слизь и обеспечивающий доступ к эпителию. Эпителиальные клетки выделяют щелочной секрет, который в сочетании с желчью является прекрасной питательной средой для размножения вибрионов. Токсинообразование вибрионов, которые вырабатывают эндо- и экзотоксины. Экзотоксин (энтеротоксин) холероген— термолабильный белок, чувствителен к протеолитическим ферментам. Холероген содержит 2 субъединицы: А и В. А активизирует внутриклеточную аденилатциклазу, происходит повышение выхода жидкости в просвет кишечника. Диарея, рвота. Фермент нейраминидазаусиливает связывание холерного экзотоксина с эпителием слизистой кишечника. Эндотоксин запускает каскад арахидоновой кислоты, которая запускает синтез простагландинов (Е, F). Они вызывают сокращение гладкой мускулатуры тонкого кишечника и подавляют иммунный ответ, чем обусловлены диарея.
Иммунитет.Гуморально-клеточный. При выздоровлении возникает напряженный непродолжительный иммунитет.
Микробиологическая диагностика.Выделение и идентификация возбудителя. Материал для исследования - выделения от больных (кал, рвота), вода.
Для экспресс-диагностики используют РИФ, ПЦР. Бактериоскопический метод в настоящее время не используется.
Лечение: а) регидратация (восполнение потерь жидкости и электролитов введением изотонических, растворов, а также плазмозаменяющих жидкостей внутривенно;
б) антибактериальная терапия (тетрациклины, фторхинолоны).
Профилактика.Санит.-гиг. мероприятия. Экстренная профилактика антибиотиками широкого спектра действия, а также вакцинопрофилактика. Современная вакцина представляет собой комплексный препарат, состоящий из холероген-анатоксина и химического О-антигена, обоих биоваров и сероваров Огава и Инаба. Прививка обеспечивает выработку вибриоцидных антител и антитоксинов в высоких титрах.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Гемофильные бактерии – это гетерогенная группа мелких грамотрицательных бактерий, не образующих спор, не обладающих подвижностью и требующих для культивирования сложные питательные среды, обычно содержащие кровь или ее компоненты.
БАКТЕРИИ РОДА HAEMOPHILUS
Гемофильные бактерии рода Haemophilus – облигатные паразиты; нуждаются в факторах роста X и (или) V, которые содержатся в эритроцитах. Фактор X представляет собой гемин-комплекс ионов железа и протопорфирина IX, термостабилен, сохраняется после автоклавирования.
Фактор V – никотинамидадениндинуклеотид (НАД) – термолабильный коэнзим, содержится в тканях растений, животных, вырабатывается многими бактериями. Поскольку фактор V разрушается при стерилизации, его заменяют в среде добавлением картофеля или дрожжей.
Некоторые виды гемофильных бактерий могут расти в присутствии одного из факторов, другие нуждаются в обоих (табл.1).
В род Haemophilus включаются 16 видов. Для человека патогенны два вида: H.influenzae – возбудитель воспалительных процессов дыхательных путей, и H.ducreyi – возбудитель мягкого шанкра.
Гемофильные бактерии. Биологическая характеристика
HAEMOPHILUS INFLUENZAE
Гемофильная палочка была впервые выделена Р.Кох в начале 80-х гг XIX века. Позднее схожий микроорганизм выделил М.И.Афанасьев (1891) и Р.Пфейффер (1892) из гнойного отделяемого и ткани легкого больного, умершего во время пандемии гриппа. Длительное время его считали возбудителем гриппа (influenza), что объясняет происхождение видового названия.
Haemophilus influenzae (палочка Афанасьева – Пфейффера) вызывает респираторные заболевания, менингит, эндокардит, абсцессы, артриты и т.д.
Гемофильная палочка. Биологические свойства. Haemophilus influenzae – мелкие короткие палочки (коккобациллы). Очень полиморфны, могут образовывать нити. В мазках располагаются одиночно, иногда короткими цепочками. Неподвижны, не образуют спор, имеют отчетливо выраженную капсулу.
Бактерии медленно окрашиваются анилиновыми красителями: фуксином Пфейффера прокрашиваются в течение 5-15 минут.
H.influenzae по специфичности капсульного антигена делят на 6 сероваров: a, b, c, d, e, f. От больных людей чаще выделяется серовар b. Кроме капсульного антигена у возбудителя инфлюэнцы имеется соматический антиген, в составе которого обнаружены термостабильный и термолабильный протеины.
Экзотоксинов H.influenzae не продуцирует, её вирулентность связана с эндотоксином, выделяющимся при разрушении бактериальных клеток. Инвазивность и подавление фагоцитоза обусловлены наличием капсулы.
В окружающей среде возбудитель малоустойчив, быстро погибает под действием прямых солнечных и ультрафиолетовых лучей, дезинфицирующих веществ в обычных рабочих концентрациях. При 60°С погибает в течение 5-10 минут.
Гемофильная палочка. Патогенез и клиника. Неинкапсулированные бактерии являются частью нормальной микрофлоры дыхательных путей человека. Инкапсулированные формы H.influenzae, особенно типа b, вызывают гнойные инфекции дыхательных путей (синуситы, ларинготрахеиты, эпиглоттиты, отиты), а у маленьких детей менингиты.
В большинстве случаев возбудитель локализуется в носоглотке и передается воздушно-капельным путем. С помощью пилей бактерии прикрепляются к клеткам эпителия слизистой оболочки верхних дыхательных путей. В последующем они проникают в подслизистую оболочку, вызывая развитие воспалительной реакции. Штаммы, обладающие высокой вирулентностью, способны проникать в лимфо- и кровоток.
Характер клинических проявлений зависит от локализации воспалительного процесса.
Острый эпиглоттит – тяжелое, потенциально смертельное заболевание у детей, вызываемое H.influenzae типа b. Заболевание начинается остро и внезапно. Характерный признак – увеличенный, гиперимированный и отечный надгортанник. Распространенное осложнение – нарастающая асфиксия, в результате чего нередко возникает необходимость в трахеостомии.
Менингит – наиболее тяжелое заболевание, вызываемое H.influenzae типа b. Развивается как следствие распространения возбудителя по лимфатическим сосудам. Нередко у детей после выздоровления остаются стойкие неврологические изменения. Частые последствия менингита – умственная отсталость, гидроцефалия, слепота. Летальность при нелеченном менингите, вызванном H.influenzae, может достигать 90%.
H. influenzae может вызывать назофарингит, часто с лихорадкой. Инфекция может распространяться и вовлекать в процесс придаточные пазухи или среднее ухо. H.influenzae типа b является наиболее частым возбудителем воспалительных заболеваний среднего уха.
Гемофильная палочка. Иммунитет. Существует связь между содержанием антител к капсульным антигенам H.influenzae и риском развития менингита. Чем выше уровень антител, тем меньше вероятность возникновения зааболевания. Новорожденные относительно невосприимчивы за счет материнских антител
Гемофильная палочка. Лабораторная диагностика. Микробиологический диагноз основан на выделении чистой культуры возбудителя и бактериоскопическом исследовании патологического материала, полученного от больных.
Гемофильная палочка. Эпидемиология. Инфекции, вызванные H.influenzae, регистрируют только у человека. Среди здоровых людей уровень носительства гемофильных палочек достигает 90%. Заболевания, вызываемые H.influenzae, регистрируют повсеместно, а в ряде стран они эндемичны. Наиболее восприимчивая группа – дети в возрасте от 3 месяцев до 6 лет. Основной путь передачи – воздушно-капельный.
Гемофильная палочка. Лечение и профилактика. Инфекции, вызванные H.influenzae типа b, обычно лечат ампициллином или хлорамфениколом. В настоящее время существуют штаммы H.influenzae, устойчивые к обоим препаратам.
Детям, находившимся в контакте с больным, назначают рифампицин, обеспечивающий хороший защитный эффект.
HAEMOPHILUS DUCREYI
Haemophilus ducreyi – возбудитель мягкого шанкра (в англоязычной литературе шанкроид) – венерического заболевания.
В мазках, окрашенных по Граму, H.ducreyi имеют вид палочек овоидной формы, расположенных параллельными цепочками (“железнодорожные пути”), группами или парами. Неподвижны, не образуют спор.
H.ducreyi – факультативный анаэроб. Для роста требует X (но не V) фактор. На кровяном агаре образует мелкие серовато-желтые колонии, напоминающие колонии стрептококков; через 3-4 суток образуют небольшую зону гемолиза.
Длительное время заболевание считали “экзотическим”, например, в отечественной практике регистрировали лишь завозные, “портовые” случаи заболевания. В последние годы многие дерматовенерологи отмечают увеличение заболеваемости мягким шанкром.
Уже через 12-18 часов на месте внедрения возбудителя образуется красное пятно, которое через 2-5 дней превращается в изъязвляющуюся папулу. Образовавшаяся язва мягкая на ощупь и болезненная (что отличает ее от твердого шанкра при сифилисе), с тонкими, подрытыми краями. Дно язвы покрыто желтоватым налетом и обильно кровоточит. В течение 3 недель язва увеличивается от размеров зерна чечевицы до 2 см. Шанкры могут быть множественными и сливаться в гигантские ползучие язвы. В 40% случаев наблюдается нагноение региональных лимфатических узлов. При неосложненном течении заживления язвы происходит через 1-2 месяца.
Гемофильная палочка. Лабораторная диагностика. Основана на обнаружении возбудителя в содержимом язвы (результаты исследования следует соотносить с данными анамнеза, так как мягкий шанкр передается только половым путем). Мазки окрашивают по Граму, фуксином Циля или метиленовым синим. К выделению культуры прибегают редко. После 8 дня болезни можно применить аллергическую пробу с внутрикожной инъекцией вакцины Haemophilus ducreyi (положительна в 90-98% случаев). Дифференциальная диагностика проводится с первичным сифилисом, генитальным герпесом и венерической лимфогранулемой. Нередки случаи одновременного заражения мягким шанкром и сифилисом.
Для лечения традиционно используют сульфаниламиды, пенициллин, стрептомицин и тетрациклин.
Читайте также:


