Герпесвирусная инфекция крс реферат








ГЕРПЕСВИРУСНАЯ ИНФЕКЦИЯ КРУПНОГО РОГАТОГО СКОТА
В последнее время появилось много сообщений о регистрации инфекции крупного рогатого скота, вызываемой герпесвирусом типа 4.
Впервые возбудитель был выделен в Венгрии в 1963 год от телёнка с клинической картиной заболевания органов дыхания и кератоконьюктивитом. Указанный штамм был назван Мовар 33/63 .С 1987 года все подобные штаммы были объединены под названием герпесвирус 4 типа.
В Венгрии герпесвирус 4 типа был обнаружен в шести из 33 исследованных плацент, взятых на фермах от абортировавших коров. Возбудитель локализовался в эпителиальных клетках, макрофагах и лимфоузлах. В присутствии простагландинов Е2 репликация патогенов в макрофагах усиливается [5,2].
В Японии на одной из ферм была зарегистрирована вспышка контагиозного мастита, вызванного герпесвирусом 4 типа. Вирус был обнаружен в вымени, лимфатических узлах, лейкоцитах, нервной ткани. Многие инфицированные коровы оставались клинически здоровыми [3].
Согласно литературным данным, герпесвирусы КРС не имеют четкого таксономического положения. Идентичные герпесподобные вирусы были выделены от коров, больных лимфосаркомой, однако этиологическая роль их в появлении лимфосарком и герпетического маммиллита не выяснена [5].
Возбудитель размножается в клетках иммунной, респираторной, пищеварительной и мочеполовой систем. У животных, инфицированных герпесвирусом 4 типа, отмечается иммунодефицитное состояние.
Однако имеется сообщение, что телята, зараженные экспериментально, не дают положительных серологических реакций. Попытку получить антисыворотку к штамму DN-599 на кроликов, цыплят, козах телят и крысах оказались безуспешными даже при использования концентрированного вируса с адьювантом.
Выделение герпесвируса 4 типа в культуре клеток весьма затруднительно, поскольку возбудитель имеет длительный цикл репродукции [1].
Источники и пути передачи инфекции в деталях не изучены. Предполагают, что, помимо прямого контакта больных и здоровых животных, в передаче инфекции принимают участие мухи. Вирус персистирует в лимфоидных органах, мононуклеарных клетках крови и клетках нервной системы.
Гемагглютинирующей активностью вирусы герпеса КРС не обладают. У больных животных вирус выделяется с истечениями из носа в течение 10 дней, в смывах из глаз в течение 3 дней, из легких, бронхов и трахеи - в различные сроки [1,4].
В западной Германии антитела к герпесвирусу 4 типа выявлены в 18,4% исследованных проб сывороток крупного рогатого скота, в Италии - в сыворотках из 50% стад . В результате проведённых в 1987 году исследований сывороток крови крупного рогатого скота из Бельгии антитела к герпесвирусу 4 типа были обнаружены в 22,4% проб. При исследовании 221 сывороток от абортированных коров из провинции Пьеж (Бельгия) антитела к герпесвирусу 4 типа были установлены в 17,2% проб.
Лабораторная диагностика герпесвирусной инфекции 4 типа основана на обнаружении фрагмента гена, кодирующего фермент тимидинкиназу полимеразной ценной реакцией (ПЦР) и выявлении вирусоспецифических антител в ИФА и МФА [1].
В настоящее время отрицательной чертой является не изученность устойчивость к физико-химическим воздействиям, антигенной структуры; источники и пути передачи инфекции в деталях не изучены, а также иммунитет и специфическая профилактика до сих пор не разработана.
Таким образом, герпесвирусы обладают сложной уникальной структурой. Уникальность герпесвирусов в том, что они могут оставаться в латентном состоянии в хозяине. Геном герпесвируса может встраиваться в геном клетки хозяина и длительное время персистировать.
Вышеизложенные данные говорят о необходимости учёта герпесвируса 4 типа при выяснении этиологии заболеваний крупного рогатого скота и при неадекватном иммунном ответе на вакцину.
Библиографический список
1. Сюрин, В.Н. Частная ветеринарная вирусология [Текст]: учебное пособие / В.Н. Сюрин. – М.: Колосс, 1979. - 472 с.
2. Сюрин, В.Н. Ветеринарная вирусология [Текст]: учебное пособие / В.Н.Сюрин, Р.В.Белоусова, Н.В. Фомина // 2-е изд., перераб. и доп.-М.: Агропромиздат,1991. - 261 с.
3. Bartha, A.В. Isolation of a bovine herpesvirus from calves with respiratory disease and keratocojunctivitis [Техt]: Acta vet. Acad. Sci. Hung., 1966. - №16. - p. 357-358.
Перепечаев Константин, ветеринарный врач
Характеристика герпесвируса кошек
Герпесвирус кошек тип 1 (FHV-1, вирус ринотрахеита кошек) – ДНК содержащий вирус подсемейства α-герпесвирусы. Общей характеристикой для данного семейства является быстрое размножение вируса в клеточных культурах с разрушением клеток, тенденция к установлению латентной инфекции в чувствительных нервных ганглиях после первоначальной инфекции. Другие вирусы, относящиеся к данному подсемейству, включают: герпесвирус лошадей тип 1, герпесвирус свиней тип 1 и герпесвирус КРС тип 2 и герпесвирус человека herpes simplex virus type 1 (HSV-1).
При первоначальном заражении FHV-1, быстрая вирусная репликация происходит в эпителии верхнего респираторного тракта, особенно в эпителии носовых ходов и эпителии трубчатых пластинок решетчатой кости. Глазная инфекция характеризуется выраженным тропизмом к конъюнктивальному эпителию. По необъяснимым причинам, FHV-1 размножается в эпителии роговицы только в очень ограниченной степени.
Экспериментальной изучение показывает, что при первоначальной инфекции, некроз чувствительных эпителиальных клеток начинается со 2 дня инфекции, достигая пика на 7-10 день инфекции. Инфекция протекает быстро, и активная клеточная регенерация наблюдается уже на 7-10 день. Выделение вируса с глазными и носовыми секретами может определяться уже на 2 день и продолжается обычно до 20 дня с момента начала инфекции.
Клинические проявления герпесвирусной инфекции
В большинстве случаев, острое течение FHV-1 наблюдается у новорожденных и молодых котят. В этих случаях преобладают признаки поражения верхнего респираторного тракта, а чихание и носовые и глазные выделения являются типичными клиническими признаками. У кошек, способных на достаточный иммунный ответ, развитие инфекционного процесса ограничивается, с последующим самовыздоровлением. Клинические признаки постепенно исчезают к 14-20 дню.
Глазные проявления острой формы FHV-1 инфекции почти всегда билатеральны. При экспериментальной инфекции, блефароспазм является первоначальным клиническим признаком, начиная проявляться через несколько дней после заражения и достигая, пика к 5 дню, когда начинает сопровождаться серозными выделениями. Выделения становятся слизистыми и слизисто-гнойными к 7 дню, начиная ослабевать к 10 дню. Внешний вид конъюнктивы при острой инфекции характеризуется сильнейшей гиперемией, конъюнктива набухает, но хемоз конъюнктивы не характерен для FHV-1 инфекции. Повреждения конъюнктивы возникают вследствие прямого цитолитического действия герпесвируса.
Корнеальные повреждения возникают и во время первоначальной инфекции, но они значительно менее заметны, по сравнению с конъюнктивальными. Корнеальные дендритные (древовидные, похожие на ветви) фигуры видны как узоры во время экспериментальной инфекции. Множество микродендритных фигур видны на роговице между 3 и 6 днями инфекции, возникая из-за размножения нанесенного на роговицу вируса. Дендритные поражения исчезают к 6 дню и вновь появляются на 11 день, когда вследствие некроза конъюнктивы высвобождается новая волна вирусных частиц. Корнеальная инфекция сопровождается слабой и временной поверхностной васкуляризацией.
Хроническая и вторичная инфекции
Корнеальные поражения, связанные с возвратной FHV-1 инфекцией проявляются несколькими различными синдромами:
Стромальный кератит – как проявления корнеальной FHV-1 инфекции встречается реже. Однако из-за своей потенциальной способности вызывать нарушающее зрение корнеальное рубцевание, стромальный кератит считается наиболее тяжелым проявлением корнеальной FHV-1 инфекции.
Стромальный FHV-1 кератит обычно сопровождается хроническими эпителиальными изъязвлениями и легко распознается по наличию стромального отека и глубокой васкуляризации, а микроскопически обнаруживается воспалительно-клеточный инфильтрат. Механизм, обуславливающий возникновение стромального кератита остается спорным.
.В связи с этим, чрезвычайный интерес представляет исследование патогенеза FHV-1 - индуцированного стромального кератита, у кошек получавших кортикостероиды.
В предыдущих исследованиях было установлено, что стромальный кератит не развивается даже после экспериментального заражения кошек, сопровождающегося механической скарификацией корнеального эпителия и стромы. Несмотря на диффузный некроз инфицированных конъюнктивальных тканей, корнеальный эпителий остается интактным и скарифицированная строма быстро заживает. Однако если кошки одновременно получают кортикостероиды, развивается стромальный кератит, в конечном счете, приводящий к фиброзу пораженных тканей.
Результаты изучения стромального кератита у животных, показали, что иммунная система функционирует дихотомично (двояко), обеспечивая защиту от заболевания при одних обстоятельствах, и медиируя корнеальную воспалительную реакцию, ответственную за стромальное рубцевание, при других обстоятельствах. Различные клинические синдромы, индуцируемые, когда клинически здоровые или находящиеся под действием кортикостероидов кошки заражаются FHV-1, показывают соответственно эффективную и патологическую иммунную реакцию. Раннему развитию кератита у кошек данного эксперимента предшествовал хронический эпителиальный язвенный процесс и замедленное заживление стромальных дефектов. Оба данных явления предположительно связаны с действием кортикостероидов, замедляющих эпителизацию и угнетающих синтез коллагена. В сочетании с продолжительным выделением вируса под влиянием этих же обстоятельств, корнеальные стромальные ткани, таким образом, должны подвергаться максимальному воздействию вируса.
По данным исследований, первыми клетками, появляющимися в пораженных тканях, являются нейтрофилы. Последующее появление Т и В-лимфоцитов значительно усиливает специфический антивирусный иммунный ответ и совмещает антитело-зависимый и клеточно-опосредованный процесс, направленный против вирусных гликопротеинов, адсорбированных корнеальной стромой.
Также выявлена роль реакции гиперчувствительности замедленного типа или цитотоксического действия Т-клеток в патогенезе стромального кератита. В этом исследовании, иммуногистохимическое обнаружение вирусного антигена в корнеальной строме и инфильтрация стромы мононуклеарными клетками согласуется с реакцией гиперчувствительности замедленного типа.
Хотя у кошек, получавших кортикостероиды титр циркулирующих FHV-1 - антител был нормальным, в сравнении с кошками не получавшими кортикостероиды, но продукция и высвобождение антител лакримальными и конъюнктивальными лимфоидными тканями могла быть замедленно из-за местного действия кортикостероидов. Также у кошек, получавших кортикостероиды с последующим развитием кератита, показатели теста стимуляции пролиферации Т-лимфоцитов и общее число циркулирующих лимфоцитов, осталось пониженным.
Иммунологический эффект от применения кортикостероидов включал уменьшение сродства антигена к Т-лимфоцитам, уменьшение продукции интерлейкина 2 и, возможно других цитокинов, нарушение функции макрофагов и клеточного иммунного ответа. Вероятно, медиированное кортикостероидами угнетение нормальной иммунной функции позволяет происходить неконтролируемому, локальному размножению вируса, которое в связи с замедленным заживлением корнеальных ран, приводит к накоплению в строме вирусных гликопротеинов.
Некоторые серьезные глазные патологии у кошек, не обязательно специфичные или вызванные исключительно FHV-1 наблюдаются вместе с FHV-1 инфекцией.
Корнеальная секвестрация – это синдром, при котором происходит дегенерация коллагена корнеальной стромы и накопление темно-коричневого или черного пигмента, источником которого предположительно является слезная пленка. Хотя могут болеть любые породы кошек, наиболее предрасположены Персидские и Гималайские кошки. Секвестрация может быть последствием тяжелого, экспериментального FHV-1 стромального кератита, однако FHV-1, скорее всего, является лишь одной из многих потенциальных угроз для роговицы, которые могут ускорять формирование секвестра. Установлено, что FHV-1 более часто обнаруживается в секвестрах домашних кошек, чаще, чем у Персидских и Гималайских.
Можно предполагать, что разница в преобладании ДНК FHV-1 в секвестрах домашних кошек (80%), по сравнению с Персидскими кошками (43%), связано исключительно с невирусными факторами и, по крайней мере, у значительной части животных, инициируется различными видами стромальных повреждений. Гистологически, секвестр состоит из изъязвленных стромальных тканей, лишенных кератоцитов, окруженных различным числом лимфоцитов, плазматических клеток, макрофагов и в меньшей степени – нейтрофилов. Характер воспалительного процесса, рассматривается как неспецифическая иммунная реакция, вызывающая дегенерацию коллагена, что, возможно, является приобретенной иммунной реакцией на вирусный антиген. Гистологические характеристики корнеальных секвестров несовместимы с иммунным механизмом, предположительно ответственным за повреждения коллагена, видимые при стромальных кератитах. Возможно, что секвестральные повреждения возникают как результат инфекции кератоцитов или сверхвыработки провоспалительных цитокинов.
Симблефарон – прирастание участка конъюнктивы к самой конъюнктиве или роговице. Теоретически, любое заболевание, значительно повреждающее конъюнктиву, может предрасполагать к формированию симблефарона. Но, принимая во внимание быстрый и обширный некроз конъюнктивального эпителия, который можно наблюдать при FHV-1 инфекции, вирус можно рассматривать, как идеальный фактор, инициирующий формирование симблефарона. Подавляющее большинство случаев симблефарона у кошек ассоциировалось с переболеванием в прошлом инфекцией конъюнктивы и верхних дыхательных путей, сравнимой с FHV-1.
Есть подозрение, что FHV-1 может являться причиной сухого кератоконъюнктивита у кошек. Данная гипотеза построена на результатах недавнего экспериментального изучения, в котором, уменьшение слезопродукции наблюдалось у 5 из 10 кошек с хронической FHV-1 инфекцией. Хотя механизм развития FHV-1 сухого кератоконъюнктивита рассматривается пока только теоретически, возможно развитие аденита слезной железы или заращения выводных протоков. В других случаях, уменьшение слезопродукции при FHV-1 инфекции носит лишь временный характер.
Увеиты – достаточно часто встречающаяся глазная патология, которая часто приводит к полной слепоте у кошек.
Интересны данные исследования для определения связи, между воспалением сосудистой оболочки глаза (увеитом) у кошек, и интраокулярной выработкой герпесвирус тип 1 (FHV-1) – специфических антител или обнаружением в жидкости передней камеры глаза герпесвирусной (FHV-1) ДНК. В опыте исследовались кошки с идиопатическим увеитом (увеитом неясного генеза), кошки с увеитом, связанным с инфекцией Toxoplasma gondi (токсоплазмоз), а также для контроля, FHV-1 - сероположительные и сероотрицательные кошки без увеита. Исследования проводились с использованием метода иммуноферментного анализа (ИФА / ELISA) для определения FHV-1 - специфических антител и общего числа иммуноглобулинов G (IgG) в сыворотке крови и жидкости передней камеры глаза и полимеразной цепной реакции (ПЦР / PCR) для определения FHV-1- ДНК в жидкости передней камеры глаза.
По результаты исследований, интраокулярные FHV-1 - специфических антитела, были обнаружены только у кошек с увеитом. Только у кошек с идиопатическим увеитом FHV-1 количество FHV-1 – специфических антител в жидкости передней камеры было максимальным. У кошек с идиопатическим увеитом среднее значение количества интраокулярных антител было значительно выше, чем у кошек с токсоплазмозным увеитом. FHV-1 - ДНК была обнаружена в жидкости передней камеры 12 кошек, у 11 из которых был увеит. Результаты исследований позволили сделать вывод, что FHV-1 способен инфицировать интраокулярные структуры кошек, и, что интраокулярная FHV-1 – инфекция может сопровождать воспаление сосудистой оболочки (увеит) кошек.
1. Feline Herpesvirus Ocular Disease Mark P. Nasisse (Small Animal Ophthalmology. May 1990)
2. Treatment of cats with ocular disease attributable to herpesvirus infection: 17 cases (1983-1993) Jean Stiles (JAVMA, Vol 207, No. 5, September1, 1995)
3. Differential sensitivity of culture and polymerase chain reaction for detection of feline herpesvirus 1in vaccinated and unvaccinated cats J.E. Sykes, G.F. Browning, G. Anderson, V.P. Studdert, H.V. Smith (Archives of Virology 1997, 142; 65-74)
4. Detection of feline herpesvirus-1 DNA in corneas of cats with eosinophilic keratitis or corneal sequestration Mark P. Nasisse, Tony L. Glover, Cecil P. Moore, Benjamin J. Weigler (American Journal Veterinary Research Vol 59, No. 7, July 1998)
5. High sensitivity polymerase chain reaction assay for active and latent feline herpesvirus-1 infection in domestic cats B.J. Weigler, C.A. Babineau, B. Sherry, M.P. Nasisse (The Veterinary Record, March 1997)
6. Immunologic, histologic and virologic features of herpesvirus-induced stromal keratitis in cats Mark P. Nasisse; Robert V. English; Mary B.Tompkins; James S. Guy; Wendy Sussman ( Am J Vet Res, Vol 56, No.1, January 1995)
7. Diagnosis of feline herpesvirus infection by immynohistochemistry, polimerase chain reaction, and in situ hybridization A. Suchy, B. Bauder, W. Gelbmann, C. V. Lohr, J.P. Teifke, H. Weissenbock (Journal Veterinary Diagnostic Investigation 12, 2000, (186-191)
8. Detection of feline herpesvirus-specific antibodies and DNA in aqueous humor from cats with or without uveitis David J. Maggs, Michael R. Lappin, Mark P. Nasisse (American Journal Veterinary Research, Vol 60, No 8, August 1999)
9. Comparison of PCR, virus isolation, and indirect fluorescent antibody staining in the detection of naturally occurring feline herpesvirus infections Kent M. Burgesser, Stephanie Hotaling, Anita Schiebel, Scott E. Ashbaugh, Steven M. Roberts, James K. Collins (Journal Veterinary Diagnostic Investigation 11, 122-126 (1999)
10. Enzyme-linked immunosorbent assay for detection of feline herpesvirus 1 IgG in serum, aqueous humor, and cerebrospinal fluid D.A. Dawson, J. Carman, J. Collins, S. Hill, M. R. Lappin (Journal Veterinary Diagnostic Investigation 10, 315-319 (1998)
11. An enzyme-linked immunosorbent assay using nuclear antigen for detection of Feline herpesvirus 1 antibody Y. Satoh, K. Iizuka, M. Fukuyama, S. Kishikawa, Y. Nishino, T. Ikeda, A. Kiuchi, M. Hara, K. Tabuchi (Journal Veterinary Diagnostic Investigation 11, 334-340 (1999)
12. Detection of feline herpesvirus infection Veterinary News, Pennsylvania State University, November 1999 Feline herpesvirus, methods for examination of specimens Veterinary Medical Diagnostic Laboratory University of Missouri, 1997 Immunofluorescence assay (IFA) or fluorescent antibody (FA) test Texas A&M University, 1998
13. Feline Viral Rhinotraheitis (FVR) Robert A. Crandell Advances in veterinary science and comparative medicine Volume 17 Academic press New-York and London 1973 (201-221)
Коллектив авторов: Березина Л. К., Косякова Н. П., Веткова Л. Г., Степанова Т. Н., Савойская С. Л., Зубашев И. К., Клицунова Н. В., Ольшанская А. А., Рахманина М. М., Элизбарашвили Э. И., Мезенцева М. В., Куриц Т., Пронин А. В., Санин А. В., Наровлянский А. Н.; ГУ НИИЭМ им. Н. Ф. Гамалеи РАМН, НИИ вирусологии им. Д. И. Ивановского РАМН, ВГНКИ ветеринарных препаратов, г. Москва, РФ; Окриджская национальная лаборатория, Окридж, США.

Вирусы группы герпеса вызывают у домашних животных целый ряд заболеваний — болезнь Ауески, респираторные и глазные заболевания, герпесвирусный энцефалит, инфекционный ринотрахеит кошек и др. Возбудители относятся к семейству герпесвирусов — эти вирусы характеризуются наличием липопротеиновой оболочки и содержат 2-цепочечную ДНК. На основании фенотипических и генетических данных семейство герпесвирусов подразделяют на 3 подсемейства: α-, β-, и γ-герпесвирусов. Ранее, при лечении кошек, больных инфекционным ринотрахеитом (возбудитель — FHV-1, герпесвирус кошек типа 1, относящийся к подсемейству α-герпесвирусов), была установлена высокая терапевтическая эффективность таких противовирусных средств как фоспренил и максидин (1). При лечении других вирусных инфекций фоспренилом было показано, что в ряде случаев противовирусный эффект препарата может быть результатом активации некоторых звеньев врожденного иммунитета (синтез интерферона и ряда других цитокинов, активация макрофагов и естественных киллерных клеток), обеспечивающих повышение неспецифической резистентности организма (2). В настоящей работе изучали противовирусную эффективность аналога фоспренила — МПФ, фосфорилированного полипренола, выделенного из древесной листвы и отличающегося от фоспренила не только происхождением (полипренолы для фоспренила выделяют из хвои), но и длиной полипренольной цепи. Оценку эффективности МПФ проводили при экспериментальной герпетической инфекции у мышей, при экспериментальном генитальном герпесе у морских свинок, при летальной инфекции кроликов, вызванных вирусом болезни Ауески, а также при инфекционном ринотрахеите кошек.
1. Экспериментальная герпетическая инфекция у мышей
Модель экспериментальной герпетической инфекции у мышей воспроизводили на белых беспородных мышах массой 10 – 12 г . Для заражения использовали вирус простого герпеса 1 типа (ВПГ-1) штамм Л2 (коллекция вирусов НИИ вирусологии им. Д. И. Ивановского) в титре 7 lg ЛД50/0,03 мл. Мышей заражали внутрибрюшинно (в/б) вируссодержащей 10%-ной суспензией мозга мышей (доза — 100 ЛД50). МПФ вводили в дозе 400 мкг/мышь/0,2 мл в/б по 2-м схемам: профилактической (за 24 часа до заражения ВПГ-1) и лечебно-профилактической (одновременно с ВПГ-1). В качестве референс-препарата использовали коммерческий препарат ридостин, который вводили в дозе 100 мкг/мышь за 24 часа до заражения ВПГ-1. В каждой группе было по 10 мышей, срок наблюдения составил 15 дней. Противовирусную активность определяли по увеличению процента выживаемости животных, увеличению средней продолжительности жизни (СПЖ). Наибольший эффект был обнаружен у МПФ при лечебно-профилактической схеме введения (0 час) — выживаемость составила 90%, защита — 50%, а СПЖ — 14,1±0,85. Аналогичным эффектом обладал и эталонный противовирусный препарат ридостин (защита составила 50%, а СПЖ — 14,3±0,66. В контроле выживаемость была 40%, а СПЖ — 10,0±1,31.
Для доказательства противовирусной активности препаратов были проведены опыты биологического титрования вируса из мозга мышей на клетках VERO. Титр ВПГ-1 в ткани мозга опытных и контрольных мышей, взятой на 6-й день после заражения, определяли в результате обработки культуры клеток 10-кратными разведениями суспензии мозга мышей. Наблюдение и учет ЦПД осуществляли на 3 – 4 день после контакта клеток с инфекционным материалом. Титр ВПГ-1, полученного из мозга контрольных мышей составил 5 lg ТЦД50/мл. Титры ВПГ-1 из мозга мышей, которым вводили МПФ, составляли 2,0 (-24 ч) и 1,5 (0 ч) lg ТЦД50/мл, соответственно. Таким образом, МПФ существенно снижал титр вируса (на 3,5 – 2,0 lg), что было сопоставимо с противовирусным действием ридостина, который снижал титр вируса на 3,5 (-24 ч) lg ТЦД50/мл.
2. Генитальный герпес морских свинок
При воспроизведении модели экспериментального генитального герпеса у самцов морских свинок использовали ВПГ 2 типа (штамм ЕС, титр 6 lg ТЦД50/мл). Степень выраженности инфекционного процесса оценивали по 4-балльной шкале, учитывая 4 основных признака: гиперемию, отечность, специфические элементы (везикулы, пустулы, изъязвления), орхит. МПФ вводили в/б в дозе 4мг, 4-кратно: за 24 часа до инфицирования, в момент заражения, через 24 и 48 часов после инфицирования. Показано, что МПФ оказывал выраженный статистически достоверный (р
3. Болезнь Ауески кроликов
4. Инфекционный ринотрахеит кошек
Исследование влияния МПФ на течение инфекции, вызванной вирусом ринотрахеита (ВРТ), проводили на 9 беспородных разнополых котятах в возрасте от 1,5 до 3,5 месяцев. До заражения смывы носоглоточные и конъюнктивы глаз, а также кал исследовали на наличие герпес-, парво- и калицивирусов методом ПЦР. После заражения ВРТ кал котят также исследовали методом электронной микроскопии. Сыворотку крови котят, полученную до заражения, исследовали на наличие вируснейтрализующих антител к ВРТ в реакции нейтрализации на культуре клеток.
В опытную группу были взяты 5 котят, а в контрольную — 4 котенка. Заражение каждого котенка проводили внутримышечно (в/м) по 1,0 мл, перорально (п/о) и интраназально по 0,5мл вируса (активность вируса равна 6,0 ТЦД50/мл). При обнаружении клинических признаков заболевания проводили лечение 0,4% раствором МПФ перорально в дозе 0,3 – 0,7мл. Наблюдение за состоянием котят вели с момента заражения до выздоровления в опыте в течение 3 – 5 недель.
Обследование котят до заражения, проведенное с помощью ПЦР, показало, что у двоих котят был обнаружен калицивирус, а у одного из них также и ВРТ. Титр нейтрализующих антител к вирусу герпеса у всех обследованных котят варьировал от 4,0 до 9,0 lоg.
По результатам электронной микроскопии были обнаружены единичные вирионы герпеса и калицивирусов у двух котят, а единичные вирионы калицивируса и парвовируса — у четырех.
Таким образом, заражение животных ВРТ в некоторых случаях производилось на фоне смешанной инфекции.

Лечение с помощью МПФ начинали с момента появления клинических признаков заболевания (депрессия, тусклая шерсть, обезвоживание, понос, рвота, отказ от еды, язвы в ротовой полости). МПФ вводили п/о в дозе 0,3 мл первые 2 дня, а затем по 0,5мл, а также орошали слизистую ротовой полости дважды в день. В качестве вспомогательной терапии использовали кламоксил, гамавит и пиобактериофаг, а для снятия обезвоживания — физиологический раствор и глюкозу 5%.
По предварительным результатам, клиническое выздоровление наступило у двух котят на 6 – 8-е сутки (исчезновение язв, снижение обезвоживания, повышение активности, улучшение состояния шерсти), а у трех котят лечение МПФ в дозе 0,7 мл дважды в день в сочетании с орошением ротовой полости привело к выздоровлению на 3 – 4-е сутки. Исчезновение признаков заболевания в контрольной группе животных наступало на 22 – 30-е сутки.
Таким образом, МПФ — препарат, во многом аналогичный фоспренилу, обладает высокой эффективностью при лечении инфекций, вызванных вирусами группы герпеса у различных животных. Возможные механизмы терапевтической активности МПФ служат предметом дальнейшего изучения.
Библиография
2. Pronin A. V., Grigorieva E. A., Sanin A. V., Narovlyansky A. N., Ozherelkov S. V., Deyeva A. V., Danilov L. L., Maltsev S. D., Najid A. Polyprenols as possible factors that determine the instructive role of innate immunity in the acquired immune response. Russian J. Immunol. 2002, v. 7, № 2, p. 135 – 142.
Summary
NOVEL APPROACH TO TREATMENT OF ANIMAL HERPES VIRUS INFECTIONS
Berezina L. K., Kosyakova N. P., Vetkova L. G., Stepanova T. N., Savoyskaya S. L., Zubashev I. K., Klitsunova N. V., Olshanskaya A. A., Rakhmanina M. M., Elizbarashvilli E. I., Mezentseva M. V., Kuritz T., Pronin A. V., Sanin A. V., Narovliansky A. N. N. F.Gamaleya Research Inst. for Epidemiology and Microbiology, Moscow, D. I. Ivanovsky Research Inst. for Virology, Moscow, All-Russian State Research Institute for Control, Standardization and Certification of Veterinary Preparations, Moscow, National Oak Ridge Lab., Oak Ridge, USA.
A novel approach has been attempted to treat herpes virus infections in animals using MPP, a new medicine derived from plant polyprenols. MPP was shown to possess a very high therapeutic efficiency during treatment of some herpes virus infections: experimental mouse herpes virus infection, guinea pig genital herpes infection, Aueski disease of rabbits and feline viral rhinotracheitis.
По материалам Ветеринарного Конгресса, 2005 г .
Методические указания для студентов к практическому занятию № 6.
Тема: Лабораторная диагностика герпесвирусных инфекций.
Цель: Изучение лабораторной диагностики герпесвирусных инфекций.
Модуль 3. Общая и специальная вирусология.
Содержательный модуль 16. Специальная вирусология.
Тема 6:Лабораторная диагностика герпесвирусных инфекций.
Актуальность темы:
Вирус простого герпеса – одна из самых распространенных вирусных инфекций человека, характеризующаяся лихорадочным состоянием и пузырьковыми высыпаниями, которые чаще всего локализуются на коже и слизистых оболочках. Важными особенностями герпетической инфекции являются пожизненное носительство вируса и частые рецидивы болезни.
Вирусная природа простого герпеса установлена в 1912 г. У. Грютером.
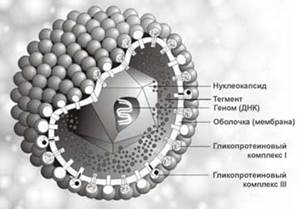
(Трёхмерное изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
| Типы вирусов герпеса | Вызываемые заболевания |
| ВПГ-1 (вирус простого герпеса типа 1) | Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы глаза, энцефалиты |
| ВПГ-2 (вирус простого герпеса типа 2) | Поражение слизистых оболочек гениталий, у новорожденных - центральной нервной системы |
| ВЗВ (вирус ветрянки) | Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-некротическая форма опоясывающего герпеса - СПИД-индикаторный признак заболевания |
| ЦМВ (цитомегаловирус) | Патологии новорожденных; осложнения после трансплантации органов и костного мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
| ВЭБ (вирус Эпштейна-Барра) | Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
| ВГ-6 | Вирус, вызывающий фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
| ВГ-7 | Вирус, выделенный от больных с синдромом хронической усталости |
| ВГ-8 | Вирус, выделенный из биоптата больного саркомой Капоши, ассоциированный с лимфопролиферативными заболеваниями |
| Примечание. ВГ - вирус герпеса. |
Таксономия, морфология, химический состав. Возбудитель простого герпеса - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Simplexvirus. По морфологии и химическому составу не отличается от вирусов ветряной оспы и опоясывающего герпеса.

Культивирование. Вирус простого герпеса (ВПГ) культивируют в куриных эмбрионах, культурах клеток и организме лабораторных животных. На хорионаллантоисной оболочке куриных эмбрионов вирус образует мелкие белые плотные узелки-бляшки; в зараженных культурах - вызывает цитопатический эффект: образование гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирующими выработку антител и клеточный иммунитет. Существует два серотипа вируса: ВПГ типа 1 и ВПГ типа 2.
Резистентность. Вирус может выживать на поверхности предметов при комнатной температуре в течение нескольких часов, чувствителен к УФ-лучам, обычным дезинфицирующим средствам, жирорастворителям, термолабилен.
Восприимчивость животных. Вирус простого герпеса патогенен для многих животных, у которых вызывает энцефалит при введении возбудителя в мозг или местный воспалительный процесс при заражении в глаз. В естественных условиях животные не болеют.
Эпидемиология. Простой герпес - одна из самых распространенных инфекций, которая поражает различные возрастные группы людей, чаще в осенне-зимний период. Отмечаются спорадические случаи заболевания, иногда небольшие вспышки в семьях, детских коллективах, больницах. Эпидемий не наблюдается.
Источником инфекции являются больные и носители. Основной механизм передачи - контактный, аэрогенный. Заражение происходит при попадании вирусов на поврежденные кожные покровы или слизистые оболочки.
Эпидемиология герпеса, вызванного вирусами типов 1 и 2, различна. ВПГ типа 1 передается через слюну, зараженные слюной руки и предметы быта, а ВПГ типа 2 - половым путем. Возможно заражение плода через плаценту.
Патогенез и клиническая картина. По клиническим проявлениям различают первичный и рецидивирующий герпес. Входными воротами возбудителя при первичной герпетической инфекции являются поврежденные участки кожи и слизистых оболочек рта, глаз, носа, мочеполового тракта, где вирусы репродуцируются. Затем по лимфатическим сосудам вирусы попадают в кровь и заносятся в различные органы и ткани.
Инкубационный период при первичном герпесе составляет в среднем 6-7 дней. Заболевание начинается с жжения, зуда, покраснения, отека на ограниченных участках кожи и слизистых оболочек, затем на этом месте появляются пузырьковые высыпания, наполненные жидкостью. Иногда заболевание сопровождается повышением температуры тела и нарушением общего состояния. При подсыхании пузырьков рубцов не образуется. Первичный герпес у новорожденных протекает тяжело и нередко заканчивается смертью. Однако у большинства людей первичная инфекция остается нераспознанной, так как протекает бессимптомно.
После первичной инфекции (явной и бессимптомной) 70-90 % людей остаются пожизненными носителями вируса, который сохраняется в латентном состоянии в нервных клетках чувствительных ганглиев. Нередко у носителей появляются рецидивы болезни в результате переохлаждения, перегревания, менструации, интоксикации, различных инфекционных заболеваний, стрессов, нервно-психических расстройств. Для рецидивирующего герпеса характерны повторные высыпания на коже и слизистых оболочках, нередко в тех же местах. Наиболее частой локализацией рецидивирующего герпеса, вызванного ВПГ типа 1, являются губы, крылья носа, полость рта, конъюнктива глаз. ВПГ типа 2 поражает мочеполовую систему и вызывает герпес новорожденных. Доказана роль ВПГ типа 2 в развитии рака шейки матки. Сравнительно редко встречаются генерализованные формы рецидивирующего герпеса, в частности поражения нервной системы и внутренних органов.
Иммунитет. В результате первичной герпетической инфекции в организме образуются сывороточные и секреторные антитела, которые обусловливают иммунитет к первичному герпесу, но не препятствуют сохранению вируса и возникновению рецидивов. Рецидивирующий герпес возникает при высоком уровне антител к вирусу герпеса. Основное значение в развитии рецидивирующего герпеса имеет состояние клеточного иммунитета.
Лабораторная диагностика. Материалом для исследования являются содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки глаза, кровь, цереброспинальная жидкость, в летальных случаях . кусочки головного и спинного мозга.
Экспресс-диагностика заключается в обнаружении гигантских многоядерных клеток с внутриядерными включениями в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе. Для дифференциации от других вирусов, принадлежащих к этому семейству, используют РИФ, ИФА, РИА, ПЦР. Выделение вируса проводят на куриных эмбрионах, культуре клеток и на лабораторных животных (мыши-сосунки), идентифицируют вирус с помощью РИФ или РН. В последние годы в диагностике простого герпеса начали применять моноклональные антитела, что дает возможность определить серотип вируса. Для серодиагностики заболевания используют РСК, РН, РИФ, ИФА.
Специфическая профилактика и лечение. Для профилактики тяжелых форм рецидивирующего герпеса в период ремиссии применяют многократное введение инактивированной, культуральной герпетической вакцины. Вакцинация, а также применение иммуномодуляторов, например реаферона, удлиняют межрецидивный период и облегчают течение последующих рецидивов. В остром периоде с лечебной целью используют химиотерапевтические препараты (виразол, ацикловир, оксолиновую, тебро-феновую, флореналовую мази, бонафтон), интерфероны и индукторы интерферона.
Вирус цитомегалии

Цитомегалия - инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ) Cytomegalovirus hominis (от греч. cytys - клетка, megas - большой). Вирус вызывает цитомегаловирусную инфекцию человека, характеризующуюся поражением почти всех органов (преимущественно слюнных желез) с образованием в них гигантских клеток с внутриядерными включениями, протекающую в различных формах - от бессимптомного носительства до тяжелой генерализованной формы, заканчивающейся летальным исходом.
Вирус впервые выделен К. Смитом в 1956 г.
Таксономия, морфология, антигенная структура. Возбудитель цитомегалии - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Cytomegalovirus.
Морфология, химический состав типичны для семейства герпесвирусов. Диаметр вирусной частицы (вириона) около 180 нм. В центре вириона находится двенадцатигранный нуклеокапсид, содержащий генетическую информацию - двухнитевую ДНК-вируса. Установлено 2 антигенных серотипа вируса.
Резистентность. Вирус термолабилен, чувствителен к дезинфицирующим средствам и жирорастворителям.
Эпидемиология. Цитомегаловирусная инфекция широко распространена на земном шаре. Источником вируса является больной человек или носитель. Вирус выделяется со слюной, мочой, секретами организма, реже фекалиями. Предполагается, что ведущий механизм передачи инфекции - контактно-бытовой, возможны аэрогенный и фекально-оральный механизмы передачи. Цитомегаловирус обладает высокой способностью проникать через плаценту (вертикальная передача), вызывая внутриутробную патологию плода.
Патогенез и клиническая картина. Патогенез не вполне выяснен. Инфекция связана с длительным носительством вируса, который в латентном состоянии сохраняется в слюнных железах, почках и других органах. Активация латентной инфекции происходит при иммунодефицитных состояниях, иммунодепрессивной терапии. Вирус поражает ЦНС, костный мозг, почки, печень, клетки крови. У беременных женщин цитомегалия может приводить к недоношенности, мертворождению, развитию аномалий у плода.
Иммунитет. У больных независимо от клинической формы инфекции, а также у носителей образуются антитела, которые, однако, не препятствуют сохранению вируса в организме и выделению его в окружающую среду. Интенсивность развития болезни находится под контролем клеточной иммунной системы хозяина.
Лабораторная диагностика. Обследованию на цитомегалию в первую очередь подлежат дети с поражением ЦНС и врожденными уродствами, а также женщины с неблагополучно протекающей беременностью. Исследуемый материал - слюна, моча, мокрота, цереброспинальная жидкость, кровь, пунктат печени.
Специфическая профилактика и лечение. Разработана живая аттенуированная вакцина. Для лечения применяют химиотерапевтические препараты (ганцикловир, фоскорнет натрия), иммуномодуляторы, интерферон.
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


