Герпесвирусная инфекция в россии
Методические указания для студентов к практическому занятию № 6.
Тема: Лабораторная диагностика герпесвирусных инфекций.
Цель: Изучение лабораторной диагностики герпесвирусных инфекций.
Модуль 3. Общая и специальная вирусология.
Содержательный модуль 16. Специальная вирусология.
Тема 6:Лабораторная диагностика герпесвирусных инфекций.
Актуальность темы:
Вирус простого герпеса – одна из самых распространенных вирусных инфекций человека, характеризующаяся лихорадочным состоянием и пузырьковыми высыпаниями, которые чаще всего локализуются на коже и слизистых оболочках. Важными особенностями герпетической инфекции являются пожизненное носительство вируса и частые рецидивы болезни.
Вирусная природа простого герпеса установлена в 1912 г. У. Грютером.
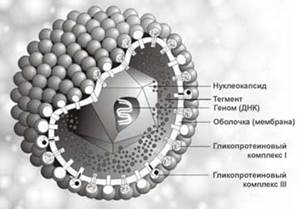
(Трёхмерное изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
| Типы вирусов герпеса | Вызываемые заболевания |
| ВПГ-1 (вирус простого герпеса типа 1) | Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы глаза, энцефалиты |
| ВПГ-2 (вирус простого герпеса типа 2) | Поражение слизистых оболочек гениталий, у новорожденных - центральной нервной системы |
| ВЗВ (вирус ветрянки) | Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-некротическая форма опоясывающего герпеса - СПИД-индикаторный признак заболевания |
| ЦМВ (цитомегаловирус) | Патологии новорожденных; осложнения после трансплантации органов и костного мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
| ВЭБ (вирус Эпштейна-Барра) | Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
| ВГ-6 | Вирус, вызывающий фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
| ВГ-7 | Вирус, выделенный от больных с синдромом хронической усталости |
| ВГ-8 | Вирус, выделенный из биоптата больного саркомой Капоши, ассоциированный с лимфопролиферативными заболеваниями |
| Примечание. ВГ - вирус герпеса. |
Таксономия, морфология, химический состав. Возбудитель простого герпеса - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Simplexvirus. По морфологии и химическому составу не отличается от вирусов ветряной оспы и опоясывающего герпеса.

Культивирование. Вирус простого герпеса (ВПГ) культивируют в куриных эмбрионах, культурах клеток и организме лабораторных животных. На хорионаллантоисной оболочке куриных эмбрионов вирус образует мелкие белые плотные узелки-бляшки; в зараженных культурах - вызывает цитопатический эффект: образование гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирующими выработку антител и клеточный иммунитет. Существует два серотипа вируса: ВПГ типа 1 и ВПГ типа 2.
Резистентность. Вирус может выживать на поверхности предметов при комнатной температуре в течение нескольких часов, чувствителен к УФ-лучам, обычным дезинфицирующим средствам, жирорастворителям, термолабилен.
Восприимчивость животных. Вирус простого герпеса патогенен для многих животных, у которых вызывает энцефалит при введении возбудителя в мозг или местный воспалительный процесс при заражении в глаз. В естественных условиях животные не болеют.
Эпидемиология. Простой герпес - одна из самых распространенных инфекций, которая поражает различные возрастные группы людей, чаще в осенне-зимний период. Отмечаются спорадические случаи заболевания, иногда небольшие вспышки в семьях, детских коллективах, больницах. Эпидемий не наблюдается.
Источником инфекции являются больные и носители. Основной механизм передачи - контактный, аэрогенный. Заражение происходит при попадании вирусов на поврежденные кожные покровы или слизистые оболочки.
Эпидемиология герпеса, вызванного вирусами типов 1 и 2, различна. ВПГ типа 1 передается через слюну, зараженные слюной руки и предметы быта, а ВПГ типа 2 - половым путем. Возможно заражение плода через плаценту.
Патогенез и клиническая картина. По клиническим проявлениям различают первичный и рецидивирующий герпес. Входными воротами возбудителя при первичной герпетической инфекции являются поврежденные участки кожи и слизистых оболочек рта, глаз, носа, мочеполового тракта, где вирусы репродуцируются. Затем по лимфатическим сосудам вирусы попадают в кровь и заносятся в различные органы и ткани.
Инкубационный период при первичном герпесе составляет в среднем 6-7 дней. Заболевание начинается с жжения, зуда, покраснения, отека на ограниченных участках кожи и слизистых оболочек, затем на этом месте появляются пузырьковые высыпания, наполненные жидкостью. Иногда заболевание сопровождается повышением температуры тела и нарушением общего состояния. При подсыхании пузырьков рубцов не образуется. Первичный герпес у новорожденных протекает тяжело и нередко заканчивается смертью. Однако у большинства людей первичная инфекция остается нераспознанной, так как протекает бессимптомно.
После первичной инфекции (явной и бессимптомной) 70-90 % людей остаются пожизненными носителями вируса, который сохраняется в латентном состоянии в нервных клетках чувствительных ганглиев. Нередко у носителей появляются рецидивы болезни в результате переохлаждения, перегревания, менструации, интоксикации, различных инфекционных заболеваний, стрессов, нервно-психических расстройств. Для рецидивирующего герпеса характерны повторные высыпания на коже и слизистых оболочках, нередко в тех же местах. Наиболее частой локализацией рецидивирующего герпеса, вызванного ВПГ типа 1, являются губы, крылья носа, полость рта, конъюнктива глаз. ВПГ типа 2 поражает мочеполовую систему и вызывает герпес новорожденных. Доказана роль ВПГ типа 2 в развитии рака шейки матки. Сравнительно редко встречаются генерализованные формы рецидивирующего герпеса, в частности поражения нервной системы и внутренних органов.
Иммунитет. В результате первичной герпетической инфекции в организме образуются сывороточные и секреторные антитела, которые обусловливают иммунитет к первичному герпесу, но не препятствуют сохранению вируса и возникновению рецидивов. Рецидивирующий герпес возникает при высоком уровне антител к вирусу герпеса. Основное значение в развитии рецидивирующего герпеса имеет состояние клеточного иммунитета.
Лабораторная диагностика. Материалом для исследования являются содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки глаза, кровь, цереброспинальная жидкость, в летальных случаях . кусочки головного и спинного мозга.
Экспресс-диагностика заключается в обнаружении гигантских многоядерных клеток с внутриядерными включениями в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе. Для дифференциации от других вирусов, принадлежащих к этому семейству, используют РИФ, ИФА, РИА, ПЦР. Выделение вируса проводят на куриных эмбрионах, культуре клеток и на лабораторных животных (мыши-сосунки), идентифицируют вирус с помощью РИФ или РН. В последние годы в диагностике простого герпеса начали применять моноклональные антитела, что дает возможность определить серотип вируса. Для серодиагностики заболевания используют РСК, РН, РИФ, ИФА.
Специфическая профилактика и лечение. Для профилактики тяжелых форм рецидивирующего герпеса в период ремиссии применяют многократное введение инактивированной, культуральной герпетической вакцины. Вакцинация, а также применение иммуномодуляторов, например реаферона, удлиняют межрецидивный период и облегчают течение последующих рецидивов. В остром периоде с лечебной целью используют химиотерапевтические препараты (виразол, ацикловир, оксолиновую, тебро-феновую, флореналовую мази, бонафтон), интерфероны и индукторы интерферона.
Вирус цитомегалии

Цитомегалия - инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ) Cytomegalovirus hominis (от греч. cytys - клетка, megas - большой). Вирус вызывает цитомегаловирусную инфекцию человека, характеризующуюся поражением почти всех органов (преимущественно слюнных желез) с образованием в них гигантских клеток с внутриядерными включениями, протекающую в различных формах - от бессимптомного носительства до тяжелой генерализованной формы, заканчивающейся летальным исходом.
Вирус впервые выделен К. Смитом в 1956 г.
Таксономия, морфология, антигенная структура. Возбудитель цитомегалии - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Cytomegalovirus.
Морфология, химический состав типичны для семейства герпесвирусов. Диаметр вирусной частицы (вириона) около 180 нм. В центре вириона находится двенадцатигранный нуклеокапсид, содержащий генетическую информацию - двухнитевую ДНК-вируса. Установлено 2 антигенных серотипа вируса.
Резистентность. Вирус термолабилен, чувствителен к дезинфицирующим средствам и жирорастворителям.
Эпидемиология. Цитомегаловирусная инфекция широко распространена на земном шаре. Источником вируса является больной человек или носитель. Вирус выделяется со слюной, мочой, секретами организма, реже фекалиями. Предполагается, что ведущий механизм передачи инфекции - контактно-бытовой, возможны аэрогенный и фекально-оральный механизмы передачи. Цитомегаловирус обладает высокой способностью проникать через плаценту (вертикальная передача), вызывая внутриутробную патологию плода.
Патогенез и клиническая картина. Патогенез не вполне выяснен. Инфекция связана с длительным носительством вируса, который в латентном состоянии сохраняется в слюнных железах, почках и других органах. Активация латентной инфекции происходит при иммунодефицитных состояниях, иммунодепрессивной терапии. Вирус поражает ЦНС, костный мозг, почки, печень, клетки крови. У беременных женщин цитомегалия может приводить к недоношенности, мертворождению, развитию аномалий у плода.
Иммунитет. У больных независимо от клинической формы инфекции, а также у носителей образуются антитела, которые, однако, не препятствуют сохранению вируса в организме и выделению его в окружающую среду. Интенсивность развития болезни находится под контролем клеточной иммунной системы хозяина.
Лабораторная диагностика. Обследованию на цитомегалию в первую очередь подлежат дети с поражением ЦНС и врожденными уродствами, а также женщины с неблагополучно протекающей беременностью. Исследуемый материал - слюна, моча, мокрота, цереброспинальная жидкость, кровь, пунктат печени.
Специфическая профилактика и лечение. Разработана живая аттенуированная вакцина. Для лечения применяют химиотерапевтические препараты (ганцикловир, фоскорнет натрия), иммуномодуляторы, интерферон.
Не нашли то, что искали? Воспользуйтесь поиском:
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Для цитирования: Щубелко Р.В., Зуйкова И.Н., Шульженко А.Е. Герпесвирусные инфекции человека: клинические особенности и возможности терапии. РМЖ. 2018;8(I):39-45.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
Key words: herpes viruses, Epstein-Barr virus, human herpes virus, cytomegalovirus, frequently ill adults, viral load, valacyclovir.
For citation: Shubelko R.V., Zuykova I.N., Shulzhenko A.E. Human herpesviruses infections: clinical features and opportunities of therapy // RMJ. 2018. № 8(I). P. 39–45.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Только для зарегистрированных пользователей
. или: Герпес, “простуда на губах”
Симптомы герпесвирусной инфекции
Инкубационный период
Формы
- Herpes labialis — герпес на губах.
Вызывается вирусом простого герпеса 1-го типа (ВПГ1). Сыпь появляется на губах, слизистой носовых ходов, полости рта. - Herpes genitalis — генитальный герпес.
Вызывается вирусом простого герпеса 2-го типа (ВПГ2). Сыпь появляется на слизистой половых органов (на половых губах, влагалище у женщин, на головке полового члена у мужчин), в области анального отверстия.
Высыпания крайне болезненны, в некоторых случаях могут затруднять ходьбу (из-за боли при трении).
Встречается несколько реже, чем инфекция, вызванная вирусом простого герпеса 1-го типа.
Причины
- Источник инфекции:
- больной человек;
- вирусоноситель (вирус содержится в организме человека, выделяется во внешнюю среду, но не вызывает у него симптомов заболевания. При этом заражает других людей).
- Пути передачи — воздушно-капельный (вирус выделяется из организма больного человека при кашле и чихании и распространяется в воздухе) и контактный — при поцелуях, со слюной и т.п.
- Практически все люди инфицированы вирусом простого герпеса. После первичного инфицирования вирус остается в организме человека навсегда.
- Обострение инфекции возникает при снижении иммунитета (переохлаждение, стресс, переутомление, простудные заболевания и т.п.).
Врач терапевт поможет при лечении заболевания
Диагностика
- Общий осмотр — характерные высыпания в виде пузырьков на губах, наружных половых органах.
- Лабораторные методы: метод ИФА (иммунофлюоресцентный анализ) и ПЦР (полимеразная цепная реакция) мазков со слизистых оболочек, крови.
- Возможна также консультация инфекциониста.
Лечение герпесвирусной инфекции
Осложнения и последствия
- В большинстве случаев инфекция простого герпеса протекает без осложнений и не имеет последствий.
- офтальмогерпес — поражение глаз, вызываемое вирусом простого герпеса 1-го типа. Чаще всего поражается роговица (прозрачная оболочка) глаза, возникает кератит (воспаление роговицы). Сопровождается болью, зудом в глазах, невозможностью смотреть на свет (светобоязнь) из-за усиления болей. При отсутствии лечения может привести к слепоте. Возможен также конъюнктивит (воспаление конъюнктивы — слизистой оболочки глаза).
- воспаление головного мозга (энцефалит) и твердой оболочки головного мозга (менингит). Сопровождается сильнейшими головными болями, рвотой, нарушением сознания, судорогами. Без своевременного лечения может привести к смерти больного.
Профилактика герпесвирусной инфекции
- Закаливание организма (проведение процедур, направленных на повышение устойчивости организма к воздействию низких (охлаждение) и высоких (перегревание) температур. Например, обливание холодной водой.
- В период подъема вирусной заболеваемости (ОРВИ) принимать поливитаминные препараты или витамин С.
- Избегать переохлаждений, стрессов, переутомлений.
- Для профилактики инфицирования генитальным герпесом рекомендуется использовать барьерные методы контрацепции (презервативы). В случае незащищенного полового акта с больным использовать антисептические растворы местно.
Дополнительно
ИНФОРМАЦИЯ ДЛЯ ОЗНАКОМЛЕНИЯ
Необходима консультация с врачом
“ Детские инфекционные болезни”, В.Н. Самарина, 2007.
“ Инфекционные болезни у детей”, В.В.Иванова, 2009.
“ Инфекционные болезни у детей”, В.Ф.Учайкин, 2011.
“ Грипп и другие острые респираторные заболевания” Методические указания по клинике, диагностике, лечению и профилактике в вооруженных силах Российской Федерации. Москва, 1998 г.
- Выбрать подходящего врача терапевт
- Сдать анализы
- Получить от врача схему лечения
- Выполнить все рекомендации
Л.Н.Хахалин, Е.В.Соловьева (Москва)
Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпесвирусным заболеваниям человека, связано со значительной эпидемиологической ролью и большой социальной значимостью некоторых из них в современном мире. Герпесвирусы были впервые идентифицированы в 1924 году; с тех пор с помощью биологических и иммунохимических методов описано более 100 типов герпесвирусов человека. Все они являются ДНК-геномными внутриклеточными паразитами и распространены повсеместно. Типичные герпесвирусы (вирионы, вирусные частицы) состоят из трех основных компонентов: нуклеоида, капсида и белково-липидной оболочки 2. Нуклеоид (геном вируса) – это двунитчатая ДНК, располагающаяся в центральной части. В ДНК герпесвирусов имеются множественные концевые и внутренние повторения концевых последовательностей – их общее количество составляет более 0,5% массы генома. Примерно каждое шестое повторение концевых последовательностей представлено нуклеозидом дезоксигуанозином.
По данным многочисленных исследований [3,4,11,12] к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпесвирусов (простого герпеса 1 и 2-го типов, варицелла зостер, цитомегаловирусом, Эпштейн-Барр, герпеса человека 6 и 8-го типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т.п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Инфицирование человека указанными герпесвирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: детская эритема (вирус герпеса человека 6-го типа), афтозный стоматит-”молочница” (вирусы простого герпеса 1 или 2-го типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейн-Барр), мононуклеозо-подобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпесвируса, влияние на течение острых и рецидивирующих герпесвирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онтогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
При всей очевидной легкости клинической диагностики острых герпесвирусных заболеваний (уж очень характерны сгруппированные герпетические везикулы) неподготовленные врачи нередко устанавливают не этиопатогенетический, а неверный, зачастую “топический” диагноз (табл. 1). Диагностические ошибки ведут к неправильному пониманию сути заболевания и препятствуют назначению этиопатогенетической терапии.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации – 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес. Реальное число больных этими формами острых герпесвирусных инфекций в России неизвестно; полагают, что в стране ежегодно не менее 3000 человек переносят герпетические нейроинфекции, 250000–300000 – офтальмогерпес, около 8000000 – генитальный герпес и 10000000– 12000000 – герпес губ и кожи. Однако на всей территории России в 1996 году по официальным данным Минздрава РФ было зарегистрировано всего 15799 случаев острого и рецидивирующего генитального герпеса [6], т.е. в 500 раз меньше минимальной рассчетной цифры.
По-видимому, все известные герпесвирусные инфекции могут рецидивировать, однако, как следует из многовекового опыта наблюдения за ними, порог и причины трансформации острой формы в рецидивирующую для каждого типа герпесвируса свои. Так, например, рецидивирование инфекций, вызванных вирусом простого герпеса, нередко наблюдается на фоне стрессов, неспецифических эндокринных нарушений, изменения географической зоны проживания, гиперинсоляции и др. У пожилых людей, перенесших в детском возрасте ветряную оспу, рецидив инфекции, вызванной вирусом варицелла зостер, протекает в форме опоясывающего лишая (опоясывающего герпеса). Субклинические рецидивы цитомегаловирусной инфекции чаще всего наблюдаются у беременных и больных, получающих иммуносупрессорную терапию. В то же время инфекции, вызванные вирусом Эпштейн-Барр, рецидивируют крайне редко и только у больных с врожденным или приобретенным иммунодефицитом. В целом герпесвирусные инфекции принимают рецидивирующее течения не более, чем у 8–20% больных. Рецидивирующие герпесвирусные заболевания у некоторых людей могут восприниматься как “хронические”, когда они продолжаются в течение многих лет, разрушая не только физическое здоровье и функции жизненно важных систем, но и психологически калеча больного. Поэтому для практических целей герпесвирусные инфекции классифицируют с учетом одновременно локализации процесса, рецидивирования и этиологии (табл. 2) [11,12]. Причины рецидивирующего течения герпесвирусных инфекций многообразны. Во-первых, трансформация острого герпесвирусного процесса в хронический происходит при явном попустительстве иммунной системы. Если приобретенный иммунодефицит в результате химиотерапии или ВИЧ-инфекции легко объясним, то все попытки вычленить какой-либо “главный дефект” иммунного ответа у иммунологически полноценных людей с рецидивирующим течением герпесвирусной инфекции оказались безуспешными. У одних больных находят дефекты в афферентном звене специфического противогерпетического иммунного ответа, у других – в эфферентном, у третьих – в обоих звеньях. Во-вторых, определенную роль играют, по-видимому, количественные и качественные особенности персистенции и латенции конкретного штамма герпесвируса в организме больного.
Некоторые рецидивирующие герпесвирусные заболевания в настоящее время являются основными причинами снижения качества жизни. По косвенным данным, на территории России рецидивирующими герпесвирусными инфекциями страдает около 15 млн человек. Наибольшее распространение и социальную значимость получил рецидивирующий генитальный герпес [3,4] – одна из наиболее часто встречающихся инфекций, передаваемых половым путем. Проблема диагностики рецидивирующего генитального герпеса осложняется тем, что у женщин почти в 65% случаев заболевание протекает атипично. Если экстраполировать европейские данные по популяционной эпидемиологии, то рассчетное число больных рецидивирующим генитальным герпесом должно составлять 8–10 млн человек, что совершенно не согласуется ни с официальной статистикой, ни с впечатлением дерматовенерологов, урологов и гинекологов о частоте этого заболевания в популяции. В зависимости от частоты рецидивов и субъективной переносимости симптомов интоксикации и местных проявлений, рецидивирующий генитальный герпес в той или иной степени ухудшает качество жизни больных. По данным зарубежных и отечественных исследователей [4,6], часто рецидивирующий генитальный герпес наблюдается у 50–75% больных, а редко рецидивирующий – у 10%.
Таблица 2. Острые и рецидивирующие герпесвирусные заболевания человека
| Тип герпесвируса | Первичные заболевания | Рецидивирующие заболевания |
| Вирус простого герпеса 1 | Гингивостоматит, кератоконъюнктивит | Оральный герпес, кератоконъюнктивит, энцефалит |
| Вирус простого герпеса 2 | Генитальный герпес, неонатальный герпес, диссеминированный герпес | Генитальный герпес |
| Вирус варицелла зостер | Ветряная оспа, диссеминированная ветрянка | Опоясывающий герпес, диссеминированная ветрянка при иммунодефиците |
| Вирус Эпштейн-Барр | Инфекционный мононуклеоз, В-клеточная лимфопролиферация | Инфекционный мононуклеоз, лимфома Беркита, назофарингеальная карцинома |
| Цитомегаловирус | Врожденные аномалии, цитомегалия при иммунодефиците | Цитомегалия у больных после трансплантации органов, ретинит, колит или нейроинфекции при СПИДе |
| Вирус герпеса человека 6 | Эритема новорожденных | Системные болезни после трансплантации |
| Вирус герпеса человека 7 | Эритема новорожденных | Неизвестны |
| Вирус герпеса человека 8 | Саркома КKапоши | Неизвестны |
Лабораторные методы диагностики герпесвирусных инфекций в настоящее время применяют только в тех случаях, когда необходимо уточнить этиологию или оценить динамику заболевания [5,10]. Наиболее часто уточнение этиологии заболевания требуется при поражении органа зрения (увеит, конъюнктивит и кератоконъюнктивит), ЦНС (серозный энцефалит и менингит) и половых органов (наружные половые органы, цервицит, уретрит), так как не только герпесвирусы, но и довольно большое число других вирусов вызывают острые и рецидивирующие заболевания этих органов. В подобных случаях ошибка при выборе этиопатогенетических препаратов и их доз зачастую приводит к необратимым последствиям. Лабораторный контроль за течением герпесвирусных заболеваний обычно необходим при диссеминации процесса, у беременных женщин и больных с иммунодефицитом различного происхождения. Этим целям никак не соответствуют получившие распространение в России методы определения титров противогерпетических антител, которые являются только косвенным свидетельством активности процесса и специфического иммунного ответа, в то время как для понимания этиологии, стадии и течения процесса врачи должны располагать сведениями о наличии или отсутствии самих герпесвирусов или их антигенов (табл. 3).
Практически во всем мире лечение острых и рецидивирующих герпесвирусных инфекций прредполагает монотерапию специфическими противогерпетическими химиопрепаратами, однако в России, к сожалению, все еще идут дискуссии на тему выбора метода лечения. Часть отечественных специалистов широко пропагандируют метод противогерпетической вакцинотерапии, обосновывая свою позицию тем, что иммунизация вакциной должна привести к созданию в организме иммунологически полноценного человека сильного специфического противогерпетического иммунитета. Другая часть врачей предпочитают применять препараты, обладающие т.н. “иммуномодулирующими свойствами”, т.е. якобы способные изменять естественно сложившуюся активность специфического иммунитета. И та, и другая концепции не выдерживают критики, так как иммунизация иммунологически полноценного и уже заведомо инфицированного человека (а таковыми являются более 90% людей старше 18 лет) противогерпетической вакциной по всем законам иммунологии и по данным контролируемых исследований не способна качественно изменить сложившийся специфический иммунитет. Наблюдающиеся количественные изменения характеризуются только повышением уровня специфических антител, которые не дают значимого протективного эффекта при герпесвирусных инфекциях [12]. Применение же препаратов, которые в лабораторных исследованиях вызывают изменения функциональной активности некоторых клеток иммунной системы, в силу неопределенности и неспецифичности этого воздействия, не может быть рекомендовано для лечения заболевания, этиология и патогенез которого известны. Тем более, что сегодня доступны высокоспецифичные противогерпетические препараты – ациклические нуклеозиды, которые представляют собой синтетические аналоги компонентов ДНК человека и герпесвирусов.
Таблица 3. Современные методы лабораторной диагностики герпесвирусных инфекций человека
| Метод диагностики | Чувствительность (%) | Специфичность (%) | Время выполнения | Цель исследования — определение |
| Kультивирование вируса | 80-100 | 100 | 5 — 10 дней | Тип вируса |
| ПЦР (реакция полимеризации цепей вирусной ДНK) | 95 | 100 | 1 день | Тип вируса |
| Выявление антигенов (иммунофлюоресцентный, иммунопероксидазный, иммуноферментный) | 70 — 75 | 90 | 2 ч | Фаза процесса |
Механизм действия всех ациклических нуклеозидов [7,8] основан на том, что при репликации “дочерних” ДНК в качестве строительного материала используются все нуклеозиды, содержащиеся в инфицированной “материнским” герпесвирусом клетке. Если такую клетку насытить избыточным количеством какого-либо псевдонуклеозида, то он будет использоваться при построении цепей “дочерней” вирусной ДНК – второго поколения герпесвирусов. В результате “дочерняя” вирусная ДНК будет содержать необычно большое число дефектных нуклеозидов, что замедлит или даже полностью прекратит процесс ее копирования. В результате прекратится клонирование герпесвирусов (вирусостатический эффект). Если же матрицей ациклического нуклеозида выбрать какой-либо часто встречающийся в составе вирусной ДНК естественный нуклеозид, то это обеспечит весьма большой объем замещений в составе дочерних вирусных ДНК. Практически, при создании ациклических нуклеозидов в качестве матрицы чаще всего используют тимидин или гуанин. Обязательная для процесса включения в биосинтез первая фаза окислительного фосфорилирования естественных и синтетических нуклеозидов и сборка цепи вирусной ДНК проходят под влиянием не клеточных, а вирусных ферментов (тимидинкиназ и полимераз). Это позволяет избежать возможного участия ациклических нуклеозидов в биосинтезе ДНК человеческих клеток. Они потребляются только активно реплицирующимися герпесвирусами, чем достигается высокая специфичность противогерпетического эффекта. В табл. 4 приведены сведения об ациклических нуклеозидах, наиболее часто используемых в клинической практике для лечения и профилактики герпесвирусных заболеваний.
Ацикловир (Зовиракс, “GlaxoWellcome) стал первым ациклическим нуклеозидом, который на протяжении 20 лет широко используется в клинической практике для лечения различных герпесвирусных заболеваний (табл. 5). Он обладает прекрасной безопасностью и обеспечивает выраженный клинический эффект у 75–95% больных. Препарат выпускается в виде кожного крема, глазной мази, раствора для внутривенного введения, суспензии и таблеток. К настоящему времени Зовиракс был использован для лечения более чем у 50 млн людей. В 1988 году создателю Зовиракса Г.Элион была присуждена Нобелевская премия. Однако в России до 1990 года ацикловир был практически неизвестен. Скудность информации о препарате, его относительно высокая стоимость и консерватизм отечественных специалистов привели к тому, что очень часто, не получив ожидаемого эффекта от вакцинотерапии и иммуномодулирующей терапии при острых и рецидивирующих герпесвирусных заболеваниях, в России врачи прибегают к химиотерапии, но предпочитают использовать неспецифические и очень слабые противовирусные препараты. На рис 1. показана сравнительная эффективность ацикловира и одного из таких популярных “противогерпетических” препаратов – алпизарпина в российском многоцентровом контролируемом клиническом исследовании [9]. Реальная клиническая эффективность ацикловира в профилактике рецидивов генитального герпеса была несопоставимо выше таковой алпизарина.
Таблица 4. Наиболее часто используемые в России ациклические нуклеозиды
Читайте также:


