Иммунология лечение ревматоидного артрита
Ревматоидный артрит (РА) – хроническое системное заболевание, характеризующееся поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита.
РА регистрируется во всех странах мира и во всех климато-географических зонах с частотой 0,6-1,3%. Чаще болеют женщины, чем мужчины (3-4:1).
Ревматоидный артрит также характеризуется поражением сосудов всех калибров. В наибольшей степени поражаются мелкие сосуды. Изменения, происходящие в средних и крупных сосудах, в большой степени связаны с процессами в vasa vasorum и главным образом связаны с ишемизацией сосудистой стенки. Наиболее часто наблюдаются продуктивные васкулиты, тромбоваскулиты, реже панваскулиты типа узелкового периартериита.
Генерализованное поражение сосудистого русла при РА приводит к тому, что в процесс вовлекаются кожа, скелетная мускулатура, серозные оболочки, внутренние органы.
Ревматоидный процесс обычно локализуется в периферических суставах, поэтому основное значение в клинической картине болезни приобретает артриты конечностей.
Основными признаками РА являются:
1) Скованность в суставах по утрам, длящаяся не менее 1 ч до полного восстановления подвижности;
2) Артрит, характеризующийся отечностью мягких тканей вокруг трех или более суставов;
3) Артрит, характеризующийся отечностью проксимальных межфалан-говых, пястнофаланговых или запястных суставов;
4) Артрит, характеризующийся симметричностью пораженных суставов;
5) Ревматоидные узелки;
6) Наличие в сыворотке крови ревматоидного фактора;
7) Рентгенологические признаки эрозий и/или периартикулярной остеопении мелких суставов рук.
Наличие 4 из указанных признаков является достаточным для установления диагноза РА.
У 80% больных РА протекает без признаков системности и без висцеропатий. Только у 12-13% больных РА носит генерализованную форму. Эта форма помимо полиартрита и лимфаденопатии характеризуется поражением внутренних органов: сердца (перикардит, ревматоидный кардит), легких и плевры (плеврит, фиброзирующий альвеолит), почек (амилоидоз, гломерулонефрит, нефроангиосклероз), желудочно-кишечного тракта, печени, селезенки, нервной системы, кожи (ревматоидные узелки, хронические язвы), глаз (эписклерит, сухой конъюктивит), системы кроветворения. Системные поражения всегда свидетельствуют о неблагоприятном течении процесса и торпидности ко всем методам лечения.
Важными критериями тяжести и характера течения заболевания являются показатели крови. У больных РА почти всегда наблюдаются повышенные значения СОЭ. У тяжелых больных этот показатель может достигать 60-80 мм/час. Раннее и значительное повышение СОЭ и развитие анемии являются плохими прогностическими признаками заболевания. Ревматоидный фактор на ранних стадиях болезни выявляется редко (в 20-30% случаев). Раннее его выявление указывает на неблагоприятное течение болезни, а высокий титр, несмотря на клиническое улучшение, свидетельствует о возможности развития рецидива. Следует заметить, что РФ обнаруживается при многих инфекционных и аутоиммунных заболеваниях.
Показателем активности процесса является диспротеинемия (изменения в соотношении между количеством альбумина и глобулина, а также других белковых фракций крови). При острых и тяжелых случаях течения болезни существенно повышается фибриноген крови, иногда до 0,01 г/л (при норме 0,005 г/л).
При суставных формах РА с минимальной и умеренной активностью процесса средства базисной терапии (чаще всего аминохолиновые препараты) сочетают с нестероидными антивоспалительными препаратами (НАВП): ацетилсалициловой кислотой, амидопирином, анальгином, бутадионом, индометацином, реопирином, вольтареном, ортофеном. Клинический эффект от применения НАВП наступает быстро, обычно на 2-3 день лечения и продолжается только в период их применения. После прекращения употребления этих препаратов суставные симптомы возобновляются (боли, экссудативные явления).
Для подавления местного воспалительноо процесса применяют внутрисуставное введение лекарственных средств. При стойком активном РА отдельных суставов чаще всего внутрисуставно вводят гидрокортизон (по 50-125 мг в крупные суставы, 25-50 мг в средние и 5-10 мг в мелкие суставы). Курс такой терапии может включать 3-5 инъекций с интервалом в одну неделю. Для внутрисуставной терапии также используют кеналог, метипред, дексон, трикорт, дипрофос.
При упорном хроническом артрите коленных суставов с прогрессирующей костно-хрящевой деструкцией показано внутрисуставное введение радиоактивных препаратов золота или иттрия. Эти препараты, фиксируясь в патологически измененной синовиальной оболочке сустава, вызывают разрушение патологической ткани (лекарственная синовэктомия).
Для подавления местного воспалительного процесса применяют аппликации диметилсульфоксида, мазей индометациновой, вольтареновой и др., локальную криотерапию, а также физиотерапевтические процедуры.
В заключение следует заметить, что имеющиеся в распоряжении лекарственные средства позволяют сохранять трудоспособность у 70% больных РА.


Врачам пока не удалось до конца выяснить, почему у человека внезапно начинают воспаляться суставы. Точно известно только то, что толчок к началу болезни дает сбой в иммунной системе.
Что это такое?
На сегодняшний день одна из самых распространенных болезней, поражающих суставы — ревматоидный артрит. По статистике, от нее страдает каждый сотый житель Земли. Представительницы слабого пола болеют в пять раз чаще, чем мужчины. Возраст тоже имеет значение: болезнь обычно развивается после 30 лет.
Ревматоидный артрит — системное заболевание соединительной ткани, проявляющееся главным образом хроническим воспалением суставов. Поражаются, как правило, голеностопные суставы, суставы лодыжек, коленей и кистей рук.
Врачам пока не удалось до конца выяснить, почему у человека внезапно начинают воспаляться суставы. Точно известно только то, что толчок к началу болезни дает сбой в иммунной системе. Провокационными факторами могут стать переохлаждение, стрессы, травмы суставов и инфекции. Банальные ОРЗ, ангина и грипп могут осложнятся ревматоидным артритом. У 80% больных выявляются антитела к вирусу Эпстайна-Барр.
Что происходит?
Развивается болезнь постепенно и незаметно. Человек может хорошо себя чувствовать, вести привычный образ жизни, а тем временем в его организме уже появились антитела, вызывающие повреждение собственных тканей. Как только этих антител накапливается достаточно много, они начинают свою разрушительную деятельность — атакуют суставы и вызывают воспалительные реакции. Пораженные суставы постепенно деформируются и не могут нормально работать.
Чем это проявляется?
Как правило, ревматоидный артрит имеет достаточно четкий набор симптомов:
- утренняя скованность в суставах, продолжающаяся не менее 1 часа
- артриты суставов кисти
- симметричность поражения суставов
- т.н. ревматоидные узелки — подкожные уплотнения в области локтей (встречаются у 10-20% больных).
На более поздних стадиях заболевания могут поражаться периферические нервы, сосуды, сердце, легкие, почки и другие органы.
Для болезни характерно умеренное повышение температуры, бессонница и отсутствие аппетита.
В отсутствие лечения ревматоидный артрит приводит к постепенному разрушению пораженных суставов.
Диагностика
Ни в коем случае нельзя ждать, что все само собой пройдет. При первых признаках болезни срочно записывайтесь на прием к врачу-ревматологу. Только он может отличить ревматоидный артрит от похожих заболеваний и поставить правильный диагноз.
Выслушав ваши жалобы и осмотрев суставы, врач обязательно назначит биохимический и иммунологический анализы крови.
Чтобы определить степень поражения суставов, будет выполнен рентген, артроскопия или магнитно-резонансная томография суставов. Если потребуется, сделают пункцию и возьмут на исследование суставную жидкость.
При поражении внутренних органов может понадобиться консультация других специалистов: кардиологов, гастроэнтерологов, пульмонологов и т.д.
Лечение
К сожалению, волшебных таблеток, избавляющих пациентов от ревматоидного артрита быстро и навсегда, ученые пока не изобрели. Однако лечить болезнь можно и нужно.
Современные средства от ревматоидного артрита тормозят развитие болезни, снимают неприятные симптомы и предотвращают появление осложнений. Они бывают двух видов: противовоспалительные и иммуномодулирующие. Первые снимают воспаление и уменьшают боль. Вторые угнетают иммунные реакции и тем самым борются с самой болезнью. Необходимо иметь в виду, что все эти препараты придется пить очень и очень долго, возможно даже всю жизнь. К тому же они часто вызывают побочные реакции, поэтому принимать их нужно только под контролем врача.
Хороший лечебный эффект при артрите дают физиопроцедуры, за исключением тех, которые нагревают пораженный сустав. Особенно помогает низкочастотная магнитотерапия и низкочастотная лазеротерапия. Также больным показаны лечебный массаж и лечебная физкультура.
Если от лекарств больному не становится лучше, ему назначают хирургическую операцию по удалению пораженной ткани в суставе, это замедляет прогрессирование болезни. Сегодня большинство таких операций выполняют артроскопически (с использованием внутрисуставного зонда).

Ревматоидный артрит (РА) – наиболее распространенное хроническое воспалительное заболевание суставов, характеризующееся формированием опухолеподобной гиперплазии синовиальной оболочки (паннус), которой свойственен инвазивный рост с разрушением суставного хряща и подлежащей кости.
Этиология
Какой-либо единственный этиологический фактор, ответственный за развитие РА, не установлен. Считается, что заболевание развивается у генетически предрасположенных лиц под воздействием различных внешних или внутренних возмущающих воздействий – вирусной или бактериальной инфекции, травмы, в том числе операционной, психо-эмоционального стресса, медикаментозного вмешательства, возрастной гормональной перестройки и т. п. К настоящему времени накопилось достаточно доказательств значения генетической предрасположенности к РА.
Генетические факторы
Установлен факт семейной агрегации этого заболевания. У близких родственников больных РА заболевание развивается в 3-8% случаев, что в несколько раз выше, чем в популяции. Относительный риск развития РA у монозиготных близнецов в 12-62 раза выше, чем у несвязанных индивидуумов, а у дизиготных близнецов с разделенными только на 50% генами риск РА выше в 2-17 раз. Однако, в отличие от классических генетических болезней, РA – полигенное и генетически гетерогенное заболевание. То есть множество различных генов и их комбинаций предрасполагает к РA, и они могут отличаться у разных пациентов. Кроме того, некоторые гены скорее влияют на тяжесть, чем на возникновение РА. Учитывая эту сложность и множественность внешних пусковых моментов заболевания, неудивительно, что небольшое количество генов надежно ассоциируется с РА.
Главный комплекс гистосовместимости – единственная генетическая область, последовательно связанная с РA. Это – большой генетический регион на коротком плече 6 хромосомы. Большая часть главного комплекса гистосовместимости включает гены HLA. Кодируемые этими генами белки играют определяющую роль в реактивности иммунной системы индивидуума. HLA гены участвуют в иммунной функции, представляя антигены T-клеткам и стимулируя их активацию. Они также регулируют тимусную селекцию незрелых T-клеток. Самую сильную связь с РА имеют гены ІІ класса HLA региона и, в частности, HLA-DRB1. Молекулы HLA-DR включают альфа цепь (HLA-DRA) и высоко полиморфную бета цепь (HLA-DRB1), и составляют платформу, на которой представлены антигенные пептиды для рассмотрения иммунной системой. На европейском континенте РА ассоциируется с носительством генов HLA-DR4 и HLA-DR1. Так, у больных с позитивным по ревматоидному фактору (РФ) РА ген HLA-DR4 выявляется в среднем в 50-55% случаев, в то время как при РФ-негативном РА и в популяции – в 20-25%. Более того, оказалось, что различные подтипы HLA-DR4 имеют корреляцию с клиническими проявлениями и течением заболевания. Например, для больных с быстрым появлением костных эрозий и внесуставными проявлениями характерен HLA-DRB1*0401 подтип, а пациенты с HLA-DRB1*01 подтипом имеют более благоприятное течение болезни. Другой аспект HLA аллелей при РА – возможные добавочные, усиливающие влияния гаплотипов. Так, лица с HLA-DRB1*0401/0404 имеют более высокий риск развития одной из наиболее тяжелых форм РА – синдрома Фелти. Выявлена также корреляция между аминокислотными последовательностями HLA-DRВ1 и выработкой РФ: у РФ-позитивных пациентов в 71 позиции представлен лизин, в то время как у РФ-негативных это положение занято аргинином [9, 10].
Имеются некоторые данные в пользу вовлечения в ассоциацию с РА и других генов, регулирующих иммунный ответ. Сюда относятся ген, кодирующий фактор некроза опухоли-альфа (ФНО-α), который также находится в пределах главного комплекса гистосовместимости, специфические гены иммуноглобулинов, в том числе иммуноглобулина, связывающего Fc-рецепторы. Есть сведения о генетических ассоциациях и с другими локусами цитокинов – интерлейкина-1 (ИЛ-1), ИЛ-3, ИЛ-4 и ИЛ-10, а также кортикотропин-рилизинг фактора. Белковый продукт последнего гена играет важную роль в гипоталамо-питуитарно-адреналовой оси, которая также может участвовать в местной воспалительной реакции в суставе.
Впрочем, считается, что генетический вклад в этиологию РА относительно мал – в пределах 15-30% [10, 25].
Триггерная роль инфекции
Предположение о вероятной роли инфекции как пускового механизма развития РА базируется на том, что многие микроорганизмы участвуют в возникновении сходных с РА воспалительных артропатий у людей или у животных. Например, адъювантный артрит у животных может быть вызван иммунизацией экстрактами микобактерий. Вирус иммунодефицита способен индуцировать у человека суставную патологию, а парвовирус В19 вызывает преходящую артропатию, имеющую черты сходства с РА. Наиболее очевидный пример – реактивные артриты, в развитии которых доказана роль различных микроорганизмов. У больных РА с повышенной частотой обнаруживают патологические титры антител к вирусу Эпштейна-Барра, Proteus mirabilis. Однако по сегодняшний день никаких доказательств взаимосвязи между РА и любым инфекционным агентом не представлено. Более частое обнаружение антител к некоторым микроорганизмам у лиц с РА (как правило, на поздней стадии), возможно, является следствием системной патологии иммунной реактивности, а не отражает этиологическую роль инфекции. К тому же не наблюдается никаких эпидемиологических черт РА, свойственных инфекционным заболеваниям – увеличения его частоты в скученных коллективах или сезонности. Теоретически же нельзя исключить, что РА вызывается хронической пока не идентифицированной инфекцией.
Другие этиологические факторы
В последние годы активно обсуждается роль средовых факторов, курения, характера питания, уровня доходов, однако представленные данные больше свидетельствуют о влиянии на течение заболевания, но не на его возникновение [13, 16, 20]. Хотя кажется высоко вероятным, что факторы окружающей среды должны вызывать развитие РА у генетически предрасположенных индивидуумов, однако фактических доказательств этого предположения пока нет.
Суммируя имеющиеся данные, можно предположить, что в организме генетически восприимчивого индивидуума вследствие нарушений регуляции иммунного ответа происходит задержка разрешения острого воспалительного процесса в суставах (клинически явного или скрытого), вызванного любым из триггерных факторов (травма, инфекция, пищевой антиген и т. п.). Таким образом, острое воспаление трансформируется в хроническое, протекающее далее по аутоиммунному механизму, в отличие от не предрасположенных к РА субъектов, у которых острый процесс в условиях нормальной иммунорегуляции заканчивается полным выздоровлением.
Патогенез
Основной патологический процесс при РА – разрушение суставного хряща и субхондральной кости эктопической гиперплазированной синовиальной тканью. В отличие от этиологии, патогенез заболевания изучен достаточно фундаментально и в сведениях о нем гораздо меньше противоречий. РА рассматривается как иммунозависимое заболевание с аутоиммунным компонентом. В пользу этого свидетельствуют: генетическая связь с комплексом HLA; инфильтрация синовиальной оболочки иммунокомпетентными клетками; наличие в полости сустава и циркулирующих в крови различных типов РФ; В-клеточно-зависимый механизм внесуставных поражений; эффективность иммуносупрессивной терапии.
Установлено, что определяющая роль в патогенезе ревматоидного воспаления суставов принадлежит Т-клеткам. В частности, формирование в синовиальной мембране сложных лимфоидных структур, определяющих деструктивную природу синовита, протекает с обязательным участием Т-клеток с хелперной функцией (Th). Все современные гипотезы патогенеза РА сконцентрированы вокруг двух концепций – Т-клеточно-цитокиновой и неиммунной. Согласно первой из них, активированные специфическим антигеном Т-клетки ответственны за формирование клеточной кооперации, состоящей из лимфоцитов, макрофагов, моноцитов, фибробластов, дендритных и других клеток, которая путем выработки цитокинов индуцирует развитие паннуса и контролирует весь ход хронического воспаления в суставе. Вторая концепция предполагает центральную роль в деструкции суставного хряща неиммунных механизмов, а именно трансформированного, генетически измененного синовиоцита, ответственного за опухолеподобный рост паннуса и обеспечивающего автономность этого процесса. По-видимому, речь идет о взаимодополняющих концепциях, отражающих соответственно раннюю и позднюю стадии РА [6, 16, 24].
Т-клетки, макрофаги и цитокины
Инициирующим этапом патологического процесса является проникновение в полость сустава экзогенного или эндогенного антигена. Он поглощается и обрабатывается макрофагами и дендритными клетками, и затем его активные пептиды выводятся на поверхность этих клеток. Там, находясь в связи с генами HLA-DR, антиген презентируется Т-лимфоцитам CD4+. Сенсибилизированные Т-клетки путем прямых межклеточных взаимодействий и выработки цитокинов активируют макрофаги, фибробласты, которые в свою очередь продуцируют провоспалительные цитокины, стимулирующие рост и пролиферацию тех же Т-лимфоцитов, а также моноцитов, синовиоцитов, хондроцитов, эндотелиальных клеток.
Центральными провоспалительными цитокинами, ответственными за формирование деструктивного клеточно-гуморального потенциала в синовиальной оболочке, являются ФНО-α и ИЛ-1. Они вырабатываются активированными Т-клетками, моноцитами, макрофагами, фибробластами и эндотелиоцитами. ФНО-α способствует высвобождению других провоспалительных цитокинов, включая ИЛ-1, ИЛ-6 и ИЛ-8, высвобождению и активации разрушающих хрящ матриксных металлопротеиназ, экспрессии молекул адгезии, которые обеспечивают миграцию клеток в воспаленную ткань. ИЛ-1 и ИЛ-2, обладая и собственной провоспалительной активностью, стимулируют выработку других провоспалительных (ИЛ-6, ИЛ-8, ИЛ-12, гранулоцито-макрофагальный колониестимулирующий фактор – ГМ-КСФ и др.) и противовоспалительных цитокинов (ИЛ-4, ИЛ-10, растворимый рецептор ФНО, растворимый рецептор и антагонист ИЛ-1 и др.) со смещением баланса в пользу первой группы. Связующим звеном между активацией клеточного и гуморального иммунитета является ИЛ-6, который играет важную роль в дифференциации В-клеток в клетки, секретирующие антитела. Показано, что уровни ИЛ-6 положительно коррелируют с уровнями РФ. Хотя в последние годы спектр приписываемых ФНО-α и ИЛ-1 биологических эффектов несколько сузился за счет рассредоточения их функций среди других интерлейкинов и интерферона-гамма (ИФ-γ) (см. таблицу), однако они по-прежнему считаются ключевыми фигурами цитокинового каскада. Это подтверждается клинической эффективностью лекарственных препаратов, нейтрализующих активность ФНО-α и ИЛ-1 (этанерцепт, инфликсимаб, адалимумаб, анакинра и др.) [5, 15, 19, 26].
Синовиальная оболочка при раннем РА представляет собой классическую картину иммунного ответа по Th1 типу, который опосредуется вырабатываемыми активированными Т-клетками цитокинами, особенно ИЛ-2, ИФ-γ, ФНО-α и ГМ-КСФ. Фактически, развитие ревматоидного синовита обеспечивается провоспалительными Th1 клетками, которые характеризуются продукцией ИЛ-2, ИФ-γ и лимфотоксина-α, в условиях нарушенной дифференцировки Th2 клеток, вырабатывающих противовоспалительные цитокины ИЛ-4 и ИЛ-5. Поэтому изменение баланса Th1/Th2 клеток в пользу противовоспалительных Th2 клеток рассматривается как клинически выгодное [7, 8]. Действительно, базисные препараты для лечения РА типа лефлюномида, сульфасалазина, метотрексата и циклоспорина демонстрируют способность модулировать Th1/Th2 баланс [3, 4, 12]. Подобным образом глюкокортикоиды способствуют секреции цитокинов Th2 клетками, вероятно, путем воздействия на активацию моноцитов [2].
Доминирующий в синовиальной оболочке потенциал провоспалительных цитокинов обеспечивает реализацию и других звеньев хронического ревматоидного синовита, в том числе новообразование сосудов (неоангиогенез), миграцию лейкоцитов, активацию циклооксигеназы-2 (ЦОГ-2) и продукцию простагландинов, высвобождение факторов комплемента.
Ангиогенез, миграция лейкоцитов
Важную роль в ангиогенезе и пролиферации фибробластов играют вырабатываемые макрофагоподобными и фибробластоподобными синовиоцитами факторы роста эндотелиоцитов, тромбоцитов, фибробластов. Стимулами роста эндотелиальных клеток и неоваскуляризации являются также гипоксия и молекулы адгезии сосудистой клетки (VCAM-1). На сосудистом эндотелии представлено также много и других молекул адгезии, включая Е-селектин и межклеточные молекулы адгезии (ICAM). Их экспрессия стимулируется провоспалительными цитокинами ИЛ-1, ФНО-α и ИЛ-8 и приводит к прилипанию нейтрофилов и моноцитов к активированному эндотелию с участием лейкоцитарных рецепторных белков – интегринов. Дальнейшее продвижение клеток воспаления через межэндотелиальные промежутки в сустав происходит с помощью хемокинов – низкомолекулярных регуляторных пептидов типа моноцитарных хемотаксических белков (МСР-1 и МСР-2), которые широко представлены в воспаленной синовиальной оболочке. Миграция лейкоцитов через сосудистую стенку идет по градиенту концентраций хемокинов и управляется взаимодействием интегринов с соединительнотканными лигандами [17, 21, 22].
Апоптоз
Физиологической гиперплазии ткани и пролиферации лимфоцитов в процессе иммунного ответа обычно противодействует запрограммированная смерть клеток, или апоптоз, предотвращающая избыточное накопление клеточных популяций. Однако в ревматоидной синовиальной оболочке присутствуют относительно немного клеток в состоянии апоптоза, несмотря на наличие таких мощных стимулов смерти клетки, как гипоксия и ФНО-α. Происходит активная ингибиция апоптоза, обусловленная изобилием антиапоптотических молекул, которые вырабатываются синовиоцитами и синовиальными лимфоцитами. Известно, например, что продуцируемый фибробластами ИФ-γ предотвращает апоптоз Т-клеток. Принципиальное значение для понимания неиммунной концепции патогенеза РА имеет нарушение апоптоза синовиоцитов, которое может быть следствием обнаруженной мутации гена р53, ответственного за подавление опухолевого роста. Генные мутации синовиоцитов, вероятно, вторичны по отношению к гипоксической внутрисуставной среде, поскольку выявляются только на поздних стадиях заболевания. Они могут происходить вследствие разрушительного влияния свободных кислородных радикалов, перекисных соединений, оксида азота и других генотоксических факторов микросреды воспаленного сустава на ДНК [16].
Воспаление и деструкция тканей
Непосредственно деструктивное действие на внутрисуставные ткани оказывает паннус, который формируется из новообразованных сосудов, обеспечивающих приток новых клеток и питательных веществ, а также активированных синовиоцитов и других типов клеток. Паннус, клеточно-соединительнотканный массив которого в десятки раз превышает массу нормальной синовиальной оболочки, обладает признаками опухолеподобного роста и пенетрирует в хрящ, субхондральную кость и связочный аппарат. Полагают, что напоминающие злокачественную опухоль свойства паннуса – длительное поддержание высокой активности клеток даже в отсутствие стимулов, неконтролируемое размножение, отсутствие контактного угнетения роста – обусловлены наличием в его составе упоминавшихся генотипически измененных фибробластоподобных синовиоцитов. Составляющие паннус клетки, в первую очередь синовиоциты, секретируют множество деструктивных ферментов. Наибольшее значение среди них имеют металлопротеиназы (коллагеназа, стромелизин, желатиназа), а также сериновые и цистеиновые протеазы, такие как катепсины. Эти ферменты действуют на коллаген и протеогликановый матрикс, разрушая основное внеклеточное вещество суставного хряща. ИЛ-1 и ФНО-α также синергически участвуют в этом процессе, повышая продукцию матричных металлопротеиназ хондроцитами, а также стимулируя резорбцию кости путем активации остеокластов. Кроме того, ИЛ-1 повышает выработку индуцибельной NO-синтетазы и содержание оксида азота. Высокий уровень оксида азота способствует гибели хондроцитов – клеток, ответственных за ремоделирование хряща. Недавно описаны и другие важные медиаторы деградации хряща и резорбции кости – фактор дифференциации остеокластов, активатор рецептора ядерного фактора (В, экспрессируемые на остеобластах и стромальных клетках, а также в растворимом виде секретируемые активированными Т-клетками. Комбинированное воздействие этих медиаторов, ИЛ-1 и ФНО-α вносит весомый вклад в развитие периартикулярного и системного остеопороза, свойственного РА [8].
Воспалительный процесс протекает при непосредственном участии мигрировавших в сустав лейкоцитов. Под действием ИЛ-8 и при фагоцитозе иммунных комплексов и продуктов деградации повышается функциональная активность нейтрофилов с образованием активных форм кислорода, высвобождением лизосомальных ферментов и продукцией простагландинов и лейкотриенов. Активированные синовиоциты, макрофаги и другие клетки также экспрессируют ЦОГ-2 и вырабатывают провоспалительные простаноиды. Накопление мембранотоксичных реактивных форм кислорода связывают еще и с реперфузионным повреждением тканей, ишемизированных вследствие хронически повышенного внутрисуставного давления (подобно тому, как это описано для ишемизированного миокарда) [22, 24].
Таким образом, развитие РА инициируется активированными Т-клетками и макрофагами, которые посредством продукции цитокинов вовлекают в патологический процесс многие типы клеток внутрисуставного происхождения и мигрирующих из крови, повышают их функциональную активность и выработку медиаторов воспаления. Ключевыми цитокинами в патогенезе ревматоидного воспаления являются ФНО-α и ИЛ-1, которые в конечном итоге способствуют инфильтрации мононуклеарными клетками синовиальной оболочки, ее гиперплазии и фиброзу, разрушению хряща и резорбции кости. Процесс становится необратимым, очевидно, на этапе образования генных мутаций в фибробластоподобных синовиоцитах, участвующих в образовании паннуса.

Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р 0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
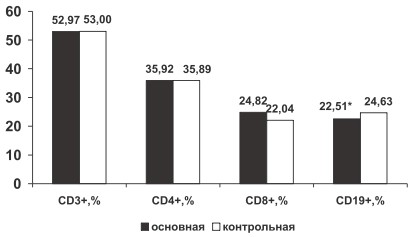
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р 0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р 0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
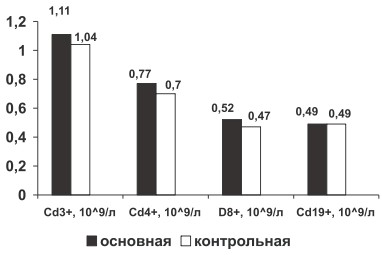
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
Читайте также:


