Индикаторы качества инфекционного контроля
Для оценки качества дезинфекции как противоэпидемического мероприятия используются следующие критерии: а) своевременность проведения дезинфекции; б) полнота охвата дезинфекционными мероприятиями; в) соблюдение методики проведения дезинфекционных мероприятий; г) качество средств дезинфекции.
Качество заключительной дезинфекции оценивается по результатам контроля, который осуществляется соответствующими подразделениями центров дезинфекции и стерилизации и центров гигиены и эпидемиологии. При этом контроль должен быть внезапным, независимым и объективным [21].
В течение длительного времени дезинфекция оценивалась как своевременная, если она была проведена после эвакуации больного не позже 6 часов в городах и не позже 12 часов в сельской местности [5, 7, 18]. Однако дезинфекционная практика показала, что эти сроки, с одной стороны, трудно объективно учесть, а с другой стороны, они часто оказывались невыполнимыми (например, при госпитализации больного в вечернее время). Так, по данным Л.И.Карпенко с соавт. [12], в день изоляции заболевшего ребенка из детского дошкольного учреждения выполнено только 12,7% заключительных дезинфекций. На второй день и позже изоляции заключительная дезинфекция проведена в 87,3% детских дошкольных учреждений. Исследования В.Г.Катькалова с соавт. [15], показывают, что в первые 6 часов после получения заявки заключительная дезинфекция проводилась в 60% очагов острых кишечных инфекций.
С учетом этого организационно оправданным и эпидемиологически приемлемым является выполнение заключительной дезинфекции в эпидемических очагах в течение суток с момента госпитализации или изоляции больного из организованного коллектива. Разумеется, что эти сроки не могут быть оправданными при возникновении очагов карантинных и особо опасных инфекций, в которых заключительная дезинфекция должна проводиться тотчас же после госпитализации больного.
Полнота охвата заключительной дезинфекцией оценивается как удовлетворительная если дезинфекционные мероприятия проведены не менее, чем в 95% от числа эпидемических очагов, подлежащих обработке.
Соблюдение методики проведения дезинфекционных мероприятий оценивается визуально и с использованием лабораторных методов не менее, чем в 1% квартирных очагов и не менее, чем 10% организованных коллективах, в период от 1 до 3 часов после окончания дезинфекции. При этом в каждом очаге отбирают не менее 10 смывов для микробиологических исследований, 10 экспресс-проб на остаточное количество дезинфицирующих веществ.
Во многих руководствах [5, 7, 18] и инструктивно-методических документах прошлых лет указывается на неудовлетворительное качество заключительной дезинфекции, если санитарно-показательная микрофлора обнаруживается хотя бы в одном смыве. Исследования последних лет показывают, что требование полного уничтожения санитарно-показательной микрофлоры (кишечная палочка, золотистый стафилококк и др.) в окружении больного в эпидемическом очаге маловероятно и научно не обосновано [44].
В настоящее время заключительная дезинфекция оценивается как удовлетворительная при высеве санитарно-показательной микрофлоры не более, чем 0,5% смывов и неудовлетворительных экспресс-пробах на наличие остаточных количеств дезинфицирующих веществ не более, чем в 0,5% проб.
Для оценки качества средств дезинфекции в контролируемых очагах отбирают не менее 2 проб дезинфицирующих растворов и средств с целью определения процентного содержания в них активно действующего вещества. Применение дезинфицирующих растворов заниженной концентрации не допускается.
Если после проведения заключительной дезинфекции высевается патогенная микрофлора, то дезинфекция оценивается как неудовлетворительная. В этих случаях необходимо повторное проведение заключительной дезинфекции с последующим лабораторным контролем.
Качество текущей дезинфекции. Текущая дезинфекция считается своевременно организованной, если население начинает выполнять ее не позже, чем через 3 часа с момента выявления инфекционного больного.
Центр дезинфекции и стерилизации или территориальный центр гигиены и эпидемиологии осуществляет контроль качества текущей дезинфекции в очагах, с применением лабораторных методов не менее, чем в 1% очагов. Обязателен контроль текущей дезинфекции в очагах брюшного тифа, паратифов, дизентерии, туберкулеза, дифтерии, грибковых заболеваний. При остальных инфекционных заболеваниях контроль проводится по эпидемическим показаниям.
При контроле текущей дезинфекции в очаге инфекционного заболевания на дому проверяют правильность приготовления дезинфицирующих растворов и методов обеззараживания.
При осуществлении контроля минимальное количество взятых анализов в одном очаге составляет: бактериологические смывы - 10 смывов; дезинфицирующие средства - по одной пробе сухого препарата и рабочего раствора.
Качество текущей дезинфекции считается удовлетворительным если число неудовлетворительных смывов менее 3%, количество отрицательных экспресс-проб на наличие остаточного количества дезинфицирующего препарата не более 3%, а число неудовлетворительных анализов дезрастворов не более 5%.
Экспресс-метод определения хлорсодержащих дезинфектантов с помощью метоловой индикаторной бумаги. При взаимодействии метола с активным хлором индикаторная полоска быстро меняет цвет на сиренево-зеленую гамму оттенков в зависимости от концентрации активного хлора. Цвет полоски сравнивают со шкалой цветности, где каждой концентрации раствора соответствует определенный цвет бумаги.
Экспресс-методом можно определить наиболее часто используемые на практике растворы следующих концентраций: 0,5; 1,0; 3,0; 5,0; 10%. Окраска индикаторной бумаги и соответствующие ей концентрации растворов представлены в таблице 14.
Для приготовления индикаторных метоловых бумажек используют фильтровальную бумагу. Ее обильно смачивают 1% водным раствором метола и высушивают в темноте. Нарезают полоски 1 х 5 см - в темноте и
Цвет индикаторной бумаги и концентрация растворов дезинфектантов
| Растворы | Концен- трация (%) | Цвет индикаторной бумаги |
| Хлорамина | 0,5 1,0 3,0 | светло-сиреневый темно-сиреневый салатовый |
| Хлорной извести | 5,0 1,0 10,0 | темно-зеленый блекло-сиреневый белый (может быть с легкой желтизной) |
| Гипохлорита кальция | 0,5 5,0 | блекло-сиреневый белый (может быть с легкой желтизной) |
их необходимо хранить в темных пакетах от фотобумаги или стеклянных оранжевых флаконах с притертой пробкой. Срок годности индикаторных бумажек - 1 месяц.
Качество камерной дезинфекции оценивается прежде всего по соблюдению предусмотренных инструкциями режимов, что отмечается в специальном журнале. Контроль температурного режима в камерах осуществляют путем закладывания в вещи максимальных термометров, которые помещаются на различных уровнях (примерно в 15 точках).
Вместо максимальных термометров могут быть использованы некоторые вещества с определенной температурой плавления, например нафталин (80°С), резорцин (110°С), сера (120°С). Вещества эти закладывают в стеклянные трубочки. Если по окончании экспозиции они оказываются расплавленными, то это является доказательством того, что в камере была достигнута нужная температура. Однако ни по показаниям максимальных термометров, ни по химическим веществам нельзя судить о том, сколько времени держалась достигнутая температура. Наиболее надежным методом контроля работы дезинфекционных камер является биологический метод.
Для контроля дезинфекции готовят тест-объекты: бумажки, пропитанные культурами определенных микробов, которые помещают в мешочки и закладывают в вещи в 15-20 точках камеры. По окончании экспозиции тест-объекты извлекают и засевают в мясо-пептонный бульон, который помещают в термостат. Если в течение суток роста в пробирках не наблюдается, то это свидетельствует о хорошем бактерицидном эффекте.
Не нашли то, что искали? Воспользуйтесь поиском:
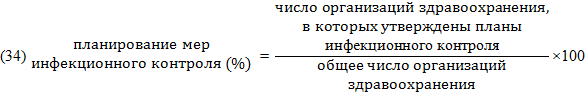
Наличие утвержденных планов инфекционного контроля, соответствующих международным рекомендациям, является основным шагом в предотвращении распространения туберкулеза в организациях здравоохранения.

Показатель может быть рассчитан как по региону в целом, так и по отдельным медицинским организациям.




Значения показателей 34 – 39 должны приближаться к 100%.


При эффективной реализации мероприятий по инфекционному контролю значения показателей 40 и 41 должны приближаться к 0%.

Показатель 42 необходим для планирования мероприятий по оздоровлению работников противотуберкулезных организаций.
ПРОВЕДЕНИЕ КОГОРТНОГО АНАЛИЗА
Общие положения
Карта лечения пациента заполняется врачом-фтизиатром противотуберкулезной организации, в которой пациент был зарегистрирован и начал лечение ПТЛС, и передается вслед за пациентом в организацию, где будет осуществляться дальнейшее лечение и наблюдение.
Оценка результатов лечения в когорте проводится через 12-15 месяцев от даты регистрации и начала лечения для всех пациентов, включая тех, у которых установлен МЛУ-ТБ.
Журнал регистрации ведется по утвержденному образцу.
Оценка результатов лечения пациентов, зарегистрированных как МЛУ-ТБ, проводится через 24-36 месяцев от даты начала лечения.
Пациенты с МЛУ-ТБ для когортного анализа распределяются:
1. В соответствии со статусом предыдущего лечения:
I группа: впервые выявленные (новые) пациенты с МЛУ-ТБ, никогда ранее не принимавшие ПТЛС или получавшие противотуберкулезную ХТ на протяжении менее 1 месяца;
II группа: пациенты с МЛУ-ТБ с рецидивом туберкулезного процесса;
III группа: пациенты с МЛУ-ТБ после отрыва от лечения;
IV группа: пациенты с МЛУ-ТБ после первого неэффективного курса ХТ;
V группа: пациенты с МЛУ-ТБ после повторного неэффективного курса ХТ;
VI группа: пациенты с МЛУ-ТБ, прибывшие из других регистров ТБ (из других стран);
VII группа: пациенты с МЛУ-ТБ, получавшие лечение ранее, не входящие в группы II-VI.
2. В зависимости от предыдущего лечения ПТЛС второго ряда:
– пациенты, лечившиеся ранее только ПТЛС первого ряда на протяжении 1 месяца и более;
– пациенты, лечившиеся ранее одним или более ПТЛС второго ряда на протяжении 1 месяца или более в сочетании с ПТЛС первого ряда или без них.
Для пациентов, зарегистрированных по IV категории, проводятся когортный анализ регистрации и когортный анализ результатов лечения.
Когортный анализ регистрации необходим для мониторинга распространенности и динамики ЛУ-ТБ в регионе. Для этого используется журнал регистрации МЛУ-ТБ и электронный регистр.
В журнал регистрации МЛУ-ТБ и электронный регистр вносятся все пациенты с установленным диагнозом МЛУ-ТБ с целью получения полной информации о бремени МЛУ-ТБ в стране.
Когортный анализ лечения МЛУ-ТБ проводится только для тех пациентов, которые начали лечение лекарствами второго ряда в отчетном периоде.
Датой начала лечения является дата получения пациентом первой дозы всех ПТЛС второго ряда.
При проведении когортного анализа необходимо фиксировать следующие даты:
– дата первоначальной регистрации случая заболевания ТБ;
– дата регистрации по МЛУ-ТБ;
– дата начала лечения.
5.2. Основные определения и понятия, используемые при проведении когортного анализа
Абациллирование (прекращение бактериовыделения) – промежуточный показатель, указывающий на успех лечения. Под абациллированием у пациентов с ЛЧ-ТБ понимают получение первых отрицательных результатов бактериоскопии и/или посева. Под абациллированием у пациентов с ЛУ-ТБ понимают получение отрицательных посевов в течение 2 последовательных месяцев с интервалом в 30 дней, при этом датой абациллирования является дата первого отрицательного результата.
Стандартные определения результатов лечения представлены в таблице 5.1.
Таблица 5.1. Определения результатов лечения лекарственно-чувствительного ТБ (ЛЧ-ТБ) и лекарственно-устойчивого ТБ (ЛУ-ТБ)
| Результат | ЛЧ-ТБ | ЛУ-ТБ |

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Инфекционный контроль (ИК)это система: организационных, профилактических и
противоэпидемических мероприятий, направленных на предупреждение возникновения и распространения инфекционных заболеваний среди пациентов и сотрудников в организации (ЛПО, ЛПУ).
Проведение эпидемиологического надзора предусматривает:
-обеспечение активного выявления и учета и регистрации ИСМП;
-выявление факторов риска инфицирования ИСМП у отдельных категорий пациентов в различных типах стационаров;
- эпидемиологический анализ заболеваемости пациентов с выявлением ведущих причин и факторов, способствующих возникновению и распространению ИСМП;
- эпидемиологический анализ заболеваемости ИСМП медицинского персонала с выявлением ведущих причин и факторов, способствующих возникновению и распространению ИСМП;
- осуществление микробиологического мониторинга за возбудителями ИСМП;
- определение спектра устойчивости микроорганизмов антимикробным средствам (антибиотикам, антисептикам, дезинфектантам и др.) для разработки рациональной стратегии и тактики применения антимикробных препаратов;
-оценку лечебно-диагностического процесса;
-оценку больничной среды, условий пребывания в медицинском учреждении пациентов и медицинских работников;
-оценку эффективности проведенных профилактических и противоэпидемических мероприятий;
-прогнозирование эпидемиологической ситуации.
Система мероприятий по профилактике ВБИ.
I. Неспецифическая профилактика
1. Строительство и реконструкция стационарных и амбулаторно-поликлинических учреждений с соблюдением принципа рациональных архитектурно-планировочных решений: изоляция секций, палат, операционных блоков и т.д.; соблюдение и разделение потоков больных, персонала, “чистых” и “грязных” потоков; рациональное размещение отделений по этажам; правильное зонирование территории.
2. Санитарно-технические мероприятия: эффективная искусственная и естественная вентиляция; создание нормативных условий водоснабжения и водоотведения; правильная воздухоподача; кондиционирование, применение ламинарных установок; создание регламентированных параметров микроклимата, освещения, шумового режима; соблюдение правил накопления, обезвреживания и удаления отходов лечебных учреждений.
3. Санитарно-противоэпидемические мероприятия: эпидемиологический надзор за ВБИ, включая анализ заболеваемости ВБИ; контроль за санитарно-противоэпидемическим режимом в лечебных учреждениях; введение службы госпитальных эпидемиологов; лабораторный контроль состояния противоэпидемического режима в ЛПУ; выявление бактерионосителей среди больных и персонала; соблюдение норм размещения больных; осмотр и допуск персонала к работе; рациональное применение антимикробных препаратов, прежде всего — антибиотиков; обучение и переподготовка персонала по вопросам режима в ЛПУ и профилактики ВБИ; санитарно-просветительная работа среди больных.
4. Дезинфекционно-стерилизационные мероприятия: применение химических дезинфектантов; применение физических методов дезинфекции; предстерилизационная очистка инструментария и медицинской аппаратуры; ультрафиолетовое бактерицидное облучение; камерная дезинфекция;
паровая, суховоздушная, химическая, газовая, лучевая стерилизация; проведение дезинсекции и дератизации.
II. Специфическая профилактика
Плановая активная и пассивная иммунизация.
Экстренная пассивная иммунизация.
Что относят к аварийным ситуациям с биологическим материалом? Порядок действий медицинского персонала при возникновении аварийной ситуации: порез и укол, попадание биологического материала на поврежденные/неповрежденные кожные покровы и слизистые, средства индивидуальной защиты.
Работник организации здравоохранения при аварийном контакте для предупреждения возникновения и распространения вирусных гепатитов должен соблюдать следующий порядок действий.
В случае повреждения целостности кожных покровов при работе с биологическим материалом:
немедленно снять перчатки рабочей поверхностью внутрь и погрузить их в емкость с дезинфицирующим раствором или поместить в непромокаемый пакет для последующего обеззараживания;
вымыть руки с мылом под проточной водой и обильно промыть рану водой или физиологическим раствором;
обработать рану 3%-й перекисью водорода.
В случае загрязнения биологическим материалом кожных покровов без нарушения их целостности:
обильно промыть загрязненный участок кожных покровов водой с мылом и обработать антисептиком.
В случае попадания биологического материала на слизистую оболочку:
немедленно снять перчатки рабочей поверхностью внутрь и погрузить их в емкость с дезинфицирующим раствором или поместить в непромокаемый пакет для последующего обеззараживания;
тщательно вымыть руки с мылом под проточной водой и обильно промыть (не тереть) слизистую оболочку водой или физиологическим раствором.
В случае загрязнения биологическим материалом СГО, личной одежды, обуви:
обмыть поверхность перчаток, не снимая с рук, под проточной водой с мылом или раствором антисептика, дезинфицирующего средства;
снять загрязненную СГО, личную одежду, обувь;
СГО, личную одежду и обувь сложить в непромокаемые пакеты для последующего обеззараживания;
снять защитные перчатки рабочей поверхностью внутрь и погрузить их в емкость с дезинфицирующим раствором или поместить в непромокаемый пакет для последующего обеззараживания;
вымыть руки с мылом под проточной водой и обработать кожные покровы в области проекции загрязнения СГО, личной одежды, обуви в соответствии с пунктом 89 настоящих Санитарных правил.
В случае загрязнения биологическим материалом объектов внешней среды биологические загрязнения на поверхности объектов внешней среды обеззараживаются раствором дезинфицирующего средства и удаляются с поверхности с последующей влажной уборкой.
ДЕЙСТВИЯ МЕДИЦИНСКОГО РАБОТНИКА В СЛУЧАЕ ПРОФЕССИОНАЛЬНОГО КОНТАКТА:
Под профессиональным контактом понимают любой прямой контакт слизистых оболочек, поврежденных и не поврежденных кожных покровов с потенциально инфицированными биологическими жидкостями при исполнении профессиональных обязанностей.
Если произошло попадание биоматериала на одежду:
- Перед снятием одежды перчатки обеззараживаются.
- При незначительных загрязнениях биологической жидкостью одежда снимается, помещается в пластиковый пакет и направляется в прачечную без предварительной обработки, дезинфекции.
- При значительном загрязнении одежда замачивается водном из дезинфектантов, используемых в учреждении (кроме 6%-й перекиси водорода и нейтрального гидрохлорида кальция, которые разрушают ткани).,
- Личная одежда, загрязненная биологической жидкостью, подвергается стирке в горячей воде (70 °С) с моющим средством.
- Кожа рук и других участков тела под местом загрязненной одежды протирается 70%-м спиртом. После этого промывается с мылом и повторно протирается спиртом.
- Загрязненная обувь двукратно протирается ветошью, смоченной в растворе одного из дезинфицирующих средств, используемых в учреждении.
Если произошло попадание биоматериала на слизистые оболочки:
- Ротовая полость - прополоскать 70%-м раствором этилового спирта.
- Полость носа - закапать 20-30%-й раствор альбуцида.
- Глаза - промыть водой, после чего закапать 20-30%-йраствор альбуцида.
Если произошел контакт с кровью или другими биологическими жидкостями при неповрежденной коже:
- срочно обработать место загрязнения одним из дезинфектантов (70%-м раствором спирта, 3%-м раствором перекиси водорода, 3%-м раствором хлорамина);
- затем промыть водой с мылом и повторно обработать спиртом.
Если произошел контакт с кровью или другими биологическими жидкостями при повреждении кожи (укол, порез):
| 25.05.2012, 16:18 |


