Инфекции ассоциированные с биопленками
Еще фото
Ключевые слова: инфекционные заболевания, этиология, патогенез, оппортунистические патогенны, острова патогенности, межклеточная коммуникация, биопленки
Key words: infectious diseases, etiology, pathogenesis, opportunistic pathogens, pathogenicity islands, intercellular communication, biofilm
Аннотация
Summary
В настоящее время как в гуманной, так и в ветеринарной медицине отмечается значительный рост инфекционных заболеваний, которые в большинстве случаев развиваются как вторичная отягощающая патология на фоне первичного патологического процесса неинфекционной природы. Инфекции характеризуются многообразием клинических форм, отсутствием характерных клинических предикторов, что затрудняет их диагностику в рутинной практике. Современные инфекции представляют трудности как для диагностики, так и для терапии, что обусловлено целым рядом факторов, которые будут рассмотрены в данной статье.
Важная черта современных инфекций – это разнообразие и изменчивость видового состава возбудителей. Подавляющее большинство из них относятся к оппортунистическим патогенам. Многие виды современных возбудителей являются комменсалами, т.е. видами, обитающими в биотопах организма-хозяина (в частности, на кожном покрове) без причинения ему ощутимого вреда. Наличие в организме данных видов обычно не требует терапевтического вмешательства, однако само их присутствие создает предпосылки для возможной инвазии и развития инфекционного заболевания. К таким потенциальным возбудителям относятся коагулазо-негативные стафилококки (S. epidermidis, S. haemolyticus, бактерии родов Corynebacterium, Enterococcus, Serratia, Klebsiella, Pseudomonas, Acinetobacter, Bacillus, грибы родов Candida, Malassezia, Aspergillus, Alternaria и целый ряд других бактериальных и грибковых патогенов (Рис. 1-6).
В норме здоровый организм животного с успехом противостоит не только оппортунистическим (условно-патогенным), но и большинству истинно патогенных микроорганизмов. Развитие патологического процесса связано с нарушением баланса сил между возбудителем и организмом-хозяином. Это может произойти за счет усиления патогенности возбудителя, с одной стороны, и ослабления защитных факторов организма-хозяина, с другой.
Еще одним важным фактором, обуславливающим проявление патогенных свойств, является социальное поведение микроорганизмов – предмет пристального научного изучения последних лет. Было установлено, что микроорганизмы способны к скоординированному взаимодействию, основанному на межклеточной коммуникации. Общение микроорганизмов между собой осуществляется посредством сигнальных молекул (феромоны и др.), которые делают возможным совместные организованные действия микробных популяций [3].
Вещества, нарушающие микробную коммуникацию, в настоящее время рассматриваются как потенциальное средство борьбы с инфекционными заболеваниями.
Биопленки представляют собой социально-организованное сообщество микроорганизмов, прикрепленных к какому-либо субстрату. Этот субстрат может быть как абиотическим (например камень, металл или пластик), так и биотическим, то есть живой тканью организма животного или человека. Прикрепившись к субстрату, клетки образуют общий защитный слой – биопленочный матрикс, состоящий из различных биополимеров. Также внутри биопленок происходит определенная специализация функции клеток, что напоминает дифференциацию тканей в многоклеточных организмах. Биопленкам присущ целый набор функций, таких как трофические, метаболические функции, регуляция газообмена, защита от неблагоприятных внешних воздействий. При этом физиология и поведение микробных клеток в составе биопленок очень сильно изменяется по сравнению с планктонным (свободным) состоянием.
Такая форма существования, как было установлено, является естественной для микроорганизмов в природных условиях. К формированию биопленок способны большинство бактерий, мицелиальные и дрожжевые грибы, а также водоросли [5].
С точки зрения инфекционного процесса, благодаря биопленкам происходит прикрепление патогена к тканям хозяина, его закрепление и дальнейшая колонизация макроорганизма. По мере созревания из биопленок высвобождаются дочерние клетки, которые дают начало новым колониям, тем самым распространяясь в тканях и органах.
В состав биопленок могут входить микроорганизмы нескольких различных видов, в совокупности составляющих сложноорганизованное сообщество. Внутри биопленки происходит интенсивный обмен генетическим материалом между клетками, в т.ч. и островами патогенности, и таким образом растет общий патогенный потенциал популяции микробов. Все это способствует очень эффективному функционированию микроорганизмов в биотопах хозяина и создает множество преимуществ с точки зрения инфекционного процесса. К настоящему времени известно, что порядка 80% всех инфекционных заболеваний сопровождается образованием биопленок [6].
С клинической точки зрения, биопленочные инфекции плохо или совсем не поддаются традиционной антибиотикотерапии. Биопленочный матрикс эффективно препятствует проникновению антибиотиков вглубь биопленки. Попавшие внутрь чужеродные вещества исторгаются обратно путем эффелюкса или разрушаются специализированными ферментами. Внедрению антибиотиков также препятствует замедленный метаболизм клеток.
Эффективные концентрации антибиотиков для уничтожения микробов в составе биопленок должны быть в десятки и сотни раз выше, нежели для тех же микробов в планктонном состоянии. Даже при длительном воздействии антибиотика погибают только поверхностные слои биопленки. Однако в глубине биопленок сохраняются жизнеспособные клетки особого типа – клетки-персисторы с очень замедленным метаболизмом, способные переживать самые неблагоприятные условия, но затем дать биопленке новую жизнь [7].
Помимо этого, биопленки надежно защищены от факторов иммунной защиты макроорганизма, а также от воздействия различных дезинфектантов. Следует учитывать, что образование биопленок ведет к хронизации инфекционного процесса. И даже при успешном лечении при биопленочных инфекциях очень велика вероятность рецидивов.
Ярким примером инфекций, сопровождающихся образованием биопленок, могут служить раневые инфекции. Раны представляют собой идеальный субстрат для микробной контаминации и последующего образования биопленок. Биопленки в ране создают среду с определенным микроклиматом, для которого характерно низкое содержание кислорода. Биопленки задерживают миграцию и пролиферацию кератиноцитов, ингибируя тем самым защитные иммунные механизмы, а снаружи создают защитный слой, непроницаемый для противомикробных препаратов местного действия. Если биопленке удалось утвердиться в ране, то процесс приобретает хронический характер, и медикаментозно вылечить такую рану без иссечения пораженных тканей обычно не удается.
Характерными биопленочными инфекциями являются также гингивиты (воспаление десен), стоматиты (воспаление слизистой рта), образование зубного камня (Рис. 7). Отиты – наиболее часто встречающаяся дерматологическая проблема – также сопровождаются образованием биопленок, причем не только бактериальных, но и грибковых. Так, способность к биопленкообразованию недавно была установлена у Malassezia pachydermatis – основного возбудителя грибковых отитов [8].
Помимо поверхностных инфекций, биопленки играют роль при инфекциях мочевыделительной системы, катетер-ассоциированных инфекциях, синуситах, эндокардитах, имплантат-ассоциированных инфекциях и др. Иными словами, биопленки играют важнейшую роль в патогенезе широкого спектра как поверхностных, так и глубоких инфекционных заболеваний.
Окончание в следующем номере.
Литература
1. Hacker J, Kaper J. Pathogenicity islands and the evolution of microbes. Annu Rev Microbiol. 2000; 54: 641-79.
2. Ahmed N., Dobrindt U., Hacker J., Hasnain S. Genomic fluidity and pathogenic bacteria: applications in diagnostics, epidemiology and intervention. Nature Reviews Microbiology 6, 587-594 (May 2008).
3. Marx V. Cell communication:Stop the microbial chatter. Nature 511, 493-497 (24 July 2014) doi:10.1038/511493a.
4. Rutherford S., Bassler B. Bacterial Quorum Sensing: Its Role in Virulence and Possibilities for Its Control. Cold Spring Harb Perspect Med 2012; 2:a012427.
5. Hall-Stoodley L, Costerton J., Stoodley P. Bacterial bio-films: from the natural environment to infectious diseases. Nat Rev Microbiol. 2004; 2(2):95-108.
6. "Research on microbial biofilms (PA-03-047)". NIH, National Heart, Lung, and Blood Institute. 2002-12-20.
7. Davies D. Understanding bioilm resistance to antibacterial agents. Nature Reviews Drug Discovery 2, 114-122 (1 February 2003) doi:10.1038/nrd1008.
8. Figueredo L., Cafarchia C, Desantis S., Otranto D. Biofilm formation of Malassezia pachydermatis from dogs. Veterinary Microbiology 160 (2012); 126-131.

Первое десятилетие нового, XXI века было объявлено ВОЗ Всемирной декадой костей и суставов. Это обусловлено постоянным увеличением числа больных среди населения ведущих стран мира, у которых регистрируются заболевания и травматические повреждения костно-суставного аппарата. В связи с увеличением случаев травматизма, количества посттравматических и постоперационных осложнений увеличилась и потребность в пластическом материале для замещения различных дефектов [20].
В европейских странах число инфекций, вызванных заражением имплантационного устройства, превышает 100 тыс. случаев в год. В США и Западной Европе каждый год фиксируется до 500 тыс. случаев катетер-ассоциированных инфекций (Бережанский, Жевнерев, 2006) [3]. В целом около 5% имплантируемых фиксирующих устройств заражаются. Частота инфицирования после внутренней фиксации закрытых переломов низкая и составляет 0,5-2%, в то время как инфицирование вследствие фиксации открытых переломов может превышать 30% [32].
С конца прошлого столетия в медицине в многочисленных исследованиях стали появляться сообщения о способности бактерий образовывать пленчатые макроструктуры на поверхностях различных медицинских имплантатов и катетеров. Микроорганизмы, которые образовывали такие структуры, отличались повышенной выживаемостью [4; 21; 26].
Образование биопленок при этом ведет к возникновению тяжелых имплантат-ассоциированных инфекционных осложнений, сепсисов. Это серьезная проблема в медицинской практике, поскольку в хирургических и реанимационных отделениях клиник широко используются различные инвазивные материалы [10].
Накопление микроорганизмов на поверхности имплантатов в виде биопленок и их дальнейшее распространение по организму может служить причиной развития хронического воспаления, имплантат-ассоциированной инфекции, что в свою очередь приводит к необходимости удаления зараженного устройства. С медицинской и экономической точки зрения их постоянная замена является неэффективной и вызывает трудности [30].
Первое свидетельство причастности биопленкообразования на поверхности имплантатов к инфекционным заболеваниям представлено в 1982 году при электронно-микроскопическом исследовании кардиостимуляторов у пациентов с рецидивирующей инфекцией, вызванной Staphylococcus aureus [26]. В своих исследованиях J.W. Costerton с сотрудниками (1999) первыми выявили взаимосвязь между развитием биопленок и хронических инфекций. В последующие десятилетия подтвердили неоспоримое участие биопленок в развитии патологических процессов в инфицированных тканях. Более того, было признано, что использование различных медицинских устройств, имплантируемых в организм человека, благоприятствует развитию инфекций [30].
К настоящему времени доказано, что 72-91% случаев нозокомиальной инфекции ассоциированы с использованием катетеров, имплантов, стентов и т.д., что сопровождается контаминацией поверхности вирулентной флорой с образованием биопленок и L-форм бактерий, которые практически не чувствительны к проводимой антибактериальной терапии [18].
Основные виды имплантатов, заражение которых может привести к имплантат-ассоциированным инфекциям - центральные венозные катетеры, сердечные клапаны, искусственные желудочки сердца, коронарные стенты, имплантируемые нейростимуляторы, желудочковые шунты, суставные протезы, устройства для фиксации переломов, грудные имплантаты, контактные линзы, зубные имплантаты, кохлеарные имплантаты.
Большие ортопедические операции, как правило, связаны с установкой металлоконструкций. Установка постоянного имплантата приводит к возникновению пожизненного риска развития инфекции, которая может привести к хроническому постимплантационному остеомиелиту и инвалидизации больного, а в самых тяжелых случаях при генерализации процесса с развитием синдрома системной воспалительной реакции или сепсиса – к летальному исходу [2].
Биопленка может быть охарактеризована как структурированное скопление микроорганизмов одного или нескольких видов, заключенное в выделенный ими экзополимерный матрикс и прикрепленное к абиотическим или биотическим поверхностям. Матрикс биопленки состоит из экзополисахаридов, белков, тейхоевых кислот, липидов, внеклеточной ДНК [6; 19].
Биопленкообразование на имплантатах можно разделить на 4 стадии: клеточная адгезия, обратимая стадия, созревание и дисперсия биопленки [24].
Бактериальная адгезия определяется физико-химическими свойствами прикрепляющихся клеток, субстрата и окружающей среды. Большая часть факторов среды, такие как её состав, гидродинамические условия, температура, время контакта, концентрация бактерий или присутствие антибиотиков и дезинфектантов, могут влиять на бактериальную адгезию. К факторам, которые могут влиять на адгезию бактерий к твердой поверхности, можно также отнести химический состав материала, поверхностный заряд, гидрофобность и свободную энергию поверхности, а также шероховатость поверхности [13].
На втором этапе бактериальные клетки начинают пролиферировать и слипаться друг с другом, что приводит к образованию микроколоний. Затем эти организованные структуры погружаются в собственно продуцированный внеклеточный матрикс. Таким образом, биопленки постепенно колонизируют поверхность инвазивного устройства [23].
На стадии созревания микроколонии разрастаются и сливаются, образуя макроколонию. Также формируются специфические структуры биопленки: каналы, полости, поры и выросты. Благодаря данным формированиям осуществляется движение питательных веществ, удаляются метаболические отходы [6]. В основном на данном этапе регуляция осуществляется при помощи системы Quorum sensing [27].
В определенный момент времени биопленка достигает критической массы, возникает динамическое равновесие, при этом от наружных слоев биопленки начинают открепляться клетки, способные покидать биопленку и колонизировать другие поверхности, чтобы повторить цикл. Благодаря этому патогенные бактерии захватывают новые места обитания, приводя к распространению инфекции. Открепление планктонных клеток может происходить как под действием внешних сил (давление жидкости, механическое воздействие), так и из-за внутренних (энзиматическая деградация протеазами, альгинатлиазами и др.) [6; 17].
Считается, что вода является главным компонентом матрикса биопленки, на долю которого приходится до 97%. Тогда как содержание бактерий составляет 10–50% от общего объема биопленки. Количество внеклеточных полимерных веществ колеблется в пределах 50–90% от общего количества органического углерода в биопленках. Кроме полисахаридов, белков, нуклеиновых кислот или фосфолипидов в матриксе биопленок также могут быть обнаружены другие неклеточные материалы, такие как кристаллы минеральных соединений или компоненты крови, присутствие которых зависит от окружающей среды, в которой развивалось это сообщество.
Имплантат-ассоциированные инфекции случаются из-за инфицирования во время операции или сразу после нее благодаря микробному распространению по кровотоку из отдаленного очага инфекции либо из-за прямого или лимфогенного распространения из инфекционного очага или проникающей травмы [28].
Анализ литературных данных позволил выявить микроорганизмы, которые чаще всего образуют биопленки на имплантатах. Почти все виды являются представителями нормальной микрофлоры организма человека. Так, ведущие позиции занимают два вида стафилококков Staphylococcus aureus и S. epidermidis – 49,9%, в том числе и метициллинрезистентные штаммы (MRSE), далее следуют Enterococcus faecalis – 6,4% представители неферментирующих грамотрицательных бактерий (Acinetobacter spp. и P. aeruginosa) – 11% и представители семейства энтеробактерий (E. cloacae, Klebsiella pneumoniae, Escherichia coli) – 4,1% (рисунок) [2].
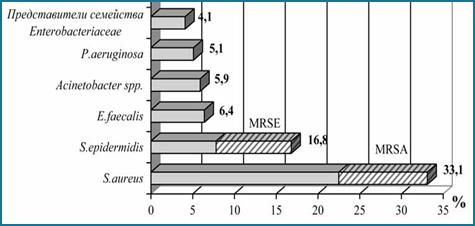
Ведущие виды микроорганизмов, образующих биопленки на имплантатах
Эти и другие биопленкопродуцирующие микроорганизмы проникают в организм в процессе имплантации или еще до операции колонизируют поверхности имплантата. Заражение имплантационных поверхностей может приводить к развитию септического шока, некроза тканей вследствие хронического воспаления вокруг имплантата и дальнейшему распространению инфекции внутри организма. Оксиданты, вырабатываемые иммунными клетками для борьбы с биопленками, не способны проникнуть сквозь экзополимерный матрикс; это приводит к накоплению этих веществ и повреждению собственных клеток [29].
Из-за высокой устойчивости к антибиотикам возникающие хронические инфекции трудно поддаются лечению и подвергают пациента риску рецидива. В течение биопленочной инфекции планктонные формы бактерий могут отделяться от биопленки и распространяться локально вокруг источника заражения или по кровотоку по всему организму. В большинстве случаев удаление зараженного устройства или хирургическое удаление пораженной ткани является единственным эффективным способом борьбы с биопленочными инфекциями [1].
Лечение хронических инфекций в настоящее время уже не может основываться на планктонной концепции микробиологии. Представление о биопленках изменяет подходы к диагностике и лечению инфекционных поражений в самых различных областях медицины. Этому способствует разработка соответствующих методов молекулярной диагностики, а также стратегий лечения, воздействующих на механизмы формирования и функционирования бактериальных сообществ в виде биопленок [25].
Таким образом, на сегодняшний день имплантат-ассоциированные инфекции, чаще всего вызванные образованием микробных биопленок на поверхности имплантатов, являются актуальными. Для борьбы с ними необходимо учитывать материалы, из которых изготовлены имплантаты, а также исследовать особенности образования биопленок всех известных возбудителей с целью их разрушения. Кроме того, необходимо обратить внимание на возбудителей сапрозоонозов, способных вызывать генерализованные инфекции и практически не исследованных в отношении взаимодействия с имплантатами.
Работа выполнена при поддержке Российского научного фонда (№ 14-33-00009) и Правительства РФ (Федерального агентства научных организаций).
Мусаелян А.Г.,Студент 3 курса,лечебного факультета,СГМУ им В.И.Разумовского
Донецкая Э.Г.-А,научный руководитель,доцент кафедры Микробиологии,вирусологии и имунологии, им В.И.Разумовского
Резюме
Проблема биопленочных инфекций в настоящее время приобретает все большую актуальность в связи с ростом и развитием числа инфекций и осложнений ,вызываемых внедрением в медицинскую практику инвазивных методов диагностики и лечения. Особенно серьезно этот вопрос рассматривается при возникновении инфекций ,имеющих хроническое течение ,проблемы устойчивости к антибиотикам ,бактерий находящихся в составе биопленки. В настоящей работе обобщены, систематизированы и проанализированы теоритические аспекты инфекций, возникающих при оказании медицинской помощи. Рассматриваются вопросы образования биопленки, ее строение, и роль в распространении инфекции, приводящих к формированию хронических очагов в органах и тканях организма .
Особое внимание уделяются вопросам направленным на предотвращении, возникновении и развитии биопленочных инфекций ,и борьбы с антибиотикоустойчивостью микроорганизмов ,находящихся в составе биопленки.
Ключевые слова
Статья
Более 99% бактериальных популяций существуют в природных экосистемах не в виде свободно плавающих планктонных клеток, а в виде специфически организованных, прикрепленных к субстратам биопленок, образование которых представляет сложный, строго регулируемый биологический процесс. Способность формировать биопленки является составной частью жизненного цикла большинства микроорганизмов и успешной стратегией защиты бактерий от неблагоприятных факторов среды. Биопленки - это физические структуры, образуемые микробными сообществами на поверхности раздела фаз: развивающиеся на границе жидкой и твердой сред.
Биопленки имеют сложную архитектуру - они заключены в экзополимерный матрикс, содержат каналы, наполненные жидкостью, через которые происходит приток питательных веществ и кислорода и выведение продуктов метаболизма бактерий. Основным компонентом матрикса являются экзополисахариды (ЭПС); матрикс содержит также белки, нуклеиновые кислоты и другие вещества; состав матрикса различен у бактерий разных таксономических групп.Каналы в матриксе создают своеобразную проводящую систему, по которой перемещаются вещества по градиентам концентрации, по ним также могут мигрировать бактерии. Важнейшей функцией матрикса, помимо каркасной, обеспечивающей стабильность биопленки, является защитная. Показано, что матрикс защищает бактерии в биопленке от антибактериальных препаратов, а также от неблагоприятных возднействий внешней среды
Стадии формирования биопленок Выделяют несколько последовательных этапов образования биопленок . Первая стадия - начало развития биопленок – это переход бактерий от планктонного способа существования к другому, связанному с прикреплением клеток к биотической или абиотической поверхности. Прикрепление возможно только у подвижных бактериальных клеток.Первичный контакт планктонно плавающей (неприкрепленной) бактерии и поверхности среды происходит либо случайно (например, при пассивной миграции клеток с током жидкости), либо вследствие направленного движения, обусловленного хемотаксисом. Стадия первичной адгезии занимает несколько секунд, является обратимой и зависит от неспецифических физико-химических механизмов взаимодействия между поверхностными структурами микроорганизма и самого субстрата.
Вторая стадия адгезии характеризуется необратимым связыванием бактериальных клеток с поверхностью при помощи специфических молекул – адгезинов. Важную роль на этом этапе играют такие клеточные структуры, как фимбрии (пили), жгутики, поверхностные белки, липополисахариды.На второй стадии образования биопленок формируются микроколонии. Происходит агрегация клеток, прикрепившихся ранее к твердой поверхности, бактерии теряют подвижность, некоторые из них слипаются друг с другом, начинают выделять полимеры, формируя внеклеточный полимерный матрикс, и образуют многоклеточный слой. При достижении определенной толщины слоя клеток наступает следущая стадия – стадия созревания биопленки. На стадии созревания биопленок в результате деления клеток возникают компактные микроколонии, объединенные внеклеточным полимерным матриксом. Микроколонии постепенно увеличиваются в размерах и объединяются с образованием макроколоний. Одновременно с увеличением толщины биопленки формируются ее специфические структуры - полости, выросты, поры и каналы Возможность роста любой биопленки ограничена доступностью питательных веществ и кислорода, проникновением их в различные слои биопленки, эффективностью удаления метаболических отходов, рН среды, осмолярностью и т.д.
Последней стадией является стадия дисперсии биопленки: в определенный момент времени биопленка достигает критической массы, возникает динамическое равновесие, при этом от наружных слоев биопленки начинают открепляться клетки, способные покидать биопленку и колонизировать другие поверхности, чтобы повторить цикл. Этот процесс имеет большое значение, так как приводит к распространению, расширению инфекции, захвату патогенными бактериями новых мест обитания. В разрушении биопленки принимают участие собственные поверхностно-активные вещества бактерий, ферменты альгинатлиаза и другие полисахаридлиазы. Открепление бактерий от биопленки может быть обусловлено как внешними (движение жидкости), так и внутренними (энзиматическая деградация) причинами. По данным ряда исследований, планктонные клетки, потерявшие связь с биопленкой, представляют большую опасность в связи с приобретением новых свойств, включая устойчивость к антибиотикам.
Катетер-ассоциированные инфекции
Повседневная практика интенсивной терапии предполагает многочисленные инвазивные вмешательства, связанные с нарушением целостности кожных и слизистых покровов, что создает условия для проникновения условно-патогенных микроорганизмов во внутреннюю среду организма человека. К наиболее распространенным вмешательствам относится установка различного рода внутрисосудистых устройств, прежде всего, центральных венозных катетеров. Так, по данным статистики, в США в год устанавливается более 5 млн центральных венозных катетеров. В силу ряда объективных причин центральные венозные катетеры могут становиться вполне реальным источником инфекции.
Патогенез и этиология
Ключевым моментом в патогенезе катетер-ассоциированных инфекций является формирование на внутренней и/или наружной поверхности катетера микробной биопленки.
Известны следующие пути проникновения микроорганизмов внутрь сосудистого русла.
- Микроорганизмы из состава нормальной микрофлоры кожи пациента могут проникать в сосудистое русло через разрез в месте введения катетера и прикрепляться к его наружной поверхности-ЭКСТРАЛЮМИНАЛЬНЫЙ ПУТЬ. Вероятность такого пути колонизации поверхности катетера наибольшая в течение первых 10 сут после его постановки.
- В более поздний период возрастает вероятность колонизации внутренней поверхности катетера-ИНТРАЛЮМИНАЛЬНО- через канюлю при нарушении техники асептики и при уходе за катетером. Необходимо, однако, отметить, что описанные закономерности носят чисто статистический характер, у индивидуальных пациентов колонизация и внутренней, и наружной поверхностей может происходить в любые сроки. Более того, не являются редкостью и случаи, когда одновременно колонизуется и внутренняя, и наружная поверхности, причем участие в этих процессах могут принимать различные микроорганизмы.
- Колонизация катетеров возможна также при использовании контаминированных инфузионных растворов. К крайне редким случаям относится гематогенный путь колонизации катетеров.
Большинство микроорганизмов в той или иной степени способны прикрепляться к поверхности катетеров за счет неспецифических механизмов адгезии. Однако адгезия происходит гораздо эффективнее при отложении на поверхности катетера белков плазмы крови (фибрина, фибронектина, ламинина).
Проблема микробных биопленок становится все более актуальной в последние десять лет. И если еще в 1990-е годы были единичные публикации по этому вопросу, то на сегодняшний день не только накоплены значительные теоретические знания в этой области, но и существует ряд практических исследований. Хотелось бы представить данные, которые мы получили в лабораториях двух больших клинических баз - Научного Центра сердечно-сосудистой хирургии имени А.Н. Бакулева РАМН, где мне посчастливилось в течение восьми лет возглавлять лабораторию клинической микробиологии и антимикробной терапии, и детской клиническая больницы имени Н. Ф. Филатова, где сейчас мы организуем лабораторию сепсиса. В настоящей лекции мне бы хотелось не только обсудить факты, опубликованные нашими зарубежными коллегами, но и представить вам некоторые результаты собственных исследований.
Существуют ли какие-то способы воздействия на процесс формирования биопленок, или способы разрушения уже существующих биопленок? Естественно, за короткий срок лекции мы не сможем охватить сотни тысяч публикаций, но я покажу вам несколько коротеньких выдержек из них. Начиная с конца 1990-х годов в литературе стали появляться работы, изучающие возможность некоторых препаратов, например, кларитромицина, ингибировать образование гликокаликса, который продуцируется в данном случае метициллинрезистентным золотистым стафилококком [2]. Авторы другой работы приводили данные сравнительных исследований, доказывающие способность кларитромицина в комбинации с цефалоспорином I поколения или ванкомицином препятствовать образованию биопленок на титановом медицинском оборудовании [3]. Для синегнойной палочки также выявлена способность к формированию биопленки. При детальном изучении механизма воздействия препарата кларитромицин на образование биопленки, было показано, что структура биопленки изменяется, уменьшается количество альгината, гексозы, истончается гликокаликс, тем самым повышается проникновение антимикробного препарата, который использовали для подавления синегнойной палочки, в данном случае – фторхинолон. Эффективность фторхинолона оказалась значительно выше в присутствии кларитромицина, что привело к эрадикации синегнойной палочки [4]. Интересны также клинические исследования на больных с муковисцидозом и диффузным панбронхиолитом, в ходе которых было показано совместное использование для воздействия на синегнойную палочку кларитромицина с этиотропными антибиотиками [5].
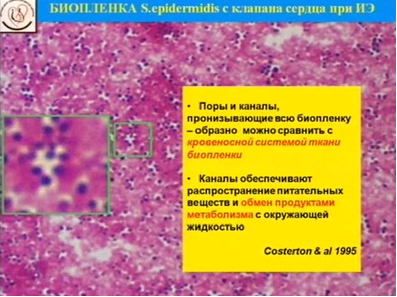
На рисунке представлен микропрепарат, полученный нами при специальной окраске биопленки, образованной эпидермальным стафилококком, штамм выделен из клапана больного с инфекционным эндокардитом. Как видно на рисунке (увеличенный фрагмент) биопленка представляет собой не только микроорганизмы, стафилококки, но и поры, каналы, которые пронизывают эту биопленку, эти каналы обеспечивают как распространение питательных веществ внутрь биопленки для питания бактерий, так и выделение продуктов метаболизма в окружающую среду, напоминая, таким образом систему кровеносных сосудов [6].
Рисунок 1. Биопленка S.epidermidis с клапана сердца при инфекционном эндокардите
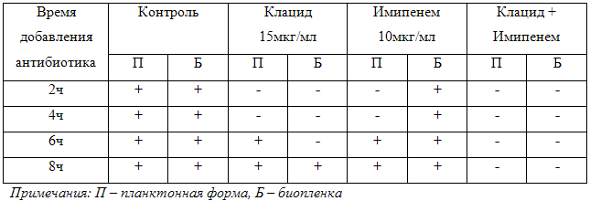
Проблема инфекции, вызванной синегнойной палочкой, чрезвычайно актуальна, и, по-видимому, она так долго оставалась нерешенной именно потому, что вопросы воздействия на биопленку ранее не были известны. Нами было проведено исследование, доказывающее способность препарата клацид (кларитромицин) препятствовать образованию биопленки. Это исследование мы провели ин-витро. Синегнойная палочка выращивалась как планктонная форма, в пробирке, и, как биопленка – на пластиковой чашке Петри. Соответственно, через 2, 4, 6 или 8 часов от момента посева микроорганизма в питательную среду, мы добавляли антибактериальные препараты. В контрольной чашке, где была засеяна синегнойная палочка, и сразу был добавлен карбапенем (имипенем), биопленка не образовалась. Действительно, чувствительность штамма к имипенему была установлена заранее, и препарат сработал так, как и ожидалось. Но если мы добавляли имипенем позднее, то есть дали возможность микроорганизму просуществовать в питательной среде какое-то время, то мы обнаружили, что биопленка все равно потом образовалась, то есть добавление имипенема не смогло препятствовать образованию биопленки, образованной синегнойной палочкой. То есть даже карбапенем, активный в отношении синегнойной палочки (имипенем), не сумел препятствовать формированию биопленки. Мы попробовали провести тот же эксперимент с одним кларитромицином в форме монотерапии. После добавления кларитромицина, чашка не была прозрачной, то есть микроорганизмы в этой чашке продолжали размножаться. Но вот когда мы добавили одновременно этиотропный препарат имипенем (карбапенем) и кларитромицин, в результате получили абсолютно прозрачную чашку, то есть биопленка в этой ситуации не образуется. Каждый из этих экспериментов был повторен многократно, для того, чтобы убедиться в действительно объективной картине. В таблице 1 обобщены полученные нами данные. В контроле, независимо от времени добавления антибиотиков, во всех случаях, естественно, был рост и в планктонной форме, и в виде биопленки. Но одновременное использование имипенема вместе с клацидом, препятствовало формированию биопленки.
Таблица 1. Результаты, полученные при исследовании влияния кларитромицина и имипенема, а также их комбинации на формирование биопленок
Еще один очень важный аспект – то, что микробные биопленки во много раз снижают эффективность антибиотиков, то есть повышают устойчивость бактерий к антибиотикам по некоторым данным, в 100-1000 раз [7]. В то же время, исследования целого ряда авторов показали, что кларитромицин не только разрушает матрикс биопленок, образованных P. аeruginosa, но и снижает ее двигательную активность, что приводит к снижению вирулентности и существенному повышению эффективности специфических антисинегнойных препаратов [8]. Кроме того, кларитромицин разрушает матрикс биопленки, облегчая доступ другим антибиотикам [9].
Таблица 2. Сравнительная эффективность кларитромицина и плацебо в комбинации с этиотропными антибактериальными препаратами у пациентов с ИВЛ-ассоциированной пневмонией и нозокомиальным сепсисом по [10]
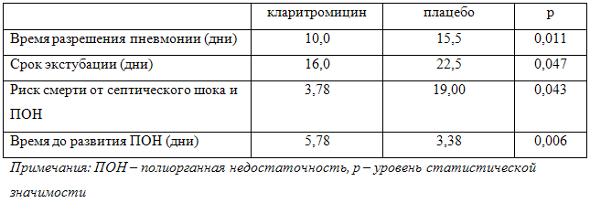
Какое резюме хотелось бы сделать после изложенных выше данных? Разумеется, у тяжелых больных, у больных в отделениях интенсивной терапии, у больных с хроническими заболеваниями, до сих пор роль микробных биопленок, недооценивается, и на сегодняшний день имеются достаточно обнадеживающие данные о том, что комбинированная терапия этиотропным антибиотиком, вместе с кларитромицином, действительно целесообразна. Благодарю вас за внимание.
Список литературы:
1. Olson ME et al. Biofilm bacteria: formation and compararive susceptibility of antibiotics. Can J Vet Res 2002 April; 66(2): 86-92.
2. Sano M, Hirose T, Nishimura M et al. Inhibitory action of clarithromycin on glycocalyx produced by MRSA. J Infect Chemother 1998; 5:10-5.
3. Fujimura S, Sato T, Mikami T et al. Combined efficacy of clarithromycin plus cefazolin or vancomycin against Staphylococcus aureus biofilms formed on titanium medical devices. Inter J Antimicrob Agent 2008; 32(6):481-4.
4. Yasuda H, Ajiki Y, Koga T et al. Interaction between biofilms formed by Pseudomonas aeruginosa and clarithromycin. Antimicrob Agents Chemother 1993; 37(9): 1749-1755.
5. Wozniak DJ, Keyser R. Effects of Subinhibitory Concentrations of Macrolide Antibiotics on Pseudomonas aeruginosa. Chest 2004; 125:625-695.
6. Costerton JW, Lewandowski Z, Caldwell DE, et al. Microbial Biofilms. Ann Rev Microbiol 1995; 49:711-45.
7. Ryder MA. Catheter-Related Infections: It's All About Biofilm. Topics in Advanced Practice Nursing eJournal. 2005;5(3); Olson ME et al. Biofilm bacteria: formation and compararive susceptibility of antibiotics. Can J Vet Res 2002 April; 66(2):86-92.
8. Wozniak DJ, Keyser R. Effects of Subinhibitory Concentrations of Macrolide Antibiotics on Pseudomonas aeruginosa. Chest 2004; 125:625-95.
9. Sano M, Hirose T, Nishimura M et al. Inhibitory action of clarithromycin on glycocalyx produced by MRSA. J Infect Chemother 1998; 5:10-15.
10. Giamarellos-Bourboulis EJ, Baziaka F, Antonopoulou A et al. Intravenous Clarithromycin in Septic Syndrome. Int J Antimicrob Agent 2008; 32S:39-43.
Читайте также:


