Инфекции при беременности литература
Рассмотрена проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода, факторы риска внутриутробных инфекций, патогенетические механизмы возникновения, развития и воздействия ВУИ, подходы к диагностике и лечению.
The issue of fetal intrauterine infecting and intrauterine infection (IUI) was considered, as well as the risk factors of intrauterine infections, pathogenic mechanisms of their occurrence, development and effect of IUI, and approaches to the diagnostics and treatment.
Проблема внутриутробной инфекции особо актуальна в современных условиях в связи с распространенностью и тяжестью воспалительных процессов. Проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода является одной из ведущих в акушерской практике и в перинатологии в связи с высоким уровнем инфицирования беременных, рожениц и родильниц, опасностью нарушения развития плода и рождения больного ребенка. Наличие инфекции у матери является фактором риска ВУИ плода, но не всегда означает его заболевание [1, 5–7, 13].
Внутриутробная инфекция — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Заболевания развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. В структуре перинатальной смертности ВУИ составляет более 30% [1, 5–7].
Кроме этого, ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности.
Согласно данным многих авторов, причиной внезапной смерти грудных детей является инфекционное заболевание, протекающее без ясной симптоматики. В числе причин или фоновых состояний скоропостижной смерти могут быть ВУИ [2].
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Как правило, инфекционный процесс затрагивает плаценту, в которой развивается плацентит, хориоамнионит и т. д. Диагноз внутриутробного инфицирования у новорожденного устанавливается на основании выделения возбудителя из клеток крови, ликвора и других источников, выявления IgM и низкоавидных IgG в пуповинной крови, а также при морфологическом исследовании плаценты [1, 5–7].
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания. Под ВУИ подразумевают не только процесс распространения инфекционных агентов в организме плода, но и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни (сепсис, пневмония, менингит, гепатит и т. д.), возникшей анте- или интранатально и выявляемой пренатально или после рождения [10, 11].
Инфекционно-воспалительные заболевания во время беременности имеют особенности: инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности; большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме; активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, острые респираторные вирусные инфекции, переохлаждение и др.) [1, 2].
Возможный спектр возбудителей внутриутробной инфекции весьма разнообразен и широк. Это бактерии (грамположительные и грамотрицательные; аэробные и анаэробные), грибы, простейшие, внутриклеточные микроорганизмы (микоплазмы, хламидии), вирусы. Чаще всего наблюдается сочетание возбудителей — бактериально-вирусная смешанная инфекция [3, 4, 10, 11].
Зачастую ВУИ ассоциируются с наличием инфекций TORCH — то есть синдромом комплекса. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врожденных инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др. [9, 11].
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
- хронические очаги инфекции в организме матери (в том числе наличие воспалительных заболеваний органов малого таза, урогенитальные инфекции);
- первичное инфицирование во время беременности, активация инфекционного процесса;
- патологическое снижение общего и местного иммунитета;
- наличие экстрагенитальной патологии (анемия, тромбофилии, аутоиммунные заболевания);
- повышение проницаемости плацентарного барьера во II и III триместрах беременности при невынашивании беременности и плацентарной недостаточности;
- отягощенный акушерско-гинекологический диагноз;
- неблагоприятные социально-бытовые факторы [1, 9, 11].
Патогенетические механизмы возникновения, развития и воздействия ВУИ разнообразны и зависят от многих факторов:
- срока беременности, при котором происходит инфицирование (чем раньше, тем прогноз будет более неблагоприятным);
- вида возбудителя, его вирулентности, массивности обсеменения;
- первичности или вторичности инфекционного процесса у беременной;
- путей проникновения инфекции к плоду (восходящий, нисходящий, гематогенный);
- степени распространенности и интенсивности воспалительного процесса;
- состояния организма матери, его иммунологической толерантности.
Влияние инфекции на эмбрион и плод заключается в воздействии комплекса следующих факторов:
- патологическое воздействие микроорганизмов и их токсинов (инфекционное заболевание, гипоксия плода, задержка развития плода);
- нарушение процесса имплантации и плацентации (низкая плацентация, предлежание плаценты);
- снижение метаболических процессов и иммунологической защиты плода [1, 9, 11].
Таким образом, реализуется ли внутриутробное инфицирование в ВУИ или нет, зависит от ряда факторов, которые мы представили выше.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика данной патологии в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-диагностических методов обследования.
Клинический метод исследования позволяет выявить различные осложнения гестационного периода, такие как невынашивание беременности и синдром задержки роста плода (СЗРП). Кроме этого, немаловажное значение имеет наличие проявлений инфекции у матери (отит, гайморит, пиелонефрит, цистит и т. д.).
Методы, позволяющие оценить состояние фетоплацентарной системы:
- эхография (плацентометрия, поведенческая активность плода, его тонус, количество околоплодных вод, степень зрелости плаценты);
- допплерография (МПК, ФПК);
- кардиотокография (КТГ).
Микробиологические и серологические исследования:
- микроскопия влагалищных мазков (повышенное содержание лейкоцитов, кокковая флора, признаки дисбиоза, грибковая флора);
- бактериальный посев (наличие анаэробных и аэробных бактерий, грибковой флоры);
- ПЦР-диагностика (геномы ВПГ-1, ВПГ-2, ЦМВ, микоплазмы, уреаплазмы, хламидии);
- иммуноферментный анализ (ИФА): обнаружение в сыворотке специфических антител к возбудителям (IgM, IgG, IgA) в диагностически значимых титрах.
Исследование хориона (биопсия хориона): бактериологический метод, ПЦР-диагностика.
Исследование околоплодных вод (амниоцентез): бактериологический метод, ПЦР-диагностика.
Исследование пуповинной крови плода (кордоцентез): бактериологический метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
Морфологическое исследование плаценты, данные аутопсии.
Предположительный диагноз внутриутробного инфицирования и ВУИ помогают поставить косвенные методы:
- наличие у матери клиники инфекционного заболевания;
- наличие специфического иммунного ответа;
- результаты УЗИ, допплерометрии, КТГ.
К прямым методам диагностики внутриутробного инфицирования и ВУИ относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, бактериологический метод), кордоцентезе (ПЦР, бактериологический метод и определение уровня специфических IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах зародыша (1–3 недели беременности) из-за отсутствия механизмов взаимодействия инфекционного агента и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться альтернативным процессом и гибелью плодного яйца. Повреждение эмбриона инфекцией на 4–12 неделях беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект [13, 15].
В I триместре беременности специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
- повышенный локальный тонус матки;
- отслойка хориона;
- изменение формы плодного яйца (деформация);
- прогрессирование истмико-цервикальной недостаточности (функционального характера);
- гипоплазия хориона;
- увеличение или персистенция желточного мешка;
- несоответствие размеров эмбриона размерам полости плодного яйца (увеличение, уменьшение);
- отсутствие редукции хорионической полости.
Инфекционные фетопатии возникают с 16-й недели, когда происходит генерализация инфекции у плода. Могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [12–15].
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде. Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
- СЗРП;
- гипоксия плода;
- фетоплацентарная недостаточность;
- многоводие или маловодие;
- неиммунная водянка плода;
- увеличение или уменьшение толщины плаценты, наличие патологических включений;
- контрастирование базальной мембраны;
- наличие взвеси в околоплодных водах;
- кальцификаты в печени и селезенке и головном мозге плода;
- поликистоз легких, почек плода;
- эхогенные фиброзные включения на папиллярных мышцах и створках клапанов сердца плода;
- расширение петель кишечника плода (гипоксия, энтерит) [12–15].
После верификации диагноза ВУИ лечебные мероприятии проводят с помощью этиотропной, антимикробной терапии: препараты пенициллинового ряда и макролиды. Целесообразность назначения антимикробных препаратов не вызывает сомнения, если ВУИ обусловлено наличием патогенных возбудителей (бледная спирохета, токсоплазма, хламидии, гонококк и т. д.) [8, 14].
В настоящее время одним из наиболее дискутабельных вопросов в акушерстве является выяснение истинной этиологической роли генитальных микоплазм (Mycoplasma hominis, Mycoplasma genitalis, Ureaplasma urealyticum) в развитии патологии матери и плода. Инфицирование плода генитальными микоплазмами происходит преимущественно интранатально: в 18–55% — у доношенных новорожденных и в 29–55% — у недоношенных [3, 16, 20].
Актуальность проблемы урогенитального микоплазмоза обусловлена не только значительным распространением этой инфекции в популяции, но и неоднозначностью ее оценки как эпидемиологами, так и клиницистами [16].
По данным различных исследователей, микоплазмы являются возможной причиной развития конъюнктивитов, врожденных пневмоний, респираторного дистресс-синдрома, хронических заболеваний легких, менингита и неонатального сепсиса. Вопрос о терапии микоплазменной инфекции до настоящего времени остается открытым. В схемах терапии предусматривается 7–10-дневные курсы макролидов [1, 3, 21, 22].
Во время беременности противовирусная терапия при генитальном герпесе, цитомегаловирусной инфекции, вирусе ветряной оспы проводится с помощью этиотропных препаратов (ацикловир) начиная со II триместра гестационного периода. Целью лечения является профилактика рецидивирования и антенатального инфицирования [14, 17, 19].
Трихомонадная инфекция относится к группе негонококковых воспалительных заболеваний мочеполовых органов. Лечение трихомониаза во время беременности осуществляется с помощью метронидазол-содержащих препаратов начиная со II триместра гестационного периода [8].
Появление новых методов диагностики, разработка и внедрение новых лекарственных средств не изменяют ситуацию с внутриутробными инфекциями, оставляя это по-прежнему актуальной проблемой в акушерстве. Все это обуславливает неуклонный рост инфекции в человеческой популяции, высокий процент рецидивов инфекции даже у пациентов, получавших курс антибиотикотерапии в соответствии с действующими инструкциями и схемами лечения. Проблема осложняется тем, что в настоящее время отсутствует единая концепция механизма рецидивирования, недостаточно изучена роль микст-инфекции в возникновении, течении и персистировании инфекции, не учитываются особенности гормонального и иммунного статуса больного, не сформированы диагностические критерии контроля излеченности патологического процесса. Это все вместе взятое является стимулом для продолжения исследований, направленных на решение данных проблем. Несмотря на то что роль вирусных и бактериальных инфекций в этиологии и патогенезе многих патологических процессов не вызывает сомнений, вопрос о значении инфекций в качестве моновозбудителя на сегодняшний день окончательно не решен. Актуальным по-прежнему остается вопрос разработки алгоритма лабораторной диагностики заболеваний.
Только совершенствование диагностических подходов, разработка оптимальных алгоритмов и методов обследования и предупреждение распространения резистентных штаммов путем адекватного отношения к каждому пациенту индивидуально (обязательное проведение посевов на определение чувствительности к антибиотикам до назначения терапии) может изменить данную ситуацию.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
К. Н. Арсланян, кандидат медицинских наук
Э. И. Харченко, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Аннотация научной статьи по клинической медицине, автор научной работы — Жексембаева Г.К., Жумадуллаева Г.С., Кадирсизова Г.К., Мусаева Р.Г.
Воспалительные заболевания бактериального происхождения, возникающие во время беременности, обусловленные нарушениями нормальной микрофлоры родовых путей, являются актуальной проблемой акушерства и гинекологии, поскольку приводят к таким исходам,как прерывание беременности, преждевременные роды, внутриутробное инфицирование плода и послеродовые воспалительные осложнения у родильниц.
Похожие темы научных работ по клинической медицине , автор научной работы — Жексембаева Г.К., Жумадуллаева Г.С., Кадирсизова Г.К., Мусаева Р.Г.
Microbial-infl ammatory diseases that occur during pregnancy due to microfl ora of parturient canal abnormalities is the actual problem of obstetrics and gynaecology, as it leads to miscarriage, premature delivery, intrauterine infection, postpartum infl ammatory complications of puerperants.
Журнал Алматинского государственного института усовершенствования врачей
Бактериальные инфекции во время беременности
Жексембаева Г.К., Жумадуллаева Г.С., Кадирсизова Г.К., Мусаева Р.Г. ГКП ПХВ Алматинская многопрофильная клиническая больница
Среди воспалительных заболеваний бактериального происхождения, возникающих во время беременности, значительное место занимают состояния, обусловленные нарушениями нормальной микрофлоры мочеполовых путей. Микрофлора влагалища характеризуется большим разнообразием видов бактерий и подразделяется на флору, характерную для здоровых женщин (облигатную), и патологическую. При неблагоприятных внешних воздействиях, в стрессовых ситуациях, при снижении иммунологической защиты организма, при гормональных нарушениях, гинекологических заболеваниях в половых путях возможны качественные и количественные изменения микрофлоры. Уменьшение во влагалище количества бактерий, принадлежащих к нормальной микрофлоре, приводит к снижению защитных барьеров во влагалище, и к избыточному размножению условно-патогенных микроорганизмов. Нарушения нормальной микрофлоры родовых путей представляют большую опасность для беременных женщин, так как может приводить к прерыванию беременности, преждевременным родам, внутриутробному инфицированию плода и послеродовым воспалительным осложнениям у родильниц.
Существует ряд факторов, которые контролируют и влияют на состав нормальной вагинальной микрофлоры. Вагинальная среда воздействует на микрофлору, обеспечивая условия для возможного присутствия в определенных количествах различных типов микроорганизмов. Вагинальная микрофлора включает в себя различные виды микроорганизмов. Отделяемое влагалища в норме содержит 108-1010 микроорганизмов в 1 мл, при этом аэробные бактерии составляют 105-108, анаэробные 108-109 КОЕ/мл. Доминируют в микробной флоре влагалища и шейки матки лактобактерии. Следует отметить, что у беременных женщин бифидобактерии встречаются чаще, чем лактобактерии, и этот факт расценивается как реакция на отсутствие или угнетение лактобактерий. В целом, анаэробные организмы превалируют над аэробными и факультативно-анаэробными. Среди аэробных бактерий наиболее часто выявляются дифтероиды, стафилококки, стрептококки, а среди анаэробных - лактобактерии, бифидобактерии, пептострептококки, превотеллы и бактероиды.
Во влагалище здоровых женщин могут присутствовать стрептококки, относящиеся к трем группам: стрептококки группы viridans (зеленящие стрептококки), стрептококки серологической группы В и стрептококки серологической группы D (энтерококки). Частота обнаружения и количество стрептококков, принадлежащих к этим группам, значительно варьирует и составляет в норме не более 104 КОЕ/мл. Во время беременности с точки зрения возможного инфицирования значение имеют в основном такие возбудители, как Streptococcus pyogenes (бетта-гемолитический стрептококк группы А), и Streptococcus agalactiae - стрептококк группы В, ставший в последнее время наиболее частой причиной инфекций как у новорожденных, особенно недоношенных, так и у их матерей.
Около 20 % беременных являются бактерионосителями (носоглотка, влагалище и перианальная область). У беременной может возникнуть тонзиллит, фарингит, пиодермия, мочевая инфекция, хорионамнионит, эндометрит, послеродовый сепсис. Инфекция может быть передана ребенку в родах, особенно при длительном безводном промежутке,
Жукттк кезтде бактерияларга байланысты пайда бола-тын, туу жолдарыныц цалыптымикрофлорасыныц бузылуымен шартталатын цабыну аурулары акушерлж жэне гинекология салаласыныц взектi мэселеа болып табылады, ce6e6i олардыц салдарынан жYктiлiктiц Yзiлуi, мерзiмiнен бурын босану, урыцтыц цурсацшшк инфекциялануы жэне жаца босанган эйелдердiц туганнан кейiнгi цабынган асцынулары сияцты нэтижелерi болуы mymюн.
Воспалительные заболевания бактериального происхождения, возникающие во время беременности, обусловленные нарушениями нормальной микрофлоры родовых путей, являются актуальной проблемой акушерства и гинекологии, поскольку приводят к таким исходам,как прерывание беременности, преждевременные роды, внутриутробное инфицирование плода и послеродовые воспалительные осложнения у родильниц.
Microbial-inflammatory diseases that occur during pregnancy due to microflora of parturient canal abnormalities is the actual problem of obstetrics and gynaecology, as it leads to miscarriage, premature delivery, intrauterine infection, postpartum inflammatory complications of puerperants.
с последующим риском возникновения неонатального сепсиса.
Основным методом диагностики является культуральный метод (на кровяном агаре, аэробно и анаэробно).
При лечении назначают антибиотики из группы пеницил-линов и цефалоспоринов не менее 10 суток. При послеродовом сепсисе назначают высокие дозы бензилпенициллина или ампициллина парентерально. Новорожденным при стрептококковой инфекции также назначают высокие дозы бензилпенициллина, ампициллина или цефалоспоринов.
В связи с тем, что Streptococcus pyogenes передается контактным путем, профилактика заключается в соблюдении правил асептики в родах.
Streptococcus agalactiae входит в состав микрофлоры влагалища у 20 % беременных. При заболевании у беременной может наблюдаться бессимптомная бактериальная колонизация влагалища и перианальной области, инфекция мочевых путей, хорионамнионит, эндометрит.
Основным методом диагностики является культуральный метод. Чем интенсивнее инфицированность беременной, тем вероятнее заражение ребенка. При родоразрешении через естественные родовые пути частота передачи инфекции ребенку составляет 50-60 %. Риск заболевания доношенного ребенка составляет 1-2 %, а недоношенного - 15-20 %, при сроке менее 28 недель беременности - 100 %. В случае инфицирования ребенка в родах возможно развитие сепсиса, пневмонии, менингита, тяжелых неврологических осложнений. В тяжелых случаях заболевание начинается сразу после рождения и быстро прогрессирует. Риск для ребенка повышается при преждевременном разрыве плодного пузыря, преждевременных родах, симптомах хорионамнионита у матери.
При назначении лечения следует принимать во внимание, что стрептококки группы В чувствительны ко всем бетта-лактамным антибиотикам, цефалоспоринам. При выявлении стрептококков у беременной даже без клинической симптоматики необходима пенициллинотерапия в
Вестник АГИУВ №2, 2011
течение 10 дней, возможно применение цефалоспоринов и макролидов.
По данным некоторых исследований, назначение ампициллина роженице предупреждает заражение Streptococcus agalactiae. К недостаткам профилактического назначения ампициллина следует отнести необходимость предварительного бактериологического исследования. Целесообразно проводить скрининг всех беременных в III триместре на наличие стрептококков группы В при помощи гинекологического посева.
Бактериальный вагиноз представляет собой клинический синдром, обусловленный патологическим изменением структуры микробной среды влагалища. У больных с бактериальным вагинозом в значительной степени преобладают концентрации факультативных и анаэробных бактерий, которые вытесняют молочнокислые палочки, что приводит к существенным изменениям влагалищной микрофлоры. Главной особенностью нарушения состава нормальной влагалищной микрофлоры при бактериальном вагинозе является значительное уменьшение числа молочнокислых палочек и выраженная колонизация влагалища анаэробными бактериями (Prevotella/Porphyromonas spp., Peptostreptococcus spp., Fusobacteium spp., Mobiluncus spp.) и Gardnerella vaginalis.
Во время беременности причинами нарушения нормального состава микрофлоры влагалища могут являться соответствующие гормональные изменения, использование антибиотиков и т.п. Более чем у половины всех женщин с бактериальным вагинозом какие-либо субъективные жалобы и патологические выделения из половых путей (бели) отсутствуют, наряду с имеющимися положительными лабораторными признаками. Воспалительная реакция влагалищного эпителия не является характерным признаком бактериального вагиноза. При клиническом варианте течения бактериального вагиноза с выраженными симптомами отмечаются длительные обильные, жидкие, молочного или серовато-белого цвета гомогенные выделения (бели), преимущественно с неприятным рыбным запахом.
Бактериальный вагиноз встречается у 15 - 20% беременных, и является серьезным фактором риска развития инфекционных осложнений. Отмечена выраженная взаимосвязь бактериального вагиноза с преждевременным прерыванием беременности и несвоевременным разрывом околоплодных оболочек. Риск развития этих осложнений по сравнению со здоровыми беременными у пациенток с бактериальным вагинозом увеличивается в 2,6 раза. Приблизительно у 10% преждевременно родивших женщин из амниотической жидкости выделяются гарднереллы и другие микроорганизмы, тогда как в норме амниотическая жидкость стерильна. Отмечено, что у женщин, родивших ранее 37 нед. имеется высокая вероятность наличия бактериального вагиноза.
Хориоамнионит, выявляемый у 1% беременных, является тяжелым осложнением, угрожающим жизни матери и плода. Развитие хорионамнионита связанное с бактериальным вагинозом у матери, в последствии может привести к возникновению преждевременного прерывания беременности или преждевременному излитию околоплодных вод. Наличие хорионамнионита у пациенток с бактериальным вагинозом гистологически подтверждается выявлением соответствующих патогенных микроорганизмов в плацентарной ткани, что также может быть причиной преждевременных родов.
Отмечается также взаимосвязь между наличием бактериального вагиноза и развитием послеродового эндометрита, в том числе и после кесарева сечения. Риск развития послеродового эндометрита у беременных с бактериальным вагинозом в 10 раз выше, чем у здоровых женщин. Микробная флора, выявляемая в эндометрии у пациенток с эндометритом, часто бывает аналогична таковой при бактериальном вагинозе. Особенно это касается
анаэробных микроорганизмов. Смешанная микрофлора при бактериальном вагинозе может приводить к развитию и других воспалительных осложнений, таких как абсцесс молочной железы, воспаление пупочной раны и др.
Таким образом, пациентки с бактериальным вагинозом входят в группу повышенного риска по развитию воспалительных заболеваний органов, малог таза, преждевременного прерывания беременности, несвоевременного излития околоплодных вод, возникновению хорионамнионита, послеродового и послеоперационного эндометрита. Высокая концентрация вирулентных микроорганизмов во влагалище пациенток, страдающих бактериальным вагинозом, является фактором риска проникновения бактерий в более высокие отделы мочеполовой системы.
Диагностика - комплекс включает четыре диагностических теста:
- при наружном гинекологическом осмотре пациентки в области преддверия влагалища отмечаются типичные для бактериального вагиноза бели. Если выделения слишком обильные, то они могут также стекать и на область промежности. При этом обычно наружные половые органы не гиперемированы и не отечны. Однако при наличии сопутствующей инфекции наблюдаются отек и гиперемия слизистой оболочки влагалища;
- показатель РН влагалищного отделяемого у пациенток с бактериальным вагинозом составляет обычно 5.0 - 6.0;
- положительный аминный тест, который сопровождается появлением неприятного рыбного запаха при воздействии 10% раствором гидроксида калия на пробу содержимого из средней трети влагалища;
Микроскопический анализ влагалищного секрета является методом окончательной диагностики, в том числе и мазков окрашенных по Граму.
В I триместре беременности для лечения бактериального вагиноза возможно назначение клиндамицина 2% в виде вагинального крема по 5,0 г 3 - 7 дней или повидон-йод по 1 вагинальной свече в день 14 дней или с 10-й недели тержинан по 1 вагинальной таблетке 10 дней.
Во II триместре беременности арсенал препаратов для лечения бактериального вагиноза может быть дополнен клотримазолом по 1 вагинальной таблетке 10 дней, а также назначением внутрь клиндамицина по 300 мг 2 раза - 7 дней.
В III триместре дополнительно к перечисленным препаратам может быть использован орнидазол по 500 мг 2 раза - 5 дней, или метронидазол по 500 мг 2 раза - 7 дней, а также свечи виферон-2 или КИП-ферон по 1 свече 2 раза 10 дней ректально.
1. Кира Е. Ф. Бактериальный вагиноз. — СПб., 2001.- 258 с.
2. Страчунский Л. С., Рафальский В. В., Кулаков В. И. Антибактериальная терапия уроинфекций у беременных; компромисс между активностью, эффективностью и безопасностью антибиотика // Акуш. и гин. — 2005.- № 2. -С. 16-20.
3. Дядык А.И., Колесник Н.А. Инфекции почек и моче-выводящих путей. Донецк: КП "Репой", -2003, -400 с.
4. Сидорова И. С., Воробьев Д. А. Боровкова Е. И. Микробиоценоз половых путей женщин репродуктивного возраста. // Акушерство и гинекология, -2005,-№ 2.-С.7-10.
5. Соловьева И. В. Характеристика микрофлоры влагалища женщин в норме и патологии: Дис. канд. мед. наук. — Горький, 1986. 148с.
6. Урванцева Г.Г. Особенности течения беременности и исходы родов при высоком риске перинатальной патологии/ Т. А. Обоскалова, В. С. Иванова, Ж. К. Егорова // Урал. мед. журн. 2005. № 4. С. 23-27

Т. В. Севастьянова, Ю.А. Батман
В зависимости от вирулентности возбудителя, массивности инфицирования и состояния макроорганизма результатом инфекционного процесса может явиться:
- элиминация возбудителя (ликвидация инфекции);
- носительство (латентная инфекция);
- инфекционная болезнь.
Инфекционный процесс в начальной стадии и латентная инфекция обычно не сопровождаются клинически значимыми изменениями состояния здоровья и, как правило, могут быть выявлены при помощи специальных лабораторных методов.
Инфекционная болезнь всегда имеет клинические проявления; их выраженность и специфичность определяются свойствами возбудителя, реактивностью макроорганизма и временем, прошедшим с момента заражения.
У взрослого человека и ребенка старшего возраста благодаря высокой эффективности иммунного ответа значительно чаще наблюдается абортивное или латентное течение инфекции. У детей младшего возраста чаще развивается инфекционная болезнь.
Беременность является уязвимым периодом, способствующим приобретению инфекций и инфекционных заболеваний. Снижение физиологических адаптационных механизмов в период беременности приводит к повышению риска инфицирования. При этом может быть инфицирована не только беременная женщина, но также возможна трансмиссия инфекционных агентов плоду или новорожденному. Риск инфицирования плода зависит от воздействующего микроорганизма, пути передачи, потенциала прохождения плацентарного барьера, времени воздействия и иммунного статуса матери/плода.
Важным звеном в понимании влияния инфекций во время беременности или в неонатальный период, а также обеспечения профилактических мероприятий по предотвращению трансмиссии от матери к ребенку являются пути передачи инфекции плоду или новорожденному. Инфекции плоду/новорожденному могут передаваться in utero (врожденные инфекции), во время родов или в неонатальный период (послеродовая инфекция) (табл. 2.1).
Следует отметить, что большинство инфекций не проходят через плаценту или это происходит крайне редко. Многие микроорганизмы могут инфицировать плод/новорожденного во время родов и после родов (табл. 2.2). Опосредованное влияние на плод могут оказывать инфекции репродуктивного тракта, такие как условно-патогенные микроорганизмы (эндогенные инфекции), а также инфекции, передающиеся половым путем (ИППП), которые могут быть причиной хориоамнионита, преждевременных родов, инфекционных заболеваний у новорожденного.
Группа инфекций, которые могут проникать через плаценту и непосредственно воздействовать на плод, представлена в таблице 2.3.
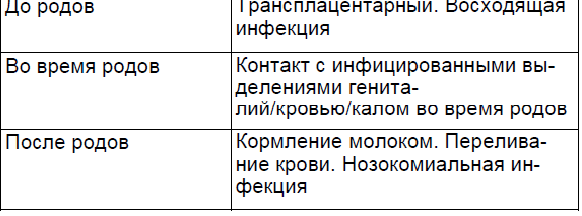
Пути распространения инфекций
Воздействие материнской инфекции на плод проявляется в прямом воздействии токсинов или микроорганизмов или в опосредованном контакте в результате нарушения функции плаценты или матки.
Следует также отметить, что при инфекционном заболевании у женщины во время беременности на эмбрион и плод действуют не только возбудители, но и токсические продукты, образующиеся при их распаде. А гипертермия и гипоксия у матери, которая может иметь место при остром процессе (и как следствие этого — образование токсических веществ), также негативно влияют на развивающийся плод и течение беременности.
Но не всегда наличие инфекционного процесса у матери сопровождается инфекционным поражением плода. Важным условием для инфицирования плода является наличие бактеремии или виремии у матери, а также длительность этой фазы, которая наиболее продолжительная при первичном инфицировании у матери, менее продолжительная — при рецидиве, и отсутствует при носительстве.
Первичная инфекция в период беременности представляет более серьезную угрозу для плода или новорожденного, нежели рецидивирующая или вторичная инфекция.
Появление материнской виремии с последующим инфицированием плода характерно для первичной инфекции краснухи. ЦМВ, как и простому герпесвирусу, характерна реактивация вируса в течение всей жизни с момента первичной инфекции, но рецидивирующие инфекции редко связаны с нежелательными последствиями для плода
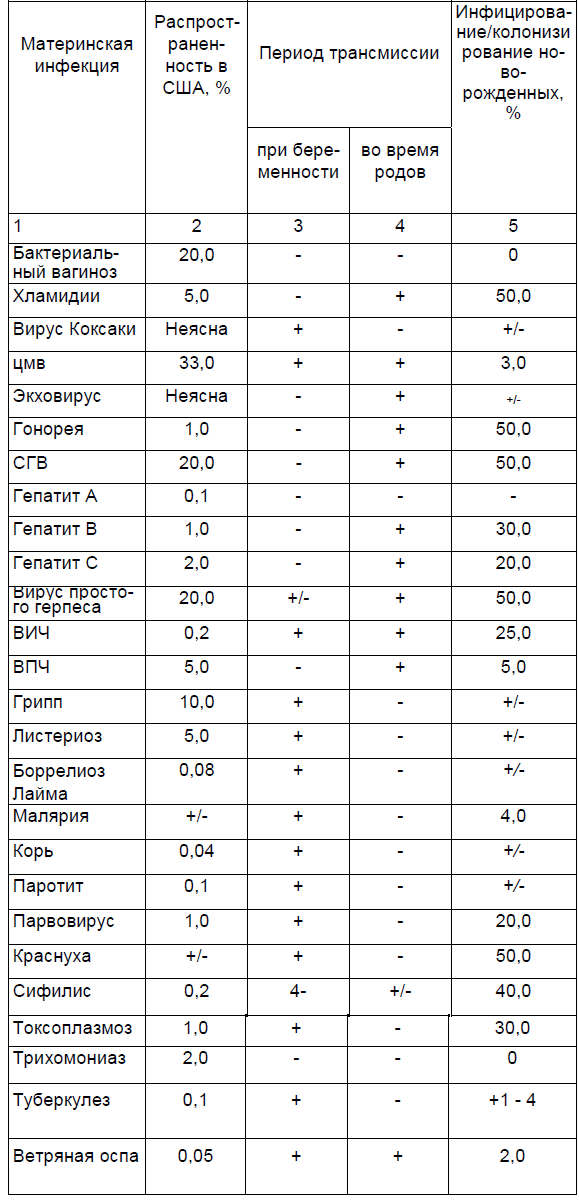
Перинатальная трансмиссия патогенов человека
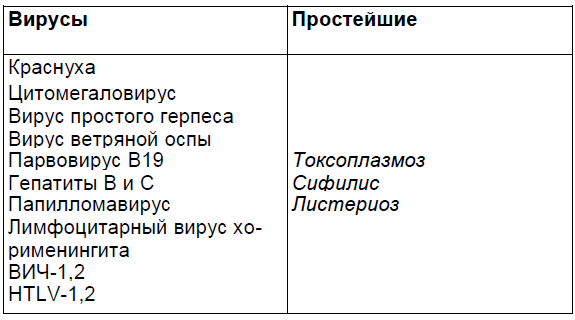
Инфекции периода беременности, способные повредить плод или новорожденного
Рецидивирующая инфекция, вызванная вирусом herpes simplex, является довольно частой и представляет значительный риск для новорожденного.
Т — Toxoplasma (токсоплазмоз);
О — Others (другие):
- сифилис;
- энтеровирусные инфекции;
- листериоз;
- парвовирус В19;
- человеческий папилломавирус;
- ветряная оспа;
R — Rubella (краснуха);
С — Cytomegalovirus (цитомегаловирус);
Н — Herpes simplex virus (вирус простого герпеса).
Возбудители данных инфекций вызывают у плода и новорожденных детей при внутриутробном заражении схожие клинические проявления, а впоследствии и стойкие структурные дефекты многих органов и систем, и особенно центральной нервной системы.
Наиболее распространенными клиническими признаками внутриутробной инфекции являются:
- задержка внутриутробного развития плода;
- гепатоспленомегалия;
- желтуха; сыпь;
- микроцефалия; гидроцефалия;
- тромбоцитопения;
- тяжелые неврологические нарушения.
Риск вертикальной трансмиссии и/или последствия для плода или новорожденного предопределяет гестационный срок беременности, в котором проявляется инфекция. Например, воздействие на плод краснухи в первый триместр беременности связано с высоким риском возникновения серьезных врожденных дефектов, таких как катаракта, аномалии сердца, сенсороневральная глухота, в то время как воздействие инфекции в более поздние сроки беременности или в послеродовом периоде создает меньшую угрозу. С другой стороны, воздействие на плод первичной цитомегаловирус-ной инфекции связано с риском возникновения нежелательных последствий в любом сроке беременности. В то же время проявление инфекции в период родов (при взаимодействии с инфицированными выделениями шейки матки) или в послеродовый период (через зараженное молоко матери) не связано с нежелательными последствиями, за исключением глубоко недоношенных или иммуноде-фицитных новорожденных.
Процент инфицирования плода в результате воздействия токсо-плазмоза матери зависит от времени проявления материнской инфекции: процент является низким (10%) при инфицировании в первые две недели после зачатия и увеличивается (более 90%), если инфицирование происходит в последние две недели беременности, а риск серьезных нежелательных последствий в результате токсоплазмоза намного выше при воздействии инфекции в ранние сроки беременности, нежели в поздние.
Появление генитальной герпесной инфекции в период родов создает риск неонатальной герпесной инфекции, заболеваемости и летальности новорожденных. С другой стороны, герпесная инфекция в ранние сроки беременности создает малую угрозу для плода. Проявление ветряной оспы в период родов или незадолго до них может быть причиной явной инфекции новорожденного, в то время как инфекция в первом и втором триместрах беременности связана с низким риском врожденного синдрома ветряной оспы (около 1%). Заболевание ветряной оспой во втором и третьем триместрах приводит к проявлению опоясывающего герпеса в детстве.
Некоторые перинатально приобретенные инфекции, такие как ВИЧ, не проявляются в форме острых инфекций в новорожденный период, а развиваются постепенно.
При развитии инфекции на ранних сроках гестации нередко формируются грубые пороки развития плода (эмбриопатия), несовместимые с жизнью; беременность часто заканчивается самопроизвольным выкидышем. При инфицировании после 8-12-й недели гестации эмбрио-/фетопатия может быть совместима с внутриутробной жизнью, однако до момента рождения в организме плода происходит ряд изменений, которые могут стать причиной мертворождения, тяжелого заболевания новорожденного или смерти в неонатальном периоде. При возникновении инфекции у плода во втором и третьем триместрах беременности могут выявляться как признаки инфекционного поражения отдельных органов плода (гепатит, миокардит, менингит/менингоэнцефалит, хориоретинит), так и симптомы генерализованной инфекции.
Исходы влияния инфекций на плод могут быть следующими:
- аборт или мертворождение;
- врожденные пороки развития;
- острое заболевание или летальность в неонатальный период;
- повреждения:
- очевидные при рождении;
- поздние проявления;
- бессимптомная инфекция.
Прерывание беременности. Большинство самопроизвольных прерываний беременностей в первом триместре является результатом хромосомных аномалий. Спонтанный выкидыш нормально развивающегося плода в первом триместре беременности происходит редко. Причиной ранних спонтанных выкидышей могут быть такие инфекции у беременной, как токсоплазмоз, сифилис, паротит, листериоз и парвовирус.
В отличие от выкидышей первого триместра, прерывание беременности во втором триместре часто связано с потерей нормально развивающегося плода и в большинстве случаев происходит в результате спонтанных преждевременных родов, разрыва околоплодных оболочек или гипоксии плода с последующими преждевременными родами. При исследовании плодов после спонтанных абортов второго триместра часто обнаруживаются гистологический хориоамнионит или колонизация микроорганизмами по сравнению с материалами, взятыми у женщин при индуцированных абортах, что указывает на связь преждевременных родов со скрытой инфекцией верхнего генитального тракта.
Мертворождение. В США мертворождение осложняет около 1% родов. Около 80% мертворожденных наблюдается до 37-й недели беременности, а половина из них — до 28-й недели. Этиология мертворождаемости, однако, не всегда ясна. Многие плоды раннего гестационного периода погибают в результате спонтанных преждевременных родов или разрыва околоплодных оболочек. Гистологические изменения плаценты с хориоамнионитом часто обнаруживаются в ассоциации с ранним мертворождением. Кроме того, у пациенток с мертворожденным плодом наблюдается повышенный риск возникновения послеродового эндометрита. Полученные данные позволяют предположить, что внутриматочная инфекция является главным фактором большинства мертворожде-ний, связанных как с преждевременными родами или разрывами оболочек, так и вызывающими гибель плода, что неизбежно ведет к рождению мертвого ребенка. Сифилис, парвовирус, краснуха, токсоплазмоз, малярия, боррелиоз Lyme, листериоз и стрептококки группы В являются главными факторами мертворождаемости.
Врожденные аномалии. Частота врожденных аномалий в общей популяции составляет 1-3%. Многие инфекции связаны с врожденными аномалиями, однако для подтверждения причин существуют лишь немногие доказательства. Следует отметить, что только сифилис, ветряная оспа и краснуха связаны с повышенной частотой врожденных аномалий. Эмбриопатия в результате ветряной оспы, характеризующаяся рубцами кожи, атрофией мышц, гипоплазией конечностей, осложняет около 3% беременностей матерей с острой инфекцией ( 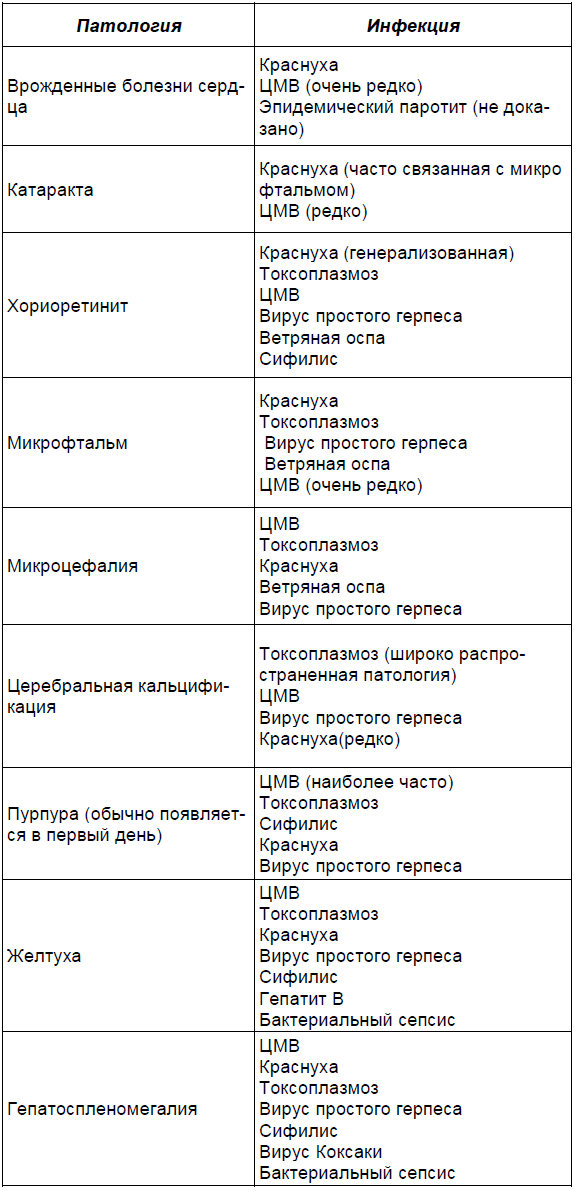
Связь клинической патологии с врожденной инфекцией
проявлений после родов и нет данных анамнеза материнской инфекции, трудно установить связь между врожденной и перинатальной инфекциями и состоянием здоровья в детском и взрослом периодах жизни.
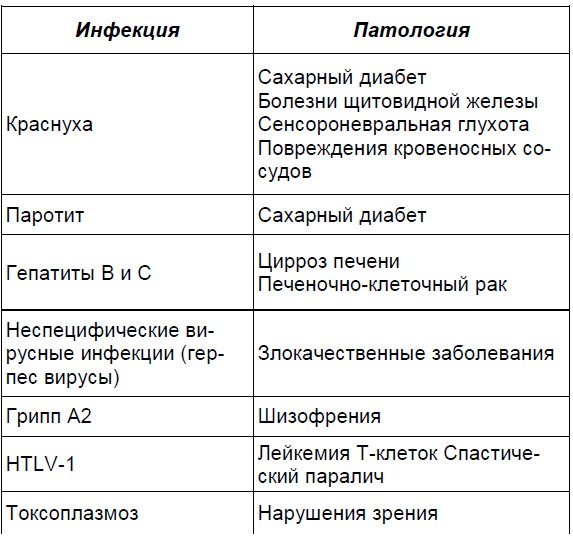
Возможные поздние последствия инфекций
Для установления возможного инфицирования плода/новорожденного вследствие материнской инфекции важны следующие моменты:
- распространенность инфекции;
- частота инфекции во время беременности;
- риск трансмиссии от матери плоду;
- период трансмиссии от матери плоду;
- факторы риска материнской и перинатальной инфекции;
- ранние и поздние последствия врожденной/перинатальной инфекции.
Читайте также:


