Инфекции в урологических отделениях
Т.С. ПЕРЕПАНОВА, доктор медицинских наук, главный научный сотрудник, руководитель группы клинической фармакологии. ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ПРИ ИНФЕКЦИЯХ МОЧЕВЫХ ПУТЕЙ
"Инфекции мочевых путей" (ИМП) - термин, охватывающий широкий круг заболеваний, при которых имеется микробная колонизация в моче свыше 10 4 КОЕ\мл и микробная инвазия с развитием инфекционного процесса в какой-либо части мочеполового тракта от наружного отверстия уретры до коркового вещества почек. В зависимости от преимущественного инфекционного поражения какого-либо органа выделяют пиелонефрит, цистит, простатит, уретрит и т.д.
Различают неосложненные и осложненные инфекции мочевых путей. Под неосложненной ИМП подразумевают инфекцию, развившуюся у больных без каких-либо анатомических, структурных или функциональных, неврологических повреждений (обычный острый цистит, острый необструктивный пиелонефрит). Этот вид инфекции хорошо поддается химиотерапии. Осложненная ИМП возникает у больных на фоне различных обструктивных уропатий, аномалий развития мочеполовой системы, мочекаменной болезни, после оперативных или инструментальных вмешательств, на фоне постоянных уретральных катетеров, при наличии инородных тел в мочевых путях (камни, стенты, дренажи), а также у больных с сопутствующими тяжелыми заболеваниями (сахарный диабет, нейтропения, иммунодефицитные состояния).
Значимость разделения инфекции мочевых путей на неосложненные и осложненные определяется не только их различными этиологическими агентами, что, соответственно, определяет различный спектр антибактериальных препаратов, но и различной тактикой ведения таких пациентов. Если при неосложненной ИМП, назначая антибиотики, мы стремимся к уменьшению или ликвидации инфекционного заболевания и предотвращению возврата инфекции, то при осложненной инфекции мочевых путей необходимо предотвратить не только возврат инфекции, но и повреждение почек. Важным моментом для успешного лечения именно инфекции мочевых путей является возможность коррекции анатомических аномалий или функциональных нарушений, удаление скрытых источников инфицирования (уретральные катетеры, дренажи, стенты, камни), на которых адгезируются микроорганизмы.
ИМП подразделяют так же на "госпитальную" и "внегоспитальную" или "уличную".
Внегоспитальная инфекция характеризуется предсказуемым и ограниченным спектром этиологических агентов, предсказуемым уровнем их антибиотикорезистентности, возникающая у пациентов с иммунокомпетентным организмом.
Госпитальная инфекция характеризуется широким спектром этиологических агентов, высоким риском разнообразных механизмом антибиотикорезистентности у них и развивается она на фоне иммунодефицитного организма.
Острый неосложненный бактериальный цистит в 80% случаев вызывается кишечной палочкой, в 15% - сапрофитным стафилококком и 5% - другими возбудителями. Возбудителями уретрита, клиническая симптоматика которых схожа с острым циститом, в настоящее время в большинстве случаев являются хламидии, гонококковая инфекция и вирус простого генитального герпеса - т.е. заболевания, передающиеся половым путем. Причиной острой дизурии у женщин также может быть вагинит, чаще грибковой, либо трихомонадной этиологии.
В ситуациях частой возвратной инфекции нижних мочевых путей, когда вновь выделяется первоначальный патогенный возбудитель необходимо урологическое обследование на предмет выявления аномалий развития или выявления сопутствующих заболеваний, соответствующая их коррекция и подбор адекватного антибиотика.
При выборе антибиотика 1-й линии для лечения ИМП отдают предпочтение антибиотикам, достигающим высокой бактерицидной концентрации в моче, с минимальными побочными действиями на микрофлору кишечника и влагалища, т.к. фекальная флора является в большинстве случаев основным источником кишечной палочки, как возбудителя инфекции нижних мочевых путей. Разрушение нормальной микрофлоры влагалища (в основном лактобактерии) также способствует колонизации влагалища колиформными бактериями, которые могут в дальнейшем колонизировать уретру и мочевой пузырь или привести к развитию кандидозного вагинита.
При выборе антибиотиков и режимов лечения осложненной госпитальной инфекции нижних мочевых путей необходимо строгое соблюдение этиотропности, т.е. в зависимости от результатов бактериологических исследований мочи. Рекомендуют ступенчатую терапию: лечение начинают с парентеральных антибиотиков, при достижении клинического эффекта через 7-10 дней (предлагают даже через 3-5 дней) - замена на парентеральный прием препаратов. Многообразие этиологических агентов (кишечная и синегнойная палочка, протей, клебсиелла, серрация, энтеробактер, стафилококки и энтерококки) обусловливает многообразие предлагаемых антибактериальных препаратов (аминогликозиды, фторхинолоны, "защищенные бета-лактамы", цефалоспорины 3-4-го поколения, карбапенемы и др.).
Выбор конкретного антибиотика для лечения осложненной инфекции основывается на многих факторах: серьезность и острота заболевания, спектр антимикробнои активности и чувствительность микроорганизма, фармакокинетика антибиотика, способность его проникать в ткани, в очаги инфекции, клиническая эффективность антибиотика, его переносимость, неблагоприятные побочные действия, удобство дозирования и стоимость лечения.
Целью антимикробной химиотерапии при лечении осложненных госпитальных инфекций мочевых путей является элиминация инфицирующих микроорганизмов за счет достижения оптимального количества активного препарата в очаге инфекции. Концентрация антибиотика в очаге должна быть достаточно высокой, выше, чем в крови, а экспозиция длительной.
В урологической практике к процедурам с высоким риском инфицирования, требующим антибактериальной профилактики относятся трансуретральные эндоскопические операции, требующие установки постоянного уретрального катетера, представляющего наиболее важный фактор риска инфицирования для больных. На катетерах и дренажах формируются "биофильмы", т.е. скопления адгезированных микроорганизмов различных родов и семейств, покрытых полисахаридной пленкой, которая защищает их от действия антибиотиков и антисептиков. Любая обтурация дренажей, промывание их стерильными растворами или рентгеноконтрастным веществом чревато вымыванием адгезированных колоний микроорганизмов, инфицированием мочевых путей и бактериемией. Персистенция микроорганизмов на дренажах и инородных телах может быть ликвидирована только после их удаления. При персистирующей ИМП основная цель - уменьшить частоту септических эпизодов.
Проблема антибиотикорезистентности микроорганизмов является одной из важнейших в борьбе с инфекцией. Для борьбы с антибиотикорезистентностью, обусловленной выработкой бета-лактамаз создаются комбинированные препараты, содержащие комбинацию антибиотика широкого спектра действия и ингибитора бета-лактамаз - амоксициллин + клавулановая кислота; ампициллин + сульбактам; цефоперазон + сульбактам; ампициллин + тазобактам.
Проведенными в НИИ урологии МЗ РФ исследованиями выявлена большая распространенность ферментов бета-лактамаз среди микроорганизмов, выделенных от больных в урологическом стационаре: процент микроорганизмов, обладающих бета-лактамазной активностью, варьировал от 36 до 75 в зависимости от видовой принадлежности возбудителя. Хорошая чувствительность к уназину (ампициллин + сульбактам) обнаружена у Staph.epidermidis - 84%, Staph.aureus - 68%, Streptococcus spp. - 83%, E.coli - 53%, Proteus mirabilis - 43%. В результате проведенного лечения уназином достигнут высокий клинико-бактериологический эффект - в 92,3% случаев, причем полной ликвидации патогена удалось добиться в 57,7% случаев.
Для проблемных микроорганизмов Pseudomonas aeruginosa, Enterobacter agglomerans, Proteus mirabilis сохраняется хорошая чувствительность к аминогликозидам, фторхинолонам, карбапенемам и цефалоспоринам. Цефалоспорины являются наиболее широко применяемыми антибиотиками при химиотерапии ГИМП, Высокая активность in vitro против микроорганизмов семейства Enterobacteriасеае, удобная фармакокинетика, хорошее проникновение в ткани, низкая токсичность и хорошая толерантность дают им преимущество при выборе антибиотика. Цефалоспориновый антибиотик цефоперазон является одним из активных бета-лактамов в отношении синегнойной палочки. Проведенными в НИИ урологии МЗ РФ исследованиями выявлена хорошая активность цефоперазона также и в отношении кишечной палочки, стафилококков, стрептококков, протеев, серрации. Обладая бактерицидным действием цефоперазон хорошо проникает в мочеполовые органы. Несмотря на преимущественное выведение его с желчью, концентрация в моче в первые 8 часов после введения в десятки раз превышает минимально подавляющие концентрации для большинства возбудителей ГИМП. При лечении осложненной инфекции мочевых путей на фоне мочекаменной болезни, дренажей хороший клинический эффект лечения получен у 86% больных, бактериологическая эффективность - в 73%. Необходимо отметить, что цефоперазон применялся у больных с ГИМП, вызванной полирезистентными возбудителями: синегнойной палочкой, серрацией, энтеробактер и др. В качестве антибактериальной профилактики однократное внутривенное введение 1 г цефоперазона на вводном наркозе у больных перед операциями (трансуретральные резекции простаты, мочевого пузыря, реваскуляризация полового члена, операции по поводу варикоцеле, кист почек лапароскопическим доступом) в 90% случаев обеспечивало хороший клинико-бактериологический результат.
Со временем видовой спектр и антибиотикочувствительность возбудителей ГИМП в любой клинике претерпевают изменения, что диктует необходимость постоянного бактериологического мониторинга, строгого контроля за проведением антибактериальной терапии в клиниках.
Не назначать антибиотики при каждом повышении температуры, умело варьировать как дозами, так и длительностью антибактериальной терапии.
Очевидна неэффективность длительного антибактериального лечения больных с наличием инородных тел в мочевой системе (камни, катетеры, дренажи), поэтому антибактериальное лечение этой группы больных необходимо проводить только в случаях выраженных клинических проявлений инфекционно-воспалительного процесса.






































Главное меню
Главное меню
Внутрибольничная, госпитальная инфекция мочевых путей (ГИМП) занимает первое место в мире среди всех видов внутрибольничных инфекций. ГИМП характеризуется широким спектром этиологических агентов и высокой частотой антибиотико-резистентных штаммов возбудителей. Наиболее частыми возбудителями ГИМП являются грамотрицательные микроорганизмы семейства Enterobacteriaceae и синегнойная палочка. Однако в последние годы отмечается увеличение роли грамположительной микрофлоры в генезе ГИМП, особенно энтерококковой инфекции.
Госпитальные штаммы микроорганизмов характеризуются множественной лекарственной устойчивостью, что вызывает значительные трудности при лечении инфекционновоспалительных заболеваний, возникших у больного в стационаре, особенно в послеоперационном периоде. Одним из путей снижения уровня ГИМП является использование антибактериальной профилактики перед проведением различных вмешательств и операций в урологических стационарах. Необходимо помнить, что главной целью этого мероприятия является профилактика инфекции, связанной с вмешательством, а не базовой инфекции, имеющейся у пациента. В этой связи назначение антибактериальной терапии за несколько дней до операции считается не профилактикой инфекции, а лечением.
В урологической практике проводят профилактику развития как симптоматической урологической инфекции (острый пиелонефрит, простатит, эпидидимит, уросепсис), так и тяжелой раневой инфекции.
Риск инфицирования во время операции зависит от общего состояния пациента, вида оперативного вмешательства и окружающих факторов.
При антибактериальной профилактике инфекционно-воспалительных осложнений урологических вмешательств, экстракорпоральной литотрипсии, трансуретральных операций, открытых операций и т.д. необходимо придерживаться двух принципов:
Системная антибактериальная профилактика не показана при открытых операциях без использования сегмента кишки; при реконструктивных операциях в генитальной области (за исключением длительного или вторичного вмешательства) или имплантационных операциях в урологии. При диагностических манипуляциях профилактика показана только при трансректальной тонкоигольчатой биопсии простаты. Антибактериальная профилактика перед смотровой цистоскопией или перед биопсией мочевого пузыря не показана из-за кратковременности вмешательства, смыва возможных уропатогенов при самостоятельном мочеиспускании после цистоскопии и антиадгезивной способности слизистой мочевого пузыря.
Перед трансуретральными операциями антибактериальная профилактика обязательна, даже при отсутствии бактериурии или данных за инфекционно-воспалительный процесс в мочевых путях перед операцией. Инфицирование возможно как во время операции (из вскрывающихся инфицированных протоков предстательной железы; нестерильного ирригационного раствора; инструментария; кожи пациента), так и после операции установка уретрального катетера приводит к восходящему инфицированию мочевых путей.
Многие антибактериальные препараты могут применяться при предоперационной профилактике: среди них цефалоспорины второго поколения; фторхинолоны; защищенные бета-лактамы. К препаратам группы резерва относятся аминогликозиды, цефалоспорины третьего-четвертого поколения, карбапенемы и ванкомицин, пиперациллин/тазобактам, азтреонам. Эти лекарственные средства должны применяться при профилактике крайне редко и осторожно, только если есть уверенность в контаминации места операции полирезистентными госпитальными штаммами.
Антибактериальная профилактика никогда не компенсирует пло□ хую оперативную технику, она является только одним из компонентов в управлении инфекцией. Необходимо строго соблюдать другие важные условия, способствующие профилактике госпитальной инфекции вообще:
- короткий срок пребывания в больнице;
- короткий предоперационный период;
- тщательный уход за катетерами и дренажами не промывать! При
обструкции катетера смена на стерильный катетер. При антеградной пиелографии смена на стерильный нефростомический дренаж и введение рентгеноконтрастного вещества по нему. Необходимо в каждом урологическом отделении разработать протокол по уходу за катетерами и строго его соблюдать! При промывании любого дренажа уретральный катетер, нефростомический или цистостомический дренаж, сосудистые катетеры биопленка (микроорганизмы различных родов и семейств, адгезированных на дренажах) смывается в мочевые пути или сосудистое русло, тем самым вызывая бактериемию, бактериурию, гипертермию и возможное развитие очаговых гнойных процессов в почке, простате, яичках, легких, эндокарде и т.д.;
Факторы, увеличивающие риск послеоперационной инфекции, представлены в таблице 1.
Таблица 1. Факторы, увеличивающие риск послеоперационной инфекции
| Состояние пациента | Увеличение бактериальной нагрузки |
| Ухудшение общего состояния | Операции с использованием кишечного сегмента |
| Метаболические нарушения, сахарный диабет | Трансректальная биопсия простаты |
| Иммуносупрессия | Длительное дренирование мочевых путей |
| Повторные операции | Обструктивная уропатия |
| Особый риск (например, искусственный клапан сердца) |
При отсутствии факторов риска и наличии стерильной мочи необходимости в антибактериальной профилактике нет, однако при повышении ожидаемого риска (перфорация кишки во время операции, вскрытие абсцесса, карбункула почки) показано интраоперационное применение антибиотиков.
Время назначения антибактериальной профилактики и длительность предоперационной профилактики
Необходимо применять антибиотик до начала контаминации, для профилактики раневой и системной инфекции. В начале операции необходим высокий уровень антибиотика в крови. При интраоперационных осложнениях необходимо немедленно внутривенно ввести антибиотик.
Если антибиотик назначается больному более чем за 1 час до операции, отмечается увеличение послеоперационных инфекционновоспалительных осложнений.
Любой антибиотик, назначенный, после того, как рана зашита, не меняет уровень раневой инфекции. Однако это не относится к эндоскопическим операциям.
Не рекомендуют применять один и тот же антибиотик для лечения и профилактики, необходимо использовать антибиотики, создающие высокую концентрацию в моче, периодически менять препараты для антибактериальной профилактики в клинике для уменьшения селекции резистентных штаммов микроорганизмов.
Классификация урологических операций и вмешательств
С учетом требований к предоперационной антибактериальной профилактике все урологические вмешательства делятся на:
- Открытые операции:
- на мочевых путях с использованием сегментов кишечника;
- на мочевых путях без использования сегментов кишечника;
- операции вне мочевых путей, с использованием имплантатов и протезов полового члена, яичек, искусственные сфинктеры, синтетические нити и др.;
- реконструктивные генитальные операции: неотложные и плановые;
- Эндоскопические инструментальные операции:
- на уретре;
- на предстательной железе;
- на мочевом пузыре;
- на мочеточнике и почке;
- перкутанная нефролитолапаксия;
- экстракорпоральная литотрипсия;
- лапароскопические операции;
- Диагностические процедуры:
- биопсия простаты: трансректальная, перинеальная;
- уретроцистоскопия;
- уретероцистоскопия;
- перкутанная пиелоскопия;
- лапароскопические процедуры.
Урологические операции на мочевых путях с использованием сегментов кишечника
При использовании сегментов кишечника в развитии послеоперационной инфекции значительную роль играют микроорганизмы кишечной группы: кишечная палочка, энтеробактерии, энтерококки, анаэробы, стрептококки.
С целью антибактериальной профилактики рекомендуют: ингибиторзащищенные аминопенициллины, цефалоспорины второго поколения в сочетании с метронидазолом.
Спорным является вопрос о необходимости длительной антибактериальной терапии после операций с замещением мочевого пузыря сегментом кишки. Однако необходимо помнить, что постоянная катетеризация и ирригация колонизированного интестинального сегмента может привести к бактериемии и в исключительных случаях к портальной пиемии. Q
Урологические операции на мочевых путях без использования сегментов кишечника
При открытых операциях без применения сегмента кишечника системная антибактериальная профилактика не требуется. Она необходима только у пациентов с повышенным риском инфекции или перед трансуретральными операциями.
Наиболее часто встречающимся возбудителем инфекционных осложнений в данном случае являются: кишечная палочка, энтерококки, стафилококки, клебсиелла и протейная инфекция. В каждом стационаре, урологическом отделении, как правило, бывают разные ведущие возбудители мочевой инфекции, поэтому необходим постоянный бактериологический мониторинг, определение уровня резистентных штаммов микроорганизмов и соответствующая локальная антибактериальная политика.
В настоящее время рекомендуются фторхинолоны, ингибиторзащищенные аминопенициллины, цефалоспорины второго поколения. Для пациентов с повышенным риском инфекции альтернативой служат цефалоспорины третьего поколения.
Урологические операции вне мочевых путей
Предоперационная антибактериальная профилактика в целом не рекомендуется, за исключением длительных реконструктивных операций в области малого таза или при имплантационной хирургии. Обычно рекомендуются цефалоспорины 1-2 поколения, т.к. доминирует стафилококковая инфекция.
Эндоурологические манипуляции
Предоперационная профилактика показана, т.к. имеется риск интраи послеоперационного инфицирования.
К факторам риска относятся:
- время операции и наркоза (> 90 минут);
- размер простаты (> 45 г);
- объем кровопотери;
- острая задержка мочеиспускания;
- установка уретрального катетера;
- наличие эпицистостомы.
Интраоперационный риск связан с вскрытием инфицированных протоков простаты во время резекции, инфицированным ирригационным раствором.
Рекомендуемые антибиотики: фторхинолоны, ингибиторзащищенные аминопенициллины, цефалоспорины второго поколения, фосфомицин трометамол. Альтернативой служат аминогликозиды. Однако необходимо помнить о повышении риска блокады нервномышечной передачи при совместном использовании с препаратами для наркоза.
При лапароскопических операциях используют те же режимы, что и при открытых операциях.
Диагностические урологические вмешательства
При тонкоигольчатой трансректальной биопсии простаты рекомендуют фторхинолоны, цефалоспорины 2 поколения + метронидазол или ингибиторзащищенные аминопенициллины. При других диагностических процедурах антибактериальная профилактика рекомендуется только у пациентов с высоким риском развития инфекции например, ципрофлоксацин 500 мг 1 раз внутривенно перед манипуляцией.
Послеоперационное дренирование мочевых путей
При длительном послеоперационном дренировании мочевых путей уретральным катетером, стентом, нефростомой антибактериальная профилактика и лечение неэффективны. Это связано с развитием биопленок на поверхности дренажей. При выраженной клинической картине заболевания, т.е. симптоматической ИМП, лечение должно быть эмпирическим до результатов бактериологических исследований, после получения которых проводят коррекцию лечения. Бессимптомную бактериурию лечат только до вмешательства или когда удалены дренажные трубки.
Принципы антибактериальной профилактики инфекционновоспалительных осложнений:
- спектр действия применяемого антибиотика должен перекрыть наиболее часто встречающихся возбудителей инфекции;
- в клиниках с высоким уровнем резистентных возбудителей, обладающих р-лактамазами широкого и расширенного спектра действия, обуславливающими устойчивость к 5 группам антибиотиков (аминопенициллины, защищенные аминопенициллины, цефалоспорины, фторхинолоны и аминогликозиды), необходимо использовать для антимикробной профилактики препараты, имеющие наибольшую чувствительность, например фосфомицин.
- перевод с цефалоспоринов в настоящее время становится необходимым из-за увеличения числа энтерококков и MRSA (метициллин-резистентного золотистого стафилококка). Также важное значение приобретает MRSE (метициллин-резистентный эпидермальный стафилококк). Эти возбудители устойчивы к цефалоспоринам. Уменьшение использования цефалоспоринов необходимо как контроль над MRSA и C. Dificille и Enterococci в стационаре;
- все препараты назначают внутривенно как в разовой дозе за / часа при в/в введении или за 1 час при в/м введении для достижения максимальной концентрации в тканях во время операции;
- одна доза антибиотика в большинстве случаев достаточна, если нет кровопотери свыше 1500 мл во время операции, гемодилюции до 15 мг/кг или если операция продолжается свыше 2-х часов.
- следующая доза антибиотиков необходима в случае контаминации раны во время операции в течение 48 часов, но уже как терапия, а не профилактика;
- использовать ступенчатую терапию: перевод на пероральный прием после внутривенного введения препаратов, имеющих две лекарственные формы, в частности, левофлоксацин, офлоксацин, ципрофлоксацин, амоксиклав, некоторые цефалоспорины, что имеет фармакоэкономические преимущества. □

Общие сведения
Частота регистрации ИСМП в разных странах варьирует в широких пределах. Так, в РФ этот показатель составляет 1-1,5% (40-60 тыс. случаев/год), США — 3-5 % (2,5 млн. случаев/год), Великобритании — 5-6 %, Германии —3,5 %, Китае — 7-8 %. Однако, эти показатели, особенно в странах СНГ и, в частности, России не отражают реальную эпидемиологическую ситуацию. Результаты научных исследований ведущих специалистов-эпидемиологов РФ свидетельствуют, что реальное количество ИСМП составляет в среднем около 10% и находится на уровне 2-2,5 миллионов случаев/год. Присоединение ИСМП к основному заболеванию увеличивает продолжительности лечения (пребывания в стационаре) пациента на 7-10 дней, а прямые затраты лечебных учреждений на 65-85 млрд рублей в год. Летальность при различных нозологических формах ИСМП варьирует в пределах 3,5-35%.
Наибольший удельный вес ИСМП приходится на хирургические и акушерские стационары (отделения травматологии, урологии, реанимации, абдоминальной хирургии, гинекологии, ожоговой травмы, стоматологии, отоларингологии, онкологии). Наиболее драматичны проявления ИСМП в отделениях интенсивной терапии и реанимации, где они в различных нозологических формах регистрируются в 25-30% случаев.
Патогенез
Патогенез внутрибольничных инфекций существенно различается и определяется видом заболевания, этиологическим фактором (видом возбудителя, факторами его вирулентности), механизмом и путями передачи инфекции.
Классификация
Прежде всего, различают две больших группы ИСМП (рис. ниже):
- Экзогенная инфекция — обусловлена заражением пациента инфекционным агентом в условиях посещения/нахождения в ЛПУ.
- Эндогенная инфекция — инфекции, вызванных условно-патогенными микроорганизмами, вегетирующими в пищеварительном тракте, на кожных и слизистых покровах, которые при неблагоприятных условиях становятся патогенными. В структуре ВБИ роль эндогенной инфекции незначительна.
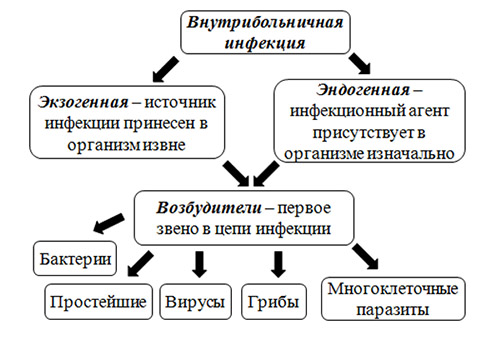
Группы и этиологический фактор ИСМП
В основу классификации ВБИ положены различные факторы. В зависимости от путей/факторов передачи различают воздушно-капельные, контактно-бытовые, контактно-инструментальные, постоперационные, постинфекционные, постэндоскопические, послеродовые, посттрансфузионные, постдиализные, посттравматические, постгемосорбционные и другие инфекции.
В зависимости от степени распространения инфекции различают:
- Генерализованные: бактериемия, септицемия, септикопиемия, токсико-септическая инфекция.
- Локализованные инфекции, включающие:
- Респираторные инфекции (ОРЗ, бронхит, плеврит, пневмония, легочный абсцесс и др.).
- Инфекции подкожной клетчатки/кожи (послеожоговые, послеоперационные, послетравматические), дерматомикозы, постинъекционные — абсцессы/флегмоны подкожной.
- Стоматологические инфекции (абсцесс, стоматит).
- ЛОР-инфекции (ринит, отиты, синуситы, ангина, ларингит, фарингит).
- Урологические инфекции.
- Инфекции пищеварительного тракта (энтерит, колит, гастроэнтероколит, холецистит, гепатиты др.).
- Постоперационные инфекции (перитонит, абсцессы брюшины).
- Инфекции глаза (конъюнктивит).
- Инфекции урологической и половой системы (пиелонефрит, уретрит, цистит, бактериурия, эндометрит, сальпингоофорит).
- Инфекции костно-cуставного аппарата (остеомиелит, бурсит, артрит).
- Инфекции сердечно-сосудистой системы (миокардит, эндокардит, перикардит, инфекции артерий и вен).
- Инфекции ЦНС (менингит).
- По характеру течения: острые, подострые, хронические. По тяжести течения: легкие, тяжёлые и среднетяжелые.
Причины
Этиологическим фактором ИСМП может быть чрезвычайно широкий спектр микроорганизмов (около 250 видов), принадлежащих к разным таксономическим группам: бактерии, вирусы, простейшие, грибы. При этом, инфекционным агентом могут быть патогенные, условно-патогенные микроорганизмы, а в ряде случаев и сапрофитная микрофлора. Наибольшей удельный вес в этиологической структуре ИСМП принадлежит возбудителям гнойно-септических инфекций (80-85%), кишечных инфекций (8-10%), вирусам гепатитов В, С, D (6-7%), инфекции дыхательных путей (2-3%). В целом, структура ВБИ изменчива и зависит преимущественно от профиля отделения/вида стационара и микробного пейзажа конкретного лечебного отделения (рисунок ниже).
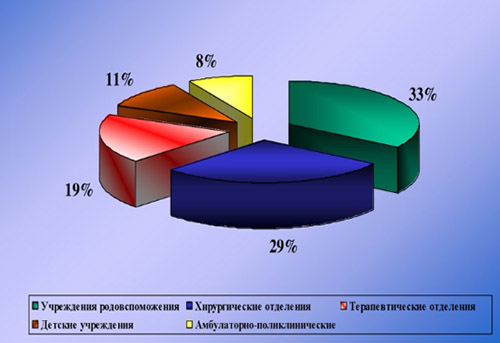
К возбудителям ВБИ, имеющими наибольшее значение относятся:
- грамположительная флора: стафилококки (золотистый, эпидермальный), стрептококки (пневмококк, энтерококк, пиогенный стрептококк);
- грамотрицательная флора: энтеробактерии (эшерихия, сальмонелла, шигелла, синегнойная палочка, клебсиелла, протей, иерсиния).
- вирусы (аденовирусной инфекции, простого герпеса, кори, ветряной оспы, гриппа, парагриппа, респираторно-синцитиальной инфекции, эпидпаротита, ротавирусы, риновирусы, энтеровирусы, возбудители вирусных гепатитов);
- грибы (рода Candida, аспергиллы).
Значимость различных видов ИСМП во многом определяется профилем ЛУ. Так, в гинекологических и родильных отделениях ведущую роль играет стафилококковая инфекция (золотистый стафилококк), кишечная палочка, энтерококки, диплоидный грибок (молочница); в ожоговых стационарах — синегнойная инфекция; в урологических отделениях — грамотрицательная микрофлора: кишечная, синегнойная палочка; в детских отделениях — вирусы краснухи, кори, эпидемического паротита, ветряной оспы.
Формирование госпитального штамма (с приобретенной устойчивостью) обеспечивается за счет их преимущества (доминирования) перед другими представителями микробной популяции. Основными отличиями госпитального штамма микроорганизма от стандартного являются: повышенная вирулентность (патогенность), формирующаяся за счет многократного пассажа через организм больных ЛПУ, высокая устойчивость к воздействию неблагоприятных факторов (дезинфектантам, антисептикам, химиопрепаратам, применяемым в конкретном мед. учреждении) и способность к длительному выживанию, постоянная циркуляция в среде больничного стационара среди больных и персонала.
Основную массу всех форм ВБИ (около 80%) составляют:
- инфекции мочевыделительной системы;
- ОРЗ и вентилятор-ассоциированные пневмонии;
- послеоперационные раневые гнойно-септические инфекции;
- кожные инфекции;
- интраабдоминальные инфекции;
- ангиогенные катетер-ассоциированные инфекции.
Любая нозологическая форма ВБИ развивается только при наличии всех звеньев эпидемического процесса: источника инфекции, механизма (факторов) передачи и восприимчивого организма человека.
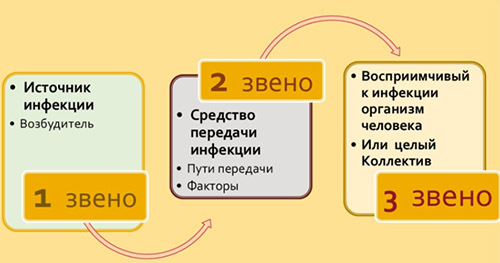
Основные источники внутрибольничной инфекции:
- больные и носители, находящиеся в стационаре;
- персонал лечебных учреждений;
- лица, ухаживающие за больными и посетители стационаров (студенты, лица, навещающие пациентов).
Аэрогенный — процесс заражения осуществляется через воздушную среду. Выделяют:
- воздушно-капельный путь (этим путем возбудитель передается при большинстве ОРЗ, пневмониях) при разговоре, кашле;
- воздушно-пылевой путь (передаются заболевания, возбудитель которых устойчив во внешней среде — кишечные инфекции, туберкулез, зоонозы).
- Контактно-бытовой путь – инфекционный агент передается через грязные рук, предметы личной гигиены, игрушки, посуду.
- Пищевой (реализуется через зараженные продукты питания при нарушениях технологии приготовления или хранения готовых блюд и пищевых продуктов).
- Водный (через воду).
- Прямой — передача возбудителя непосредственно через физический контакт между резервуаром инфекции (инфицированный индивидуум/контаминированный предмет) с кожей, слизистой или раневой поверхностью восприимчивого организма человека.
- Непрямой — посредством механического переноса инфекционного агента через руки медицинского персонала, предметы обихода, инструменты и оборудование лечебного учреждения. Непрямой контакт является наиболее часто задействованным путем распространения. Этот путь передачи часто называют артифициальным (искусственным) или парентеральным путем передачи возбудителя, который реализуется путем проведения различных инвазивных манипуляций (инъекции, забор крови, инструментальные манипуляции, вакцинацию, местные/общие операции) или использовании специальной аппаратуры при проведении гемодиализа, ИВЛ.
- Гемоконтактный — передается через кровь при обширных хирургические вмешательствах, инфузионной терапии, программном гемодиализе.
Заболеваемость ИСМП носит преимущественно эндемический характер и обусловлена индивидуальными факторами риска и клиническими процедурами. Значительно реже ИСМП протекают в виде локальных эпидемий. Развитию эпидемических вспышек способствует несвоевременная диагностика стертых форм заболевания и выявление носителей инфекционных агентов, как среди поступающих пациентов, так и среди медицинского персонала, контаминация предметов общего пользования, систематическое нарушение методов асептики при выполнении инструментальных процедур.
Специфичны для каждого вида инфекционного возбудителя. Однако, в целом для большинства нозологических форм ИСМП определяющими факторами являются параметры, характеризующие организм хозяина:
- возраст (пожилой/старческий, дети — новорожденные и раннего возраста, особенно недоношенные, со сниженной сопротивляемостью организма и перенесшие родовую травму);
- пациенты, страдающие тяжелыми хроническими заболеваниями, с алиментарной дистрофией;
- длительно находящиеся в стационаре и особенно на постельном режиме;
- беременные/роженицы;
- пациенты, получающие лучевую/иммуносупрессивную терапию;
- имунноскомпрометированные лица;
- больные после обширных хирургических операций, получающие кровезаместительную/инфузионную терапию, с программным гемодиализом, находящиеся на ИВЛ.
Факторы риска ИСМП, связанные с предметами окружающей среды (загрязнение поверхностей, воздуха, воды в распространении инфекции) имеют меньшую значимость.
Возникновению и распространению ИСМП способствуют:
Симптомы
Симптоматика внутрибольничных инфекций определяется конкретной нозологической формой и симптомами основного заболевания, формой и тяжестью их течения, вирулентностью инфекционного агента и состоянием организма больного.
Анализы и диагностика
К ВБИ относятся случаи, отвечающие следующим критериям:
- Повторное поступление пациента в стационар с установленной инфекцией (с клиническими признаками, данными инструментальных и лабораторных методов исследовани — микробиологических, серологических и методов экспресс-диагностики), являющееся следствием предыдущей госпитализации.
- Период развития клинической симптоматики заболевания ВБИ после поступления в лечебный стационар должен составлять не менее 48 часов и более.
- Выявляется четкая взаимосвязь между симптоматикой заболевания и проведенными вмешательства инвазивного типа (после ингаляции, инъекций, перевязки и т.д.) или в ряде случаев — с выявленным источником инфекционного агента (поступивший больной со стертой формой заболевания/носитель) и фактором ее распространения.
Для точной диагностики заболевания и определения конкретного штамма возбудителя инфекции, требуется проведение лабораторных—бактериологических/серологических исследований различных биоматериалов (мазок из зева, мокрота, кровь, моча, кал, раневое отделяемое).
Лечение
Проблема лечения госпитальных инфекций представляет значительную трудность, что обусловлено неэффективностью большинства широко применяемых антибиотиков, в частности цефалоспоринов. Для лечения таких инфекций применяются карбапенемы (Меропенем, Дорипенем), имеющие широкий спектр антимикробной активности, в частности к микроорганизмам, устойчивым к пенициллинам/цефалоспоринам или в ряде случаев комбинированные лекарственные препараты пенициллинов с ингибиторами бета-лактамаз (Пиперациллин + Тазобактам, Тикарциллин, Амоксициллин-Клавуланат и др.).
Карбапенемы используются для лечения тяжелых нозокомиальных пневмоний и других инфекций верхних дыхательных путей; инфекций органов малого таза, гинекологических, абдоминальных, мочеполовых инфекций; кожи и мягких тканей; сепсиса. Однако, препараты этой группы могут вызывать побочные реакции в виде крапивницы, сыпи, диспепсических расстройств, поражения печени и почек, дисбактериоза.
При выявлении метициллинрезистентных штаммов золотистого стафилококка, являющегося частым возбудителем внутрибольничных резистентных стафилококковых инфекций для лечения, используются гликопептидные антибиотики (Ванкадицин, Тейкопланин-Тева, Ликованум, Таргоцид и др.), которые высокоактивны по отношению к грамположительным аэробным/анаэробным инфекционным агентам — стафилококкам, стрептококкам, пневмококкам, энтерококкам, клостридиям, листериям, коринебактериям и другим. Показаниями к назначению являются тяжелые инфекции, вызванные энтерококками, инфекционный эндокардит, ассоциированный с зеленящими стрептококками, менингит и пневмонии, вызванные пневмококком, катетер-ассоциированный сепсис, перитонит, антибиотик-ассоциированная диарея и других инфекций, угрожающих жизни. В ряде случае гликопептидные антибиотики сочетаются с цефалоспоринами 3 поколения (Цефтибутен, Цефиксим, Цефотаксим, Цефоперазон, Цефтазидим и др.) или фторхинолонами (Офлоксацин, Ципрофлоксацин, Пефлоксацин, Норфлоксацин, Левофлоксацин и другие).
Необходимо отметить, что спектр возбудителей внутригоспитальных осложнений, а также их антибиотикорезистентность существенно различаются в отделениях различного профиля, поэтому при выборе антибиотика следует ориентироваться на чувствительность выделенной микрофлоры к ним, в также учитывать эпидемиологическую ситуацию в каждом конкретном лечебном учреждении.
Кроме антибиотикотерапии назначается специфическое лечение при той или иной конкретной нозологической форме ВБИ с учетом клинических проявлений, тяжести течения, риска развития осложнений. В индивидуальном порядке проводится симптоматическое лечение. В качестве дополнительной терапии назначают иммуностимуляторы: интерферон; бактериофаги, витаминно- минеральные комплексы.
В настоящее время для борьбы с тяжелыми проявлениями ВБИ разработана стратегия деэскалационной терапии, базирующаяся на нескольких принципах:
- Безотлагательное начало проведения антибактериальной терапии.
- Выбор антимикробных препаратов (АМП) с учетом чувствительности микроорганизмов и способности проникать в ткани, при отсутствии таких данных — использование антибиотиков широкого спектра действия.
- Назначение высоких доз антибиотиков, подбираемых индивидуально.
Эта стратегия предполагает безотлагательное назначение стартового антибиотика широкого спектра действия (комбинации антибиотиков) с целью максимально полного охвата спектра вероятных возбудителей с последующим переходом на антибиотик, к которому отсутствует устойчивость согласно данным микробиологического исследования. Именно своевременная и адекватная антимикробная терапия является ключевым условием и благоприятным прогностическим фактором, увеличивающей вероятность благоприятного исхода заболевания.
Читайте также:


