Инфекционные болезни птиц бактериальной этиологии
Бактериальные болезни птиц следует рассматривать как проблему не только ветеринарную, но и как медико-экологическую, так как кишечник сельскохозяйственной птицы может быть источником патогенных для людей микроорганизмов из которых наиболее серьезными возбудителями заболеваний являются сальмонеллы, кампилобактерии, шигеллы и др. Поэтому вопрос эффективной профилактики бактериальных болезней птицы актуален не только с позиций ветеринарии и медицины, но и с позиций наращивания объёмов производства продукции и экономических показателей хозяйства.
Широкое применение антибиотиков для лечения и профилактики бактериальных болезней птицы, особенно бессистемное, с невыдерживанием доз и схем, не только неэффективно, но и наносит существенный ущерб за счёт развития антибиотикорезистентности и, следовательно, сокращения выбора антибиотиков.
Поэтому в ветеринарии актуальным становится изучение альтернативных путей профилактики бактериальных болезней с использованием новых высокоактивных, экологически чистых препаратов с целью нормализации микробиоценоза желудочно-кишечного тракта птицы и снижения инфицированности патогенной и условно-патогенной микрофлорой.
В основе состава кормовых добавок, выпускаемых под товарным знаком КЛИМ (КЛИМ Гидро, КЛИМ Термо, КЛИМ) — кислые соли и кислоты цикла Кребса. Их уникальный состав позволяет подкислять корм и питьевую воду, а в организме птицы — подавлять патогенные микроорганизмы, действовать как гепатопротектор, иммуномодулятор, антиоксидант, антистрессовый препарат. В результате действия данных продуктов повышаются сохранность и среднесуточные приросты, отмечается однородность цыплят и лучший выход мяса.
Целью наших исследований явилось изучение антитоксического и профилактического действия кормовых добавок КЛИМ в отношении возбудителей сальмонеллёза и колибактериоза птицы при экспериментальном заражении цыплят, а также влияния на продуктивность и сохранность цыплят-бройлеров.контроль болезней птицы бактериальной этиологии с использованием современных препаратов
В опыте были использованы цыплята-бройлеры суточного возраста кросса РОСС 308. Цыплята были разделены на 4 группы по 30 голов в каждой. Контрольная группа получала только стандартный рацион. Первая опытная группа получала стандартный рацион и препарат КЛИМ Гидро: начиная с первых суток препарат ежедневно выпаивали с водой в дозе 1 мл на 1 л воды через специально оборудованные поилки. Второй опытной группе начиная с 4 суток ежедневно выпаивали препарат КЛИМ Термо в дозе 1,5 мл на 1 л воды. Третьей опытной группе с 5 суток ежедневно выпаивали препарат КЛИМ в дозе 1 мл на 1 л воды.
Каждые 7 дней, начиная с первых суток, проводилось взвешивание цыплят на электронных весах (по 20 голов от каждой группы). В 21-суточном возрасте по 8 цыплят каждой из четырех групп были заражены культурами Salmonella enteritidis и Escherichia coli. Заражение проводили суточными бульонными культурами per os индивидуально каждую птицу однократно в дозе 1 млрд микробных клеток на голову. За заражёнными цыплятами вели наблюдение, при падеже цыплят проводили вскрытие, патологоанатомическое и бактериологическое исследование. По окончании опыта (через 14 дней после заражения) было проведено взвешивание выживших цыплят, затем они были убиты, вскрыты, проведены патологоанатомические и бактериологические исследования. Эффективность действия препаратов определяли по клиническим признакам болезней, частоте встречаемых патологоанатомических признаков, выделению возбудителей заражающего штамма из внутренних органов.
В результате наших исследований установлено, что препараты КЛИМ Гидро, КЛИМ Термо, КЛИМ положительно влияют на продуктивность цыплят-бройлеров. Цыплята всех опытных групп, получавшие препарат, имели более высокий прирост массы, чем в контроле (рис. 1)
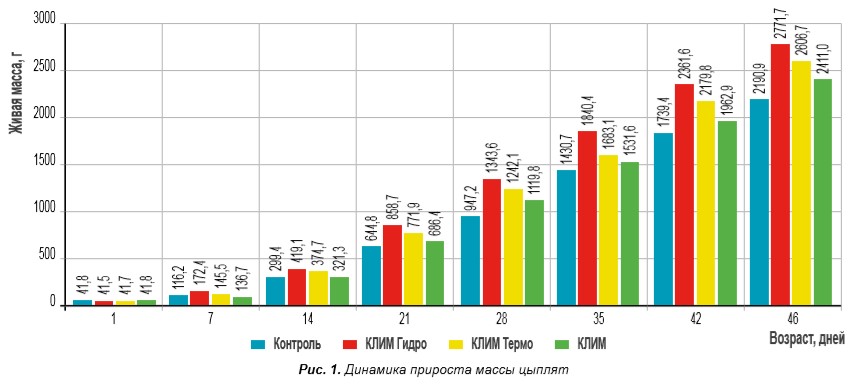
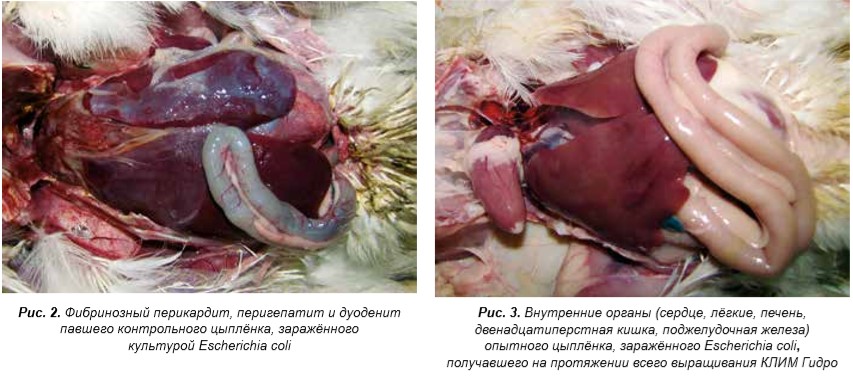
Как показали исследования, при экспериментальном заражении цыплят культурами Escherichia coli и Salmonella enteritidis в контрольных вариантах наблюдался падёж цыплят, на вскрытии отмечены патологоанатомические признаки бактериальных болезней (рис. 2), из внутренних органов выделены культуры заражающих штаммов.
В то же время заражённые цыплята, получавшие препараты КЛИМ, были живы и клинически здоровы на протяжении всех 14 дней наблюдения (рис. 3), к убою имели более высокую живую массу; культуры заражающего штамма Salmonella enteritidis не выделены (антиинвазивные свойства).
На протяжении всей технологической цепи производства кормов, начиная с периода вегетации кормовых культур или начального этапа переработки побочных продуктов мясо- и рыбоперерабатывающей промышленности и до поступления готового корма в кормушки, происходит непрерывный процесс его обсеменения микрофлорой. В том числе, возможно, и патогенной. Наиболее опасно с точки зрения здоровья не только непосредственно птицы, но и человека (через птицу и её продукты) заражение кормов E. coli, Salmonella, Campylobacter, Listeria, Clostrida. Наибольшую опасность представляет контаминация кормов сальмонеллами.
Существует несколько способов обеззараживания кормов: гранулирование, эструдирование (тепловая обработка), обработка антибактериальными препаратами.
Два первых метода, безусловно, эффективны, однако не предотвращают повторной контаминации. Гарантированно может предохранить корма от заражения условно-патогенной и патогенной микрофлорой лишь обработка антибактериальными препаратами. Это могут быть комплексные препараты, представляющие собой тщательно подобранную смесь органических кислот и их солей, или отдельные препараты на базе муравьиной, лимонной и других кислот.
Одними из таких антибактериальных средств являются новые препараты СабКонтрол и СабКонтрол плюс.
СабКонтрол — кормовая добавка для предотвращения роста патогенной микрофлоры в кормах, нормализации пищеварения, повышения сохранности и продуктивности свиней и сельскохозяйственной птицы. Это уникальный комплекс органических кислот и солей, обладающий подкисляющим, фунгицидным, бактерицидным, бактериостатическим и физиолого-стимулирующим действиями, а также выраженным пребиотическим эффектом. СабКонтрол состоит из формиата натрия, пропионата кальция, бутирата натрия и фумаровой, лимонной, бензойной и сорбиновой кислот. Следует также отметить, что наполнитель СабКонтрол — алюмосиликат со слоистой структурой, которая обеспечивает плавное и пролонгированное действие препарата, высвобождая кислоты постепенно на протяжении всего ЖКТ. СабКонтрол плюс — фунгицидно-антисептический комплекс кислот и бутирата натрия, предназначенный для уничтожения патогенных микроорганизмов и повышения конверсии корма. Препарат может применяться для обеззараживания кормов и кормового сырья, при обработке емкостей комбикормовых и премиксных заводов, производственных и технологических линий в птицеводческих и свиноводческих цехах. СабКонтрол плюс уничтожает патогенные бактерии и плесневые грибы, стимулирует регенерацию и подвижность адсорбционных ворсинок кишечного тракта, поддерживает оптимальный уровень рН в ЖКТ, улучшает конверсию корма. Препарат абсолютно безопасен для животных и птицы, устойчив при термической обработке. Продукцию после применения СабКонтрол плюс можно использовать без ограничений.
Нами была изучена антимикробная активность препаратов СабКонтрол и СабКонтрол плюс в отношении основных возбудителей бактериальных болезней — микроорганизмов видов Salmonella enteritidis и Escherichia coli, выделенных от птиц. Оба препарата испытывали в двух дозах — 0,3 и 0,1 г препарата на 100 г корма. Для проведения опыта был использован корм Гатчинского комбикормового завода. Всего было исследовано 33 пробы корма массой по 100 г каждая:
1–3-я пробы — чистый контроль: корм без добавления препаратов и инфицирования культурами микроорганизмов;
4–6-я пробы — заражённый контроль: пробы корма без добавления препаратов, инфицированные культурой Salmonella enteritidis;
7–9-я пробы — заражённый контроль: пробы без добавления препаратов, инфицированные культурой Escherichia coli;
10–12-я пробы — опыт: пробы с добавлением 0,3 г препарата СабКонтрол на 100 г корма, инфицированные культурой Salmonella enteritidis;
13–15-я пробы — опыт: пробы с добавлением 0,3 г препарата СабКонтрол плюс на 100 г корма, инфицированные культурой Salmonella enteritidis;
16–18-я пробы — опыт: пробы с добавлением 0,3 г препарата СабКонтрол на 100 г корма, инфицированные культурой Escherichia coli;
19–21-я пробы — опыт: пробы с добавлением 0,3 г препарата СабКонтрол плюс на 100 г корма, инфицированные культурой Escherichia coli;
22–24-я пробы — опыт: пробы с добавлением 0,1 г препарата СабКонтрол на 100 г корма, инфицированные культурой Salmonella enteritidis;
25–27-я пробы — опыт: пробы с добавлением 0,1 г препарата СабКонтрол плюс на 100 г корма, инфицированные культурой Salmonella enteritidis;
28–30-я пробы — опыт: пробы с добавлением 0,1 г препарата СабКонтрол на 100 г корма, инфицированные культурой Escherichia coli;
31–33-я пробы — опыт: пробы с добавлением 0,1 г препарата СабКонтрол плюс на 100 г корма, инфицированные культурой Escherichia coli.
Опытные пробы корма с препаратами тщательно перемешивали и выдерживали при комнатной температуре 24 часа. Через сутки экспозиции три контрольных (без добавления препаратов) и шесть опытных проб корма (с добавлением препаратов СабКонтрол и СабКонтрол плюс) инфицировали Salmonella enteritidis (в каждую пробу вносили по 0,1 мл суточной бульонной культуры, разведённой в 1 мл стерильного физиологического раствора); и три контрольных (без добавления препаратов) и шесть опытных (с добавлением препаратов СабКонтрол и СабКонтрол плюс) инфицировали Escherichia coli (в каждую пробу вносили по 0,1 мл суточной бульонной культуры, разведённой в 1 мл стерильного физиологического раствора).
Пробы корма с культурами тщательно перемешивали и выдерживали при комнатной температуре 24 часа. После суточной экспозиции из каждой из двадцати одной пробы корма (инфицированных культурами сальмонелл, кишечной палочки и чистых) были сделаны разведения в стерильном физиологическом растворе (1:10) и посевы из каждого разведения (по 1 мл на чашку Петри) на среды для выделения кишечной микрофлоры — Эндо и XLD-агар. Через сутки инкубирования чашек Петри с посевами в термостате при температуре +37°С проводили учёт результатов.
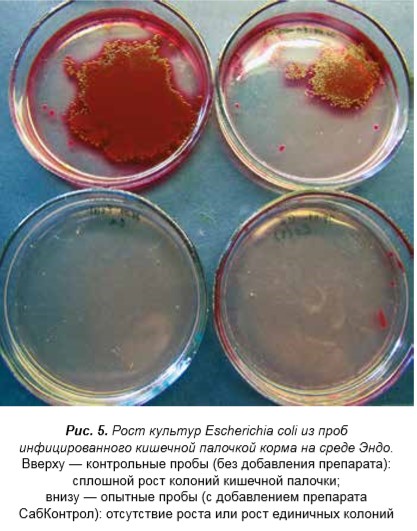
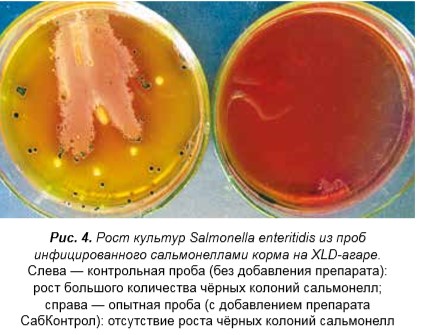
В результате исследований отмечена существенная разница в кормах, инфицированных культурами сальмонелл и кишечной палочки без добавления препаратов и с препаратами СабКонтрол и СабКонтрол плюс. В контрольных пробах без добавления препаратов, инфицированных культурами Salmonella enteritidis и Escherichia coli, выявлен рост большого количества колоний сальмонелл и кишечной палочки на XLD-агаре и сплошной рост на среде Эндо. В пробах корма с добавлениями препаратов 0,3 г на 100 г корма СабКонтрол и СабКонтрол плюс, инфицированных сальмонеллой и кишечной палочкой, рост патогенов отсутствовал; при дозе 0,1 г/100 г корма на XLD-агаре рост патогенов отсутствовал и лишь на среде Эндо выявлен рост единичных колоний культур Salmonella enteritidis и Escherichia coli.
В результате проведенных исследований установлено, что препараты КЛИМ Гидро, КЛИМ Термо, КЛИМ положительно влияют на продуктивность цыплят-бройлеров, увеличивают среднесуточный прирост массы, подавляют рост патогенных и условно-патогенных микроорганизмов. В результате повышаются сохранность и однородность цыплят, отмечается лучший выход мяса.
Препараты СабКонтрол и СабКонтрол плюс обладают высокой бактериостатической и бактерицидной активностью в отношении основных возбудителей бактериальных болезней птицы — сальмонелл и кишечной палочки и оптимальны для подавления и препятствия росту и активному размножению патогенной и условно-патогенной микрофлоры в кормах.
Исследования показали: препараты с торговой маркой КЛИМ и СабКонтрол необходимо широко применять в практике птицеводства для увеличения продуктивности птицы, снижения и предотвращения обсеменения кормов патогенной и условно-патогенной микрофлорой, профилактики бактериальных болезней в птицеводстве с целью создания эпизоотического благополучия хозяйства в отношении сальмонеллёзов и получения безопасной продукции, свободной от эпидемиологически опасной микрофлоры.
Контроль бактериальных болезней птицы
Адель БОРИСЕНКОВА,
доктор ветеринарных наук,
профессор ВНИВИП
Наличие в хозяйстве бактериальных болезней негативно сказывается не только на эпизоотической ситуации, но и на экономике предприятия, так как существенно повышает падёж птицы при остром или подостром течении (пастереллез, колибактериоз, стафилококкоз и др.).
При хронических, вялотекущих болезнях бактериальной этиологии отмечают неравномерный или низкий прирост массы бройлеров, повышенную чувствительность к стрессам, ухудшение яйценоскости и выводимости цыплят, биологических качеств эмбрионов, поствакцинального противовирусного иммунитета, плохую конверсию корма, особенно это проявляется при наличии в стаде микоплазм.
Бактериальные болезни птиц имеют ряд особенностей. Это связано с использованием в промышленном птицеводстве современных кроссов, которым необходима соответствующая компенсация затрат на выработку продуктивности. Невыполнение обязательной зооветеринарной технологии ведет к снижению общей резистентности птицы. Быстрое увеличение мышечной массы бройлеров и непропорциональное отставание массы внутренних органов ведет к ослаблению иммунитета. На этом фоне возникают предпосылки для активизации условно_патогенной микрофлоры.
Одна из особенностей бактериальных болезней - снижение вирулентности возбудителей, вследствие чего развиваются смешанные инфекции и затрудняется диагностика. Ослабление вирулентности характерно для возбудителя пастереллеза птиц.
Развитие смешанных инфекций особенно часто наблюдается при респираторном синдроме птиц. Клинические признаки - воспаление тканей в области подглазничных синусов, сережек, бородок, межчелюстного пространства, трахеиты, при падеже птиц - пневмонии, вызванные наличием микоплазм, пастерелл, стафилококков, эшерихий, орнитобактерий и др., но чаще всего их ассоциаций.
Мы провели сравнительный анализ микрофлоры, выделяемой при респираторном синдроме птиц из 311 проб патологического материала. Результаты исследований представлены в таблице.
Указанные возбудители выделялись как монокультуры, но чаще - в ассоциации.
При экспериментальном заражении была воспроизведена ярко выраженная клиника воспаления подглазничных синусов при введении курам смеси трех культур - P.multocida, E.coli и St.aureus в соотношении 1:1:1. При заражении в тех же дозах монокультурами результат оказался отрицательным.
В ЮАР от цыплят с клиническим проявлением респираторного синдрома были выявлены 128 культур, из которых 40 составили O.rhinotracheale, 14 - P.multocida, 64 идентифицированы как Haemophilus paragallinarum.
Одной из существенных особенностей проявления бактериальных болезней птиц на современном этапе развития промышленного птицеводства является способность некоторых возбудителей вызывать иммуносупрессивное действие в организме птицы. В первую очередь это относится к микоплазмам.
Особенностью бактериальных болезней птиц на современном этапе является носительство сельскохозяйственной птицей возбудителей, вызывающих острые кишечные инфекции людей, - сальмонелл и кампилобактерий.
Поэтому проблему бактериальных болезней птиц в промышленном птицеводстве следует рассматривать в двух аспектах - создание эпизоотического благополучия, охраны здоровья птицы, следствием чего является производство высококачественной продукции, свободной от эпидемиологически опасной и условно патогенной микрофлоры, улучшение экономических показателей и обеспечение охраны здоровья людей. Для обеспечения эпизоотического и эпидемического благополучия птицехозяйств нами разработана система контроля, основанная на диагностическом мониторинге. Система включает в себя девять основных положений, что отражено в соответствующей схеме контроля.
- Диагностический мониторинг
- серологические исследования
- микробиологические исследования (прижизненный метод - бактериологические исследования групповых проб помета, мазки из клоаки)
- Микробиологический мониторинг вывода и выращивания цыплят
- Эпизоотологический мониторинг технологического цикла производства
- Антибиотикопрофилактика
- Пробиотикопрофилактика
- Дезинфекция
- Дератизация
- Специфическая профилактика
- Точки критического контроля анализа опасности (НАССР)
- микробиологический контроль за кормами
- контроль за технологическими объектами
- контроль за выходом продукции
В системе контроля бактериальных болезней своевременная и качественная диагностика, безусловно, имеет приоритетное значение. Диагностика болезни - понятие широкое, включающее комплекс или систему данных: эпизоотологических, клиническую картину, патолого_анатомические изменения, бактериологические исследования. Одними из составляющих диагностического комплекса являются серологические исследования. Развитие молекулярной биологии, генной инженерии позволило предложить для диагностики бактериальных болезней птиц ряд высокочувствительных реакций. Это серологический ELISA_тест, или ИФА. Этот метод нашел применение в первую очередь для выявления антител к сальмонеллам (S.enteritidis, S.typhimurium) в сыворотке крови птицы и желтке. ИФА применяется также для выявления антител к другим бактериальным возбудителям, в частности к микоплазмам и пастереллам.
Разработаны высокочувствительные методы для выявления патогенов в организме птицы и в ее продуктах - яйце и мясе - на молекулярном уровне с использованием фрагментов ДНК, РНК для видовой идентификации и для выявления генов вирулентности. Это PCR - метод полимеразно_цепной реакции.
Метод завоевывает в бактериологии все большую популярность, особенно при выявлении возбудителей, опасных не только для птицы, но и для человека. Объектами бактериологического контроля в технологическом цикле производства являются трупы птицы всех возрастов, замершие эмбрионы, отходы инкубации, меконий, свежий помет (групповые пробы), мазки из трахеи, воздух (пух, пыль) выводного шкафа инкубатория в процессе вывода, комбикорма, вода, смывы с продукции. Для идентификации возбудителя применяются общепринятые методы, пластины биохимические дифференцирующие (ПБДЭ, ПБДС), системы индикаторных бумажных дисков (СИБ), серологическая идентификация (СКРА, РНГА, ККРНГА, ИФА, ПЦР).
Существенно при постановке диагноза определение вирулентных свойств выделенной микрофлоры. С этой целью, помимо существующих классических методов определения вирулентных свойств на модели заражения белых мышей, мы предложили и внедрили в практику интраорбитальный метод заражения суточных цыплят и определение вирулентных свойств на модели заражения куриных эмбрионов в хориоаллантоисную полость. Эти методы особенно помогают при определении вирулентных свойств потенциально патогенной микрофлоры.
При микробиологической диагностике заболеваний, вызываемых условно_патогенными или потенциально-патогенными микроорганизмами - эшерихиями, стафилококками, псевдомонадами - существуют лабораторные показатели, дифференцирующие их от апатогенных микроорганизмов.
Это - способность продуцировать токсины, гемолитические свойства, способность индуцировать ферменты патогенности, в частности гиалуронидазу, которая обеспечивает такой фактор патогенности, как инвазивность и др.
Одним из факторов патогенности, характерным для кишечной палочки, является ее способность колонизировать эпителиальные клетки кишечника.
Определение адгезивных свойств и типа адгезивных антигенов проводят с использованием антиадгезивных сывороток в РА, в иммуноадгезивной гемагглютинации по тесту Д-маннозы.
Активность кишечной палочки определяют по среднему показателю адгезии на модели эритроцитов человека О-группы. Для определения адгезивных свойств эшерихий, выделенных от птицы, нами (в соавторстве с Л.И.Смирновой) разработаны и предлагаются модели, близкие к биологическому типу, - эритроциты петуха и эпителиальные клетки трахеи цыплят. Использование этих моделей позволяет выявить большое количество E.coli, способных к адгезии на 25-50%.
Наиболее чувствительны к заражению патогенной и условно-патогенной микрофлорой цыплята раннего возраста. Для снижения потерь в этом технологическом звене основное внимание должно быть уделено своевременному сбору полноценного инкубационного яйца от благополучного по инфекционным заболеваниям стада несушек и своевременной и качественной его дезинфекции, а также инкубаторию и схеме антибактериальной профилактики с первого дня посадки цыплят на выращивание.
Поскольку все бактериальные болезни передаются с яйцом либо трансовариально (микоплазмоз, пуллороз и др.), либо за счет контаминации скорлупы и последующего всасывания поверхностной микрофлоры в подскорлупные оболочки, важным в профилактике бактериальных болезней птицы является качественная подготовка инкубационных яиц и контроль за инкубацией. Радикальным технологическим звеном в профилактике бактериальных болезней птицы и возможном их распространении является инкубаторий, и именно завершающее звено инкубации - выводной инкубатор - один из основных энергобиологических узлов промышленного птицеводства, так как в процессе инкубации происходит увеличение микробного потенциала до критических размеров. Выводной шкаф инкубатория - уникальное звено в технологии промышленного птицеводства как минимум по шести параметрам:
- самая высокая концентрация поголовья;
- только в выводном шкафу инкубатория взаимодействуют оба пути передачи инфекции - вертикальный и горизонтальный;
- аэрогенное заражение цыплят на выводе - это всегда острый сепсис, сопровождающийся падежом цыплят в первые дни жизни. Единственным патолого-анатомическим признаком при этом является острая катаральная пневмония;
- только в выводном шкафу инкубатория совпадают оптимальные условия по температуре и влажности как для биологического объекта (эмбрион-цыпленок), так и для его врага - патогенной и условно_патогенной микрофлоры;
- по микрофлоре, выделяемой в выводном шкафу в процессе вывода цыплят, можно осуществить контроль бактериальных болезней и их прогноз;
- в выводном шкафу инкубатория возможна первая прижизненная профилактика.
Нами разработан микробиологический мониторинг вывода цыплят и предложен аэрозольный метод их обработки в выводном шкафу эффективными дезинфектантами, в частности катаполом, для снижения бактериальной инфицированности цыплят на выводе.
Следующий этап контроля - это эпизоотологический мониторинг выращивания цыплят в возрасте 1-30 дней. Существенен при этом выбор эффективных антибиотиков с первого дня выращивания. Контролем эффективности их применения является учет динамики подневного падежа цыплят и учет частоты встречаемых патолого_анатомических признаков, характерных для острого бактериального сепсиса, в частности изменения в легких и бактериологический контроль. Применение эффективных антибиотиков следует проводить под контролем их чувствительности к культурам, выделенным в хозяйстве.
Отдельного внимания требует антибиотикопрофилактика микоплазмоза, поскольку микоплазма - особый представитель микромира, так как занимает промежуточное положение между микробами и вирусами. Главное отличие микоплазм от микробов - это отсутствие выраженной клеточной стенки. Поэтому при проведении антибиотикопрофилактики микоплазмоза птиц нельзя применять антибиотики, принцип действия которых основан на ингибировании клеточной стенки. Выбор должен основываться на препаратах, угнетающих синтез белка. Это антибиотики из группы макролидов (тилан, тилозин), антибиотики тетрациклиновой группы, антибиотики из группы плеуромутилина и антибиотики, влияющие на синтез ДНК (фторхинолоны). Эффективное применение может быть только раннее, то есть с первого дня выращивания, и должно быть повторено через 3-4 недели однократно. Необходимо учитывать фармакокинетические свойства препаратов, которые обеспечивали бы необходимый уровень их в тканях_мишенях (респираторный тракт, репродуктивные органы, инкубационные яйца). Целесообразно комбинированное применение антимикоплазменных и антибактериальных препаратов для профилактики других бактериальных инфекций при ассоциированном течении. Корректировка схемы применения антибиотиков должна проводиться под контролем гемограммы и выявлении чувствительности выделяемой микрофлоры.
Разработаны и широко применяются способы профилактики бактериальных болезней и улучшения микробиоценоза организма птицы с помощью пробиотиков.
У здоровой птицы в кишечнике взаимодействует полезная и условно-патогенная микрофлора. При этом происходит химическая селекция ингибирующими агентами (жирные кислоты, желчь, лизоцим и др.) и механическая - за счет очистительного эффекта перистальтики. Избежать эвакуации популяция бактерий может двумя способами: путем прикрепления микробных клеток к стенкам кишечника и за счет быстрого размножения, превышающего скорость удаления из кишечника. В результате взаимодействия двух разнонаправленных факторов очищения и приспособления формируется комплексная микрофлора, стабильность которой - залог резистентности организма птицы. Этот феномен называют по_разному: бактериальный антагонизм, бактериальная интерференция, барьерный эффект, колонизационная резистентность, конкурентное исключение, и именно он лежит в основе создания целого ряда пробиотиков для птицеводства.
В системе ветеринарно_санитарных профилактических мероприятий важная роль отводится дезинфекции объектов производства, инкубационного яйца и воздушной среды в присутствии птицы. Существует большой перечень эффективных дезинфектантов, схем и методов их применения, однако поиск в этой области продолжается и направлен он на экологическую чистоту средств.
Дератизация - один из существенных моментов профилактики бактериальных болезней птиц, так как крысы являются для нее биологическим резервуаром и переносчиками патогенных микроорганизмов, в частности пастерелл и сальмонелл, и патогенных для людей, в том числе возбудителей особо опасных инфекций. Своевременная и качественная дератизация - одна из необходимых составляющих системы контроля бактериальных болезней.
Эпизоотическое благополучие в отношении отдельных бактериальных болезней можно обеспечить средствами специфической профилактики. С этой целью предложены инактивированная сорбированная вакцина против пастереллеза птиц, инактивированная сорбированная вакцина против сальмонелла_энтеритидис инфекции птиц.
Обязательной составляющей контроля бактериальных болезней птиц является внедрение системы НАССР (АРККТ) - оценки производственного процесса с точки зрения анализа
опасности и соответствующих им степеней риска. В этом аспекте мы выделили три основные позиции: микробиологический контроль за кормами, за технологическими объектами и микробиологический контроль на выходе продукции. Центральным звеном концепции являются три контролируемых этапа: предотвращение опасности, предотвращение распространения опасности и устранение опасности. Оценка с этих позиций технологического цикла производства позволяет создать эпизоотическое благополучие хозяйства и обеспечить получение безопасной продукции, свободной от эпидемиологически опасной и условно-патогенной микрофлоры.
При заболеваниях дыхательных органов очень часто удается выделить из легких и воздухоносных мешков возбудителей колибактериоза, псевдомоноза, стрептокок-коза, стафилококкоза, пастереллеза. В зоологических парках иногда встречаются случаи туберкулеза среди птиц. Лечение осуществляют с применением антибиотиков и витаминов, вводимых парентеральным путем по рекомендациям, приведенным в общем разделе.
Псевдомоноз. Заболевание вызывает микроб псевдомонас аэругиноза, который попадает в организм птиц с водой и кормом. Инфекция протекает в виде тяжелой формы септицемии с конъюнктивитом, насморком, поносом, анемией, слабостью. У погибших птиц находят увеличенную печень с очагами некроза, слизистая оболочка кишечника воспалена.
Диагноз ставится после микробиологических исследований и обнаружения возбудителя.
Лечение и профилактика основываются на курсовом применении тетракциклина. Дезинфекция питьевой воды служит обязательной мерой профилактики.
Вибрионный гепатит встречается у всех видов птиц, в том числе декоративных и певчих. Возбудитель - вибрион, который выделяется скрыто больной птицей с пометом, загрязняя воду, корм.
При заболевании у птиц возникает слабость, повышенная жажда, расстройства кишечника. При вскрытии трупов находят перигепатиты, очаги некроза, кровоизлияния в печень, увеличение селезенки, энтерит.
Лечение. Имеются данные о положительном использовании фуразолидона.
Колибактериоз. Заболевание свойственно всем видам птиц, в том числе певчим и декоративным. Зерноядные и насекомоядные виды, как правило, содержат меньше грамотрицательной микрофлоры в кишечнике, в то же время этот микроорганизм преобладает у насекомоядных. Часто бактерии коли вызывают у различных птиц тяжелые энтериты, нередко оканчивающиеся смертельным исходом. Заражение может происходить через воду, корм, для комнатных птиц источником заражения может быть человек, который является постоянным носителем этих микробов.
Ведущий клинический признак - расстройство кишечника. Возбудитель выделяется с пометом, содержимым яйца, находится на скорлупе.
Пагологоанатомические изменения малохарактерны и сводятся к увеличению в объеме печени, селезенки, почек, геморрагическому катару слизистой оболочки- кишечника. Тяжелопротекающие случаи сопровождаются аэросакулитами, перитонитами, артритами. Диагностика заключается в получении и серологической типизации штаммов. У декоративных и певчих птиц часто выделяют устойчивые к лекарственным препаратам штаммы бактерий.
Лечение. Применяют антибиотики широкого спектра действия (биомицин), энтеросептол в общепринятых дозах в течение 5-7 дней. Необходимо соблюдать общие правила по уходу и содержанию за птицей. Рекомендуют раз в неделю дезинфицировать клетки, кормушки, поилки раствором хлорамина.
Псевдотуберкулез. Заболевание вызывает пастерелла псевдотуберкулеза, которая встречается у свободноживущей и домашней птицы в виде облигатного каменсала, попадающего в корм и воду от больной птицы. После заражения через короткий промежуток времени птица погибает. Особенно чувствительны к этому заболеванию канарейки и зяблики, у других видов птиц также встречается, однако развивается на фоне понижения резистентности, например при длительном расстройстве кишечника.
При заболевании птица угнетена, оперение взъерошено, голова согнута, дыхание затруднено. Под кожей можно обнаружить локализованные очажки. Определяют некротические очаги в печени, селезенке, почках, кишечнике и мышцах.
Диагноз ставят на основании бактериологических исследований. Прогноз, как правило, неблагоприятен. Больные погибают, хотя возбудитель очень чувствителен к антибиотикам широкого спектра действия, но быстро развивающаяся интоксикация организма приводит к летальному исходу.
Листериоз. Листерия моноцитогенес была изолирована у многих видов птиц, в том числе и свободноживущих. Для данного заболевания характерен длительный период бактерионосительства, при котором редко проявляются клинические признаки. Видимые признаки заболевания отмечаются после переохлаждения птицы, содержании на неполноценном рационе во время линьки. В таких случаях листериоз протекает остро, с признаками нарушения центральной нервной системы, быстрой гибелью.
При патологоанатомическом вскрытии видны кровоизлияния во внутренние органы, некрозы в печени, селезенке, миокард и печеночный энцефаломиелит. Характерные признаки у попугаев и канареек - серо-фибринозный перикардит. Лечение проводить нецелесообразно, так как возбудитель листериоза передается людям. Рекомендуется птицу усыпить или лечить стационарно (в ветеринарной лечебнице).
Профилактика болезни сводится к предупреждению контакта со свободноживущей птицей, которая может быть листерионосителем. Данное заболевание относится к группе зооантропонозных.
Ботулизм. Наличие в корме экзотоксина клостридиум ботулини приводит к отравлению птицы с определенными клиническими признаками развития болезни: нарушается масса птицы, отмечают параличи шеи, конечностей. Скорость развития болезни зависит от количества токсинов Возбудитель данного заболевания может содержаться не только в мясе, но также в мясо-костной муке, растениях застоявшейся грязной воде. При возникновении отравления промывают зоб, дают умеренные дозы глауберовой соли или касторового масла.
Спирохетоз. Заболевание встречается у птиц в условиях естественного обитания в жарком климате. Переносчиком спирохетоза является клещ, который разносит возбудителей при укусе (клещ вида аргас), кроме того, переносчиками могут быть клопы, пухопероеды. Спирохеты размножаются в крови и вызывают септицемию, сонливость, понижение тактильной чувствительности, нарушение координации движений, быструю гибель. Селезенка и печень сильно увеличены, с очагами некроза. Печень с жировой дегенерацией паренхимы.
Диагноз. Для постановки диагноза исследуют каплю крови с целью обнаружения спирохет.
Лечение. В начале болезни применяют окситетрациклин, пенициллин, спироцид (0,2 г/кг) или неосальварсан 003 г на 1 кг живой массы тела с питьевой водой.
Профилактика сводится к предупреждению нападения кровососущих насекомых.
Источник: Бессарабов Б. Ф. Болезни певчих и декоративных птиц. Россельхозиздат, 1980
Читайте также:


